文章信息
- 左利萍, 李毅, 焦健.
- Zuo Liping, Li Yi, Jiao Jian
- 渗透胁迫下河北杨叶片的生理响应及相关分析
- Physiological Responses and Their Correlations of Populus hopeiensis Leaves Under Osmotic Stress
- 林业科学, 2008, 44(8): 56-61.
- Scientia Silvae Sinicae, 2008, 44(8): 56-61.
-
文章历史
- 收稿日期:2007-07-13
-
作者相关文章
 产生速率的大幅度增加;但在胁迫18 h时,SOD、POD活性及脯氨酸和可溶性糖含量的显著升高可以起到一定的减轻伤害的作用。相关分析结果表明:MDA含量及
产生速率的大幅度增加;但在胁迫18 h时,SOD、POD活性及脯氨酸和可溶性糖含量的显著升高可以起到一定的减轻伤害的作用。相关分析结果表明:MDA含量及 产生速率与相对含水量均呈极显著负相关;而SOD、POD活性与相对含水量相关性不显著;SOD活性与
产生速率与相对含水量均呈极显著负相关;而SOD、POD活性与相对含水量相关性不显著;SOD活性与 产生速率相关性显著,而POD活性与
产生速率相关性显著,而POD活性与 产生速率相关性不显著。上述指标间相关性说明河北杨对水分胁迫的响应是多种生理生化过程综合作用的结果,各生理指标间存在着一定的内在联系。
产生速率相关性不显著。上述指标间相关性说明河北杨对水分胁迫的响应是多种生理生化过程综合作用的结果,各生理指标间存在着一定的内在联系。 production rate increased while the activities of superoxide dismutase (SOD) and peroxidase (POD) decreased. However, the activities of SOD and POD, the content of proline and soluble sugar increased at18 h of treatment with the PEG solution, which might alleviate the damage of the stress. Correlation analyses showed that there was a significant negative correlation between the relative water content and MDA content or
production rate increased while the activities of superoxide dismutase (SOD) and peroxidase (POD) decreased. However, the activities of SOD and POD, the content of proline and soluble sugar increased at18 h of treatment with the PEG solution, which might alleviate the damage of the stress. Correlation analyses showed that there was a significant negative correlation between the relative water content and MDA content or  production rate respectively, whereas there was no significant correlation between the relative water content and the activities of SOD and POD. SOD activities were significantly and negatively correlated with
production rate respectively, whereas there was no significant correlation between the relative water content and the activities of SOD and POD. SOD activities were significantly and negatively correlated with  production rate while no significant correlation was found between the relative water content and POD activities. The relationship between the above physiological indexes indicated that the responses of Populus hopeiensis leaves during PEG osmotic stress were the results of various physiological processes, and there existed some close correlations among the indexes in some way.
production rate while no significant correlation was found between the relative water content and POD activities. The relationship between the above physiological indexes indicated that the responses of Populus hopeiensis leaves during PEG osmotic stress were the results of various physiological processes, and there existed some close correlations among the indexes in some way. 河北杨(Populus hopeiensis)是杨柳科山杨属的树种,为高大乔木,干形通直,材质轻软而细密,富有弹性。水平根系发达,抗旱耐盐,耐瘠薄,是黄土高原半干旱地区少有的能够上山栽植、生长稳定、可以成材的乔木树种(陈旭吉等,2003),在林业生产和经营中占有重要地位,特别是在农田林网的经营中起着举足轻重的作用(冯谦等,2003)。
近几十年来,越来越多的人认为,用PEG模拟植物干旱逆境是可行的。通过随机标记的14C方法确定了PEG 4000-10000能模拟干旱逆境的原因是其可阻塞植物的输导组织(Atree et al., 1993;王瑾等,2005;朱教君等,2006)。在PEG渗透胁迫下,势必引起植物体内一系列的生理生化反应,以增强植物体的抗旱能力(龚子端等,2006),但PEG渗透胁迫下,乔木树种的生理响应及其相关性分析还缺乏深入的报道。
本研究通过PEG 6000渗透胁迫处理河北杨枝条,测定在处理6、12、18、24 h时叶片MDA含量、膜相对透性、
在甘肃农业大学校园内,选取河北杨成年树,采集树冠中部向阳方向生长的整齐一致的枝条,分别用质量分数为5%、15%、25%的聚乙二醇(PEG)溶液进行渗透胁迫处理,期间的光照强度为120 μmol·m-2s-1,分别处理6、12、18、24 h,取叶片进行各项生理生化指标的测定。
1.2 相关指标测定方法 1.2.1 相对含水量(RWC)烘干法(华东师范大学,1980)。
1.2.2 相对电导率电导仪法(郝再彬等,2004)。
1.2.3 脯氨酸含量采用茚三酮比色法(郝再彬等,2004)。显色后用UV-2450分光光度计测定520 nm波长处的光密度值,通过标准曲线计算游离脯氨酸含量。
1.2.4 丙二醛(MDA)含量采用硫代巴比妥酸法(郝再彬等,2004)。
1.2.5 可溶性糖含量采用蒽酮比色法(王学奎,2006)。
1.2.6
参照王爱国等(1990)的方法,测定环境中的光照强度为120 μmol·m-2s-1。
1.2.7 抗氧化酶活性超氧化物歧化酶(SOD)活性用氮蓝四唑法(郝再彬等,2004),以抑制氯化硝基氮蓝四唑(NBT)光化还原50%为一个酶活性单位;过氧化物酶(POD)活性用愈创木酚比色法(郝再彬等,2004),活性的测定基于愈创木酚的氧化,在470 nm测定,以每g植物鲜质量中每min所含酶活性单位(U)表示。
1.3 数据处理各项试验重复3~5次,数据采用SPSS统计分析软件进行相关性分析,取P<0.1为相关,P<0.05为显著相关。各数据均用平均值±标准差表示。
2 结果与分析 2.1 渗透胁迫对河北杨叶片水分含量的影响植物组织相对含水量反映了植物体内水分亏缺程度,由图 1可以看出:不同质量分数PEG溶液处理下河北杨叶片相对含水量均低于对照;且随着PEG溶液质量分数的升高和胁迫处理时间延长,河北杨叶片相对含水量均呈不断下降趋势,但下降的幅度不同。随PEG质量分数增大,其下降幅度有所增加。
|
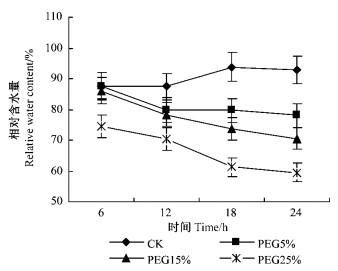
图 2 PEG渗透胁迫对河北杨叶片相对电导率及丙二醛含量的影响 Figure 2 The effect of PEG osmotic stress on relative conductivity and content of MDA in the leaves of P. hopeiensis |
|
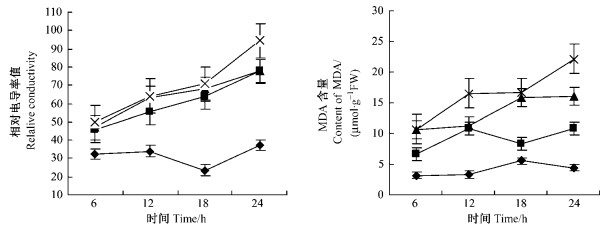
图 3 PEG渗透胁迫对河北杨叶片  |
|
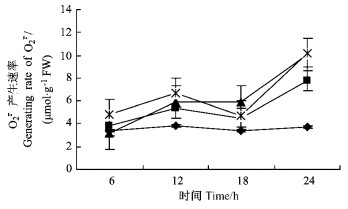
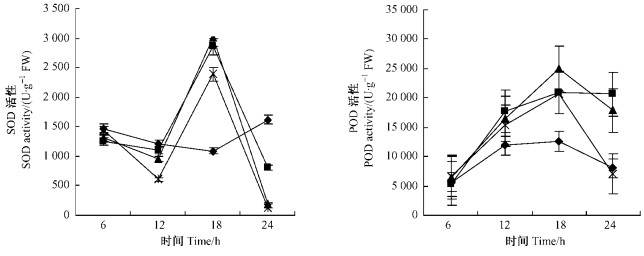
图 4 PEG渗透胁迫对河北杨叶片SOD活性和POD活性影响 Figure 4 The effect of PEG osmotic stress on SOD activity and POD activity in the leaves of P. hopeiensis |
|
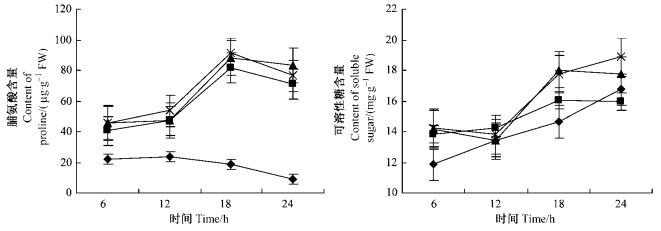
图 5 PEG渗透胁迫对河北杨叶片脯氨酸及可溶性糖含量影响 Figure 5 The effect of PEG osmotic stress on the content of proline and soluble sugar in the leaves of P. hopeiensis |
细胞膜透性是反映细胞膜结构和功能的一个常用指标,水分胁迫首先引起膜脂过氧化作用,使细胞膜受伤害,导致膜透性增大,电解质外渗量增加。叶片中的丙二醛(MDA)含量是表征细胞膜的脂质过氧化程度的有效指标,其含量可表示膜脂过氧化作用的程度(Placer et al.,1966)。试验结果表明(图 2):河北杨叶片细胞膜透性在3种PEG胁迫下均有显著升高,在胁迫24 h时达到了最大值。不同质量分数PEG处理叶片细胞膜透性增大幅度不同,25%PEG处理24 h时较对照升高达到175%,在处理12 h时较对照升高98.28%;5%和15%PEG处理24 h时细胞膜透性也显著高于对照。15%和25%PEG渗透胁迫处理后,河北杨叶片中MDA含量主要表现为随胁迫时间延长而增加,但5%PEG溶液处理后,MDA含量在胁迫12 h时达到最大值。
2.3 渗透胁迫下河北杨叶片






从图 4看出,各质量分数PEG溶液处理的河北杨叶片SOD活性随胁迫时间的延长呈先下降,后升高,再降低趋势。在胁迫18 h时,各质量分数处理的河北杨叶片SOD活性达到峰值,24 h时,叶片SOD活性显著下降。各质量分数PEG处理的河北杨叶片POD活性均较对照高,但随处理时间的延长其变化趋势不同,在胁迫处理前18 h各处理河北杨叶片POD活性均呈升高趋势,胁迫24 h,5%PEG处理的叶片POD活性仅有不显著的下降,15%和25%PEG处理的POD活性显著下降,其中25%PEG处理下降幅度最为显著。
2.5 渗透胁迫下河北杨叶片渗透调节物质的变化脯氨酸在植物细胞中主要起渗透调节作用。脯氨酸含量的增加,可以增强细胞的渗透调节能力,对植物抗旱有益,为此曾有人提出以干旱时植物体内游离的脯氨酸的积累能力,作为选育抗旱作物的指标(汤章城等,1986)。结果表明(图 5):不同质量分数PEG溶液处理下,河北杨叶片脯氨酸和可溶性糖含量均高于对照,且随着处理时间的延长,基本呈上升趋势,但两者也有一定的差异性。在胁迫的初期(6~12 h)脯氨酸和可溶性糖含量变化幅度很小,随着时间的延长(12 h),脯氨酸和可溶性糖含量均有增加,但脯氨酸增加幅度较大(图 5),胁迫后期(24 h),脯氨酸含量变化稍有下降,但可溶性糖含量仍基本呈递增趋势。
2.6 各生理指标相关性分析 2.6.1 叶片相对含水量与各生理指标间的相关性分析通过对河北杨叶片各生理指标与叶片相对含水量进行相关分析,结果表明(图 6):河北杨叶片MDA与






|
图 6 相对含水量与各生理指标的相关性分析 Figure 6 Correlation analysis of water content and other indexes |

抗氧化酶活性与





植物对逆境的反应涉及到植物体内一系列生理生化变化。在水分胁迫下,植物通过增加细胞内溶质,比如脯氨酸和可溶性糖进行渗透调节被认为是一种抵抗水分胁迫的有效途径。游离脯氨酸是植物体内一种重要的氨基酸,当植物受到干旱胁迫时,可作为植物的渗透剂,参与植物的渗透调节作用(McMichael et al., 1997)。另外脯氨酸作为一种高亲水性物质,可防止细胞干旱时脱水(Leveitt,1980),因此当植物受到干旱胁迫时会使植物体内游离脯氨酸积累增加。从脯氨酸的生物合成来看,干旱将影响脯氨酸的合成,最终造成脯氨酸的积累在干旱处理末期下降和停止。王霞等(1999)认为在整个干旱处理过程中,脯氨酸与可溶性糖积累进程不同,脯氨酸在干旱后期含量降低,而可溶性糖在干旱后期大量积累,对植物体渗透调节而言,严重干旱会使植物体渗透调节能力丧失,因此可溶性糖在干旱后期的大量积累可能是脯氨酸下降的补偿策略。这与本试验结果基本一致:不同程度的渗透胁迫处理条件下,游离的脯氨酸与可溶性糖变化规律有相似之处,同时也存在一定的差异性:相同的是各处理的脯氨酸与可溶性糖含量均随胁迫进程而增加。不同的是在中度胁迫下,游离脯氨酸先于可溶性糖积累,而在重度胁迫下,脯氨酸累积停止,而可溶性糖累积继续(图 5)。
在干旱胁迫下,细胞内自由基的产生和清除平衡受到破坏,积累下来的自由基首先攻击质膜系统,使其透性增大(Smart et al., 1983),从而使细胞膜受到伤害,膜透性增大。逆境胁迫使活性氧产生过多,会造成活性氧清除不及时,从而引发膜脂过氧化链式反应进程,导致脂质过氧化产物MDA含量的增加。研究结果显示:在不同程度的渗透胁迫下河北杨叶片MDA含量呈增大趋势(图 2),这与前人的研究结果是一致的。
细胞内活性氧水平大幅度提高可造成氧化胁迫,并引起脂质过氧化、蛋白质与核酸的氧化修饰以及细胞膜的破坏,而植物在长期的进化过程中也形成了一系列的抗氧化酶和抗氧化剂来对抗与清除活性氧(焦健等,2006a;2006b; Li et al., 2004)。干旱胁迫下,保护酶活性的变化因植物品种、胁迫方式、胁迫强度和时间而不同。整个保护酶系统的防御能力的变化取决于这几种酶彼此协调的综合结果(陈少裕,1991;蒋明义等,1996;张木清等,1996)。
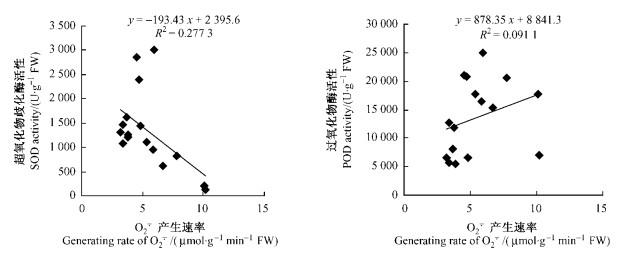
超氧化物歧化酶(SOD)是一种能消除植物体内过剩的超氧阴离子自由基的酶,从而保护植物免受活性氧伤害,SOD的活性决定了




|
图 7   |
有关干旱胁迫对植物的伤害及其保护酶系统与植物耐旱关系的研究已有许多报道,结果都不尽相同。这可能与不同植物的抗旱机制有关(万美亮等,1999)。保护酶系统对自由基的清除能力的变化可能是植物抗逆性的共同机制。植物体在逆境胁迫下保护酶的作用,可能是通过它们之间相互协调且保持一个稳定的平衡态而实现的。
总之,在PEG溶液的渗透胁迫下,河北杨叶片相对含水量逐渐下降(图 1),由此造成脂质过氧化产物丙二醛(MDA)积累(图 2),细胞膜相对透性破坏(图 2),而上述过程伴随着



陈旭吉, 周富吉. 2003. 河北杨休眠期带木质芽嫁接繁育技术. 甘肃林业科技, 19(10): 149-151. |
陈少裕. 1991. 膜脂过氧化对植物细胞的伤害. 植物生理学通讯, 27(2): 84-90. |
冯谦, 魏德胜, 虎岷. 2003. 河北杨组培苗优化配套移栽技术途径. 东北林业大学学报, 31(5): 7-9. DOI:10.3969/j.issn.1000-5382.2003.05.003 |
龚子端, 李高阳. 2006. PEG干旱胁迫对植物的影响. 河南林业科技, 26(3): 21-23. DOI:10.3969/j.issn.1003-2630.2006.03.012 |
顾继杰, 陈富裕, 郑荣梁. 1996. 干旱诱导作物叶片膜损伤和膜脂过氧化的关系. 兰州大学学报:自然科学版, 32(2): 90-94. |
华东师范大学生物系植物生理教研组. 1980. 植物生理实验指导. 北京: 人民教育出版社, 1-3.
|
韩蕊莲, 李丽霞, 梁宗锁, 等. 2002. 干旱胁迫下沙棘膜脂过氧化保护体系研究. 西北林学院学报, 17(4): 1-5. DOI:10.3969/j.issn.1001-7461.2002.04.001 |
郝再彬, 苍晶, 徐仲. 2004. 植物生理实验. 哈尔滨: 哈尔滨大学出版社, 101-108.
|
焦健, 李朝周, 黄高宝. 2006a. 钴对干旱胁迫下大豆幼苗叶片的保护作用及其机理. 应用生态学报, 17(5): 796-800. |
焦健, 李朝周, 黄高宝. 2006b. 乙烯产生抑制剂对高温胁迫下蚕豆幼苗叶片的保护作用. 植物生态学报, 30(3): 465-471. |
蒋明义, 郭绍川. 1996. 水分亏缺诱导的氧化胁迫和植物的抗氧化作用. 植物生理学通讯, 32(2): 144-150. |
吕庆, 郑荣梁. 1996. 干旱及活性氧引起小麦膜脂过氧化与脱脂化. 中国科学:C卷, 26(1): 26-30. |
聂磊, 刘鸿先, 彭少麟. 2001. 水分胁迫对长期UV-B辐射下柚树苗生理特性的影响. 植物资源与环境学报, 10(3): 19-24. DOI:10.3969/j.issn.1674-7895.2001.03.005 |
汤章城. 1986. 水分胁迫和植物的气孔运动.植物生理生化进展(四). 北京: 科学出版社, 43-50.
|
万美亮, 邝炎华, 陈建勋. 1999. 缺磷胁迫对甘蔗膜脂过氧化及保护酶系统活性的影响. 华南农业大学学报, 2(2): 58-61. |
王爱国, 罗广华. 1990. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, 26(6): 55-57. |
王瑾, 刘桂茹, 杨学举. 2005. PEG胁迫下不同抗旱性小麦品种幼苗形态及主要理化特性的比较. 河北农业大学学报, 28(5): 6-10. DOI:10.3969/j.issn.1000-1573.2005.05.002 |
王学奎, 章文华, 郝再彬. 2006. 植物生理生化原理与技术. 北京: 高等教育出版社, 202.
|
王霞, 候平, 伊林克. 1999. 水分胁迫对柽柳植物可溶性糖的影响. 干旱地区研究, 16(2): 1-10. |
张木清, 余松烈. 1996. 水分胁迫下蔗叶活性氧代谢的数学分析. 作物学报, 22(6): 729-735. DOI:10.3321/j.issn:0496-3490.1996.06.015 |
朱教君, 康宏樟, 李智辉. 2006. 不同水分胁迫方式对沙地樟子松幼苗光合特性的影响. 北京林业大学学报, 28(2): 57-60. DOI:10.3321/j.issn:1000-1522.2006.02.010 |
Atree S M, Fowke L C. 1993. Embryogeny of gymnosperms:advances in synthetic seed technology of conifers. Plant Cell, Tissue and Organ Culture, 35: 1-35. DOI:10.1007/BF00043936 |
Bowler C, Van Montagu M, Inze D. 1992. Superoxide dismutase and stress tolerance. Ann Rev Plant Physiol Plant Mol Biol, 43: 83-116. DOI:10.1146/annurev.pp.43.060192.000503 |
Leveitt J. 1980. Response of plant to environmental stresses. New York: Academic Press, 131-134.
|
Li C Z, Jiao J, Wang G X. 2004. The important roles of reactive oxygen species in the relationship between ethylene and polyamines in leaves of spring wheat see dlings under root drought stress. Plant Sci, 166: 303-3l. DOI:10.1016/j.plantsci.2003.09.019 |
McMichael B L, Elmore C D. 1997. Proline accumulation in water stressed cotton leaves. Crop Sci, 17: 905-908. |
Placer Z A, Cushman L L, Johnson B C. 1966. Estimation of product of lipid peroxidation (malonyl-dialdehyde) in biochemical systems. Anal Biochemistry, 16: 359-364. DOI:10.1016/0003-2697(66)90167-9 |
Smart R E, Coombe B G. 1983. Water relations of grapevines//Kozlowski T T. Water deficits and plant growth. New York: Academic Press.
|
 2008, Vol. 44
2008, Vol. 44