文章信息
- 苑智华, 何秀丽, 徐哲, 义鸣放.
- Yuan Zhihua, He Xiuli, Xu Zhe, Yi Mingfang
- 唐菖蒲球茎形成期蔗糖和淀粉代谢及其相关酶活性
- Metabolism and Related Enzymes Activities of Sucrose and Starch in the Stages of Bulb Formation of Gladiolus hybridus
- 林业科学, 2008, 44(8): 47-51.
- Scientia Silvae Sinicae, 2008, 44(8): 47-51.
-
文章历史
- 收稿日期:2007-08-15
-
作者相关文章
唐菖蒲(Gladiolus hybridus)为鸢尾科唐菖蒲属植物,是世界著名的球根花卉。唐菖蒲当年形成的地下器官主要有新球、匍匐茎和籽球(统称球茎)(陈菊,2003)。其球茎的生长发育是通过叶片光合细胞中蔗糖的不断合成来供应的,包括形态建成和贮藏物质的积累。其中蔗糖和淀粉是变态器官主要的积累形式,它们对调节和平衡碳水化合物的形态起重要作用,也是协调植物源库关系的信号(钱树林,2007)。目前国内外对蔗糖和淀粉代谢及其相关酶的研究非常广泛,蔬菜主要集中芋(Colocasia esculenta)(周素平,1999)、甘薯(Dioscorea esculenta)(沈淞海等,1994)和番茄(齐天岩等,2005),果树主要集中在苹果(Malus)、脐橙(Citrus sinensis)、猕猴桃(Actinidia)、杨梅(Myrica)和葡萄(Vitis)(张秀梅等,2006)。但是花卉上仅限于百合(Lilium davidii var. unicolor)(孙红梅等,2005)和郁金香(Tulipa gesneriana)(夏宜平等,2005),唐菖蒲仅有蔗糖和淀粉含量在籽球生长发育过程中变化的研究(钱树林,2007),而碳水化合物与其代谢相关酶活性之间的关系未见报道。本文旨在通过唐菖蒲生长发育过程中蔗糖和淀粉代谢及其相关酶活性之间关联的研究,以期探明唐菖蒲蔗糖和淀粉代谢机理,为进一步利用分子生物学的手段调节唐菖蒲地下器官碳水化合物的积累和分配,促进种球的优质生产提供理论依据和实践指导。
1 材料和方法 1.1 材料以唐菖蒲品种‘Rose Supreme'(‘RS')为试材,荷兰进口种球,周径8~10 cm。试验在中国农业大学科学园进行,2006年4月13日定植。期间常规水肥管理,进入盛花期后去除花序,保留叶片。
1.2 方法在唐菖蒲球茎形成期(种植后10~29周),每周取样1次,每次10株,新球取样兼顾内、中、外3层,籽球直径为0.4~0.8 cm,籽球和匍匐茎均为混合取样。
1.2.1 蔗糖和淀粉含量的测定唐菖蒲叶片和球茎中蔗糖和淀粉含量分别采用磷钼蓝分光光度法(分光光度计型号为UV-2000)(李利军等,2003)和蒽酮-浓硫酸法(李合生,2000)进行测定,重复3次。
1.2.2 蔗糖和淀粉代谢相关酶活性测定酶液提取参照Keller等(1993)方法略有改进。取唐菖蒲叶片和球茎各0.5 g,5 mL提取液研磨。提取液成分:50 mmol·L-1 Tris-HCl (pH7.5),10 mmol·L-1 MgCl2,1 mmol·L-1 EDTA,2.5 mmol·L-1 DTT,0.05% (v/v) Triton X-100,0.1% (w/v) BSA和0.03 g PVPP。匀浆液4 ℃,12 000×g离心20 min。上清液在4 ℃下用稀释10倍的提取液透析20 h。透析后的酶液即可用于酶活性的测定。
蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS合成方向)活性测定参照Zhun等(1997)方法,通过测定从UDPG生成的蔗糖进行测定。测定反应液包括:100 mmol·L-1 Tris-HCl (pH7.5),5 mmol·L-1 MgCl2,1 mmol·L-1 EDTA,3 mmol·L-1 UDPG,4 mmol·L-1 F-6-P或D-果糖和酶提取液。以不加酶液作为对照,以不同浓度的蔗糖和测定的A520值绘制蔗糖标准曲线。
酸性转化酶(AI)和中性转化酶(NI)活性测定参照Merlo等(1991)方法。AI活性测定反应液包括:0.1 mol·L-1HAc-NaAc缓冲液(pH4.8)、0.5 mol·L-1蔗糖和酶提取液。NI活性测定反应液包括:0.1 mol·L-1 K2HPO4-0.1 mol·L-1柠檬酸钠(pH 7.2)、0.5 mol·L-1蔗糖和酶提取液。以不加酶液和蔗糖作为对照。以不同浓度的葡萄糖和测定的A520值绘制葡萄糖标准曲线。
Q酶活性测定反应液包括:0.2 mol·L-1柠檬酸缓冲液(pH 7.0)、0.5 mol·L-1 EDTA、0.75%可溶性淀粉和酶液,以蒸馏水为对照(沈波等,1997)。
淀粉酶活性采用常规分光光度计法测定(李合生,2000)。以上酶活性的测定均重复3次。
2 结果与分析 2.1 蔗糖含量及代谢相关酶活性变化在本试验中唐菖蒲生长发育的进程是:籽球形态建成初期从10~15周,籽球快速膨大期是从盛花期到半枯期(15~25周),半枯期(25~29周)。
2.1.1 蔗糖含量的变化叶片中的蔗糖含量不断上升,至25周达到最高峰,随着地上部分衰老而开始下降;新球、匍匐茎和籽球中蔗糖含量变化均表现为前期增加,后期降低。15周之前,新球和匍匐茎中的蔗糖含量缓慢上升,之后随着籽球快速膨大期的临近快速升高,新球在25周达到峰值。籽球从形成之日起蔗糖含量即开始快速上升,在24周达到峰值后下降(图 1-a)。总的看来,叶片、新球和籽球中蔗糖含量变化均表现为前期增长,后期降低;叶片中的蔗糖含量在整个发育过程中都显著高于其他3个部位,新球和籽球中蔗糖含量又高于匍匐茎。
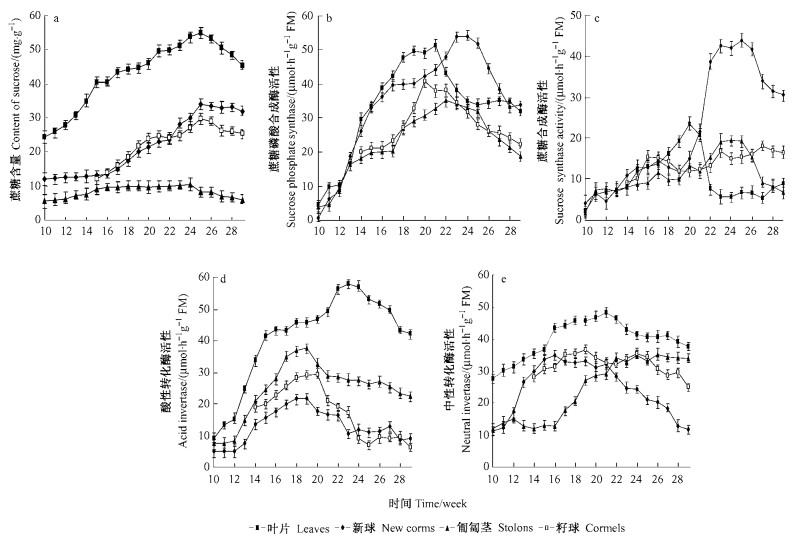
|
图 1 唐菖蒲叶片、新球、匍匐茎、籽球中蔗糖含量和代谢相关酶活性的变化 Figure 1 Changes of sucrose and related enzymes in leaves, new corm, stolons and cormels of Gladiolus hybridus |
唐菖蒲的叶片、新球、匍匐茎和籽球中的SPS活性变化趋势均表现为先增加后降低,且都是在盛花期后期活性迅速下降,其中新球SPS活性的下降略滞后于其他部位。在21周叶片SPS活性最高,进入半枯期后活性仅次于新球的;籽球在形态建成初期SPS活性较低,进入籽球快速膨大期后活性迅速升高后又快速下降(图 1-b)。
在20周前,唐菖蒲叶片、新球、匍匐茎和籽球中SS活性都逐渐上升,之后不同部位SS活性的变化差异较大。叶片中SS活性迅速下降,至22周降到最低后基本保持不变;新球中SS活性急剧升高,且显著性高于其他3个部位,进入植株半枯期后活性开始减弱;匍匐茎中SS活性变化趋势与新球一致,但活性明显低于新球的;籽球中的SS活性呈缓慢上升的趋势(图 1-c)。
2.1.3 蔗糖转化酶(Inv)活性变化蔗糖转化酶(Inv)包括AI和NI 2类,其活性也随唐菖蒲生长发育而变化。AI在唐菖蒲的叶片、新球、匍匐茎和籽球中的活性变化趋势均表现为先增加后降低;叶片中的AI活性最高,直至植株进入半枯期后活性才有所下降;新球、匍匐茎和籽球的AI活性变化相似,表现为19周前快速升高,在进入20周后迅速降低,24周后籽球的AI活性低于匍匐茎和新球(图 1-d)。
各部位NI活性亦表现为先增加后降低,而且叶片中的NI活性始终高于其他部位;新球的NI活性在籽球形态建成初期快速升高,进入籽球快速膨大期又迅速下降;匍匐茎的NI活性变化与新球的刚好相反,前期平缓,籽球快速膨大期迅速上升;籽球NI的活性是缓慢升高,直至盛花期后有所下降(图 1-e)。
2.2 淀粉含量及代谢相关酶活性变化 2.2.1 淀粉含量的变化新球内淀粉含量15周前缓慢上升,此后持续快速增加;籽球内淀粉含量则不断升高。由于新球生长发育进程早于籽球,因此新球内淀粉含量在盛花期之前高于籽球,此后随着籽球生长发育速度的加快,从18周开始籽球中的淀粉含量超过新球的。叶片和匍匐茎中淀粉含量较低,整个生长发育过程中变化较缓(图 2-a)。不同部位淀粉含量(18周后)大小的排序为:籽球>新球>叶片>匍匐茎。
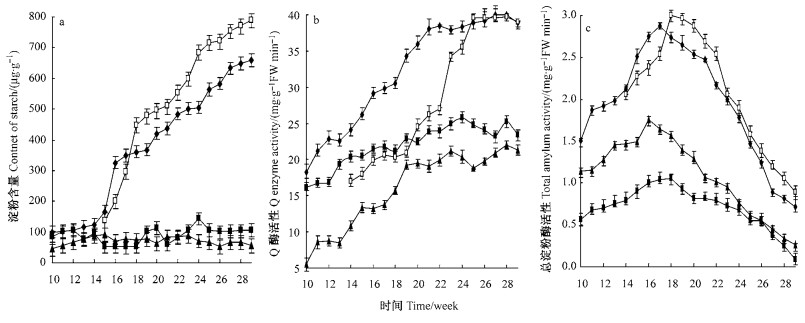
|
图 2 唐菖蒲叶片、新球、匍匐茎、籽球中淀粉、Q酶和总淀粉酶活性的变化 Figure 2 Changes of starch, Q enzyme and total amylase activities in leaves, new corm, stolons and cormels of Gladiolus hybridus |
在生长发育过程中唐菖蒲叶片、新球、匍匐茎和籽球中的Q酶活性均呈上升的趋势,其中新球中Q酶的活性最高,在种植后20~29周活性保持在38.02%~38.82%;叶片的Q酶活性居中且上升缓慢,维持在16.20%~25.78%;匍匐茎的Q酶活性最低;籽球的Q酶活性在籽球形态建成初期缓慢升高,进入籽球快速膨大期几乎呈直线上升,到植株半枯期Q酶活性与新球持平(图 2-b)。
2.2.3 淀粉酶活性的变化唐菖蒲地下各部位的总淀粉酶活性均呈先升后降之势,且在整个生长发育过程中,总淀粉酶活性为新球>匍匐茎>叶片,而籽球在其形态建成初期,总淀粉酶活性小于新球,之后快速增加并大于新球(图 2-c)。故在新球和籽球生长发育过程中它对调节和平衡碳水化合物的形态起重要作用。
3 结论与讨论 3.1 蔗糖和淀粉代谢蔗糖是重要的光合产物,是植物体内主要的运输物质和碳水化合物的暂存形式之一。唐菖蒲籽球形态建成初期,各部位蔗糖和淀粉代谢水平较低。籽球快速膨大期,叶片、新球、籽球中的蔗糖积累迅速增加,尤以叶片中的蔗糖积累最快,以便为地下部球茎的生长发育提供物质基础。匍匐茎作为蔗糖的运输器官蔗糖积累较少,它从新球中得到蔗糖后传递到籽球,以利于籽球的形态建成。此时新球和籽球中的淀粉也迅速积累,为新球和籽球的快速膨大提供物质基础,而叶片和匍匐茎中的淀粉含量较低,因为它们不是贮藏器官。纵观唐菖蒲整个生长发育过程,叶片合成蔗糖,通过长距离运输到地下部的球茎中,并转化为合成淀粉的原料,这一过程与叶片的蔗糖合成和球茎的淀粉积累紧密地联系在一起。随着半枯期的临近,唐菖蒲各部位蔗糖积累有所下降,新球和籽球的淀粉积累也趋于平缓。因此,唐菖蒲蔗糖和淀粉的代谢变化与其整个生长发育进程密切相关。
3.2 蔗糖代谢与其相关酶的关联在高等植物中,与蔗糖代谢密切相关的酶主要有SPS、SS、AI和NI。本研究发现:叶片和新球中的蔗糖随着SPS和SS活性的升高在不断积累,直至盛花期结束SPS和SS活性才下降,蔗糖含量也有所下降,因此,SPS和SS是叶片和新球中影响蔗糖合成的关键酶。Huber(1983)认为SPS活力越高,蔗糖积累的越多,SPS活性的高低代表了小麦旗叶光合产物转化为蔗糖的能力(李永庚等,2001);在柑橘果实快速生长阶段,汁囊中的SPS活性高于运转组织,而且SPS活性一般在含叶绿素的组织中更活跃,尤其是向外输出蔗糖的组织(Lrnvell et al.,1989)。本研究也得到了相同的结论,叶片中的SPS活性高且与蔗糖含量正相关。匍匐茎的蔗糖含量的变化与其代谢相关酶的关系还有待于进一步研究;籽球在其形态建成初期SPS是决定其蔗糖合成的关键酶,但进入快速膨大后期,AI和SPS活性显著下降,降低了蔗糖的合成,而SS活性则呈缓慢增加的趋势,故此时籽球中蔗糖的合成更主要受SS调控。综上所述,籽球中蔗糖的代谢也是SPS,SS和AI综合作用的结果。
Inv(invertase,转化酶)包括NI和AI,它被认为参与了植物的生长和器官建成。有研究表明,一般在植物的分生组织和快速生长的幼嫩的组织和器官中(如幼嫩的叶片,茎,花芽,根尖,幼嫩的果实等)Inv活性较高(张明方等,2002)。本试验中,唐菖蒲籽球形态建成初期直到快速膨大前期,各部位转化酶活性均升高,是因为此阶段正处于细胞分裂、分化高峰期,需要构建各种细胞器、细胞壁和细胞液成分。高的蔗糖分解酶活力有利于蔗糖迅速分解为单糖,以供呼吸消耗,为旺盛的生理活动提供能量。故在唐菖蒲中转化酶对幼嫩组织和器官的快速生长同样起着重要作用。
3.3 淀粉代谢与其相关酶的关联Q-酶不仅参与合成支链淀粉,而且还能活化SSase,提高淀粉生物合成的速率,它还有利于ADPG焦磷酸化酶和淀粉合成酶的催化反应,使它们能在短时间内催化合成更多的淀粉(Nakamura et al., 1992)。本研究发现唐菖蒲新球和籽球中淀粉含量和Q酶活性始终保持增加的趋势,故Q酶是淀粉合成的关键酶之一。进入18周后,新球和籽球的总淀粉酶活性迅速下降,而此时淀粉仍快速积累,说明淀粉酶活性与淀粉的积累成负相关。叶片和匍匐茎中的淀粉含量与淀粉酶、Q酶没有明显的相关性,这说明叶片和匍匐茎都不是贮藏器官,淀粉在叶绿体和匍匐茎中积累只是碳水化合物的暂存形式。
3.4 蔗糖和淀粉代谢相关酶活性与其“源”与“库”的关系唐菖蒲生长发育过程中,其“源”与“库”的关系呈动态变化,但叶片始终为最大的“源”。籽球形态建成初期,存在2个库即花序和新球,但花序的库强大于新球。本试验根据唐菖蒲种球生产的常规,在盛花期去除花序,提早去除花序对养分的消耗及与地下器官的竞争,地下球茎便成为主要的“库”。新球相对于籽球又作为“源”通过匍匐茎将光合产物和自身合成的营养物质传递给籽球,供其生长膨大。
叶片光合产物向库器官运输的主要形态是蔗糖,而SS是蔗糖进入各种代谢途径所必需的关键酶之一。SS影响库强,调控输入蔗糖多少和代谢蔗糖的能力。有些学者甚至把库器官中的SS活性作为库强的标志(张明方等,2002)。本试验结果表明,在新球膨大的过程中SPS活性不断增加,加大了新球这个强源;新球中SS活性在进入半枯期前始终不断上升,提高了“源"与“库"之间的蔗糖浓度梯度,增大了库强。故SS和SPS在调节唐菖蒲“源-库”关系中起着举足轻重的作用。
淀粉是新球和籽球主要的贮藏物质,尤其当进入籽球快速膨大期,淀粉的含量显著增加,说明此时新球和籽球已经成为全株的“代谢库”,而与此同时,其总淀粉酶活性也显著下降,有利于淀粉的迅速积累;Q酶活性迅速升高,增强了植株合成支链淀粉的能力,提高淀粉生物合成的速率,同时它还活化了合成淀粉的一些关键酶的活性,在短时间内催化合成更多的淀粉。所以淀粉酶和Q酶都不同程度地增大了库强,使光合产物源源不断地输入地下部分,最终完成籽球的膨大生长。
陈菊. 2003. 不同播种期对唐菖蒲匍匐茎和籽球生长发育的影响. 北京: 中国农业大学, 硕士学位论文.
|
李合生. 2000. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 169-172.
|
李利军, 孔红星, 何云, 等. 2003. 蔗汁中蔗糖含量的分光光度法测定. 分析测试学报, 22(4): 51-54. DOI:10.3969/j.issn.1004-4957.2003.04.015 |
李永庚, 于振文, 江东, 等. 2001. 冬小麦旗叶蔗糖和籽粒淀粉合成动态及其有关酶活性的研究. 作物学报, 27(5): 658-664. DOI:10.3321/j.issn:0496-3490.2001.05.017 |
齐天岩, 李天来, 刘海涛, 等. 2005. 番茄不同部位中糖含量和相关酶活性的研究. 园艺学报, 32(2): 239-243. DOI:10.3321/j.issn:0513-353X.2005.02.010 |
钱树林. 2007. 唐菖蒲籽球发育特点及其碳水化合物代谢变化. 中国农业大学学报, 12(2): 34-39. DOI:10.3321/j.issn:1007-4333.2007.02.007 |
沈波, 李太贵, 陈能, 等. 1997. 温度对早籼水稻稻米垩白发生与胚乳物质形成的影响. 中国水稻科学, 11(3): 183-186. DOI:10.3321/j.issn:1001-7216.1997.03.012 |
沈淞海, 沈海铭. 1994. 甘薯生长发育过程中可溶性糖含量与淀粉积累的关系. 浙江农业大学学报, 20(4): 400-404. |
孙红梅, 李天来, 李云飞. 2005. 百合鳞茎发育过程中碳水化合物含量及淀粉酶活性变化. 植物研究, 25(1): 59-63. |
夏宜平, 杨玉爱, 杨肖娥, 等. 2005. 郁金香更新鳞茎发育的碳同化物积累与内源激素变化研究. 园艺学报, 32(2): 278-283. DOI:10.3321/j.issn:0513-353X.2005.02.017 |
张明方, 李志凌. 2002. 高等植物中与蔗糖代谢相关的酶. 植物生理学通讯, 38(3): 289-295. |
张秀梅, 杜丽清, 谢江辉, 等. 2006. 蔗糖代谢相关酶在卡因菠萝果实糖积累中的作用. 果树学报, 23(5): 707-710. |
周素平, 何玉科, 李式军. 1999. 芋测球茎发育的形态机理. 西北植物学报, 19(3): 408-414. |
Huber S C. 1983. Role of sucrose-phosphate synthase in parti-tioning of carbon in leaves. Plant Physiol, 71: 818-821. DOI:10.1104/pp.71.4.818 |
Keller F, Lusdlow M M. 1993. Carbohydrate metaboliam in drought-stressed leaves of pigeonpea (Cahamnus cajan). J Exp Bot, 44: 1351-1359. DOI:10.1093/jxb/44.8.1351 |
Lrnvell C A, Tomlinson P T, Koch K E, et al. 1989. Sucrose-metabolizing enzymes in transport and adjacent sink structure in developing citrus fruit. Plant Physiol, 90: 1394-1402. |
Merlo L, Passera C. 1991. Changes in carbohydrate and enzyme levels during development of leaves of Prunus persica, a sorbitol synthesizing species. Physiol Plant, 83: 621-626. |
Nakamura Y, Yuki K. 1992. Changes in enzyme activities associated with carbohydrate metabolism during the development of rice endosperm. Plant Science, 82(1): 15-20. DOI:10.1016/0168-9452(92)90003-5 |
Rufty T W, Kerr P S, Huber S C. 1983. Characterization of diurnal changes in activities of enzymes involved in sucrose biosynthesis. Plant Physiol, 73: 428-433. DOI:10.1104/pp.73.2.428 |
Zhun Y J, Komor E, Moore P H. 1997. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose hospate synthase. Plant Physiol, 115: 609-616. DOI:10.1104/pp.115.2.609 |
 2008, Vol. 44
2008, Vol. 44

