文章信息
- 王义, 李仙, 赵文君, 孙春玉, 张美萍.
- Wang Yi, Li Xian, Zhao Wenjun, Sun Chunyu, Zhang Meiping.
- 刺五加体细胞胚胎发生过程及解剖学观察
- Anatomic Observation in the Process of Somatic Embryogenesis of Acanthopanax senticosus
- 林业科学, 2008, 44(7): 17-22.
- Scientia Silvae Sinicae, 2008, 44(7): 17-22.
-
文章历史
- 收稿日期:2008-04-07
-
作者相关文章
2. 哈尔滨工业大学(威海)分校 威海 264209;
3. 吉林省白山市经济开发区管理委员会 白山 134300
2. Harbin Institute of Technology at Weihai Weihai 264209;
3. Management Committee of Baishan Economy Development Zone Baishan 134300
刺五加(Acanthopanax senticosus)是五加科(Araliaceae)五加属(Acanthopanax)的一种落叶灌木,其嫩茎、嫩叶为优质山野菜,根、茎、叶、皮、果实均可入药(吉林省中医中药研究所,1982)。单纯依靠野生资源很难保证可持续开发利用。刺五加的种子在自然条件下出苗率很低,实生野生苗极少见,而且如连续采摘刺五加鲜叶2~3年,植株就衰亡,如果秋季挖根1次,需要10~15年左右的自然恢复期才能第2次采挖;同时刺五加的引种驯化、人工栽培技术尚不成熟。早在1992年出版的《中国植物红皮书——稀有濒危植物》第一册(傅立国,1992)中,刺五加被列为濒危植物。
目前,国内外对刺五加的研究主要集中在中药化学、药理学、生态学等方面(吉林省中医中药研究所,1982;祝宁等,1998;傅克治,1987;中国医学科学院药用植物资源开发研究所, 1991;王志睿等,2003;祖元刚等,2005),而对离体形态发生的研究报道较少且不系统(宋永贤等, 2005;梁建萍,2005;张喜春等,1996;张健夫,2004;邢朝斌等,2005;2006)。
刺五加组织培养周期短,人为可控,可加速良种繁育。本试验以刺五加不同部位为供试材料,筛选最优外植体和培养基质、最佳培养条件,建立了刺五加高效再生体系,同时进行了刺五加形态建成研究,以期为遗传转化受体系统的建立、种苗和医药工业原料的工厂化生产奠定理论和技术基础。
1 材料与方法 1.1 愈伤组织诱导和分化外植体材料为2004年7月采集于吉林省临江的1~2年生刺五加实生苗。取刺五加的须根、茎、叶,用流水冲洗干净,用0.1%氯化汞消毒8~10 min,无菌水漂洗3~5遍,叶片切成大小为0.5 cm×0.5 cm的方块,茎、须根切成1 cm左右的小段,备用。
1.2 基本培养基的选择基本培养基为MS和B5,蔗糖浓度为30 g·L-1, 琼脂6.5 g·L-1,灭菌前pH值调至5.8,高温高压灭菌15~20 min。常规培养条件为温度(23±2)℃,每天16 h光照。培养材料每月继代1次。
1.3 诱导培养基的选择筛选出的基本培养基,附加不同浓度、不同种类的植物生长调节物质,蔗糖浓度为30 g·L-1, 琼脂6.5 g·L-1,灭菌前pH值调至5.8,高温高压灭菌15~20 min。常规培养条件为温度(23±2)℃,每天16 h光照。培养材料每月继代1次。
1.4 石蜡切片的制作用FAA固定液固定24 h,放置于70%酒精中保存,然后将组织块进行脱水、透明、浸蜡、包埋,常规切片,切片厚度为l0 μm,60 ℃烘干, 铁钒-苏木精染色,加拿大树胶封片,TS100型倒置显微镜下观察并照相。
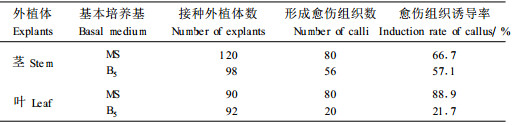
2 结果与分析 2.1 愈伤组织诱导的影响因素 2.1.1 不同基本培养基对愈伤组织诱导的影响以刺五加实生苗的茎和叶为外植体,以MS和B5为基本培养基进行离体诱导,观察30 d后愈伤组织诱导率(表 1)。由表 1看出,接种到不同培养基上的刺五加茎和叶的愈伤组织诱导率有差异,MS培养基上茎和叶的愈伤组织诱导率均高于B5培养基。尤其是叶片在MS培养基中的愈伤组织诱导率达到88.9%,是叶片外植体在B5培养基中愈伤组织诱导率的4倍左右,其诱导能力显著高于B5培养基。茎在MS培养基和B5培养基中的诱导率差别不显著,但是MS培养基的诱导率也比B5培养基高。由此可见,MS培养基更适合刺五加离体培养,因此选择MS培养基为以下试验的基本培养基。
|
|
刺五加外植体在接种4 d后,部分叶片边缘起褶并向上卷起,部分叶片内部隆起;茎和根没有变化。接种5~7 d,叶片变化更加明显,部分茎段两端开始膨大,部分茎段整体均匀膨大。到第30天,3种外植体均形成愈伤组织(表 2)。由表 2可以看出,3种外植体均能脱分化形成愈伤组织,但各外植体形成愈伤组织的能力有明显差异,叶片愈伤组织诱导率最高,达92.8%,茎为83.3%,根为33.3%,诱导率最低。从观察中可看出,叶片从接种第4天开始脱分化,到第30天时形成愈伤组织,诱导率能达到92.8%,脱分化能力极高;与此相反,根脱分化形成愈伤组织后,其诱导率始终为33.3%,诱导效果明显次于叶片和茎段。这可能与其植株本身的特性和生理状态有一定关系。本试验认为,刺五加的叶片和茎适合离体培养,而根离体培养效果一般。
|
|
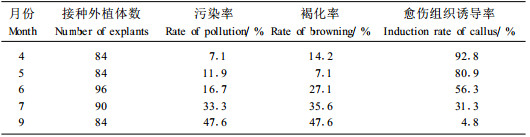
不同发育时期的外植体生理状态各不相同。因此,外植体脱分化及分化能力也与植物生长发育的时期有着密切的关系。本试验对不同月份采集的刺五加叶片进行离体诱导,观察外植体愈伤组织诱导情况(表 3)。由表 3可以看出,不同发育时期外植体的诱导情况有显著差异。4月取材外植体诱导率高,褐化程度较低,且消毒容易,污染率也低,但此时取材可接种的外植体数量不多。5月取材,诱导率也较高,为80.9%,污染率较低,褐化率仅为7.1%,试验结果表明此时的外植体处于组培最佳取材的生理发育期,容易脱分化或直接分化。而6、7月和9月的外植体脱分化较难,外植体易染菌,并伴随着褐化现象。尤其是9月的外植体材料,不仅诱导率低,染菌率也高,即使诱导出愈伤组织也会发生褐变。这不仅与外植体本身所产生的酚类物质有关,还与外植体材料所处的生长发育时期有关。所以,在本试验体系下刺五加离体培养最适取材季节为4—5月。
|
|
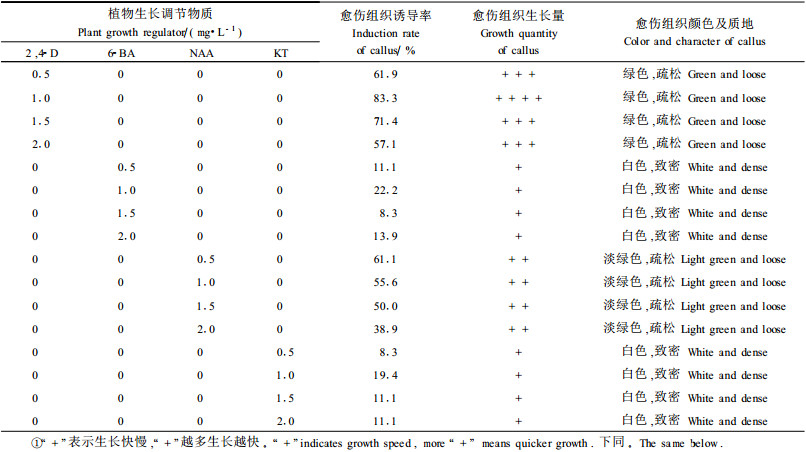
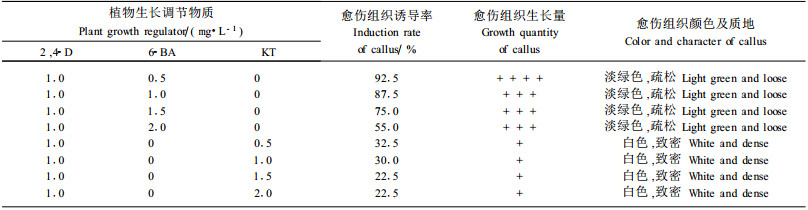
1) 单独使用植物生长调节物质的诱导效应 外植体在添加不同植物生长调节物质的培养基中诱导形成的愈伤组织的颜色和质地有一定差异(表 4及图版Ⅰ-1~5)。由表 4可以看出,4种植物生长调节物质中2, 4-D对愈伤组织诱导及生长速度的影响最大,单独使用浓度为1.0 mg·L-1时,诱导率和生长量最高。虽然使用NAA的愈伤组织诱导率也较高,但是NAA诱导的愈伤组织在培养一段时间后,少部分出现褐化现象。6-BA和KT在单独使用时,也可形成愈伤组织,但其诱导能力远不如单独使用2, 4-D或NAA。单独使用2, 4-D或NAA所形成的绿色、淡绿色愈伤组织能在继代过程中不断形成愈伤组织或在改变一定条件时可再分化形成不定芽,因此,2, 4-D和NAA对于诱导外植体脱分化是有效的,其中单独使用2, 4-D的效果优于单独使用NAA。6-BA、KT 2种生长调节物质在单独使用时诱导率较低。因此,应探讨各生长调节物质之间的配合使用。
|
|

|
图版Ⅰ Plate Ⅰ |
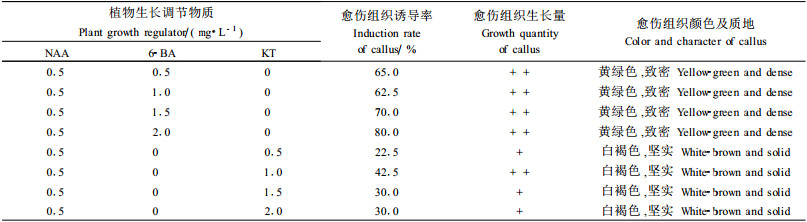
2) 植物生长调节物质的配合使用效果 ①NAA与细胞分裂素的配合使用 由表 5可以看出,外植体在添加NAA和6-BA的组合中,愈伤组织诱导率高于NAA和KT的组合。前者形成的愈伤组织为黄绿色、致密状(图版Ⅰ-1),后者形成的愈伤组织为白褐色、坚实状(图版Ⅰ-2)。其中NAA浓度为0.5 mg·L-1、6-BA浓度为2.0 mg·L-1时,愈伤组织诱导率最高可达80.0%;外植体在添加NAA+KT的基质中愈伤组织诱导率较低,最高时为42.5%。虽然NAA和6-BA的愈伤组织诱导率较高,但是两者形成的这种质地坚硬的愈伤组织在继代培养过程中均逐渐转变为褐色愈伤组织,最后死亡。
|
|
② 2, 4-D与细胞分裂素的配合使用 由表 6可以看出,在2, 4-D浓度不变的情况下,改变6-BA和KT浓度,外植体均能诱导形成愈伤组织,但是愈伤组织的颜色及松散度明显不同。用2, 4-D和6-BA诱导的愈伤组织为淡绿色、疏松状(图版Ⅰ-3,4);而用2, 4-D和KT诱导的愈伤组织为白色、致密状(图版Ⅰ-5)。黄绿色疏松愈伤组织能够在不含2, 4-D的培养基中分化形成芽或体细胞胚,而白色致密的愈伤组织在继代培养过程中由白色转变为褐色逐渐死亡。由此发现,6-BA是诱导刺五加离体培养的重要调节物质。
|
|
综上所述,2, 4-D和6-BA是刺五加愈伤组织诱导必不可少的生长调节物质。外植体在添加1.0 mg·L-12, 4-D和0.5 mg·L-1 6-BA的培养基中愈伤组织诱导率最高为92.5%。此培养基为刺五加愈伤组织诱导的最适组合。
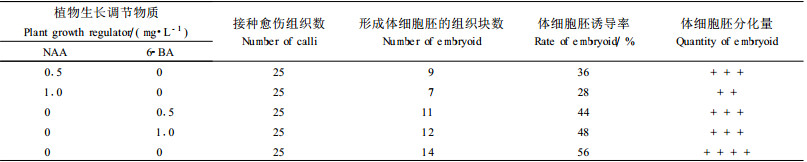
2.2 刺五加体细胞胚胎发生途径再生植株 2.2.1 体细胞胚的诱导将继代3次的愈伤组织接种到以下5种培养基中培养1个月后,愈伤组织表面出现一些松散的淡黄色颗粒状物——体细胞胚(图版Ⅰ-6, 7)。第5个处理,即不含任何激素的培养基形成体细胞胚的能力最高(表 7)。因此,确定刺五加体细胞胚诱导培养基为无植物生长调节物质的MS培养基。
|
|
将上述5种处理所获得的体细胞胚接种到不含任何激素的培养基中进行培养。1个月后,体细胞胚能够在不含任何激素的培养基中从光滑的小颗粒逐渐发育成小子叶胚(图版Ⅰ-11)。继续在无激素培养基质中培养,胚状体进一步成熟发育成子叶胚(图版Ⅰ-8),进而发育成熟形成再生植株(图版Ⅰ-9,10)。因此,无激素的MS培养基亦是刺五加体细胞胚发育、成熟的最适培养基。
2.2.3 细胞学观察结果分析首次对刺五加培养物进行细胞学观察,证实刺五加组织培养中存在着2类愈伤组织:非胚性愈伤组织呈松软状,细胞大而不规则,看不到明显的细胞核,细胞液泡化程度高,细胞染色浅,非胚性细胞大多是横向分裂,形成由多个细胞构成的纤维状细胞,而且这些细胞相互交替出现而形成了非胚性愈伤组织的多种形态结构(图版Ⅰ-13);胚性愈伤组织为结构比较致密的颗粒状,其中大部分细胞体积小、核大、质浓、染色深、细胞间排列紧密,且以细胞团形式存在。胚性细胞除进行横向分裂外,可能还进行纵向分裂,因而形成了细胞之间结合紧密的多细胞团,这些细胞团表现为不易分离的颗粒体,这一点可以说明为什么刺五加组织培养中存在着各式各样质地各异的愈伤组织。能产生体细胞胚的胚性细胞在显微镜下能够很容易地跟周围细胞区分开来,这些细胞跟周围的细胞有一个很明显的界限(图版Ⅰ-12)。无论是石蜡切片还是水装片观察,都不难看出,体细胞胚的发生与合子胚的发育相同,也是经过球形胚、心形胚(图版Ⅰ-14)、鱼雷形胚(图版Ⅰ-15)以及子叶胚,最终发育成完整植株。Steward等(1958)指出,细胞与其周围组织之间生理上的隔离是其进行胚状体发生的先决条件。Zee等(1980)在芹菜(Apium graveolens)中观察到,在多细胞原胚阶段胚体周围有一层细胞构成“边缘细胞层”,后来此层细胞退化解体,在胚状体与周围组织间形成缝隙。本研究也观察到在刺五加体细胞胚处于多细胞原胚阶段跟周围的细胞形成较为清晰的细胞界线(图版Ⅰ-16)。
3 结论与讨论 3.1 影响愈伤组织诱导的因素外植体是影响愈伤组织诱导的因素之一。前人对刺五加诱导的研究主要集中在种胚、叶片和茎尖的诱导和培养(宋永贤等, 2005;梁建萍,2005;张喜春等,1996;张健夫,2004;邢朝斌等,2006),而本研究以刺五加根、茎、叶为外植体进行诱导,发现刺五加的根、茎和叶在诱导培养基上均能脱分化形成愈伤组织,但这3种外植体的诱导能力有明显差异,这与外植体的分化程度、生理状态密切相关,其中叶片最快、最易形成愈伤组织,茎次之,根最差。
外植体的生理状态与发育程度都直接影响其脱分化能力。在不同生长时期外植体的生理状态各不相同,一般生理代谢旺盛而分化程度较低的组织有利于脱分化形成愈伤组织。本研究发现,4—5月的外植体材料处于生理发育期,容易脱分化形成愈伤组织,并且此时取材污染率及褐化死亡率最低;其他月份取材则都不同程度地受到褐化和污染的影响,尤其是9月取材,污染率高,诱导率低。造成这种差异可能与植物体内酚类含量和多酚氧化酶活性的季节性变化以及环境中微生物的数量有一定关系。
本研究中无论是单独还是配合使用,2, 4-D都表现出较强诱导作用,并且在1~2 mg·L-1的浓度范围内达高诱导率。其他3种物质对刺五加愈伤组织的诱导作用都明显不如2, 4-D。单独使用2, 4-D时,诱导率最高可达83.3%。这说明2, 4-D也是刺五加脱分化最有效的植物生长调节物质。在配合使用生长素和细胞分裂素类物质时,诱导率总体水平上升,说明刺五加愈伤组织发生是生长素和细胞分裂素共同作用的结果。
3.2 刺五加离体培养形态发生过程中2, 4-D的作用植物生长调节物质是刺五加培养物形态发生中重要的调控因子。通常情况下,植物组织培养中诱导细胞的脱分化、分化及植株再生均离不开植物生长调节物质的连续供给,而改变培养基成分,特别是植物生长调节物质的比例与组成,是组织培养成功的关键。试验表明,在诱导胚状体发生的培养基中必须含有生长素类物质,特别是2, 4-D,才能诱导细胞处于胚胎发生状态,但只有将这种处于胚胎发生状态的培养物再转移到不含有生长素(或生长素浓度很小)的培养基上才能产生大量的胚状体(崔凯荣等,2000;周俊彦等,1982)。
本研究认为2, 4-D对于诱导外植体脱分化是有效的。刺五加离体培养中2, 4-D的浓度对愈伤组织的诱导起很大的作用。虽然2, 4-D是诱导愈伤组织不可缺少的生长调节物质,但是2, 4-D的存在会抑制刺五加形态发生。若培养物一直在含有2, 4-D的基质中培养,培养物只会不断形成愈伤组织,而不会形成不定芽或体细胞胚。将愈伤组织接种在不含2, 4-D的培养基中培养,1个月后愈伤组织表面形成一些松散的淡黄色颗粒状物,这种淡黄色颗粒状物在无激素培养基中形成进而发育、成熟形成再生植株。这与日本落叶松(Larix kaempferi)、胡萝卜(Daucus carrota)、金鱼草(Antirrhinum majus)、茄子(Solanum melongena)、芹菜、人参(Panax ginseng)(吕守芳等,2005;张琪等, 1991;桂耀林等,1987;崔凯荣等,2000;张立功等,1981)等植物的体细胞胚胎发生的结论是一致的,即2, 4-D在诱导的前期是有利的,但抑制体胚后期发育。因此,认为2, 4-D是愈伤组织诱导的重要因素,但如果不及时降低其浓度,将抑制体细胞胚的形成,不能通过体胚发生途径获得再生植株。这与邢朝斌等(2006)、宋永贤等(2005)关于刺五加的报道不同。
崔凯荣, 邢更生. 2000. 植物激素对体细胞胚胎发生的诱导和调节. 遗传, 22(5): 349-354. DOI:10.3321/j.issn:0253-9772.2000.05.023 |
傅克治. 1987. 中国刺五加. 哈尔滨: 黑龙江人民出版社, 65-65.
|
傅立国. 1992. 中国植物红皮书——稀有濒危植物. 北京: 科学出版社.
|
桂耀林, 郭仲琛, 徐廷玉, 等. 1987. 西洋参组织培养研究. 植物学报, 29(2): 223-224. |
吉林省中医中药研究所. 1982. 长白山植物药志. 长春: 吉林人民出版社, 686-688.
|
梁建萍. 2005. 刺五加叶片组织培养研究. 山西农业大学学报:自然科学版, 25(4): 340-341. |
吕守芳, 张守攻, 齐力旺, 等. 2005. 日本落叶松体细胞胚胎发生的研究. 林业科学, 41(2): 48-52. |
宋永贤, 孙利, 孙金元. 2005. 刺五加离体培养中胚状体的诱导. 时珍国医国药, 16(5): 440-442. DOI:10.3969/j.issn.1008-0805.2005.05.051 |
王志睿, 林敬明, 张忠义. 2003. 刺五加化学成分与药理研究进展. 中药材, 26(8): 603-606. DOI:10.3321/j.issn:1001-4454.2003.08.035 |
邢朝斌, 沈海龙, 赵丽娜, 等. 2006. 刺五加的体细胞胚胎发生研究. 中草药, 37(5): 669-772. |
邢朝斌, 陈正恒, 曹蕾. 2005. 刺五加组织培养与细胞工程进展. 中草药, 36(12): 1896-1899. DOI:10.3321/j.issn:0253-2670.2005.12.052 |
张琪, 高微微. 1991. 影响人参种胚体细胞胚胎发生的几个因素. 植物学通报, 8(增刊): 43-47. |
张立功, 张永华, 王凤勤, 等. 1981. 杨树体细胞胚状体的诱导发生. 林业科学, 27(4): 426-428. |
张喜春, 张中弘. 1996. 影响刺五加茎尖培养的因素. 东北林业大学学报, 24(6): 107-110. |
张健夫. 2004. 刺五加的组织培养及快速繁殖的研究. 长春大学学报, 14(4): 73-75. DOI:10.3969/j.issn.1009-3907-B.2004.04.025 |
中国医学科学院药用植物资源开发研究所. 1991. 中国药用植物栽培学. 北京: 农业出版社, 178-178.
|
周俊彦. 1982. 植物体细胞在组织培养中产生的体细胞胚Ⅱ:影响植物体细胞胚胎发生和发育的因素. 植物生理学报, 8(1): 91-99. |
祝宁, 卓丽环, 臧润国. 1998. 刺五加会成为濒危种吗. 生物多样性, 6(4): 253-259. DOI:10.3321/j.issn:1005-0094.1998.04.003 |
祖元刚, 曹建国. 2005. 刺五加生活史特征及其形成机制. 北京: 科学出版社.
|
Steward F C, Mapes M O, Mears K. 1958. Growth and organized development of cultured cells Ⅱ: Organization in culture growth from suspension cells. Amer Bot, 45: 705-708. DOI:10.1002/ajb2.1958.45.issue-10 |
Zee S Y, Wu S C. 1980. Somatic embryogenesis in the leaf explants of Chinese celery. Aust Bot, 28: 429-436. DOI:10.1071/BT9800429 |
 2008, Vol. 44
2008, Vol. 44