文章信息
- 魏媛, 喻理飞, 张金池.
- Wei Yuan, Yu Lifei, Zhang Jinchi.
- 退化喀斯特植被恢复过程中土壤微生物学特性
- Soil Microbial Characteristics during Succession of Degraded Karst Vegetation
- 林业科学, 2008, 44(7): 6-10.
- Scientia Silvae Sinicae, 2008, 44(7): 6-10.
-
文章历史
- 收稿日期:2007-07-11
-
作者相关文章
2. 南京林业大学森林资源与环境学院 南京 210037
2. College of Forest Resources and Environment, Nanjing Forestry University Nanjing 210037
贵州地处我国西南喀斯特地区的中心,境内多为碳酸岩山地。因生态环境脆弱,植被破坏后很难恢复,形成“石漠化”,退化喀斯特森林生态系统的恢复与重建已成为农业生产环境改善、区域经济发展及人民脱贫致富的迫切要求。
土壤微生物在植物凋落物的降解、土壤养分循环与平衡、土壤理化性质的改善中起着重要作用。高质量的土壤一般具有良好的生物活性、由稳定的微生物种群组成(孙波等,1997)。随着人们对土壤微生物重要生态学意义认识的不断加深,对土壤微生物多样性的研究日益增多(蔡燕飞等,2003;陈素华等,2002;杨芳等,2002)。但人们在研究生态系统恢复时,较多地考虑植被指标以及土壤理化性质(喻理飞等,2002),而对于土壤微生物学性质的研究较少,尤其对贵州退化喀斯特植被恢复过程中土壤微生物学特性缺乏系统研究(朱海燕等,2006;郑华等,2004)。本试验以贵州喀斯特高原生态综合治理示范区不同恢复阶段的植物群落为研究对象,研究土壤微生物学特征变化,为揭示退化群落恢复机理、构建恢复技术体系提供参考。
1 研究区概况研究区地处贵州省西南部贞丰县北盘江镇板围村(105°38′487″ E,25°38′982″ N),是国家“十五”科技攻关计划项目“喀斯特高原生态综合治理技术与示范”的试验示范区。该区出露的岩石以纯质石灰岩和白云岩为主,裸露型喀斯特峡谷地貌,海拔800~1 150 m;河谷气候,日照充足,年均气温15.8 ℃,年均极端最高气温32.4 ℃,≥10 ℃年积温6 542 ℃;年均降水量1 100 mm,10月至次年4月为干旱季节,5—10月为雨季,降水量占全年的90%以上;土层浅薄且不连续,pH值为6.5~8,土体持水能力很弱,土壤经常处于干旱状态,特别是冬季,因此常在雨季(5—6月)造林。与常态地貌相比,该区生境复杂多样,有石面、石沟、石洞、土面等多种小生境类型。该区内退化植被恢复过程为裸地阶段(Ⅰ)、草本群落阶段(Ⅱ)、灌木阶段(Ⅲ)和乔木阶段(Ⅳ):
裸地阶段:极少量阳性先锋树种幼苗,如野桐(Mallotus tenuifolius)、盐肤木(Rhus chinensis);无草本植物。
草本群落阶段:草本植物主要有荩草(Arthraxon hispidus)、芒萁(Dicranopteris dichotoma)、猪毛蒿(Artemisia scoparia)及灰苞蒿(A.roxburghiana)等;木本植物主要有野桐(Mallotus tenuifolius)、青檀(Pteroceltis tatarinowii)、火棘(Pyracantha fortuneana)及构树(Broussonetia papyrifera)等。
灌木群落阶段:主要有川钓樟(Lindera pulcherima var. hemsleyana)、清香木(Pistacia weinmannifolia)、云南鼠刺(Itea yunnanensis)、圆叶乌桕(Sapium rotundifolium)、山麻杆(Alchornea davidii)、石岩枫(Mallotus repandus)、烟管荚蒾(Viburnum utile)、重阳木(Bischofia polycarpa)、暖木(Meliosma veitchiorum)、薄叶鼠李(Rhamnus leptophylla)及悬钩子蔷薇(Rosa rubus)等。
乔木群落阶段:乔木层主要有青檀、朴树(Celtis sinensis)、南酸枣(Choerospondias axillaris)、香椿(Toona sinensis)、小叶榕(Ficus concinna)及川钓樟等;灌木层主要有竹叶椒(Zanthoxylum planispinum)、喜玛拉雅旌节花(Stachyurus himalaicus)、灰毛浆果楝(Cipadessa cinerascens)、山麻杆、野桐及石岩枫等。
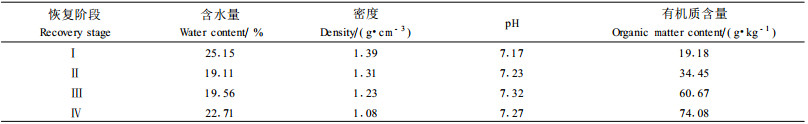
2 试验方法以空间代替时间的方法(梁士楚,1992),在有代表性的地段,选择裸地、草本群落、灌木群落、乔木群落4种类型的样地(面积分别为800 m2,分别标记为Ⅰ,Ⅱ,Ⅲ及Ⅳ)。用锄头和铁铲采用S型或梅花型三点混合取样法对每类样地分不同生境(土面、石沟、石槽)不同层次(A层和B层)进行土壤取样(在土壤剖面上先取B层,再取A层),同一样地按相同生境、相同层次的3个重复样等比例混匀为一个混合样,每一类型样地共取6个混合样,迅速将混合样放入无菌袋内并装入带冰块的取样箱中运回。在实验室的无菌台上将混合样除去可见的土壤动植物残体,过2 mm筛,将其分为2份,1份鲜样保存于4 ℃冰箱中,立即进行土壤微生物学指标分析;另1份土样经风干、磨细、过100目筛,备用。采样时间为2007年3月16日。供试土壤的基本情况见表 1。
|
|
土壤微生物记数采用稀释平板表面涂布法(许光辉等,1986):细菌、真菌、放线菌分别采用牛肉膏蛋白胨琼脂培养基、马丁氏(Martin)培养基和改良高氏一号培养基,具体操作参照《土壤微生物分析手册》(许光辉等,1986);土壤氨化作用强度、硝化作用强度、固N作用强度、纤维素分解作用强度及呼吸作用强度分别采用土壤培养法、溶液培养法、土壤培养法、埋片法及碱液吸收滴定法,具体操作参照《土壤微生物分析手册》(许光辉等,1986)及《土壤微生物生态学及其实验技术》(姚槐应等,2006);微生物生物量碳的测定采用熏蒸-浸提法(Vance et al., 1987);土壤有机碳的测定采用重铬酸钾-硫酸外加热法(鲁如坤,1998)。
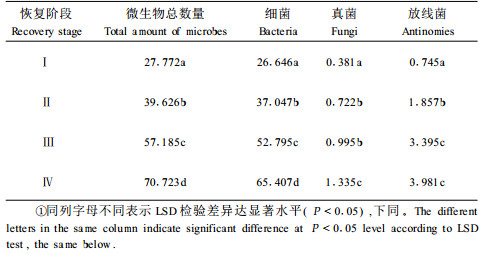
3 结果与分析 3.1 土壤微生物数量分析结果表明(表 2),随着退化植被恢复,土壤细菌、真菌、放线菌数量及微生物总数均呈上升趋势,不同植被群落类型中土壤微生物数量表现为乔木群落阶段>灌木群落阶段>草本群落阶段>裸地阶段,且4个植被类型中细菌均为优势类群,其在微生物总数中分别占95.95%,93.49%,92.32%和92.48%。这说明土壤细菌在退化喀斯特植被凋落物分解、腐殖质合成、土壤养分循环、物质和能量的代谢过程中起着重要作用。真菌对分解木质化纤维成分的作用同样不可低估(Pill et al., 1993;吴兴亮等,1993)。因真菌菌体或生物量较大,其对土壤质量的改善、植物生长的促进仍具有不可忽视的作用。退化喀斯特植被恢复过程中土壤微生物的数量变化较大,乔木群落阶段是植被恢复的顶极群落,其细菌、放线菌、真菌及总数均为最高,细菌、真菌、放线菌数量分别占微生物总数的92.48%、1.89%和5.63%,这与龙健等(2003)的研究结果相近。分析结果说明植被恢复有利于土壤生物循环和生物富集作用。
|
|
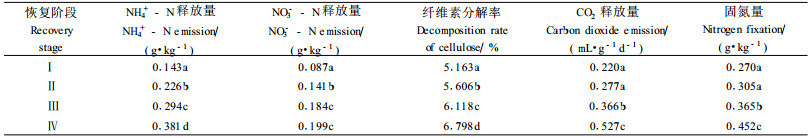
分析结果表明(表 3),退化喀斯特植被恢复过程中,土壤生化作用强度明显上升。从裸地阶段→草本群落阶段→灌木群落阶段→乔木群落阶段,土壤氨化作用强度分别上升58.04%,30.09%和29.59%;硝化作用强度分别上升62.07%,30.50%和8.15%;纤维素分解作用强度分别上升8.59%,9.13%和11.11%;土壤呼吸量分别上升25.90%,32.1%和44.00%;固氮作用强度分别上升13.00%,19.67%和23.84%。乔木群落阶段土壤CO2释放量最高,土壤中有机残体的分解速度较快,尤其对新进入土壤的有机残体的分解速度更快,而且其凋落物量大,加之微生物数量丰富,所以凋落物的分解速度较快。这说明随着退化植被的恢复,土壤肥力逐渐提高,土壤环境条件有利于微生物的生长,微生物活性增强,加快了土壤中营养元素的循环速度,增加了土壤中有效养分的供应,提高了土壤质量。
|
|
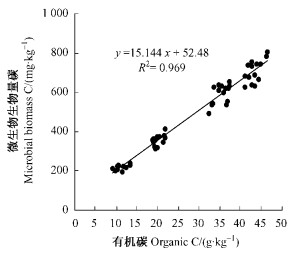
土壤微生物生物量碳含量是反映土壤质量变化的理想指标(徐秋芳等,2007),表 4表明:供试土壤的微生物生物量碳含量为219.76~695.58 mg·kg-1,与任京辰等(2006)研究的贵州岩溶土壤结果(179~844 mg·kg-1)及朴河春等(2003)研究的贵州山地(海拔1 000~2 000 m)黄壤农田结果(200~400 mg·kg-1)相近。退化喀斯特植被恢复过程中,供试土壤微生物生物量碳呈上升趋势:乔木群落阶段>灌木群落阶段>草本群落阶段>裸地阶段。裸地阶段微生物富集不明显,这可能是由于裸地阶段大量对于土壤条件变化敏感的微生物种群消失,仅保留了抗逆性较强的少量微生物。土壤有机碳的大小排列顺序与之相吻合,说明土壤微生物生物量碳与土壤有机碳之间关系密切。从图 1可以看出,微生物生物量碳与土壤有机碳呈显著正相关关系(P < 0.01)。在通常情况下,土壤碳含量高,土壤微生物生物量也高(Jenkinson et al., 1976; Insam et al., 1988; Singh et al., 1989)。土壤微生物生物量碳Cmic与土壤有机碳Corg的比值(Cmic/Corg)是衡量林地土壤有机碳积累或缺失的一个重要指标(Insam et al., 1988),比微生物生物量碳含量更能体现土壤生物学肥力特性。Cmic/Corg在退化喀斯特植被恢复过程中逐渐减小(表 4),说明土壤正处于碳素的积累过程中,土壤生物学肥力在不断提高,土壤质量也在逐渐提高。
|
图 1 土壤微生物生物量碳与土壤有机碳的关系 Figure 1 Relation between microbial biomass carbon and soil organic carbon |
|
|
退化喀斯特植被恢复从早期变化剧烈生境向后期中生化生境发展。早期的群落环境稳定性低,光照、土壤温度、相对湿度及气温等的波动性较大,植被稀少,有极少量阳性先锋树种,土壤微生物的生存环境受到影响,因而裸地阶段土壤微生物数量较少,生化功能较低。后期群落环境稳定性高,光照强度减弱,土壤水分蒸发量降低,土壤温度、相对湿度及气温等的波动性小,物种组成丰富,具有最高的根系生物量,根系本身及其分泌物为土壤微生物群落提供了丰富的碳源,因此其土壤微生物数量及生物量碳增加。
4 结论与讨论龙健等(2004)研究结果表明,喀斯特森林退化演替过程(森林—灌木林—灌丛—草地—裸荒地)中,土壤微生物总数下降、土壤呼吸作用强度减弱、土壤生化作用强度也呈降低趋势。本试验也得到与之相一致的结果。土壤微生物活性上升是表征退化喀斯特植被恢复过程中生态功能上升的重要生物学指标之一。可见,贵州花江退化喀斯特植被恢复过程中的土壤质量正以不同的速率处于恢复进程之中,这提示我们可以通过施用菌肥来提高土壤微生物活性,从而促进植被恢复。菌肥的选择及施用技术有待于进一步研究。
退化喀斯特植被不同恢复阶段土壤微生物数量、生化作用强度、微生物生物量碳与有机质含量密切相关,均在裸地阶段→草本群落阶段→灌木群落阶段→乔木群落阶段的恢复过程中呈上升趋势。土壤微生物数量在土壤中的变化可能与土壤有机质含量有关(陈楚莹等,2000)。微生物生物量碳虽然只占土壤总有机碳的1%~3%,但这一部分有机碳却影响着所有进入土壤的有机质的转化(Laurie et al., 1998),因此微生物生物量可以作为退化喀斯特植被恢复过程中土壤质量的生物指标之一。但土壤微生物生物量只反映了微生物在总量上的差异,不能反映土壤微生物在组成上的变化,还应深入开展土壤微生物多样性研究。
孙波等(1999)认为土壤微生物数量与土壤微生物生物量有一定的相关性,本研究也得到了类似的结果。退化喀斯特植被恢复过程中,土壤三大微生物数量及微生物总数、生化作用强度与微生物生物量碳的变化规律一致,均是乔木群落阶段>灌木群落阶段>草本群落阶段>裸地阶段。土壤微生物数量、生化作用强度与微生物生物量碳可以作为土壤生物活性的一种表现方法(焦如珍等,2005)。由于平板分离法仅能分离出部分种类的微生物,用其定量反映土壤微生物含量是不可靠的,而微生物生物量碳能更确切地反映土壤微生物在土壤中所起的作用,故最好将二者结合起来测定土壤微生物的变化趋势。
蔡燕飞, 廖宗文, 章家恩, 等. 2003. 生态有机肥对番茄青枯病及土壤微生物多样性的影响. 应用生态学报, 14(3): 349-353. DOI:10.3321/j.issn:1001-9332.2003.03.007 |
陈楚莹, 廖利平, 汪思龙, 等. 2000. 杉木人工林生态学. 北京: 科学出版社.
|
陈素华, 孙铁珩, 周启星, 等. 2002. 微生物与重金属间的相互作用及其应用研究. 应用生态学报, 13(2): 239-242. DOI:10.3321/j.issn:1001-9332.2002.02.027 |
焦如珍, 杨承栋, 孙启武, 等. 2005. 杉木人工林不同发育阶段土壤微生物数量及其生物量的变化. 林业科学, 41(6): 163-165. DOI:10.3321/j.issn:1001-7488.2005.06.028 |
梁士楚. 1992. 贵阳喀斯特山地云贵鹅耳枥种群动态研究. 生态学报, 12(1): 53-60. DOI:10.3321/j.issn:1000-0933.1992.01.013 |
龙健, 李娟, 江新荣, 等. 2004. 贵州茂兰喀斯特森林土壤微生物活性的研究. 土壤学报, 41(4): 597-602. DOI:10.3321/j.issn:0564-3929.2004.04.016 |
龙健, 李娟, 滕应, 等. 2003. 贵州高原喀斯特环境退化过程中土壤质量的生物学特性变化. 水土保持学报, 17(2): 47-50. DOI:10.3321/j.issn:1009-2242.2003.02.014 |
鲁如坤. 1998. 土壤农化分析. 北京: 中国农业出版社.
|
朴河春, 朱建明, 余登利, 等. 2003. 贵州山区十壤微生物生物量的碳同位素组成与有机碳同位索效应. 第四纪研究, 23(5): 546-556. DOI:10.3321/j.issn:1001-7410.2003.05.010 |
任京辰, 张平究, 潘根兴, 等. 2006. 岩溶土壤的生态地球化学特征及其指示. 地球科学进展, 21(5): 504-512. DOI:10.3321/j.issn:1001-8166.2006.05.009 |
孙波, 赵其国, 张桃林. 1997. 土壤质量与持续环境.土壤质量评价的生物学指标. 土壤, 29(5): 225-234. DOI:10.3321/j.issn:0253-9829.1997.05.001 |
孙波, 张桃林, 赵其国. 1999. 我国中亚热带缓丘区红粘土红壤肥力的演化Ⅱ.化学和生物学肥力的演化. 土壤学报, 36(2): 203-217. DOI:10.3321/j.issn:0564-3929.1999.02.008 |
吴兴亮, 王季槐, 钟金霞. 1993. 贵州茂兰喀斯特森林区真菌的种类及其生态分布. 生态学报, 13(4): 306-312. DOI:10.3321/j.issn:1000-0933.1993.04.001 |
徐秋芳, 姜培坤, 邬奇峰, 等. 2007. 集约经营板栗林土壤微生物量碳与微生物多样性研究. 林业科学, 43(3): 15-19. |
许光辉, 郑洪元. 1986. 土壤微生物分析手册. 北京: 农业出版社.
|
杨芳, 徐秋芳. 2002. 土壤微生物多样性研究进展. 浙江林业科技, 22(6): 39-41. DOI:10.3969/j.issn.1001-3776.2002.06.011 |
姚槐应, 黄昌勇. 2006. 土壤微生物生态学及其实验技术. 北京: 科学出版社.
|
喻理飞, 朱守谦, 叶镜中. 2002. 喀斯特森林不同种组的耐旱适应性. 南京林业大学学报:自然科学版, 26(1): 19-22. |
郑华, 欧阳志云, 王效科, 等. 2004. 不同森林恢复类型对土壤微生物群落的影响. 应用生态学报, 15(11): 2019-2024. DOI:10.3321/j.issn:1001-9332.2004.11.006 |
朱海燕, 刘忠德, 钟章成. 2006. 喀斯特退化生态系统不同恢复阶段土壤质量研究. 林业科学研究, 19(2): 248-252. DOI:10.3321/j.issn:1001-1498.2006.02.023 |
Insam H, Domsch K H. 1988. Relationship between soil organic carbon and microbial biomass on chronosequences of reclamation sites. Microbe Ecology, 15: 177-188. DOI:10.1007/BF02011711 |
Jenkinson D S, Powlson D S. 1976. The effects of biocidal treatments on metabolism in soil-Ⅴ. A method for measuring soil biomass. Soil Biol Biochem, 8: 209-213. DOI:10.1016/0038-0717(76)90005-5 |
Laurie A T, Mary A A, Ruth D Y. 1998. Forest floor microbial biomass a cross a northern hard wood successional sequence. Soil Biol Biochem, 31: 431-439. |
Pill E A, Clark F E. 1993. Soil microbial and biochemistry (In Chinese). Beijing: Science Technology Literature Press, 109-110.
|
Singh J S, Reghbanshi A S, Singh R S, et al. 1989. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna. Nature, 338: 499-500. DOI:10.1038/338499a0 |
Vance E D, Brookes P C, Jenkinson D C. 1987. An extraction method for measuring soil microbial biomass C. Soil Biology & Biochemistry, 19: 703-707. |
 2008, Vol. 44
2008, Vol. 44