文章信息
- 梁丽松, 王贵禧.
- Liang Lisong, Wang Guixi.
- 次氯酸钠处理对板栗货架期萌芽与激素含量变化的影响
- Effects of Sodium Hypochlorite Solution Dipping of Chinese Chestnut(Castanea mollissima) on Its Germination and Hormone Contents during Shelf-Life
- 林业科学, 2008, 44(6): 79-84.
- Scientia Silvae Sinicae, 2008, 44(6): 79-84.
-
文章历史
- 收稿日期:2007-08-16
-
作者相关文章
板栗(Castanea mollissima)是我国主要的经济林树种。我国板栗具有香、甜、糯的独特风味,品质高居世界之首,是我国出口创汇的主要果品之一。板栗是顽拗性种子,含水量高(通常可达40%~60%),采后呼吸强度大,贮藏过程中极易失水、腐烂、发芽,丧失食用价值和商品价值。目前,通过冷藏、气调等贮藏方式已延长了板栗的贮藏保鲜期,甚至达到全年供应,但关于板栗货架期保鲜方面的研究还鲜见报道。发芽是板栗货架期最严重的问题之一,抑制板栗货架期发芽是实现板栗高效流通的重要措施。
板栗种子具有生理休眠特性,当生理休眠解除后,板栗在适宜条件下可以萌发。低氧、高CO2、低温等环境条件可以诱导顽拗性种子产生次生休眠或强制休眠,进而抑制发芽(王贵禧等,1999)。板栗货架期环境温度较高,当板栗度过生理休眠期并从低温环境进入较高的室温环境时,在很短时间内迅速萌发,导致商品价值降低或丧失。种子休眠除受环境因素影响外,还与其本身的生理状态等密切相关。1960年,Villiers和Wareing在研究欧洲白蜡树(Fraxinus excelsior)种子的基础上,提出了发芽抑制物和促进物之间作用的概念;1968年,Amen提出种子休眠状态决定于内源抑制物和促进物的平衡,这一观点目前被人们普遍接受(彭幼芬,1994)。本文以“燕昌”板栗为试材,研究不同浓度NaOCl浸泡处理对板栗货架期发芽率与内源激素含量变化的影响,以期找出内源激素变化与板栗萌芽之间的关系,为板栗货架期保鲜提供理论依据。
1 材料与方法 1.1 试验材料2002年9月26日采收于北京市昌平区下庄,品种为“燕昌”,采收后即入-2~0 ℃冷库,预冷48 h后装入打孔聚乙烯塑料薄膜保鲜袋(PE)中冷藏至次年5月上旬。出库时用NaOCl浸泡处理。
1.2 试验方法 1.2.1 处理方法试验设3个NaOCl浓度:1 000、3 000、5 000 mg·L-1。每个处理用果量10 kg,2次重复,将冷藏板栗于室温下(25~27 ℃)分别在3个不同浓度NaOCl溶液中浸泡20 min,取出晾干至恢复原重后装入打孔PE袋(孔径10 mm,孔数10个)于常温下放置。以不做任何处理为对照(CK)。
1.2.2 调查项目和测定指标1) 呼吸强度 气相色谱法测定。将1 kg板栗放入干燥器内密封1 h,取1 mL气样用SQ-206气相色谱测定CO2的浓度。色谱条件:FID检测器,温度120 ℃;GDX-502填充柱,温度70 ℃;转化炉温度360 ℃;载气为N2(压力0.1 MPa),燃气为H2(压力0.105 MPa),助燃气为空气(压力0.144 MPa)。外标法定量,重复6次。2)发芽率 随机取30粒板栗进行调查,以胚芽萌动即视为发芽,统计发芽率。3)激素含量植物激素酶联免疫测定法(ELISA)(试剂盒及测定方法由中国农业大学农学与生物技术学院提供)测定脱落酸(ABA)、赤霉素(GA3)、吲哚乙酸(IAA)、玉米素核苷(ZR)。激素的提取:称取0.2 g板栗胚芽鲜样,加2 mL提取液[80%甲醇,内含1 mmol·L-1 BHT(二叔丁基对甲苯酚,为抗氧化剂,先用甲醇溶解BHT,再配成80%的浓度)],冰浴下研磨成匀浆,摇匀后在4 ℃下放置4 h,1 000×g离心15 min,取上清液记录体积。上清液过C-18固相萃取柱,过柱后的上清液转入5 mL塑料离心管中,真空浓缩干燥,用样品稀释液[100 mL PBS中加0.1 mL Tween-20,0.1 g明胶(稍加热溶解)]定容。
1.3 数据处理本试验数据用SPSS软件进行统计处理,采用ANOVA进行邓肯氏多重差异分析。
2 结果与分析 2.1 NaOCl处理对板栗货架期呼吸强度的影响从图 1可见,NaOCl处理结束时,各处理板栗的呼吸强度较对照略有升高,但无显著差异。在货架期间,1 000 mg·L-1 NaOCl处理板栗的呼吸强度变化趋势与对照相同,均在货架期6天时达到呼吸高峰,随后即下降,第9天以后又升高,但在整个货架期内1 000 mg·L-1 NaOCl处理均显著低于对照板栗(P<0.05)。3 000 mg·L-1与5 000 mg·L-1 NaOCl处理板栗的呼吸强度变化趋势相同,在货架期3天时即出现呼吸高峰,在货架期6天以后呼吸强度变化较小,但前者显著低于后者(P<0.05)。另从图中可见,对照和1 000 mg·L-1 NaOCl处理的板栗呼吸强度峰值出现在货架期第6天,而3 000 mg·L-1和5 000 mg·L-1 NaOCl处理的板栗,由以上分析可知,高浓度NaOCl处理改变了板栗呼吸代谢的变化趋势,使呼吸高峰出现时间提前,并使后期变化相对稳定。

|
图 1 板栗货架期呼吸强度变化 Figure 1 The changes of respiration intensity of Chinese Chestnut in shelf-life |
如图 2可见,NaOCl浸泡处理对发芽率有较大影响。5 000 mg·L-1 NaOCl处理完全抑制了板栗的发芽,在整个货架期内,该处理的板栗发芽率为0。其他处理组和对照板栗在货架期的前6天发芽率随时间的延长呈线性增加;货架期6天以后,对照板栗的发芽率不再增加,而处理组板栗的发芽率也只有少许增加。在整个货架期内,1 000 mg·L-1 NaOCl浸泡处理的板栗发芽率始终低于对照和3 000 mg·L-1 NaOCl浸泡处理;在货架期的前6天,3 000 mg·L-1 NaOCl浸泡处理与对照板栗发芽率水平相当,没有显著差异,在此之后,3 000 mg·L-1 NaOCl浸泡处理的板栗发芽率继续升高,而对照板栗的发芽率不再变化。货架期12天时,发芽率从低到高依次为:5 000 mg·L-1 NaOCl处理(0%)、1 000 mg·L-1处理(15.48%)、对照(18.06%)、3 000 mg·L-1 NaOCl处理(21.62%)。由此可见,NaOCl浓度高低对板栗萌芽的影响非常大,当浓度相对较低(3 000 mg·L-1以下)时,对板栗发芽的抑制作用很小甚至在货架期后期促进萌芽,浓度一定高时(5 000 mg·L-1)即可完全抑制板栗萌芽。
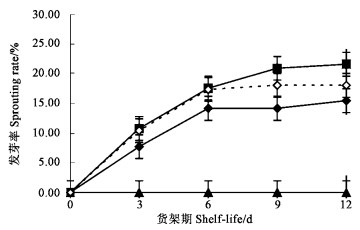
|
图 2 板栗货架期发芽率 Figure 2 The sprouting rate of Chinese Chestnut in shelf-life |
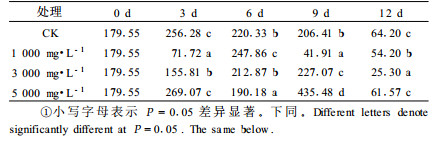
表 1可见,各处理和对照板栗货架期间ABA含量变化趋势不尽相同。对照板栗在货架期3天时ABA含量显著升高并达到峰值,此后则随着时间的延长逐渐缓慢下降,第9天以后迅速降低。1 000 mg·L-1和3 000 mg·L-1 NaOCl处理的板栗ABA含量在货架期前期较0天时显著降低,且显著低于对照和5 000 mg·L-1NaOCl处理的值(P<0.05);二者分别在第6天和第9天时达到最大值后又迅速下降,直至货架期结束。5 000 mg·L-1 NaOCl处理在第3天和第9天时出现2个峰值,且第9天时的值显著高于其他。各处理和对照均在货架期第9天以后显著降低,第12天时ABA含量均较货架期开始时显著降低(P<0.05)。以上分析可见,在整个货架期间,NaOCl处理浓度对ABA含量变化趋势的影响很大,就总体趋势而言,1 000 mg·L-1 NaOCl处理使板栗ABA含量降低,3 000 mg·L-1和5 000 mg·L-1 NaOCl处理使板栗ABA含量增加。
|
|
|
|
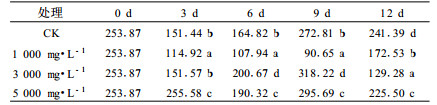
在货架期初始时,对照板栗GA3含量显著降低,第3天以后又逐渐升高,第9天出现峰值后又略有下降。1 000 mg·L-1 NaOCl处理板栗GA3含量在货架期内显著低于其他处理和对照,在货架期的前9天随着时间的延长迅速降低,第12天时显著升高。3 000 mg·L-1 NaOCl处理的板栗GA3含量变化趋势与对照相同,第9天时达到峰值,且在第6天和第9天的值显著高于对照(P<0.05)。5 000 mg·L-1 NaOCl处理的板栗GA3含量在货架期的前3天变化较小,第6天时降到最低,随后又显著增加,并在整个货架期内较其他2个处理保持较高的GA3水平。由此可见,NaOCl处理改变了板栗货架期间GA3含量的变化趋势,与对照相比,1 000 mg·L-1 NaOCl处理使GA3含量降低,3 000 mg·L -1和5 000 mg·L-1 NaOCl处理使GA3含量增加,其中3 000 mg·L-1 NaOCl处理在第6~9天时GA3含量显著高于其他处理和对照(P<0.05),这正与该处理板栗在第6天以后发芽率继续升高的结果一致。
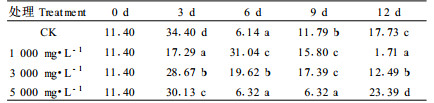
2.3.3 NaOCl处理对板栗胚芽IAA含量的影响表 3可见,NaOCl处理改变了货架期间板栗IAA含量的变化趋势。对照板栗IAA含量变化趋势为“W”型,即在货架期初始时略有降低,随后升高,第6天时达到峰值后迅速下降,第9天以后再次迅速升高。板栗IAA含量随着NaOCl浓度的升高而增加。1 000 mg·L-1和3 000 mg·L-1NaOCl处理板栗的IAA含量变化趋势基本一致,即在货架期开始后先降低,随后又升高,分别在第9天和第6天出现最大值后再次下降,直至货架期结束。5 000 mg·L-1 NaOCl处理板栗的IAA含量在货架期开始后即升高,第6天时达最大值,此后随时间延长逐渐降低,呈单峰型变化趋势。由此看出,低浓度NaOCl处理可使IAA含量降低并推迟峰值出现的时间,高浓度NaOCl处理使IAA含量升高,但并没有改变峰值出现的时间。
|
|
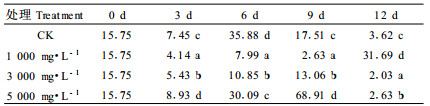
对照板栗在货架期开始后ZR含量急剧增加,第3天达到峰值后迅速降低,第6天时降到最低值,以后则随着时间的延长逐渐增加。各NaOCl处理的板栗ZR含量在货架期开始后均有不同程度增加,但变化趋势不尽相同。1 000 mg·L-1 NaOCl处理的板栗ZR含量在第6天达到峰值,随后则迅速下降,直到货架期结束;而其他2个处理组的板栗ZR含量均在第3天时达到最大值,与对照相同。在此之后,3 000 mg·L-1 NaOCl处理的板栗ZR含量随着时间的延长逐渐下降,而5 000 mg·L-1 NaOCl处理的板栗ZR含量在第3天后急剧降低,到第12天时又急剧升高。以上分析可知,各处理的ZR含量峰值均显著低于对照(P<0.05),其中1 000 mg·L-1 NaOCl处理推迟了ZR含量峰值出现时间,但1 000 mg·L-1和3 000 mg·L-1 NaOCl处理板栗的ZR含量在货架期前期和中期均始终保持较高水平(表 4);5 000 mg·L-1 NaOCl处理在货架期前期和中期ZR含量显著低于对照(P<0.05)。这与发芽率的结果一致。
|
|
从表 5可见,不同处理板栗的ABA/GA3比值变化趋势不同。对照板栗ABA/GA3比值在第3天达到峰值后逐渐降低。3 000 mg·L-1 NaOCl处理的板栗ABA/GA3比值变化趋势与对照基本一致,但在整个货架期内均显著低于对照(P<0.05)。1 000 mg·L-1 NaOCl处理的板栗ABA/GA3比值峰值显著高于对照和其他处理(P<0.05),但出现时间推迟到第6天。5 000 mg·L-1 NaOCl处理的板栗ABA/GA3比值分别在3天和9天时出现峰值,且第9天时显著高于其他处理和对照(P<0.05)。根据以上分析推测,板栗在货架期前期的萌芽受ABA的影响更大些,在中后期GA3的影响逐渐加大,进而通过ABA与GA3协同作用影响萌芽,而5 000 mg·L-1 NaOCl处理在中后期保持了较大的ABA/GA3比值,从而更好地抑制板栗萌芽。
|
|
从表 6可见,NaOCl处理降低了ABA/IAA比值。在货架期内,对照和5 000 mg·L-1 NaOCl处理板栗的ABA/IAA比值的变化趋势基本一致,即均在第3天时达到最大值,在第9天时出现第2个峰值;1 000 mg·L-1 NaOCl处理板栗的ABA/IAA比值在第6天时最高,之后则急剧降低;3 000 mg·L-1 NaOCl处理板栗ABA/IAA比值的变化较平稳,没有出现明显峰值,并从第6天以后逐渐降低。
|
|
从表 7可见,各处理和对照板栗在货架期内的变化趋势不尽相同,出现峰值的时间也不同。对照板栗的ABA/ZR比值在第6天达到最大值,随后急剧降低;3个处理中,1 000 mg·L-1 NaOCl处理的板栗ABA/ZR比值在货架期开始后迅速降低,到第12天时急剧升高,达最大值;3 000 mg·L-1 NaOCl处理板栗在货架期开始后降低,随后逐渐升高,但变化较其他2个处理幅度小,在第9天时达到峰值;5 000 mg·L-1 NaOCl处理板栗从第6天开始迅速增加,第9天时达到峰值,且峰值远远高于其他处理和对照。在货架期12 d时,除1 000 mg·L-1 NaOCl处理板栗外,其他处理和对照板栗的ABA/ZR比值均较低,且没有显著差异。以上分析可知,与对照相比,1 000和3 000 mg·L-1 NaOCl处理使ABA/ZR比值降低,而5 000 mg·L-1 NaOCl处理使ABA/ZR比值在较长时间内(货架期的前9天)保持较高水平,这与发芽率的结果一致。由此推测板栗在货架期前期的萌芽受ABA的影响更大些,随时间的延长ZR的影响逐渐加大,进而通过ABA与ZR的协同作用共同影响萌芽,5 000 mg·L-1 NaOCl处理可以在较长时间内保持较大的ABA/ZR比值,从而更好地抑制板栗萌芽。
|
|
板栗是顽拗性种子,当生理休眠期结束以后,板栗在适宜条件下可以萌发。通常种子在萌发过程中呼吸作用增强。但本研究发现,与对照相比,NaOCl处理使板栗呼吸强度降低,但不同浓度NaOCl处理对板栗呼吸与发芽的影响不同。低浓度NaOCl(1 000和3 000 mg·L-1)处理促进了板栗萌芽,高浓度(5 000 mg·L-1)NaOCl处理抑制了板栗萌芽,但呼吸强度反而较低浓度NaOCl处理的板栗高。研究结果表明:板栗发芽主要集中在货架期前期,除3 000 mg·L-1 NaOCl处理外,其他处理和对照在货架期6天以后发芽率基本不再升高。呼吸强度除与萌芽有关外,还与板栗的衰老代谢相关。虽然对照板栗的发芽率低于3 000 mg·L-1 NaOCl处理的板栗,但其呼吸强度却始终高于3 000 mg·L-1 NaOCl处理板栗,这可能与其衰老进程较快(尤其在后期)有关。由此推测,NaOCl处理可能对板栗呼吸代谢产生影响,这一影响导致板栗呼吸升高的贡献大于发芽导致的呼吸升高,且与NaOCl浓度呈正比。但NaOCl如何影响板栗呼吸代谢还不清楚,高浓度NaOCl处理在抑制板栗发芽的同时是否加速了板栗的衰老代谢,这将是下一步研究的关键问题。
种子休眠与萌芽受形态结构、生理作用、生态因素等调节。激素的对抗作用是调节生物过程的一个重要因素。激素的协同作用是调节生物过程的一个重要因素。种子的休眠与萌芽是由赤霉素(GA)、细胞分裂素(CTK)和发芽抑制物(如ABA等)这三因素决定的,GA在调节种子萌发中起原初作用,抑制物起抑制作用,而CTK则起着解抑制作用(彭幼芬,1994)。ABA在种子发育、萌发和休眠等许多生理生化过程中都起着重要作用(郑郁善,1998;余朝霞等,2003),而种子休眠的打破通常与ABA水平的降低相关(David et al., 2003;Zeevaart et al., 1988;刘永庆等,1995;Hocher et al., 1990)。GA和ABA的相互作用是调节从种子形成到萌发的生长过程转变的重要因素(Wang et al., 2001;David et al., 2003)。种子休眠的打破通常与ABA水平的降低相关。用ABA生物合成抑制剂处理可导致种子休眠能力丧失(Zeevaart et al., 1988)。在ABA的生物合成中,有缺陷的基因突变体对ABA的敏感性降低,导致种子过早萌发(Nambara et al., 2000;Jia et al., 2001)。另一方面,外源GA的应用常促进种子萌发,如冷处理和光处理促进种子萌发通常与外源GA的增加有关(Yamaguchi et al., 1998)。研究指出(吴奇等,1993),CO2对冷藏板栗的萌芽有明显的抑制作用可能与板栗胚内ABA相对含量升高有关。未萌动、萌动和发芽的板栗胚内ABA含量依次下降。50% CO2处理可明显抑制板栗的发芽,并且明显提高板栗胚芽中ABA含量以及ABA/GA3比值,而100%N2冲击处理则显著促进板栗发芽,并使板栗胚芽中ABA含量下降和ABA/GA3比值降低(梁丽松等,2004)。Khan的种子发育调节的三因子学说认为,种子的休眠与发芽是由赤霉素(GA)、细胞分裂素(CTK)和发芽抑制物(如ABA等)这三因素决定的。种子在萌发过程中,CTK代谢非常旺盛。CTK可直接参与种子萌发中各种物质和能量代谢的调节过程;也可通过与其他激素的相互作用,并参与基因表达的调控,在转录和翻译水平上影响着植物种子的生理状况与形态建成。激素间的相互作用对代谢有很大影响。本研究通过对4种主要内源激素含量变化的分析发现,NaOCl处理浓度对板栗货架期间内源激素含量变化有显著影响:1 000 mg·L-1 NaOCl使板栗ABA、GA3、IAA含量降低,并推迟了IAA和ZR含量峰值出现的时间;3 000 mg·L-1 NaOCl处理使板栗ABA含量降低,使其他激素水平升高,这与其使发芽率升高的结果一致;5 000 mg·L-1 NaOCl处理使板栗各激素水平有不同程度升高。这种影响使得各内源激素在整个货架期间的变化趋势发生改变,它们之间的协同作用共同影响板栗萌芽,导致不同浓度NaOCl处理板栗的萌芽能力发生改变。NaOCl处理降低了板栗货架期前期ABA/GA3、ABA/IAA比值,并推迟其峰值出现时间;1 000和3 000 mg·L-1 NaOCl处理还降低了ABA/ZR比值,而5 000 mg·L-1 NaOCl处理使板栗ABA/ZR比值升高。5 000 mg·L-1 NaOCl处理后板栗ABA含量和ABA/ZR比值升高。这一结果与板栗发芽率结果一致。由此推测,板栗货架期萌芽受几种内源激素的共同作用,但更易受ABA的影响。因此,影响板栗发芽的原因是多方面的,NaOCl处理影响板栗发芽的机理尚不明确,有待进一步研究。
梁丽松, 王贵禧, 孙晓珍. 2004. 板栗采后高CO2冲击处理对品质和耐藏性的影响. 林业科学, 40(6): 91-96. DOI:10.3321/j.issn:1001-7488.2004.06.016 |
梁丽松, 王贵禧. 2005. 高CO2和纯N2冲击处理对板栗货架期品质变化的影响. 林业科学研究, 18(3): 236-240. DOI:10.3321/j.issn:1001-1498.2005.03.002 |
刘永庆, 罗泽民, Karssen C M, 等. 1995. 赤霉素和脱落酸对番茄种子发芽的生理调控— —文献综述. 园艺学报, 22(3): 267-271. DOI:10.3321/j.issn:0513-353X.1995.03.001 |
彭幼芬. 1994. 种子生理学. 长沙: 中南工业大学出版社, 61-111.
|
王贵禧, 梁丽松, 宗亦臣. 1999. 贮藏板栗休眠与萌芽的温度调控. 林业科学, 35(3): 29-33. DOI:10.3321/j.issn:1001-7488.1999.03.006 |
吴奇, 韩继成, 何钟佩. 1993. 冷藏期间板栗胚内激素含量的变化. 北京农业大学学报, 19(4): 11-14. |
余朝霞, 黄雪群, 方志尚, 等. 2003. GA对林木种子萌发的调控研究进展. 浙江林业科技, 23(1): 73-76, 80. DOI:10.3969/j.issn.1001-3776.2003.01.022 |
郑郁善. 1998. 板栗和锥栗种子发育过程中ABA生理效应的研究. 林业科学, 34(4): 1-7. DOI:10.3321/j.issn:1001-7488.1998.04.001 |
Hocher V, Scotta B, Maldiney R, et al. 1990. Changes in levels of abscisic acid and its β-D-glucopyranosyl ester during tomato embryogenesis. Physiol Plant(Suppl), 79: A28. |
Jia W S, Zhang J H, Liang J S. 2001. Initiation and regulation of water deficit- induced abscisic acid accumulation in maize leaves and roots: cellular volume and water relations. J Exp Bot, 52(355): 295-300. DOI:10.1093/jexbot/52.355.295 |
Nambara E, Hayama R, Tsuchiya Y, et al. 2000. The role of ABI3 AND FUS3 loci in Arabidopsis thaliana on phase transition from late embryo development to germination. Dev Biol, 220: 412-423. DOI:10.1006/dbio.2000.9632 |
David Ho Tuan-hua, Gomez-Cadenas Aurelio, Zentella Rodolfo, et al. 2003. Crosstalk between gibberellin and abscisic acid in cereal aleurone. J Plant Growth Regulation, 22: 185-194. DOI:10.1007/s00344-003-0026-7 |
Wang X Q, Ullah H, Jones A M, et al. 2001. G protein regulation of inchannels and abscisic acid signaling in Arabidopsis guard cells. Science, 292: 2070-2072. DOI:10.1126/science.1059046 |
Yamaguchi S, Smith M W, Brown R G, et al. 1998. Phytochrome regulation and differential expression of gibberellin 3beta-hydroxylase genes in germinating Arabidopsis seeds. Plant Cell, 10: 2115-2126. |
Zeevaart J A D, Creelmann R A. 1988. Metabolism dissection of the gibberellin/abscisic acid. Annu Rev Plant Physiol Plant Mol Biol, 39: 439-473. DOI:10.1146/annurev.pp.39.060188.002255 |
 2008, Vol. 44
2008, Vol. 44