文章信息
- 万雪琴, 张帆, 夏新莉, 尹伟伦.
- Wan Xueqin, Zhang Fan, Xia Xinli, Yin Weilun.
- 镉处理对杨树光合作用及叶绿素荧光参数的影响
- Effects of Cadmium on Photosynthesis and Chlorophyll Fluorescence Parameters of Solution-Cultured Poplar Plants
- 林业科学, 2008, 44(6): 73-78.
- Scientia Silvae Sinicae, 2008, 44(6): 73-78.
-
文章历史
- 收稿日期:2007-10-18
-
作者相关文章
2. 北京林业大学生物科学与技术学院 北京 100083
2. College of Biological Sciences and Biotechnology, Beijing Forestry University Beijing 100083
镉(Cd)是一种毒性很强的重金属,它对植物没有功能,当其在叶片中的含量达到3~10 mg·kg-1时,就会导致生物产量下降(Bahlsberg, 1989)。绝大多数研究表明:Cd胁迫会降低叶绿素含量和叶绿体数量,破坏叶绿体结构,产生失绿症(Baryla et al., 2001; Drążkiewicz et al., 2005;蒋文智等, 1992; 孙光闻等, 2005);Cd胁迫还会通过降低Rubisco酶数量和活性(Pietrni et al., 2003),改变蛋白质结构(Polle et al., 2004),降低PSⅡ量子效率(Pietrini et al., 2003; 蒋文智等, 1989;1992; 邓培雁等, 2007)等途径来降低光合作用。但也有Cd处理不影响光合、生长的报道(Zhou et al., 2005;Haag-Kerwer et al., 1999;Greger et al., 1986; 李德明等, 2005)。在Cd如何导致叶绿素减少(Polle et al., 2004;Schützendübel et al., 2002;Pietrini et al., 2003)和Cd对光系统的作用位点(Schützendübel et al., 2002; 蒋文智等, 1989; 1992)上存在明显分歧。Cd对植物的毒害机制,尤其是对光合系统的影响机制依然不清。为探讨和揭示Cd胁迫对植物毒害的生理机制,本文结合对Cd具有较高富积效应的杨树无性系(用于土壤Cd污染植物修复)的选育,在溶液培养条件下,开展了Cd处理对杨树光合系统毒害机制的研究。
1 材料和方法 1.1 试验材料和试验设计试验材料为2004年从北美引进的31个欧美杂交杨无性系中的3个:XMH-4 (Populus deltoides × P. nigra)、MH-8 (P. trichocarpa × P. deltoides)、XMH-10 (P. deltoides × P. nigra)。这3个无性系在引种试验中表现出良好的适应性、速生性和抗病性能。用这3个无性系的插条进行水培,容器为长100 cm、宽50 cm、高25 cm的塑料盆,盆内盛60 L培养液,用一泡沫浮于培养液面作为插条的固定支持物,每盆每无性系扦插10株,随机排列。每盆内培养液中置一小水泵,不停地通气,每10 d换培养液一次。扦插后先用自来水培养20 d,生根后用Hoagland全营养液培养,并加入Cd(NO3)2进行处理。处理浓度依次是:0、25、50、100 μmol·L-1 Cd2+。在北京林业大学温室大棚中培养5个月(4—8月)后进行测试。
1.2 分析测试方法取处理和对照植株的成熟叶片(第5~7叶)测定叶绿素含量(Ouzounidou et al., 1992)和矿质元素含量。用于元素分析的样品先用双蒸水冲洗3次,于80 ℃烘干后用研钵研成粉末,准确称取0.250 0 g用HNO3-H2SO4-HCLO4消解完全(吴建之等, 1999),定容25 mL,用电感耦合等离子体发射光谱仪(ICP-OES, OPTIMA 2000A,USA)测定样品元素浓度(中国科学院生态环境研究中心测定)。用LI-6400便携式光合系统配以荧光叶室测定成熟叶片的净光合和荧光-光强响应曲线及暗呼吸速率。仪器参数设置为:气孔比率0,参比室CO2浓度用CO2注入系统控制在400 μmol·mol-1,气体流速300 μmol·s-1,干燥管全旁路,气温30 ℃。测定步骤为:1)叶样品暗适应30 min后记录暗呼吸速率,开启中心波长为630 nm的测定光(Intensity 1, Modulation 0.25 kHz, Filter 1, Gain 10)测定Fo并开启荧光记录(Flr Recording),再用中心波长为630 nm,光强大于7 000 μmol·m-2s-1的饱和光(Duration 0.8, Intensity 8, Blue 10%, Modulation 20 kHz, Filter 50Hz)测定Fm。2)光强调至25 μmol·m-2s-1,连续照光20 min后,记录净光合速率等气体交换参数,再用测定光(Intensity 5, Modulation 20 kHz, Filter 1, Gain 10)测Fs,再施加饱和光(同上)测F′m,随后施加一个暗脉冲(即关闭LED光化学光,再施加一个中心波长为740 nm的远红光)(Duration 6, Far red intensity 8, Pre-time 2, Post-time 2, Modulation 0.25 kHz, Filter 1)测定F′o。3)将光化学光依次调整到50、100、200、400、700、1 000、1 300、1 600、2 000 μmol·m-2s-1,分别重复步骤2),测得各光水平的净光合速率、Fs、F′m和F′o等荧光参数和气体交换参数。
1.3 数据处理和统计分析用光强小于100 μmol·m-2s-1范围的光响应回归直线方程求算光补偿点、光饱和点、表观量子效率;用Walker模型(Walker, 1989)拟合各处理的光响应曲线求得回归方程,然后用所得方程找出净光合速率达到最大光合速率90%处的光强作为光饱和点。
所用的荧光参数及相应定义如下(Ouzounidou et al., 1997; Havaux et al., 1991; Strasser et al., 2000; Maxwell et al., 2000):
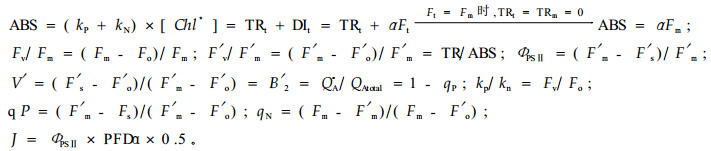
|
式中:ABS是指被叶绿素分子吸收的光量子能量,kP和kN分别是PSⅡ原初光化学反应退激耗能比例常数(rate constant of primary photo chemistry to the excited antenna chlorophyll of photosystem Ⅱ)和总的非光化学退激耗能比例常数(sum of all rate constants of non-photochemical deexcitation events to the excited antenna chlorophyll of photosystem Ⅱ),[Chl*]表示处于激发态叶绿素分子的浓度,TR是指被PSⅡ反应中心捕获的能量,DI是指以荧光、热传递到其他系统的能量总和,α是DI部分以荧光散失的比率常数;Fo是暗适应叶片的最小叶绿素荧光,Fm是暗适应叶片的最大叶绿素荧光,Fv是暗适应叶片的可变叶绿素荧光,F′o是光适应叶片的最小叶绿素荧光,F′m是光适应叶片的最小叶绿素荧光,F′v是光适应叶片的可变叶绿素荧光;F′v/Fm、F′v/F′m分别是暗适应和光适应叶片PSⅡ最大量子效率,ΦPSⅡ是光适应叶片PSⅡ实际量子效率;V′是光适应下PSⅡ的相对可变荧光, B′2是PSⅡ关闭反应中心比率, QA-、QAtotal分别是PSⅡ关闭态和总的原初电子受体数量,qP是光化学猝灭,qN是非光化学猝灭;J是PSⅡ电子传递速率,0.5是PSⅡ与PSⅠ间的光能分配常数,PFD是光强,α是叶片对入射光的吸收比率常数,取值0.85。
2 结果与分析 2.1 Cd处理对光合色素的影响3种浓度的Cd处理下,3个无性系植株叶片的总叶绿素含量的平均值分别比对照低44.8%、77.8%和93.3%,出现明显的黄化症状。培养液中Cd浓度与叶片中叶绿素a、b和类胡萝卜素含量呈显著负相关,相关系数分别是-0.919、-0.913和-0.872。25 μmol·L-1的Cd处理对类胡萝卜素的含量无显著影响,但当Cd浓度达到50和100 μmol·L-1时,类胡萝卜素的含量显著减少(图 1)。

|
图 1 Cd处理对杨树叶片光合色素含量的影响 Figure 1 Influences of cadmium on photosynthetic pigments of poplar CK:对照Control; T1:25 μmol·L-1 Cd2+处理Treatment with 25 μmol·L-1 Cd2+; T2:50 μmol·L-1 Cd2+处理Treatment with 50 μmol·L-1 Cd2+; T3:100 μmol·L-1 Cd2+处理Treatment with 100 μmol·L-1 Cd2+。下同。The same below. |
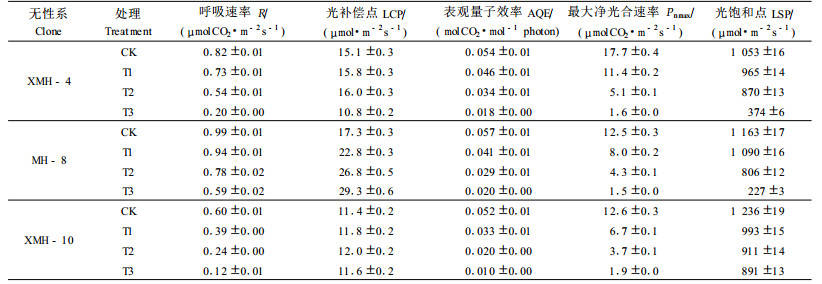
Cd处理显著降低处理植株的最大净光合速率(Pnmax)、光饱和点(LSP)、表观量子效率(AQE)和呼吸速率(R),且与处理浓度呈显著负相关(表 1)。此外,Cd处理还使杨树植株的光补偿点明显增大(表 1)。可见,Cd胁迫能明显降低植株的碳同化能力和新陈代谢速率。
|
|
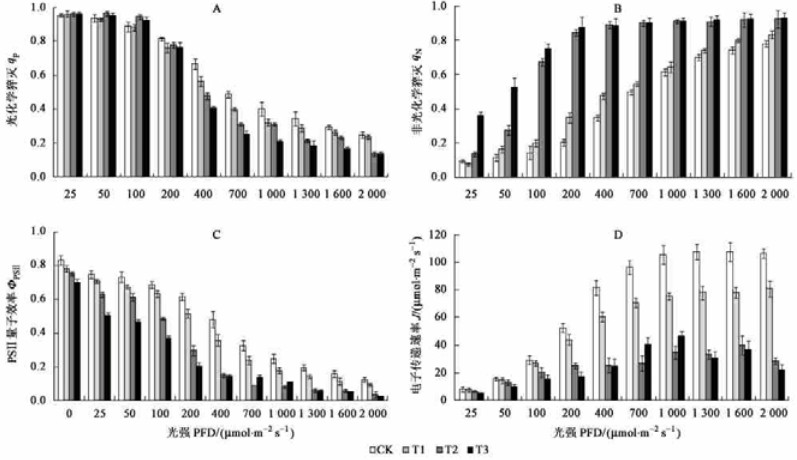
Cd处理使植株在暗适应下的叶绿素最小荧光(Fo)显著增大,最大荧光(Fm)和PSⅡ最大量子效率(Fv/Fm)显著降低(表 2);使光适应下的PSⅡ最大量子效率(F′v/F′m)、实际量子效率(ΦPSⅡ)和电子传递速率(J)明显降低,并且在高光强下的降幅大于低光强(图 2C, D)。由于Fm与被激发的叶绿素分子数量成正比(ABS=(kP+kN)×[Chl*]=αFm),因此推测Fm的降低是由叶绿素分子减少所致。Fo的升高和(kP/kN)的降低表明被叶绿素吸收的能量转化成电能(电子传递)的比例下降,更直观的表现是Fv/Fm、F′v/F′m、ΦPSⅡ和J显著减小。Fo升高和(kP/kN)下降的可能原因有:1)单位面积叶绿素分子显著减少使能量在天线色素分子间的传递效率下降;2)PSⅡ反应中心数量减少;3)PSⅡ反应中心捕获天线色素分子传来的能量的效率下降。
|
|
|
图 2 不同浓度Cd处理对杨树在不同光强下PSⅡ的光化学猝灭(A)、非光化学猝灭(B)、量子效率(C)和电子传递速率(D)的影响 Figure 2 The effects of cadmium on photochemical quenching(A), nonphotoche mical quenching(B), quantum yield of photosystem Ⅱ photochemistry(C) and J(D) of poplar plants |
参试的3个无性系在“光强-荧光曲线”上表现出相同的规律,由于同一荧光参数在相同处理和光强下的不同无性系间存在较大差异,较大的标准差会使平均值的代表性降低,甚至可能掩盖真实规律。此外,由于“光强-荧光曲线”涉及3个无性系,4个Cd处理水平,4个荧光参数,10个光梯度,包括大量冗余数据,不宜一一列出。因此,此处以无性系XMH-4为例说明Cd处理对“光强-荧光曲线”的影响(图 2)。由图 2可见,Cd处理显著降低PSⅡ量子效率(ΦPSⅡ)和电子传递速率(J),显著增大非光化学猝灭(qN),在200 μmol·m-2s-1以下的低光强下,光化学猝灭(qP)在处理与对照间无显著差异,而在200 μmol·m-2s-1以上的高光强下,处理植株的qP显著低于对照植株。这说明在200 μmol·m-2s-1以下的低光强下,开放态PSⅡ反应中心比例在处理与对照间无明显差异,天线色素分子所捕获的光能主要以非光化学猝灭形式(叶绿素荧光和热量)散失,从而使ΦPSⅡ和J明显降低。这进一步反映出:虽然处理植株大多数PSⅡ反应中心处于开放状态,但却不能将天线色素分子捕获的光能转换成电能,这是Cd处理导致杨树PSⅡ量子效率(ΦPSⅡ)、电子传递速率(J)和光合速率(Pn)降低的主要原因之一;同时也暗示了在PSⅡ反应中心的电子供体侧存在电子传递障碍。
2.4 对5种与光合系统密切相关的金属元素含量的影响Ca、Mg、Fe、Cu、Mn在光合电子传递链中起着重要的作用,它们的亏缺将导致PSⅡ量子效率(ΦPSⅡ)、电子传递速率(J)的下降,非光化学猝灭(qN)的增加,而且,Fe、Mg和Mn都参与叶绿素的形成,其中任何一种的亏缺都会出现失绿症状。元素分析表明,功能叶的Cd含量与处理浓度显著正相关(图 4A);Ca、Mg、Cu、Fe在25、50 μmol·L-1处理下增加(图 3B, C, D, E);Mn则极显著地降低(图 3F)。因此,可推断Cd处理导致的失绿症并不是由于叶组织缺Mg或Fe引起的,PSⅡ量子效率和电子传递速率的下降也与Ca、Mg、Fe、Cu没有直接关系。相关分析表明,叶绿素a、b含量与叶组织中Mn的含量呈极显著正相关。由于Mn与植物的光合、呼吸、叶绿素和蛋白质的合成等重要代谢过程密切相关,缺Mn时叶绿素和PSⅡ放氧复合体的合成将受到抑制,光合放氧和电子传递亦将受阻,新陈代谢减慢。这些症状与Cd胁迫的症状极其相似。因此推测Cd处理下Mn的亏缺是黄化症和光合下降的主要原因之一。

|
图 3 水培下Cd处理对功能叶矿质元素含量的影响 Figure 3 The effects of cadmium on mineral elements in functional leaves of poplar plants cultured in different Cd concentration solutions |
尽管关于Cd胁迫对植物光系统影响的研究已经很多,但目前对Cd胁迫如何导致叶绿素含量下降,如何降低PSⅡ量子效率的机制依然不清。对Cd胁迫导致黄化的原因,有3种观点:一是Cd胁迫导致Fe、Mg等元素亏缺而失绿(Polle et al., 2004);二是Cd胁迫间接抑制叶绿素的生物合成(Schützendübel et al., 2002);三是Cd抑制叶绿体的合成而间接导致失绿症(Pietrini et al., 2003)。本研究结果表明:Cd处理导致的失绿症不是Fe、Mg亏缺引起的,而与Mn的缺乏有关,其可能机制是Mn的缺乏抑制了叶绿素的生物合成。在Cd对光系统的伤害作用位点上也存在分歧,Schützendübel等(2002)认为Cd既可作用于PSⅡ的氧化端,也可作用于其还原端,而蒋文智等(1989;1992)则指出Cd的抑制点位于PSⅡ的氧化端。本研究发现Cd处理显著降低叶绿素含量,出现高qP,低ΦPSⅡ和J现象,进一步推断PSⅡ氧化端存在电子传递障碍。其推理如下:PSⅡ反应中心上的电子传递过程(武维华, 2003)为:H2O → D1-161Tyr → P680+;P680+→ Pheo → QA → QB。P680被激发,将电子传递给脱镁叶绿素(Pheo),形成P680+Pheo-对,一旦P680+产生,立即从D1-161Tyr夺取电子,D1-161Tyr给出电子后又通过Mn聚集体从水分子得到电子,同时使水裂解,形成分子氧和质子。而Pheo将电子传递给牢固结合于D2的质醌QA,QA-又将电子传递给位于D1上的另一质醌QB,QB得到2个电子后形成PQH2并释放到膜脂中。当激发态的P680+将电子传递给Pheo后,如果P680+不能从D1-161Tyr获取电子,就会出现高qP(高的QA/Qtotal)低ΦPSⅡ(低的电子传递速率)现象。因此Cd处理植株在低光强下,qP基本不变,ΦPSⅡ和J明显降低(均与对照相比)的现象,说明在PSⅡ反应中心电子供体侧存在电子传递障碍。PSⅡ氧化端最主要的结构单元是放氧复合体(OEC),其由Mn聚集体和3条多肽链构成的复合体帽结构组成,而Mn聚集体和帽结构的破坏都会使水的光解受抑制,电子传递受阻。由于Cd处理导致了Mn含量的极显著下降(图 3F),因此推测Mn的亏缺使OEC的数量下降或结构破坏,从而导致水光解受抑制,PSⅡ氧化端的电子供给不足,进一步引起氧化态的PSⅡ反应中心不能将天线色素分子捕获的光能转变成电能,从而出现qP、qN较高,而ΦPSⅡ和J降低的现象。此外,Mn是叶绿素合成、叶绿体维持正常结构所必需的元素,也是许多酶的活化剂(如柠檬酸脱氢酶、草酰琥珀酸脱氢酶等),还是硝酸还原的辅助因素,因此,缺Mn植株会出现叶绿素含量减少,PSⅡ量子传递效率下降,氨基酸和蛋白质的合成受阻等症状。由于Mn的亏缺与Cd的毒害症状极其相似,且Mn的亏缺从理论上能很好解释Cd对植物的毒害机制,因此推测缺Mn是Cd胁迫下杨树出现黄色症状和光合效能下降的主要原因之一。
邓培雁, 刘威, 韩博平. 2007. 宝山堇菜(Viola baoshanensis)镉胁迫下的光合作用. 生态学报, 27(5): 1858-1862. DOI:10.3321/j.issn:1000-0933.2007.05.023 |
蒋文智, 黎继岚. 1989. 镉对烟草光合特性的影响. 植物生理学通讯, (6): 27-31. |
蒋文智, 黎继岚. 1992. 镉对光合器膜系统结构的影响. 云南大学学报, 14(3): 318-323. |
李德明, 朱祝军, 刘永华, 等. 2005. 镉对小白菜光合作用特性影响的研究. 浙江大学学报:农业与生命科学版, 31(4): 459-464. |
孙光闻, 陈日远, 刘厚诚, 等. 2005. 镉对植物光合作用及氮代谢影响研究进展. 中国农学通报, 21(9): 234-236, 251. DOI:10.3969/j.issn.1000-6850.2005.09.068 |
吴建之, 葛滢. 1999. 植物标样多元素测定的五种前处理方法比较. 光谱学与光谱分析, 19(3): 369-372. DOI:10.3321/j.issn:1000-0593.1999.03.032 |
武维华. 2003. 植物生理学. 北京: 科学出版社, 132-139.
|
Bahlsberg-Pahlson A M. 1989. Toxicity of heavy metals(Zn, Cu, Cd, Pb) to vascular plants. Water Air Soil Poll, 47: 287-319. DOI:10.1007/BF00279329 |
Baryla A, Carrier P, Franck F, et al. 2001. Leaf chlorosis in oil seed rape plant (Brassica napus) grown on cadmium-polluted soil: caused and consequences for photosynthesis and growth. Planta, 212: 696-709. DOI:10.1007/s004250000439 |
Drążkiewicz M, Baszyński T. 2005. Growth parameters and photosynthetic pigments in leaf segments of Zea mays exposed to cadmium, as related to p rotecton mechanisms. Journal of Plant Physiology, 162: 1013-1021. DOI:10.1016/j.jplph.2004.10.010 |
Greger M, Lindberg S. 1986. Effects of Cd2+ and EDTA on young sugar beets (Betavulgaris) Ⅰ.Cd2+ uptake and sug-araccumulation. Plant Physiol, 66: 69-74. DOI:10.1111/ppl.1986.66.issue-1 |
Haag-Kerwer A, Schafer H J, Heiss S, et al. 1999. Cadmium exposure in Brassica juncea causes a decline in transpiration rate and leaf expansion without effect on photosynthesis. Journal of Experimental Botany, 50(341): 1827-1835. DOI:10.1093/jxb/50.341.1827 |
Havaux M, Strasser R J, Greppin H. 1991. A theoretical and experimental analysis of the qP and qN coefficients of chlorophyll fluorescence quenching and their relation to photochemical and nonphotochemical events. Photosynthesis Research, 27: 41-55. DOI:10.1007/BF00029975 |
Maxwell K, Johnson G N. 2000. Chlorophyll fluorescence-a practical guide. Journal of Experimental Botany, 51: 695-668. |
Ouzounidou G, Eleftherion E P, Karataglis S. 1992. Ecophysiological and ultrastructural effects of copper in Thlaspi ochroleucum(Cruciferae). Canadian Journal of Botany, 70: 947-957. DOI:10.1139/b92-119 |
Ouzounidou G, Moustakas M, Strasser R J. 1997. Sites of action of copper in the photosynthetic apparatus of maize leaves: kinetic analysis of chlorophyll fluorescence, oxygen evolution, absorption changes and thermal dissipation as monitored by photoacoustic signals. Aust J Plant Physiol, 24: 81-90. DOI:10.1071/PP96028 |
Pietrini F, Iannelli M A, Pasqualini S, et al. 2003. Interaction of cadmium with glutathione and photosynthesis in developing leaves and chlorophasts of Phragmites australis (Cav.) Trin. Ex Steudel. Plant Physiology, 133: 829-837. DOI:10.1104/pp.103.026518 |
Polle A, Schützendübel A. 2004. Heavy metal signalling in plants: linking cellular and organismic responses// Hirt H, Shinozaki K. Plant responses to abiotic stress. Berlin: Springer-Verlag, 187-216.
|
Schützendübel A, Polle A. 2002. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization. J Exp Bot, 53: 1351-1365. |
Strasser R J, Srivastava, Tsimilli-Michael M. 2000. The fluorescence transient as a tool to characterize and screen photosynthetic sample//Mohammad Yunus, Uday Pathre, Prasanna Mohanty. Probing Photosynthesis. London: Taylor & Francis, 445-483.
|
Walker D A. 1989. Automated measurement of leaf photosynthetic O2 evolution as a function of photon flux density. Philosophical Trascations of the Royal Society London B, 323: 313-326. DOI:10.1098/rstb.1989.0013 |
Zhou W B, Qiu B S. 2005. Effects of cadmium hyperaccumulation on physiological characteristics of Sedum alfredii Hance(Crassulaceae). Plant Science, 169(4): 737-745. DOI:10.1016/j.plantsci.2005.05.030 |
 2008, Vol. 44
2008, Vol. 44