文章信息
- 姚瑞玲, 方升佐.
- Yao Ruiling, Fang Shengzuo.
- 盐胁迫对青钱柳根部离子分布及幼苗生长的影响
- Effect of NaCl Stress on Ion Distribution in Root and Growth of Cyclocarya paliurus Seedlings
- 林业科学, 2008, 44(6): 66-72.
- Scientia Silvae Sinicae, 2008, 44(6): 66-72.
-
文章历史
- 收稿日期:2007-05-31
-
作者相关文章
全世界盐渍土面积约10亿hm2,占所有可耕地资源的5%(Lambers,2003),我国盐渍土面积达0.27亿hm2(蔡清泉,1990)。研究表明,较农作物而言,大多数树木为深根性植物,营造森林能有效缓解土壤盐碱问题(Ward et al., 2003)。盐胁迫下,限制植物生长的因子除水分亏缺外,还包括Na+和Cl-过多积累。植物体内存在过多的Na+和Cl-通常被看作是非盐生植物遭到单盐毒害的关键因子(Niu et al., 1995)。
青钱柳(Cyclocarya paliurus)是我国特有的单种属植物,也是国家重点保护的濒危植物,属三类保护植物。它集药用、保健、材用和观赏等多种价值于一身,是一种很有发展和开发利用前景的珍贵树种(方升佐等,2007)。但目前国内外对青钱柳抗性方面的研究报道还很少。根部是植物与环境接触的重要界面,外界环境对植物的影响首先作用于根,根部感受逆境信号后产生相应的生理变化。盐胁迫会抑制根部对水分、养分的吸收,引起植物体内离子失衡(Parida et al., 2005),进而影响植物的正常生长。本研究采用无土水培法,对3个种源青钱柳幼苗根部离子分布及幼苗生长变化进行研究,旨在确定种源间幼苗耐盐能力的差异性是否与植物根部组织中离子含量的变化有关,试图阐明盐胁迫对青钱柳幼苗的作用机理,从而为人工林早期选育和培育提供科学依据。
1 试验方法 1.1 试验材料与设计2005年10月分别在安徽黄山(H)、江西九江(J)、云南昆明(K)地区收集自然成熟落地的青钱柳种子,种子经过浓硫酸酸蚀处理后,用拌有赤霉素(GA)的湿沙进行层积。2006年3月取出部分种子播于装有培养基(体积比为珍珠岩:蛭石:泥炭土=1:2:2)的容器杯内,3个月后选取生长较为一致的健壮苗木(平均苗高7 cm左右),在1/2 Hoagland完全营养液(潘瑞炽,1995)中适应性培养10 d,然后对苗木进行不同胁迫强度的4个盐处理(NaCl一次性添加,以后每7 d换一次营养液并添加NaCl,直至试验结束):0、1、3及5 g·L-1NaCl(分别标记为CK、S1、S2与S3)。每处理重复3次,各重复分别置于一个黑色有机玻璃箱中(规格为56 cm×36 cm×26 cm),每箱40株苗。苗木进行适应性培养及盐处理期间,在智能人工气候生长室RGS-20中进行,光照强度350~400 μmol·m-2s-1,日照时数12 h,昼夜温度分别为(26±0.5) ℃和(20±0.5) ℃,昼夜相对湿度分别为70%与80%,每周换1次营养液,每日早晚各充气1次,每次30 min。
1.2 根部离子相对含量测定苗木盐处理23 d后,截取植株根尖进行横切面的徒手切片,样品直径长1 mm、厚0.3 mm。然后在光学显微镜下将样品平铺于贴有导电胶带的铜板上,每处理放4个样品,自然晾干后喷镀碳膜。在德国LEO 1530VP型可变压力场发射扫描电子显微镜下观察,用英国OXFORD INCA-300型X-射线能谱仪(EDS)分析,加速电压20 kV,样品倾角0°。选定分析Na+、K+、Ca2+、Mg2+、Cl-,进行谱线与能谱图的收集。通过计算机附带软件,自动判读根部表皮、皮层和中柱中各离子的相对百分含量(Lindsay et al., 1996)。
1.3 幼苗存活率测定盐处理2、4、8、15、23、28 d时,统计各处理剩余苗木存活株数和死亡株数。
1.4 苗高、地径和叶面积测定在胁迫处理开始前和试验结束时各测定1次,苗高用钢卷尺测定,精度0.1 cm。地径用游标卡尺测定,精度0.05 cm。叶面积采用美国ADC Bioscientific公司生产的便携式AM300叶面积仪测定,精度0.01 mm2。
1.5 生物量测定在胁迫处理前和试验结束时,用自来水冲洗苗木根部,使植株保持完整,然后用吸水纸吸干,分别测定根、茎、叶和叶柄4部分的鲜质量,先在105 ℃下进行杀青,然后在80 ℃的烘箱内烘干至衡重,分别测定它们的干质量,以干质量表示生物量。
1.6 数据处理采用EXCEL软件绘图,SPSS 11.5系统软件进行方差分析和多重比较。
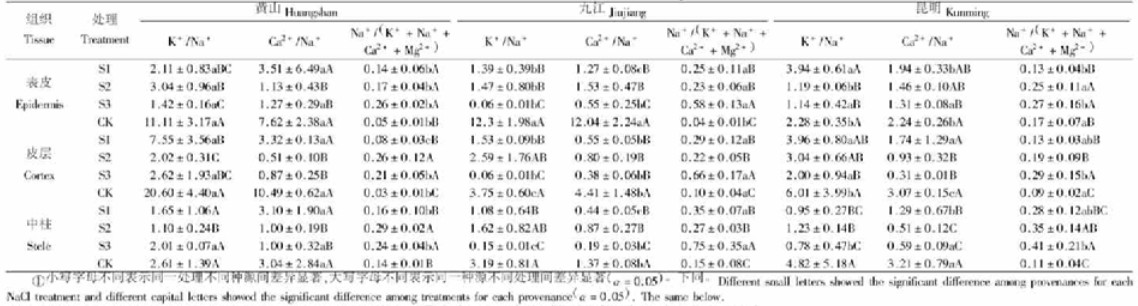
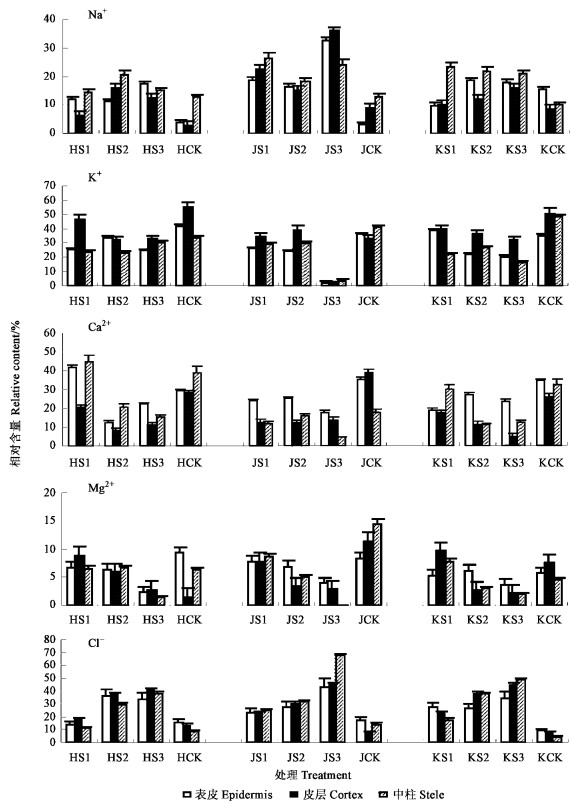
2 结果与分析 2.1 盐胁迫下根部离子变化 2.1.1 盐胁迫下根部组织中的离子分布盐胁迫显著影响了根部组织中的离子分布(图 1)。盐胁迫下Na+在中柱中的含量较高,但随着盐浓度增加,表皮和皮层中的Na+含量明显增加,而中柱中的变化趋势不明显;K+在皮层中的含量较高,随着盐胁迫强度增强,表皮、皮层中K+含量均呈下降趋势,中柱中K+含量变化趋势不明显;相对而言,大多数情况下Ca2+在表皮中的含量较高,随着盐浓度增加,根部组织中的Ca2+与Mg2+减少;低盐胁迫下,表皮中Cl-1含量较高,但随着盐浓度增加,Cl-进入到中柱中,导致中柱中Cl-含量明显增多。以上结果表明:1)从根部表皮到中柱各区,各种源Cl-相对含量均随着盐浓度增加显著增加,Na+相对含量表现为上升趋势,且中柱中Cl-和表皮中Na+量的增加趋势尤为明显,这可能是植物在盐胁迫下,Cl-导致叶片焦斑较早产生的原因之一;2)各区Na+相对含量变化与K+、Ca2+、Mg2+变化相反,即Na+相对含量增加,K+、Ca2+、Mg2+相对含量降低,反之亦然,二者呈一种“消涨”趋势。上述结果说明Na+抑制了植物对K+、Ca2+、Mg2+的吸收,表现出一定的拮抗作用。
|
图 1 盐胁迫23 d后根部组织的离子分布 Figure 1 Ion distribution in the root tissues under 23 days salt stress H、J、K分别代表黄山、九江、昆明种源 H, J and K show Huangshan, Jiujiang and Kunming provenances, respectively. |
从供试种源幼苗根部组织中离子相对含量的变化情况来看,在1 g·L-1NaCl处理下,供试幼苗根部离子失衡不严重,遭到的伤害程度较小。在5 g·L-1NaCl胁迫下,九江种源幼苗根部微区Na+、Cl-相对含量分别为黄山、昆明种源的2.21、1.75倍和1.40、1.22倍,而K+相对含量仅为黄山、昆明种源的0.09和0.13倍。表明高盐胁迫下,江西九江种源的耐盐能力较弱,而黄山种源的相对较强。
2.1.2 盐胁迫下根部离子比[K+/Na+、Ca2+/Na+、Na+/(K++Na++Ca2++Mg2+)]由表 1可知,盐胁迫下供试种源幼苗随着盐浓度增加,从根部表皮到中柱K+/Na+、Ca2+/Na+值呈下降趋势,而Na+/(K++Na++Ca2++Mg2+)值均呈上升趋势,这说明在5 g·L-1NaCl胁迫下,Na+抑制了供试幼苗根部对K+、Ca2+、Mg2+的吸收,导致营养失衡。较其他2个种源而言,九江种源幼苗根部K+/Na+、Ca2+/Na+值偏低,而Na+/(K++Na++Ca2++Mg2+)值偏高,表明该种源幼苗的营养失衡较为严重,根部受到单盐毒害的程度较为明显。
|
|
方差分析结果表明:盐胁迫下供试幼苗根部K+/Na+、Ca2+/Na+与Na+/(K++Na++Ca2++Mg2+)值在种源间、处理间及组织间的差异均达显著水平(表 1)。九江种源的K+/Na+与Ca2+/Na+值明显偏低,Na+/(K++Na++Ca2++Mg2+)值偏高(分别为2.08、1.15、2.14),昆明种源居中(分别为4.70、3.96、1.63),黄山种源K+/Na+和Ca2+/Na+值最高,Na+/(K++Na++Ca2++Mg2+)值最低(分别为6.28、8.64、0.69);从处理来看,在5 g·L-1NaCl胁迫处理下K+/Na+和Ca2+/Na+值最低,Na+/(K++Na++Ca2++Mg2+)值最高,分别为1.21、0.67、3.81,而对照处理下的K+/Na+、Ca2+/Na+值最高,Na+/(K++Na++Ca2++Mg2+)值最低,分别为2.97、1.84、0.34;从组织来看,K+/Na+值在中柱最高为4.83,Ca2+/Na+值在表皮中最高为8.54,Na+/(K++Na++Ca2++Mg2+)值在中柱中最高为0.94。上述分析表明,根部组织中离子比的变化差异可能是由各离子在盐胁迫下的分布变化所致。Na+在中柱中分布较多,但随着盐浓度增加,中柱中的Na+含量变化不大,表皮和皮层中的Na+增多;K+在皮层中分布较多,但随着盐浓度增加而明显减少,而除九江种源外,中柱中的K+含量变化不大;Ca2+在表皮中整体较多,因此导致K+/Na+和Na+/(K++Na++Ca2++Mg2+)值在中柱中较大,Ca2+/Na+值在表皮中较大。这说明,盐浓度越高,根部表皮、皮层中Na+量越多,具有一定的局部离子区域化现象,但从整体上看,盐胁迫下仍以根部中柱中的Na+含量较高,从而导致幼苗根部从营养液中吸收的K+、Ca2+、Mg2+量较少,且以九江种源最为明显。其中,中柱中K+量受影响较小,而Ca2+却大多集中分布在表皮,这可能就是为什么在大多数缺素施肥的情况下,多以钙镁混合肥为主。当然,这也可能与营养元素自身的理化性质及其活跃性有关。
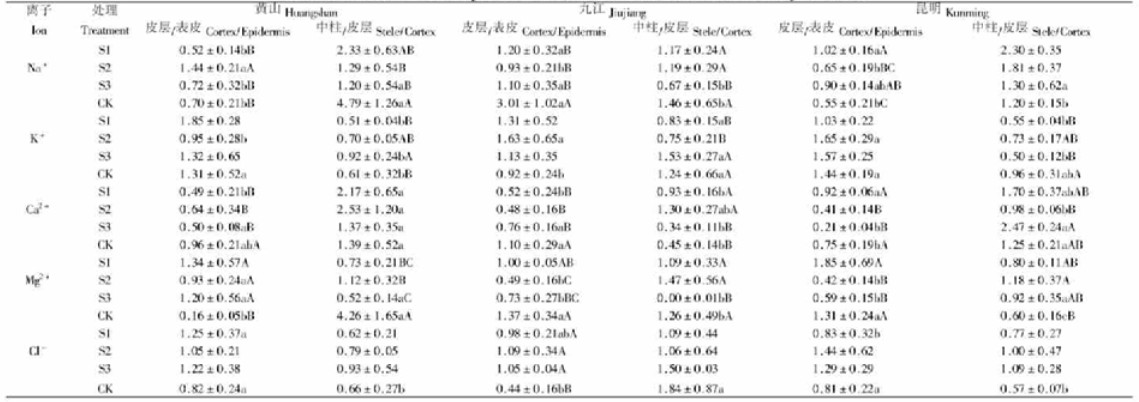
2.1.3 盐胁迫下根部组织中离子的选择性运输盐胁迫下根部组织中离子的选择性运输情况见表 2。由表 2可知,盐胁迫下,供试种源幼苗随着盐浓度增加,Cl-进入幼苗根部中柱、皮层增多;Na+由表皮运输到皮层的比率变化不大,但由皮层到中柱的量呈减少趋势,这说明Na+大部分沉积在根部的皮层及外表皮上;K+由表皮到皮层的比率变化较小,但由皮层进入中柱的比率逐渐增多;Ca2+由表皮到皮层的量减少,由皮层到中柱的量变化趋势不明显;Mg2+由表皮进入皮层的量增加,但由皮层进入中柱的量减少。
|
|
盐胁迫下,供试种源幼苗根部离子的选择性运输表现为(表 2):对于Na+而言,由表皮进入皮层最多的是九江种源,而由皮层进入中柱各种源均表现为降低趋势,因此差异不明显;对于K+而言,由表皮进入皮层中最少及由皮层进入中柱最多的均为九江种源;对于Ca2+而言,由表皮进入皮层较少的是昆明种源,而由皮层进入中柱中最少的是九江种源;对于Mg2+而言,由表皮进入皮层较少的是九江和昆明种源,由皮层进入中柱中最少的是九江种源,且在5 g·L-1盐处理下,进入中柱的量趋于0;对于Cl-而言,由表皮进入皮层的量在种源间差异较小,但由皮层进入中柱的量以九江种源较多。以上结果说明,九江种源幼苗根部组织中Na+、Cl-量最多,昆明种源次之,黄山种源最少。
方差分析结果表明,盐胁迫下幼苗根部离子由表皮到皮层和由皮层到中柱的运输在种源间、处理间及离子间的差异均达显著水平。从种源来看,九江种源进入中柱中的营养元素总量最少(1.06),昆明种源居中(1.14),黄山种源最多(1.48);从处理看,在5 g·L-1NaCl胁迫处理下进入根部中柱中的营养元素总量仅为1.02,明显低于对照水平(1.51);从离子来看,进入根部皮层、中柱的离子以Na+、Cl-较多。
以上结果表明,盐胁迫下盐浓度越高,Na+量越多,K+量越少,其中以九江种源较为明显。从供试种源幼苗根部离子的选择性运输结果来看,在1 g·L-1NaCl处理23 d后,Na+、Cl-的分布比率接近甚至低于对照,说明1 g·L-1NaCl对供试幼苗的影响较小。
2.2 盐胁迫下幼苗生长变化 2.2.1 幼苗存活率变化由图 2可知,整个试验期间,在正常条件下,供试种源幼苗的存活率均为100%。而在盐胁迫下,随着胁迫强度和胁迫时间的增加,供试种源幼苗的存活率均呈下降趋势。其中,胁迫8 d时,在1、3 g·L-1NaCl胁迫下,供试种源幼苗存活率均为100%;在5 g·L-1NaCl胁迫下,供试黄山与昆明种源分别为90%与92%,九江种源仅为68%。当胁迫达到28 d时,在1 g·L-1NaCl下,供试九江种源幼苗的存活率为84%,黄山种源为85%,昆明种源为90%;在3 g·L-1NaCl胁迫下,供试九江种源为33%,黄山种源为70%,昆明种源为50%;而在5 g·L-1NaCl胁迫下,供试九江种源幼苗完全死亡,黄山种源的幼苗存活率降至25%,昆明种源的幼苗存活率仅为7.5%。以上结果表明,盐胁迫下供试种源幼苗出现不同程度的死亡。相对而言,在1 g·L-1NaCl胁迫下,供试各种源幼苗的存活率较高,适应较好,可初步认为青钱柳幼苗的耐盐阈值为1 g·L-1。而当盐浓度达到3至5 g·L-1时,黄山种源的幼苗存活率明显较高,昆明种源居中,九江种源最低。综合比较而言,3个种源以安徽黄山种源的耐盐能力较强。
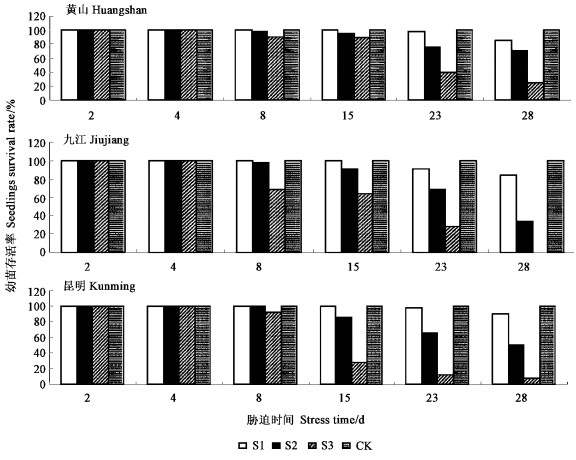
|
图 2 盐胁迫下幼苗存活率 Figure 2 Survival percentage of seedlings under salt stress |
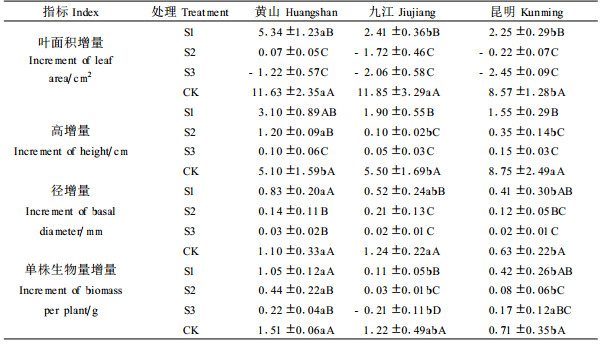
盐胁迫下,苗木生长状况能直观反映出它的抗性强弱(Slama et al., 2007)。由表 3可知,盐胁迫28 d后,各种源处理间幼苗叶面积、苗高及地径增长量的差异均达显著水平,低盐胁迫下差异明显,随着盐浓度增加,差异减小。随着盐胁迫强度增加,均呈下降趋势。其中,在1 g·L-1NaCl胁迫下,供试种源幼苗苗高、地径及叶面积均有不同程度的增长,相对而言以黄山种源幼苗苗高、地径、叶面积的增长量较大;在3 g·L-1NaCl胁迫下,供试种源幼苗的苗高、地径仍有一定增长,但幼苗叶面积增长量极小甚至为负值;在5 g·L-1NaCl胁迫下,供试各种源幼苗苗高、地径增长量较小,叶面积增长量均为负值。这表明,在1 g·L-1NaCl胁迫下,供试种源幼苗受到的盐害程度较小,因此供试幼苗的根茎叶仍能进行生长发育。但随着盐浓度增加,供试幼苗受到的伤害程度加重,根茎发育受阻,叶片从根部获得的养分减少。加上盐胁迫下幼苗受到的水分胁迫及单盐毒害,叶片出现不同程度的萎蔫卷曲及枯焦,因此叶面积增长量在较强盐胁迫下为负值。
|
|
由表 3可知,盐胁迫下随着盐浓度增加,供试种源幼苗的生物量增量基本呈下降趋势。方差分析结果表明,盐胁迫28 d后种源间及处理间幼苗生物量增量均达差异显著水平。盐胁迫下,3个种源幼苗生物量增量的大小顺序为黄山>昆明>九江。生物量直接反映植物的生长状况。结果说明,盐胁迫下黄山种源的幼苗生长状况较佳,即其耐盐能力较强。其中,在1 g·L-1NaCl胁迫下,黄山种源幼苗的生物量增量为1.05 g,昆明种源幼苗的生物量增量为0.42 g,均较接近对照水平。据此,可以确定黄山、昆明种源幼苗正常生长的耐盐阈值为1 g·L-1左右。
3 结论与讨论根是植物重要的运输器官。Na+、K+、Ca2+、Mg2+及ABA(脱落酸)等物质在根部质外体中能自由移动,而要到达髓部时则需要穿过内皮层的“凯氏带”,这个过程主要是通过内皮层细胞质膜的选择性吸收功能来控制(Chen et al., 2002)。本试验研究结果表明,在青钱柳幼苗根部横切面中,随着盐浓度增加,根部表皮和皮层中的Na+含量增加,而在中柱中的变化较小。这说明,为保护植物细胞质免遭Na+毒害,Na+在根部表皮中进行一定程度的区域化。而在3和5 g·L-1NaCl处理下,大多数幼苗根部中柱中的Cl-含量均较高。这表明,Cl-通过质外体和共质体途径能穿过植物细胞的凯氏带,这可能导致Cl-对青钱柳生长的毒害作用比Na+大。
对大多数非盐生植物而言,单盐胁迫下过多的Na+将导致植物体内的营养失衡。本研究结果表明,随着盐胁迫强度增强,根部组织中Na+的相对含量增加,而K+、Ca2+、Mg2+的相对含量减少,尤其以K+的变化较为明显,进一步说明Na+对K+具有拮抗作用。有学者认为,根系生长状况能作为衡量植物耐盐能力大小的标准,而根生长与根组织中K+量的多少密切相关(Zhu et al., 1998)。本试验发现3个种源间幼苗根部K+/Na+值的差异显著,其中以黄山种源的最高,这可能是导致黄山较其他2个种源耐盐能力强的原因。
单盐胁迫下,盐浓度增加,生长介质的水势降低,植物遭到渗透胁迫,进而导致植物生长下降(Slama et al., 2007)。在本试验中,幼苗存活率和生长均随着盐浓度的增加而减少。这可能是由于植物为调节渗透压,吸收较多离子,尤其是Na+、Cl-的过多积累所致。淡土植物与盐生植物不同,不能进行完全离子区域化,从而对细胞代谢产生毒害作用(Yang et al., 2007),本试验的研究结果与之相符。试验中发现,随着盐浓度增加,根部表皮和皮层中的Na+增多,中柱中的变化不大,从某种程度上说,供试幼苗具有一定的离子区域化现象,但从整体上看,根部中柱中的Na+含量仍是最高的,这表明与盐生植物的完全离子区域化相比,青钱柳不能进行有效的离子区域化,且在盐浓度较低的处理中,大多数供试幼苗的生长下降,这些均表明青钱柳为盐敏感植物。然而,在1 g·L-1NaCl处理下,除九江种源外,供试幼苗基本能进行生长发育,这说明青钱柳幼苗的耐盐阈值为1 g·L-1左右。从供试幼苗的生长情况来看,黄山种源最佳,即该种源的耐盐能力最强,进一步说明植物耐盐性可能与K+相对Na+的选择性吸收能力密切相关。
综上所述,盐胁迫下供试幼苗根部离子分布受到显著影响,在3或5 g·L-1NaCl胁迫下,根部组织中Na+、Cl-的相对含量增加,K+、Ca2+、Mg2+的相对含量降低。随着盐浓度增加,根部表皮和皮层中的Na+含量增加,而Cl-在根部中柱和皮层中的相对含量明显增加。根部组织中的离子失衡,K+/Na+和Ca2+/Na+值减小,Na+/(K++Na++Ca2++Mg2+)值增大,尤其是根部组织中K+/Na+值的减小和Cl-的显著增加导致幼苗存活率和生长下降。初步认为,供试种源幼苗耐盐能力的大小顺序为黄山>昆明>九江,且青钱柳幼苗的耐盐阈值为1 g·L-1左右。
蔡清泉. 1990. 我国海涂资源开发利用的现状和展望. 国土与自然资源研究, (2): 33-37. |
方升佐, NFDA4香香. 2007. 青钱柳资源培育与开发利用的研究进展. 南京林业大学学报:自然科学版, 31(1): 95-100. |
潘瑞炽. 1995. 植物生理学. 北京: 高等教育出版社.
|
Chen S, Li J, Wang S. 2002. Sodium and chloride distribution in roots and transport in three poplar genotypes under increasing NaCl stress. Forest Ecology and Management, 168: 217-230. DOI:10.1016/S0378-1127(01)00743-5 |
Lambers H. 2003. Dryland salinity: a key environmental issue in southern Australia. Plant and Soil, 257: 5-7. |
Lindsay E, Ma H, Wang S. 1996. X-ray microanalysis of ion distribution in salt tolerancy and salt intolerant poplar genotypes. Journal of Beijing Forestry University, 5(2): 23-30. |
Niu X, Bressan R, Hasegawa P, et al. 1995. Ion homeostasis in NaCl stress environments. Plant Physiology, 109: 735-742. DOI:10.1104/pp.109.3.735 |
Parida A, Das A. 2005. Salt tolerance and salinity effects on plants: a review. Ecotoxicology and Environmental Safety, 60: 324-349. DOI:10.1016/j.ecoenv.2004.06.010 |
Slama I, Ghnaya T, Messedi D, et al. 2007. Effect of sodium chloride on the response of the halophyte species Sesuvium portulacastrum grown in mannitol-induced water stress. Journal of Plant Research, 120: 291-299. DOI:10.1007/s10265-006-0056-x |
Ward J, Hirschi K, Sze H. 2003. Plants pass the salt. Trends in Plant Science, 8(5): 200-201. DOI:10.1016/S1360-1385(03)00059-1 |
Yang C, Chong J, Li C, et al. 2007. Osmotic adjustment and ion balance traits of an alkali resistant halophyte Kochia sieversiana during adaptation to salt and alkali conditions. Plant and Soil, 294(263): 276. |
Zhu J, Liu J, Xiong L. 1998. Genetic analysis of salt tolerance in Arabidopsis: evidence for the critical role of potassium nutrition. The Plant Cell, 10: 1181-1191. DOI:10.1105/tpc.10.7.1181 |
 2008, Vol. 44
2008, Vol. 44