文章信息
- 胡启鹏, 郭志华, 李春燕, 马履一.
- Hu Qipeng, Guo Zhihua, Li Chunyan, Ma Lüyi.
- 植物表型可塑性对非生物环境因子的响应研究进展
- Advance at Phenotypic Plasticity in Plant Responses to Abiotic Factors
- 林业科学, 2008, 44(5): 135-142.
- Scientia Silvae Sinicae, 2008, 44(5): 135-142.
-
文章历史
- 收稿日期:2007-05-16
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 北京 100091
2. Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091
植物在进化过程中,不断与周围环境进行选择与被选择的作用,最终形成许多外在形态和内在生理上的适应策略,这些生态适应特征表现为植物性状(plant traits)。然而环境总是存在不同程度的异质性,植物在与环境相互作用过程中,总会以“扬长避短"的方式向有利的方向发展,最大程度地减小不利的影响,这种响应特征即为植物表型可塑性(phenotypic plasticity),所以可塑性可以更好地反映环境的变化,特别是在气候变化的大环境下,植物可塑性研究对气候变化的反映具有非常重要的意义。
近年来,在植物表型可塑性研究中,除了对一般的生物因子,包括竞争者、草食动物以及传粉昆虫等进行研究外(Schlichting et al., 1993),研究重点逐渐转移到异质性巨大的非生物因子上,如光照、温度、水分和营养等(Weinig,2000;Portsmuth et al., 2006;Niinemets,2007),而且国外研究重点正从具体点上向全球变化的面上深入(Valladares et al., 2006;Crispo,2007),但国内的研究却很少。本文基于全球变化的影响,分析了可塑性与非生物因子的关系。同时,总结出一套评价可塑性的指标与方法,以供国内相关研究者参考,推动国内植物可塑性研究进展。
1 可塑性的定义表型(phenotype)是基因与环境相互作用而塑造的结果,对生物在异质或变化环境中生存至关重要,特别是对不能移动的光合有机体(Bradshaw,1965;Pintado et al., 1997)。而可塑性则被定义为生物受到环境影响而基因型能够作出相应改变、产生不同表型来应对其生存的时空异质环境的能力(Bradshaw,1965;2006)。可塑性能够使植物改变形态、生理和发展性状,最大限度地达到其表型与生存环境相一致而缓冲环境对生长和生殖产生的消极影响(Sultan,2005)。随着生物学、生态学的发展,可塑性得到了进一步深入研究,其中传统的观点(把可塑性看作是对分化的一种选择)继续得到证实(Schmitt et al., 2003);同时也提出了一种新的观点,即植物某些性状的可塑性可以代表分化(Lortie et al., 1996),而且本身可以遗传,可以独立接受进化选择(van Kleunen et al., 2005)。但这些由特定基因型决定的可塑性往往立足于分化与环境影响之间的关系,即在有利的环境中,分化能够增加可塑性,而在不利的环境中,分化则降低可塑性。
2 可塑性与性状的关系可塑性与性状都是植物与环境相互作用的结果。一种观点认为某一性状的可塑性程度可能与性状平均值存在内在的相互关系(Pigliucci et al., 2003);而另一种则认为可塑性自身可以作为一种性状,并可从性状平均值中进化分离出来(Scheiner,1993),这样,选择可以单独作用于可塑性本身,独立于性状平均值。虽然以前工作也发现可塑性与性状平均值存在正相关性(Scheiner,2002;Pigliucci et al., 2003),但这些研究一般基于不同环境中两者的比较,因为较高可塑性的基因型比较低可塑性的基因型可能具有较高的性状平均值,也可能具有较低的性状平均值。针对这些不充分的结论,Weijschedé等(2006)设计了遮荫诱导和高光处理对白车轴草(Trifolium repens)的试验表明,选择不仅能够作用高光下表达的性状值,而且能够作用可塑性程度,即可塑性可以以自己的方式作为性状而进化,且独立于性状平均值,因为性状平均值不能通过诱导可塑性的环境来表达。
像任何性状的适应进化一样,表型可塑性的适应进化的前提条件是基因变异和自然选择(Schmitt et al., 2003),但进化更可能在时空异质性大的环境中发生(He et al., 2004)。理论研究表明,即使当这些条件都满足,可塑性适应进化可能受到可塑性的代价和限制所阻碍(van Kleunen et al., 2005)。在一个复杂的环境中,可塑性的代价往往会降低基因型的适合度,因为性状的表达是通过可塑性而不是固定发展,即这种性状的表达是和可塑性的表达能力有关,而与特定可塑基因型相比,多数可塑基因型的全球适合度非常低,在很大程度上决定了全球植被的多样性。而限制则是在某单一环境中性状值表达的代价而不是可塑性发展能力的代价,因为在这种环境中,特定可塑基因型已决定了性状的表达,只是性状的表达方式不同而已,所以会降低适应性。van Kleunen等(2005)总结了可塑性适应进化可能的代价和限制,并提出采用一些先进的生物手段来了解可塑性的基因背景,这样可以从分子水平找到基因表达与表型及与适合度的关系,就可以更好地理解适应可塑性并不是比非适应可塑性普遍,同时也可以预测可塑性响应的进化。
3 可塑性与光环境(耐荫性)的关系 3.1 耐荫性可塑性的大小一般被用作不同植物功能组(functional groups)或者不同耐荫性植物(shade-tolerance plants)之间的比较。根据植物的生长特征、存活率、演替阶段及形态和生活史等的不同,生态学家给出了很多关于耐荫性可能的解释(Grubb,1998;Reich et al., 2003;Valladares et al., 2005)。耐荫性是演替的基础,但植物对光需求的内在差异则成为演替期间植物组成变化的主要依据(Sack et al., 2001)。如果按长期在低光下的生存能力来表示,则耐荫性被定义为植物在遮荫环境中的生长能力(Niinemets et al., 2004a),生长能力的大小则从耐荫性指标的排序中得到。由于机械损伤或被草食,植物会不间断地损失生物量,并且老叶的更新和健康根系的发展都会消耗生物量,所以保持一个足够高的生长率对长期生存至关重要,因此,也可以根据总生长率的高低,把不同耐荫性植物数量化,然后排序(1=非常不耐荫,5=非常耐荫) (Portsmuth et al., 2006),从而可以更直观地区分耐荫性的大小。
3.2 耐荫性植物通常根据耐荫性不同可将植物划分为:先锋种(pioneer species)或非耐荫种(shade-intolerant species)与耐荫种(shade-tolerant species)。一般将演替早期阶段的植物称为非耐荫种,非耐荫种具有高的光合生理能力(Koike et al., 2001;Delagrange et al., 2004;Suarez et al., 2005),目的主要是通过增加高生长率为演替初期的建立奠定基础,在此阶段,环境往往波动很大,受干扰严重,所以植物必须有一个易变化的结构才能够最大化地利用环境资源,以利于快速生长。而在林分演替后期,耐荫种会通过调整树冠结构、增加总叶面积来改变林分结构成为优势种(Valladares et al., 2002;Sterck et al., 2003;Pearcy et al., 2005)。
在演替初期,林下光有效性似乎是被既定降低的,但依赖光的可塑性会在植物占据一个变化的生境中(变化的资源有效性)得到发展(Givnish,2002),从而植物能够在林下多变的低光下生存,并最终演替到顶级。而在整个演替过程中,似乎不同的性状共同决定了植物的发展(de Kroon et al., 2005),据此,Portsmuth等(2006)将能够描述植物生长的性状定义为生理性状,能够影响光能捕获的性状定义为结构性状,两者共同决定耐荫种与非耐荫种之间的可塑性差异,且这些性状是由种子大小和个体发育速率的变化来驱动(Niinemets,2006)。
3.3 不同耐荫性植物可塑性差异根据结构性状和生理性状的不同功能特征,将植物表型可塑性分为生理可塑性与结构可塑性。许多证据表明耐荫种生理可塑性比非耐荫种要低(Valladares et al., 2002;Delagrange et al., 2004;Sánchez-Gómez et al., 2006),因为高的可塑性可以让非耐荫种获得高的生长率,从而可以快速地占据迹地(Walters et al., 1999);而耐荫种之所以在林下比非耐荫种生长好,是因为其具有较高的结构可塑性,这正好抵消生理可塑性方面的不足(Valladares et al., 2002;Paz,2003;Niinemets et al., 2004a)。但以前的证据认为,不同耐荫性植物提高光能捕获的可塑性与加强碳同化的可塑性之间呈负相关(Lortie et al., 1996),而且近年来的研究也发现耐荫种的结构可塑性比非耐荫种低(Bloor et al., 2004;Sánchez-Gómez et al., 2006)。针对这些不统一的结论,Portsmuth等(2006)对5个温带不同功能组乔木树种的可塑性比较表明,非耐荫种结构可塑性与生理可塑性均比耐荫种高,且两者之间也并不存在相互弥补的关系;同时,Valladares等(2000)发现不论在耐荫树种之间,还是叶性状之间,植物生理性状可塑性均比结构可塑性要高。
对此,可从两方面来解释,一种解释认为,在林下低光环境中生存本质上是耐荫植物一种被选择的结果,耐荫植物不仅可以最低限度地降低呼吸损失(Walters et al., 2000a;Noda et al., 2004;Craine et al., 2005),并且可以长期地最大化茎和根的生物量储存,而不是通过光合产物的可塑性消耗对环境变化进行跟踪适应来获取资源(Reich et al., 2003;Portsmuth et al., 2006),相比较,在异质性环境中非耐荫种对光照适应的可塑性要求更高,因为光并不能成为非耐荫种的限制条件,所以截获光能的结构可塑性要比通过光合产物的可塑性消耗增加高生长和竞争力的生理可塑性要低(Givnish,2002),如果这样,非耐荫种这种高的可塑性会随着演替过程而逐渐降低,而耐荫种的可塑性则会增大。另一种解释认为,耐荫种的生长潜力在低光下并没有受到限制,但似乎是植物幼苗的总质量而不是生长率决定其成功占据林下地位,但反过来,低光下幼苗的总质量是由其种子的大小决定的而不是生长率(Niinemets,2006)。所以,一般种子大的植物相对较耐荫,种子小的则更喜光。
3.4 可塑性的可比性在对植物表型可塑性的研究中,往往会得出一些不一致或不相关的结论,这可能是研究条件或者是研究材料也或者是研究手段不同而造成的,在这里本文只总结出3种常见的例子,希望在今后的研究中加以注意。一是试验重复不够,以前关于耐荫植物具有高的结构可塑性往往数据很有限(Valladares et al., 2002;Niinemets et al., 2004b)。比如,Valladares等(2002)在对中度耐荫种欧洲枥(Quercus robur)和耐荫种欧洲水青冈(Fagus sylvatica)幼苗的结构与生理可塑性研究中发现后者具有更高的结构可塑性,但对同样的2个种,Welander等(1998)却发现两者之间可塑性相似。这说明相接近的种间可塑性的比较,有必要设置足够多的重复。二是试验材料的选择要有可比性。比如Givnish (1988)发现耐荫种比非耐荫种具有更低的比叶质量(leaf dry mass per area,LMA),也有证据证明了这一点(King,2003),但另外一些研究则表明非耐荫种的LMA更高(Poorter,1999;Reich et al., 2003;Walters et al., 2000b)。同时有的研究支持低光下耐荫种的净吸收率(net assimilation rate,NAR)比非耐荫种高(Kazda et al., 2000),这可以解释遮荫环境下的植物为什么具有特殊的功能表现,但其他的研究结果恰恰相反(Kitajima,1994;Reich et al., 2003)。其实,这些相悖的研究结论缘由选择的材料不同而已,那些认为非耐荫种具有低的LMA和高的光合能力是选择植物幼苗为研究材料,而认为耐荫种具有低的LMA是因为选择了多年生的小树或者是成熟的大树作为研究材料(Niinemets,2006a)。一般,植物成熟器官的表型性状基本固定,可塑性是不可逆的,Piersma等(2003)将这定义为“发展可塑性(developmental plasticity)”,而将可逆性状定义为“表型韧性(phenotypic flexibility)"。因此,在分析表型可塑性与耐荫性时要考虑清楚植物个体发育所处的阶段。除此之外,研究条件要有可比性,虽然常认为,可塑性高的植物比可塑性低的植物具有更高的生长速率和更强的竞争力,但如果植物在一个较大范围内且具体的环境因子梯度上相比较(González et al., 2004),可塑性与这种适合度并不相关,这是因为在大环境下其他因子也会影响到植物的发展,所以要控制好因子或者多方面考虑因子。
4 可塑性与其他非生物因子的关系除了光照外,在演替过程中,植物常会遇到营养、水分、温度、地理空间等的巨大变化,这些非生物因子共同影响植物的发生和发展。但地理空间的异质性一般体现在温度、水分及太阳辐射上,在此不予论述。
在营养成分中,氮是最主要的植物营养元素,与植物的光合作用密切相关,所以本文的营养因子是指氮元素。有的研究认为,高光下植物对营养的需求越大,生长对营养的响应就越强烈(Poorter et al., 2000),而沿着林窗-林下光梯度,光照与土壤营养有效性之间常呈负相关(Kobe,2006),特别是在次生演替中,土壤营养有效性一般很高,但为了加强叶片生长,林下植物在高的营养有效性条件下光有效性却降低很快(Bergh et al., 1999),因为较高的对光照变化的可塑性调整的能力将能够为耐荫植物提供一个重要的适应对策,这样能够加强对光能的截获,从而能够在冠层下生存,并最终演替为树冠层。这似乎说明依赖光照的可塑性表现要依赖营养有效性。Portsmuth等(2006)对温带不同耐荫性植物的研究也证明营养有效性对改变植物对光的响应至关重要,特别是耐荫种的可塑性对营养有效性的变化的响应最强烈,同时发现增加营养有效性可以减小耐荫种与非耐荫种之间的可塑性差异。如果这样,那么通过提高营养有效性就可以增加耐荫种光依赖的可塑性,这对树木的抚育非常有意义。虽然改变营养有效性,对改善光依赖可塑性具有显著的积极作用,但在较低的营养条件下,增加光照有效性会大大降低耐荫种的营养有效性(Portsmuth et al., 2006),且生长最不好(Burton et al., 1995),因此要通过提高营养或降低光照来改变不利于耐荫植物生长的环境状况。
水分是一种非常重要的生命物质,因为它参与许多生理代谢过程。在干旱条件下,一般植物生长高度较低,这缩短了根部水分到达叶部的距离,有利于水分的有效输送(Tyree et al., 1991);为了汲取更多水分,植物倾向于将更多的生物量分配到根部,延长其向更深地下生长(Sultan et al., 1993);同时,为了防止水分的过度蒸发散,植物叶面积会降低(Valladares et al., 2006)。Hoda等(2004)在马蹄香(Primula siebodii)对光照-水分梯度响应的研究中发现,马蹄香的叶面积在水分亏缺时比盈湿时更小,且这种响应在高光条件下比在低光下更强烈。这就说明高的根部生物量与叶面积之比能保证根部吸水与叶片蒸腾失水之间的平衡(Tani et al., 2001)。甚至,水分有效性能够调控植物的繁殖方式,在对油莎草(Cyperus esculentus)的研究中,Li等(2001)发现湿润环境有利于其营养繁殖(块茎繁殖),而干燥环境则有助于其有性繁殖。对于C3和C4植物,季节性水分有效性的变化对其光合特征及生长机制调控及其重要(Niu et al., 2005),干燥的冬季和湿润的夏季能增加C4植物的数量,而湿润的冬季和干燥的夏季适宜C3植物的繁殖(Monson et al., 1983);而在全球尺度上,季节性降水的增加使C4植物在北美、中国和非洲大量生长(Pagani et al., 1999)。
不难理解,根据生长快慢,可将植物分为快速生长树种(fast-growth species)和慢速生长树种(slow-growth species),如果在不考虑系统发生条件下,生长快的树种比生长慢的树种具有更大的温度依赖变化;而在不同温度梯度间,叶片与根之间高的生物量分配在慢生树种上得到了较好体现(Atkin et al., 2006)。相似地,根据植物生长温度的高低,可将植物分为暖生长植物(warm-grown plant)和冷生长植物(cold-grown plant)(Atkin et al., 2006),前者比后者具有较低的光合和呼吸能力(Atkin et al., 2005),但两者的新陈代谢速率相似(Atkin et al., 2003),而新陈代谢的适应导致两者呼吸与光合之比相似(Loveys et al., 2003),最终,这些表型变化导致了两者相对生长率的不变。而长期生长在低温下的植物,茎与叶片的生物量比率会降低,而叶片厚度和比叶面积(specific leaf area ration,SLA)均比较高温度下的厚和大(Atkin et al., 2005)。这常导致植物个体生长率对温度的依赖(Storkey,2004),且这种响应可能会随着未来年均气温的增加而显现出来,如果植物正在经历的温度变化是全球气候变化引起的,那么预测植物对温度的生长响应将会是全球变化对生物圈影响的基础(Long et al., 1991)。
5 可塑性与适应性的关系适应是植物个体对变化环境所作出的形态和生理的响应调整。因为多数有机体,特别是植物通过改变它们的表型来响应环境的改变,所以表型可塑性常被认为是植物对环境异质性的一种适应。然而,当环境受到胁迫时,比如水分、光照、营养胁迫等,许多表型响应为资源限制,植物常表现为消极生长(van Kleunen et al., 2000)。同样地,为了让植物生长更好,而可塑性没有响应时,可塑性会导致不适应或不利于适应(Weinig,2000;Poulton et al., 2002),比如,通过增加光照让耐荫种生长更好,这不但不能使其更好生长,反而会导致不适应。其实,表型可塑性不仅对适应非常必要,而且由于与其他性状具有遗传相关性,而这些性状恰恰是选择或者是遗传的表现(van Kleunen et al., 2005),所以,某一性状的可塑性又不能笼统地说它是适应的。但与消极的可塑性响应相比,植物在发展过程中,还需要积极的可塑性响应,但积极的可塑性响应需要一个能使植物产生响应的专门的信号感应转换系统来完成(van Kleunen et al., 2005)。在某些条件下,积极的与消极的响应是同时存在的,比如森林中处于竞争力强的树种遮荫下的树木,一般会积极地伸长茎或枝来决定其最佳的叶片高度,尽可能地截获光能,以达到植物的上层,同时由于资源受限,节间生长可能会消极地降低。这意味着积极的响应似乎很大,但观测到的相对较小,甚至有相反的迹象。
6 可塑性评价可塑性的评价一般通过模型建立,将不同性状可塑性指标综合化(常见性状可塑性指标见表 1),以此来决定植物可塑性的大小。常见可塑性评价方法如下:
|
|
1) 基于相对生长率(RGR)的组成成分净吸收率(NAR)和叶面积比(LAR)的变化程度,以及NAR与LAR相对于RGR的变化程度,NAR代表生理可塑性,LAR代表结构可塑性。用NAR与RGR,LAR与RGR作回归曲线,前者的回归斜率为生理可塑性值,后者的回归斜率为结构可塑性值,总的可塑性值为两者的平均值。
2) 基于标准回归斜率可塑性值,标准回归斜率为:
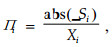
|
式中:Si是指标与环境因子的回归斜率,Xi是环境梯度上指标的平均值,abs()为绝对值函数,Πi值是标准化的可塑性值(生理可塑性ΠP和结构可塑性ΠS)。ΠP由NAR和RGR对环境因子的回归斜率的平均值求得,ΠS由其他指标对环境因子的回归斜率的平均值求得,两者平均值为可塑性值。
3) 基于回归斜率法一般用于植物在全光下的可塑性评价。评价低光和中度光照下植物的可塑性值,如5%和10%,5%和30%的低中光照,以5%和10%为例,公式为:
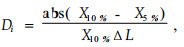
|
式中:X10%是性状在10%光照下的值,X5%是性状在5%光照下的值,ΔL是光照强度之差(10%-5%),Di是结构可塑性值。同理,中度光照下的可塑性值用5%和30%的光照。同样,生理可塑性和结构可塑性以及总的可塑性参照标准斜率方法计算。
4) 可塑性大小=(某一指标在环境梯度上的最大平均值-最小平均值)/最大平均值。
5) 反映准则斜率,即可塑性指标与环境因子的回归斜率,最多适用于2个环境因子下的可塑性评价。
6) 响应系数,高资源有效性下可塑性指标平均值与低资源有效性下可塑性指标平均值的比率,仅用于2个环境因子条件下。
7) 变异系数法,不同环境梯度下某一指标的标准偏差与平均值的比率。
7 研究展望表型可塑性是植物应对其生存异质环境,基因型产生不同表型的能力,且可以遗传,而且可以适应进化,也就是说植物表型可塑性在异质环境中,如光、水分、营养和温度等变化的大环境下,能够发生遗传变异,接受自然选择,或者表现为消极的可塑性响应,或者表现为积极的可塑性响应,但不论是积极的还是消极的响应,可塑性能够使植物改变形态、生理或发展性状,最大限度地达到其表型与生存环境相一致。所以,通过对植物表型可塑性的研究或跟踪,可以更好地反映环境变化。
目前关于植物表型可塑性的研究多集中在某个地点上的几种植被,但在大的区域上,研究一般较少。在全球气候变化的影响下,植物将会面临光照、温度和水分最直接的时空挑战。因为可塑性本身可以遗传,可以接受选择进化,且表现在生理和结构上,所以在未来环境变化的影响下,植物势必会对这些变化作出响应,进化出某些性状来应对异质的环境变化。反过来,运用先进的生物学手段,可以更好地从植物的表型可塑性来反馈气候的变化,这将会得到非常有用的与气候相关的信息。
在国内,对表型可塑性系统研究很有限。我国不仅拥有典型的地域性植被分布,如针叶林、阔叶林、灌丛和萌生矮林等,还有海拔空间上的典型分布,比如长白山植被分布等。虽然国内的研究手段一般都能达到国际水平,但研究成果却很有限。在全球气候变化影响下,应加强植物可塑性研究,特别是对大区域尺度上气候变化对植被可塑性的影响评价,以此来反映我国的气候变化特征。
Atkin O K, Loveys B R, Atkinson L J, et al. 2006. Phenotypic plasticity and growth temperature:understanding interspecific variability. Journal of Experimental Botany, 57(2): 267-281. DOI:10.1093/jxb/erj029 |
Atkin O K, Bruhn D, Hurry V M, et al. 2005. The hot and the cold:unraveling the variable response of plant respiration to temperature. Functional Plant Biology, 32: 87-105. DOI:10.1071/FP03176 |
Atkin O K, Tjoelker M G. 2003. Thermal acclimation and the dynamic response of plant respiration to temperature. Trends in Plant Science, 8: 343-351. DOI:10.1016/S1360-1385(03)00136-5 |
Bergh J, Linder S, Lundmark T, et al. 1999. The effect of water and nutrient availability on the productivity of Norway spruce in northern and southern Sweden. Forest Ecology and Management, 119: 51-62. DOI:10.1016/S0378-1127(98)00509-X |
Bloor J M G, Grubb P J. 2004. Morphological plasticity of shade-tolerant tropical rainforest tree seedlings exposed to light changes. Functional Ecology, 18: 337-348. DOI:10.1111/fec.2004.18.issue-3 |
Bradshaw A D. 1965. Evolutionary significance of phenotypic plasticity in plants. Advanced Genetics, 13: 115-155. |
Bradshaw A D. 2006. Unravelling phenotypic plasticity—why should we bother?. New Phytologist, 170: 644-648. DOI:10.1111/nph.2006.170.issue-4 |
Burton P J, Bazzaz A. 1995. Ecophysiological responses of tree seedlings invading different patches of old-field vegetation. Journal of Ecology, 83: 99-112. DOI:10.2307/2261154 |
Craine J M, Reich P B. 2005. Leaf-level light compensation points in shade-tolerant woody seedlings. New Phytologist, 166: 710-713. DOI:10.1111/nph.2005.166.issue-3 |
Crispo E. 2007. The Baldwin effect and genetic assimilation of evolutionary change mediated by phenotypic plasticity. Evolution, 61(11): 2469-2479. DOI:10.1111/evo.2007.61.issue-11 |
De Kroon H, Huber H, Stuefer J F, et al. 2005. A modular concept of phenotypic plasticity in plants. New Phytologist, 166: 73-82. DOI:10.1111/j.1469-8137.2004.01310.x |
Delagrange S, Messier C, Lechowicz M J, et al. 2004. Physiological, morphological and allocational plasticity in understory deciduous trees:importance of plant size and light availability. Tree Physiology, 24: 775-784. DOI:10.1093/treephys/24.7.775 |
Givnish T J. 1988. Adaptation to sun and shade:a whole-plant perspective. Australian Journal of Plant Physiology, 15: 63-92. DOI:10.1071/PP9880063 |
Givnish T J. 2002. Ecological constraints on the evolution of plasticity in plants. Evolutionary Ecology, 16: 213-242. DOI:10.1023/A:1019676410041 |
González A V, Gianoli E. 2004. Morphological plasticity in response to shading in three Convolvulus species of different ecological breadth. Acta Oecologica, 26(3): 185-190. DOI:10.1016/j.actao.2004.05.001 |
Grubb P J. 1998. A reassessment of the strategies of plants which cope with shortages of resources. Perspectives in Plant Ecology, Evolution and Systematics, 1: 3-31. DOI:10.1078/1433-8319-00049 |
He W M, Zhang H, Dong M. 2004. Plasticity in fitness and fitness-related traits at ramet and genet levels in a tillering grass Panicum miliaceum under patchy soil nutrients. Plant Ecology, 172: 1-10. DOI:10.1023/B:VEGE.0000026043.27342.e2 |
Hoda H, Muraoka H, Washitani I. 2004. Morphological and physiological acclimation responses to contrasting light and water regimes in Primula sieboldii. Ecological Research, 19: 331-340. DOI:10.1111/ere.2004.19.issue-3 |
Kazda M, Salzer J, Reiter I. 2000. Photosynthetic capacity in relation to nitrogen in the canopy of a Quercus robur, Fraxinus angustifolia and Tilia cordata flood plain forest. Tree Physiology, 20: 1029-1037. DOI:10.1093/treephys/20.15.1029 |
King D A. 2003. Allocation of above-ground growth is related to light in temperate deciduous saplings. Functional Ecology, 17: 482-488. DOI:10.1046/j.1365-2435.2003.00759.x |
Kitajima K. 1994. Relative importance of photosynthetic traits and allocation patterns as correlates of seedling shade tolerance of 13 tropical trees. Oecologia, 98: 419-428. DOI:10.1007/BF00324232 |
Kobe R K. 2006. Sapling growth as a function of light and landscape-level variation in soil water and foliar nitrogen in northern Michigan. Oecologia, 147: 119-133. DOI:10.1007/s00442-005-0252-8 |
Koike T, Kitao M, Marugama Y, et al. 2001. Leaf morphology and photosynthetic adjustments among deciduous broad-leaved trees within the vertical canopy profile. Tree Physiology, 21: 951-958. DOI:10.1093/treephys/21.12-13.951 |
Li Bo, Shibuya T, Yogo Y, et al. 2001. Interclonal differences, plasticity and trade-offs of life history traits of Cyperus esculentus in relation to water availability. Plant Species Biology, 16: 193-207. DOI:10.1046/j.1442-1984.2001.00064.x |
Long S P, Hutchin P R. 1991. Primary production in grasslands and coniferous forests with climate change—an overview. Ecological Applications, 1: 139-156. DOI:10.2307/1941807 |
Lortie C G, Aarssen L W. 1996. The specialization hypothesis for phenotypic plasticity in plants. International Journal of Plant Sciences, 157: 484-487. DOI:10.1086/297365 |
Loveys B R, Atkinson L J, Sherlock D J, et al. 2003. Thermal acclimation of leaf and root respiration:an investigation comparing inherently fast- and slow-growing plant species. Global Change Biology, 9: 895-910. DOI:10.1046/j.1365-2486.2003.00611.x |
Monson R K, Littlejohn R O, Williams Ⅲ G J. 1983. Photosynthetic adaptation to temperature in four species from the Colorado shortgrass steppe:a physiological model for coexistence. Oecologia, 58: 43-51. DOI:10.1007/BF00384540 |
Niinemets Ü, Aiafas N, Cescatti A, et al. 2004a. Determinants of clonal differences in light-interception efficiency in dense poplar plantations:petiole length and biomass allocation. Tree Physiology, 24: 141-154. DOI:10.1093/treephys/24.2.141 |
Niinemets Ü. 2006. The controversy over traits conferring shade-tolerance in trees:ontogenetic changes revisited. Journal of Ecology, 94: 464-470. DOI:10.1111/jec.2006.94.issue-2 |
Niinemets Ü. 2007. Photosynthesis and resource distribution through plant canopies. Plant, Cell and Environment, 30: 1052-1071. DOI:10.1111/pce.2007.30.issue-9 |
Niinemets Ü, Valladares F. 2004b. Photosynthetic acclimation to simultaneous and interacting environmental stresses along natural light gradients:optimality and constraints. Plant Biology, 6: 254-268. DOI:10.1055/s-2004-817881 |
Niu Shuli, Yuan Zhiyou, Zhang Yanfang, et al. 2005. Photosynthetic responses of C3 and C4 species to seasonal water variability and competition. Journal of Experimental Botany, 56(421): 2867-2876. DOI:10.1093/jxb/eri281 |
Noda H, Muraoka H, Washitani I. 2004. Morphological and physiological acclimation responses to contrasting light and water regimes in Primula sieboldii. Ecological Research, 19: 331-340. DOI:10.1111/ere.2004.19.issue-3 |
Pagani M, Freeman K H, Arthur M A. 1999. Late Miocene atmospheric CO2 concentrations and the expansion of C4 grasses. Science, 285: 876-879. DOI:10.1126/science.285.5429.876 |
Paz H. 2003. Root/shoot allocation and root architecture in seedlings:variation among forest sites, microhabitats, and ecological groups. Biotropica, 35: 318-332. DOI:10.1111/btp.2003.35.issue-3 |
Pearcy R W, Muraoka H, Valladares F. 2005. Crown architecture in sun and shade environments:assessing function and trade-offs with a three-dimensional simulation model. New Phytologist, 166: 791-800. DOI:10.1111/j.1469-8137.2005.01328.x |
Piersma T, Drent J. 2003. Phenotypic flexibility and the evolution of organismal design. Trends in Ecology and Evolution, 18: 228-233. DOI:10.1016/S0169-5347(03)00036-3 |
Pigliucci M, Pollard H, Cruzan M B. 2003. Comparative studies of evolutionary responses to light environments in Arabidopsis. American Naturalist, 161: 68-82. DOI:10.1086/345460 |
Pintado A, Valladares F, Sancho L G. 1997. Exploring phenotypic plasticity in the lichen Ramallina capitata:morphology, water relations and chlorophyll content in north and south facing populations. Annals of Botany, 80: 345-353. DOI:10.1006/anbo.1997.0453 |
Poulton J, Winn A A. 2002. Costs of canalization and plasticity in response to neighbors in Brassica rapa. Plant Species Biology, 17: 109-118. DOI:10.1046/j.1442-1984.2002.00081.x |
Poorter L. 1999. Growth responses of 15 rain-forest tree species to a light gradient:the relative importance of morphological and physiological traits. Functional Ecology, 13: 396-410. DOI:10.1046/j.1365-2435.1999.00332.x |
Poorter H, Nagel O. 2000. The role of biomass allocation in the growth response of plants to different levels of light, CO2, nutrients and water:a quantitative review. Australian Journal of Plant Physiology, 27: 595-607. |
Portsmuth A, Niinemets Ü. 2006. Structural and physiological plasticity in response to light and nutrients in five temperate deciduous woody species of contrasting shade tolerance. Functional Ecology, 12: 1-17. |
Reich P B, Wright I J, Cavender-Bares J, et al. 2003. The evolution of plant functional variation:traits, spectra and strategies. International Journal of Plant Sciences, 164: s143-s164. DOI:10.1086/374368 |
Sack L, Grubb P J. 2001. Why do species of woody seedlings change rank in relative growth rate between low and high irradiance?. Functional Ecology, 15: 145-154. DOI:10.1046/j.1365-2435.2001.00507.x |
Sánchez-Gómez D, Valladares F, Zavala M A. 2006. Functional traits and plasticity in response to light in seedlings of four Iberian forest tree species. Tree Physiology, 26: 1425-1433. DOI:10.1093/treephys/26.11.1425 |
Scheiner S M. 1993. Plasticity as a selectable trait—reply to Via. American Naturalist, 142: 371-373. DOI:10.1086/285544 |
Scheiner S M. 2002. Selection experiments and the study of phenotypic plasticity. Journal of Evolutionary Biology, 15: 889-898. DOI:10.1046/j.1420-9101.2002.00468.x |
Schlichting C D, Pigliucci M. 1993. Control of phenotypic plasticity via regulatory genes. American Naturalist, 142: 366-370. DOI:10.1086/285543 |
Schmitt J, Stinchcombe J R, Heschel M S, et al. 2003. The adaptive evolution of plasticity:phytochrome-mediated shade avoidance responses. Integrative and Comparative Biology, 43: 459-469. DOI:10.1093/icb/43.3.459 |
Sterck F, Martinez-Ramos M, Dyer-Leal G, et al. 2003. The consequences of crown traits for the growth and survival of tree saplings in a Mexican lowland rainforest. Functional Ecology, 17: 194-200. DOI:10.1046/j.1365-2435.2003.00729.x |
Storkey J. 2004. Modelling seedling growth rates of 18 temperate arable weed species as a function of the environment and plant traits. Annals of Botany, 93: 681-689. DOI:10.1093/aob/mch095 |
Suarez F, Pardos J A. 2005. Shade tolerance, photoinhibition sensitivity and phenotypic plasticity of Ilex aquifolium in continental-Mediterranean sites. Tree Physiology, 25: 1041-1052. DOI:10.1093/treephys/25.8.1041 |
Sultan S E. 2005. An emerging focus on plant ecological development. New Phytologist, 166: 1-5. DOI:10.1111/j.1469-8137.2005.01381.x |
Sultan S E, Bazzaz F A. 1993. Phenotypic plasticity in Polygonum persicaria Ⅱ. Norms of reaction to soil moisture and the maintenance of genetic diversity. Evolution, 47: 1032-1049. DOI:10.1111/evo.1993.47.issue-4 |
Tani T, Kudoh H, Kachi N. 2001. Responses of photosynthesis and biomass allocation of an understory herb, Pteridophyllum racemsosum, to gradual increases in irradiance. Annuals of Botany, 88: 393-402. DOI:10.1006/anbo.2001.1483 |
Tyree M, Ewers F E. 1991. The hydraulic architecture of trees and other woody plants. New Phytologist, 119: 345-360. DOI:10.1111/nph.1991.119.issue-3 |
Valladares F, Arrieta S, Aranda I, et al. 2005. Shade tolerance, photoinhibition sensitivity and phenotypic plasticity of Ilex aquifolium in continental-Mediterranean sites. Tree Physiology, 25: 1041-1052. DOI:10.1093/treephys/25.8.1041 |
Valladares F, Chico J M, Aranda I, et al. 2002. The greater seedling high-light tolerance of Quercus robur over Fagus sylvatica is linked to a greater physiological plasticity. Trees:Structure and Function, 16: 395-403. |
Valladares F, Sanchen G D, Zavala M A. 2006. Quantitative estimation of phenotypic plasticity:bridging the gap between the evolutionary concept and its ecological applications. Journal of Ecology, 94: 1103-1116. DOI:10.1111/jec.2006.94.issue-6 |
Valladares F, Wright S J, Lasso E, et al. 2000. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest. Ecology, 81: 1925-1936. DOI:10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 |
Van Kleunen M, Fischer M, Schmid B. 2000. Clonal integration in Ranunculus reptans: by-product or adaptation?. Journal of Evolutionary Biology, 13: 237-248. DOI:10.1046/j.1420-9101.2000.00161.x |
Van Kleunen, Fischer M. 2005. Constraints on the evolution of adaptive phenotypic plasticity in plants. New Phytogist, 166: 49-60. DOI:10.1111/j.1469-8137.2004.01296.x |
Walters M B, Reich P B. 1999. Low-light carbon balance and shade tolerance in the seedlings of woody plants:do winter deciduous and broad-leaved evergreen species differ?. New Phytologist, 143: 143-154. DOI:10.1046/j.1469-8137.1999.00425.x |
Walters M B, Reich P B. 2000a. Trade-offs in low-light CO2 exchange:a component of variation in shade tolerance among cold temperate tree seedlings. Functional Ecology, 14: 155-165. DOI:10.1046/j.1365-2435.2000.00415.x |
Walters M B, Reich P B. 2000b. Seed size, nitrogen supply, and growth rate affect tree seedling survival in deep shade. Ecology, 81: 1887-1901. DOI:10.1890/0012-9658(2000)081[1887:SSNSAG]2.0.CO;2 |
Weinig C. 2000. Plasticity versus canalization:population differences in the timing of shade-avoidance responses. Evolution, 54: 441-451. DOI:10.1111/evo.2000.54.issue-2 |
Weijschedé J, Martinkova J, de Kroon H, et al. 2006. Shade avoidance in Trifolium repens: costs and benefits of plasticity in petiole length and leaf size. New Phytologist, 172: 655-666. DOI:10.1111/nph.2006.172.issue-4 |
Welander N T, Ottosson B. 1998. The influence of shading on growth and morphology in seedlings of Quercus robur L. & Fagus sylvatica L. Forest Ecology and Management, 107: 117-126. DOI:10.1016/S0378-1127(97)00326-5 |
 2008, Vol. 44
2008, Vol. 44


