文章信息
- 戴清良, 徐焰平, 林清强, 王国红, 杨民和.
- Dai Qingliang, Xu Yanping, Lin Qingqiang, Wang Guohong, Yang Minhe.
- 内生炭疽菌在茶树体内的分布及其内生特性
- Distribution and Characteristics of Colletotrichum sp.as an Endophyte in Tea Plants (Camellia sinensis)
- 林业科学, 2008, 44(5): 84-89.
- Scientia Silvae Sinicae, 2008, 44(5): 84-89.
-
文章历史
- 收稿日期:2007-08-01
-
作者相关文章
内生真菌是指在其生活史的某一阶段生活在健康植物体内,但对植物不引起明显病害症状的真菌。近20年来, 内生真菌以丰富的物种多样性、结构和功能多样的次生代谢产物及前所未知的生态学作用, 越来越受到人们的重视,成为近年来菌物学、天然代谢产物和菌物生态学的研究热点(邹文欣等, 2001)。迄今为止,所研究过的植物均含有内生真菌,因此我们所认识的植物实际上可能是植物和真菌的镶嵌体(Herre et al., 2005)。内生真菌有些是垂直传播的,典型的如禾草的内生真菌,以菌丝形态存在于宿主的组织中(细胞间),形成系统侵染,并通过宿主的种子传播到下一代,与宿主形成紧密的共生关系(Stone et al., 2000);但大多数内生真菌,特别是木本植物的内生真菌,大多以不同类型的孢子作为侵染源,对宿主产生局部性感染,在宿主体内往往占据少数几个细胞(胞内或胞间),甚至是一个细胞。这类内生真菌的侵染源来自于植物生长季节大气中的真菌孢子,属于水平传播的内生真菌(Wilson, 2000)。
炭疽菌属(Colletotrichm sp.)的真菌既是植物的重要病原菌, 又是植物体内常见的内生真菌, 有些菌种已作为重要的生防微生物应用于植物病害和杂草的防治(Promputtha et al., 2007)。在茶树(Camellia sinensis)真菌的系统分离和物种多样性研究发现, 炭疽菌属的真菌是组成茶树健康组织中微生物群的主要因子之一(陈晖奇等,2006;谢丽华等,2006)。因此, 我们在对该菌进行系统分离的基础上, 分析内生炭疽菌在茶树不同组织中的分布特征;并首次对无菌茶树苗以人工接种的方式,研究内生炭疽菌在茶树组织中的结构特征和分布,以说明炭疽菌的内生特性。
1 材料与方法 1.1 试验材料 1.1.1 茶树样本茶树样本采自福建农林大学园艺学院教学实习茶园和福建省安溪县官桥镇草坂村茶园。采用5点取样,每点取2棵茶树,共10棵。样本采回实验室后在24 h内分离内生真菌。
1.2.2 供试菌株本实验室分离并保存的内生炭疽菌株CSN-16。
1.2.3 无菌茶树苗于2005年10月,自福建农林大学园艺学院实习茶园购买茶树种子。在前期工作中,我们多次以茶树种子作为内生真菌分离材料,均未分离到真菌,可以认为茶树种子内是无菌的。种子经表面消毒后,播种于花盆中。2006年4—8月,每隔1个月自盆栽的茶苗中分离内生真菌,并与福建农林大学园艺学院实习茶园同一批的种子,以自然方法播种的茶苗相比较。以自然播种茶苗为对照,至2006年8月,盆栽茶苗内生真菌分离率低于1%,而自然播种的茶苗达100%。因此可认为盆栽茶苗为无内生真菌感染苗,该茶苗用于内生真菌的人工接种。
1.2 方法 1.2.1 不同茶树组织中内生炭疽菌的分离取样及样本处理见谢丽华等(2006)的方法。分别采集茶树的芽、叶、枝条、主茎、根、花、花托、种子、种托和种皮, 经表面消毒后, 用无菌解剖刀将叶片和花分别切成约5 mm×5 mm大小的组织块;芽、茎、根分别切成约5 mm长度的组织块; 每个花托和种托切成两半; 将以上茶树组织块分别置培养基上, 25~27 ℃恒温下培养。在7~15 d的培养过程中, 逐日观察自茶树组织块上长出的内生真菌, 及时移菌保存, 统计分离结果。
1.2.2 不同发育期叶片中内生炭疽菌的分离从福建安溪茶园中, 按5点取样, 从每一取样点随机取叶芽、幼叶(未展开)、成熟叶(已展开,叶色嫩绿,角质化不明显)、老叶(叶色暗绿,角质化明显)各5片, 每处理各25个叶片, 从每一叶片中随机切取4个约5 mm×5 mm大小的组织块, 叶芽则视大小不同, 分别切成约5 mm长度的组织块, 经表面消毒后, 放入培养基中恒温培养, 统计分离结果。
1.2.3 内生炭疽菌的培养特性及分生孢子的诱导产生自茶树组织块中生长出的茶树内生炭疽菌培养1周后,一部分能产生桔红色、粘质的分生孢子堆,但数量不多。有些菌株常规培养不易产生孢子。为满足人工接种的需要,采用以下方法诱导分生孢子产生:待菌丝长满培养皿后,用接种环重刮菌落表面,使菌丝倒伏,后在自然散射光照射下,再培养3~5 d,即可见大量的孢子产生。
1.2.4 内生炭疽菌的人工接种人工接种所采用的茶树品种均为铁观音。参照Yoshida等(2006)的方法检测所分离获得的内生炭疽菌对茶树离体叶片的侵染过程和致病性。按1.2.3方法培养所得分生孢子,用无菌水刮洗后,配成孢子悬浮液,孢子浓度为1×106~2×106个·mL-1,以接种成熟叶(已展开3~6 d,叶色嫩绿)观察内生真菌的感染过程。叶片摘下后,用清水冲洗干净,在叶片的背面采用涂抹孢子悬浮液的方法接种内生炭疽菌,培养皿中保湿培养,分别在培养后每隔24 h取样观察。以针刺接种和涂抹接种两种方法对茶树苗进行人工接种,用于人工接种效果和真菌内生性的观察。两种接种方法均以清水接种为对照。保湿培养48 h后,按常规方法对树苗作进一步培养。分别在接种后30 d和120 d,采用1.2.1方法,进行内生真菌的分离, 观察和分析人工接种的效果和真菌的内生特性。
1.2.5 茶树组织中内生真菌的显微观察以上人工接种的离体叶片和树苗,茶树叶片按以下两种方法进行样品的处理。样品处理方法及过程:1)取样后的叶片,剪成5 mm×5 mm的小块,将茶叶组织块在1 mol·L-1的KOH溶液中煮10 min, 煮后的组织块在苯胺蓝溶液中染色10 min,后用清水漂洗,漂洗后的叶片组织用于显微镜检查。2)接种并培养后的茶叶组织块先浸入0.15%的三氯乙酸(溶解于3:1的乙醇:氯仿混合液中(v/v))中处理12~24 h, 经脱色的组织块在0.025%的苯胺蓝溶液中染色2~3 h,经此处理后的组织块用于显微镜的检查。
处理后的叶片组织做成玻片,用Olympus BX51型显微镜进行观察,对真菌特征性结构拍照、保存。
2 结果与分析 2.1 炭疽菌的分离和初步鉴定茶树组织块在PDA培养基上培养3~4 d后,即可见菌丝从组织块的边缘长出,每日将长出的菌丝体移入PDA斜面培养基保存。其中有些菌落颜色为灰褐色的真菌(图版Ⅰ-1),在培养至7~10 d后,先在茶树叶片组织块上产生大量的棕色至红棕色的粘质物,部分也可在菌丝体中产生。而经保存的菌丝体再移殖到新的PDA培养基上,则大多数分离物不易产生分生孢子,需要经过一定的刺激处理才能产生繁殖体。如在菌丝体长满平板后,用接种环刮倒菌丝体,再在散射光照射条件下,培养3~4 d后,则可产生大量的分生孢子(图版Ⅰ-1-A, 箭头所示)。该菌分生孢子椭圆形,单细胞,大小为:(3.2~6.4) μm×(1.8~2.7) μm。在清水中内生炭疽菌在培养6 h后即可发芽,大多数分生孢子的芽管较长,并在培养18 h后可见附着胞的产生(图版Ⅰ-1-B)。在茶树离体叶片上,观察到附着胞发芽后,分化出类似于侵染菌丝的结构(图版Ⅰ-1-C),我们将该菌初步鉴定为炭疽菌属(Colletotrichum)的真菌(周茂繁,1989)。
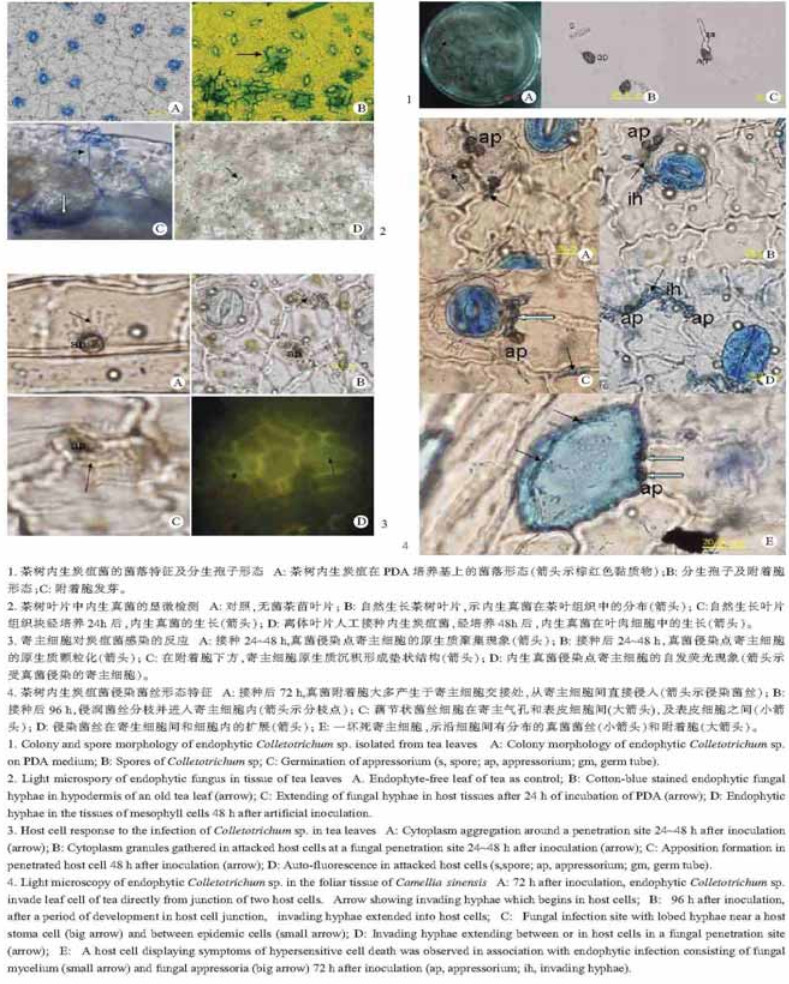
|
图版Ⅰ Plate Ⅰ |
从图 1可以看出,在茶树中内生炭疽菌的分布具有明显的组织专化性。该菌主要分布于茶树的叶片和枝条组织中,在枝条组织中的分离率可达73.47%;在顶芽组织中的分离率很低,只有2.67%;而在茶树根、主茎、花、花托、种子、种托和种皮中没有分离获得该种炭疽菌。

|
图 1 内生炭疽菌在茶树不同组织中的分布 Figure 1 Colonization frequency of endophytic Colletotrichum sp. from different tissues of tea plants |
在不同季节长出的茶树新梢中,一般难于分离到炭疽菌。新梢长出后大概一周,内生炭疽菌的分离率开始上升(图 2)。在茶树叶片的成熟老化过程中,内生炭疽菌的发生具有明显的规律性。一般分为两个阶段。从茶树芽到叶片展开、成熟的过程中,内生炭疽菌的分离率逐渐上升;但之后随着叶片的老化,分离率又逐步下降。在老叶中,内生球座菌(Guignardia spp.)逐渐上升为优势菌。

|
图 2 不同发育期叶片中内生炭疽菌的分布 Figure 2 Colonization frequency of endophytic Colletotrichum sp. in leaves of different ages |
以无菌茶苗为对照, 首先对茶园自然生长条件下茶叶进行了内生真菌的检测。无菌茶树苗叶片组织经KOH溶液处理和苯胺蓝染色后, 没有检测到真菌(图版Ⅰ-2-A);而在自然生长的茶树成熟叶片中, 叶片组织块经KOH溶液处理和苯胺蓝染色后, 在下表皮细胞之间可以检测到大量真菌侵染菌丝的分布(图版Ⅰ-2-B);这些菌丝占据1个或少数几个寄主细胞, 形成许多局部的侵染点。为验证这些局部侵染点的菌丝细胞是否有生活力,茶树叶片组织块经表面消毒, 在PDA培养基上培养24 h后, 再作染色处理。镜检可见内生真菌的菌丝从其中的一个侵染点生长出来, 在茶树叶片细胞之间生长和扩展(图版Ⅰ-2-C, 大箭头示茶叶气孔细胞附近的内生真菌侵染点), 继续培养2~3 d后, 即可形成肉眼可见的菌落。另外, 茶树的叶肉细胞中也可以检测到内生真菌的分布(图版Ⅰ-2-D)。
在人工接种的茶苗叶片上,保湿培养6 h后,炭疽菌的分生孢子开始发芽。分生孢子的芽管长短不一,绝大多数孢子自一端发芽,并在芽管顶端产生一个附着胞;部分孢子可两端发芽,产生两个附着胞;也有的芽管进一步生长成菌丝,产生分枝,并在分枝的顶端产生附着胞。保湿培养24 h后,可在叶片接种部位观察到大量炭疽菌的附着胞,附着胞球形、梨形或不规则形,暗褐色至黑色;绝大多数附着胞着生于2个宿主细胞交界处,很少位于宿主气孔口处。在采自茶园的自然生长的茶树叶片上,偶尔可在显微镜下明显检查到炭疽菌的分生孢子、发芽的孢子及真菌的附着胞。
接种后24 h, 在受到内生炭疽菌侵染的寄主细胞中,可观测到原生质颗粒向真菌侵染点的聚集分布现象(图版Ⅰ-3-A),这种现象占所观察到的真菌侵染点的87%。接种后48 h, 在未成功入侵的附着胞附近,可明显观察到真菌侵染点宿主细胞中原生质的沉积和细胞壁的次生增厚现象,在真菌附着胞下的寄主细胞中形成垫状结构(图版Ⅰ-3-C)。在荧光显微镜下,部分真菌侵染点寄主细胞中可检测到自发荧光现象(图版Ⅰ-3-D),寄主细胞表现自发荧光现象的真菌侵染点占观察细胞总数的67.5%。
接种24~48 h后, 未在寄主细胞中检查到真菌的侵染菌丝。接种72 h后, 可在个别的真菌侵染点观察到侵染菌丝的发生,表明内生炭疽菌已开始侵入到茶树的组织中(图版Ⅰ-4-A)。接种96 h后, 可观察到在茶树叶片组织中,炭疽菌生长于叶片的细胞内或细胞间,并可产生分枝(图版Ⅰ-4-B,小箭头示分枝点),生长于细胞间的菌丝明显多于生长于细胞内的。部分内生真菌的侵染点在寄主气孔细胞边缘,侵染菌丝藕节状,隔膜明显(图版Ⅰ-4-C,大箭头所示),内生菌丝也可存在于表皮细胞之间(图版Ⅰ-4-C,D,小箭头所示)。偶尔可见坏死的寄主细胞,在坏死的寄主细胞之间,明显可以观察到真菌菌丝在其间的分布(图版Ⅰ-4-E)。
2.5 炭疽菌人工接种效果采用离体叶片进行茶树内生炭疽菌的人工接种。接种5 d后, 未在接种的叶片上发现任何可见的褐变, 叶片表面和对照比较是一致的。而内生真菌的分离率为91.36%, 且均为炭疽菌, 表明炭疽菌已成功地侵入叶片中。
用涂抹和针刺2种方法将炭疽菌分生孢子悬浮液接种于无菌茶苗, 分别在接种30 d后和120 d后进行内生真菌的分离,结果见图 3、4。从接种后的每株茶苗中都可分离到炭疽菌, 说明涂抹和针刺2种接种方法用于茶树内生炭疽菌的人工接种都是有效的。接种120 d后, 采用涂抹接种的茶树苗茎部的分离率可达41.17%,而针刺接种的茶树苗叶片中的分离率也可达24.07%。同时也观察到,即使是针刺接种的茶树叶片,针刺造成的伤口在随后慢慢愈合,接种120 d后的茶树苗没有表现明显的病害症状,说明炭疽菌生长于茶树组织中,对茶树没有导致明显的组织病变。
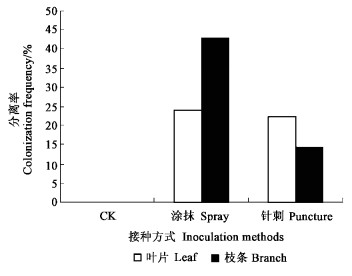
|
图 3 人工接种后30 d内生炭疽菌的再分离 Figure 3 Colonization frequency of endophytic Colletotrichum sp. in tea plants 30 days after inoculation |
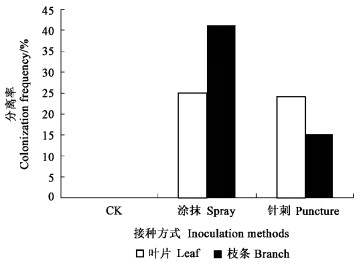
|
图 4 人工接种后120 d内生炭疽菌的再分离 Figure 4 Colonization frequency of endophytic Colletotrichum in tea plants 120 days after inoculation |
本试验中,在茶树的枝条和叶片中能分离到相对较为丰富的内生炭疽菌, 但在主茎、根、花和果实等部位难于分离获得内生炭疽菌;在叶部, 随着叶片组织的成熟, 内生炭疽菌的分布逐渐增多;但在老熟的叶片中, 则又逐渐地下降, 表现为一个动态的消长过程。在可可树(Theobroma cacao)内生真菌的研究中发现,有些内生真菌的分布表现明显的组织专化性,但另外一些内生真菌却不同(Arnold et al., 2003;Herre et al., 2005)。哪些因素影响内生真菌的分布和种群消长,目前还没有明确。有报道表明内生真菌的分布和种群变化受多种生物和非生物因素的影响, 其中, 植物的遗传背景和化学组成可能是决定内生真菌分布的重要因素(Bailey et al., 2005)。同时,内生真菌的分布和种群消长可能也受其他内生微生物群体的影响(陈晖奇等, 2006;Rakotoniriana et al., 2007)。在茶树-内生炭疽菌的相互作用过程中, 影响和决定着内生炭疽菌的分布和消长的因素尚有待研究。
3.2 内生炭疽菌的侵染源经多次分离,自茶树种子和新长出的实生苗没有分离获得内生真菌。在福建农林大学园艺学院实习茶园,2006年4月30日以前对自然播种的茶苗未分离到真菌,而到2006年7月4日分离,获得大量的内生真菌。表明茶苗中的内生炭疽菌不是来自于种子,而是在茶苗生长过程中,环境中的真菌接种体感染而成。这一结果说明茶树的内生炭疽菌是水平传播的,与其他的研究结果是一致的(Herre et al., 2005)。
3.3 炭疽菌的内生特性炭疽菌侵入茶树组织后,侵染菌丝一般占据1个或2个茶树细胞即停止生长。接种后7 d (离体叶片)和120 d (实生苗), 未在接种部位观察到明显的病害症状。同时,人工接种后120 d,可以再分离获得与接种菌一致的炭疽菌。这些均表明本研究所采用的菌株符合内生真菌的基本特点(Stone et al., 2000)。
显微观察的结果表明:在炭疽菌的侵染点, 有高达87%的侵染点寄主细胞, 由于真菌感染的刺激, 而在寄主细胞中诱导产生原生质颗粒聚集分布, 并形成原生质的沉积(apposition)。有67.5%的真菌侵染点寄主细胞表现自发荧光现象,说明在这些细胞中有多酚类物质的积累(Koga, 1994)。这些观察结果表明内生炭疽菌的入侵诱导茶叶细胞的抗性反应。在植物-病原菌非亲和性互作过程中,寄主细胞原生质颗粒化、原生质沉积和细胞多酚类物质的诱导产生是植物抗病性的普遍反应(Hammond-Kosach et al., 1996)。有多位学者认为, 植物与内生真菌之间的互作关系是一种平衡的拮抗关系, 它们之间此消彼长, 处于一个动态的平衡状态中(Schulz et al., 2005;Saikkonen et al., 1998)。寄主植物生长旺盛时,真菌以内生的方式潜伏于植物组织内,待到植物的组织衰老和脱落后,则以腐生的方式,成为衰败植物组织中腐生菌的重要组成因子(Weber et al., 2006)。本研究中所观察到的炭疽菌侵染点茶叶细胞抗性反应是否对炭疽菌的内生性产生影响,将有待于进一步的研究。
炭疽菌与植物之间的互作关系包括腐生、共生和寄生的不同层次。在系统进化的关系上, 有研究者认为, 内生真菌来源于致病性降低或丧失的病原菌。因为病原炭疽菌经诱变处理后, 丧失某一与致病性相关的基因, 病原菌转变为内生菌(Freeman et al., 1993), 并能诱导植物产生多种与抗病性相关的生化反应(Redman et al., 1999)。自2004年9月以来, 笔者在福建不同地区茶园进行系统而长期的分离, 均能不同程度地自茶树叶片和枝条中分离到内生炭疽菌, 表明该种炭疽菌在茶树组织中普遍存在。同时,有多个炭疽菌属的真菌种可以引起茶叶的病害。笔者已获得这些菌株,正在对它们作进一步的研究。通过深入研究内生炭疽菌与病原炭疽菌的关系,对说明炭疽菌的致病性进化和遗传多样性有重要指导意义。
3.4 内生炭疽菌的生态学作用目前对内生真菌生态学功能的了解所知甚少。具体到本文所研究的茶树内生炭疽菌,笔者认为至少有两个方面值得关注。一是内生菌在茶树叶部病原菌防治中的作用。茶树中以叶部的病害影响最大,是造成现今大量使用化学农药和农药残留的重要因素。内生炭疽菌是茶树体内的优势菌,这些真菌在叶片组织中形成密集的局部侵染点(图版Ⅰ-2-B),这种生态“占位效应”可能对病原菌的入侵产生重要的抑制作用(Arnold et al., 2003);同时,在内生真菌的侵染点,诱导抗性也可能发挥一定的作用(图版Ⅰ-3)。这些有待于今后进一步的确证。二是茶树内生真菌对茶叶化学和物质代谢的影响。从进化的意义上,内生真菌和茶树长期共生,协同进化,成为茶树组织中不可分割的一部分,特别是现在以无性繁殖为主的茶树栽培模式中。内生炭疽菌的感染导致茶叶细胞中多酚类物质的积累(图版Ⅰ-3-D),有的茶树内生真菌在摇瓶条件下能产生茶多酚(谢丽华等,2006),表明内生真菌可能对茶叶的生化代谢产生一定的影响。
陈晖奇, 徐焰平, 谢丽华, 等. 2006. 茶树内生真菌的分离及其在寄主组织中的分布特征. 莱阳农学院学报:自然科学版, 23(4): 250-254. |
谢丽华, 徐焰平, 王国红, 等. 2006. 茶树品种、叶片生育期和茶叶化学成份对内生真菌的影响. 菌物研究, 4(3): 35-41. DOI:10.3969/j.issn.1672-3538.2006.03.008 |
周茂繁. 1989. 植物病原真菌属分类图索. 上海: 上海科学技术出版社.
|
邹文欣, 谭仁祥. 2001. 植物内生菌研究新进展. 植物学报, 43(9): 881-892. DOI:10.3321/j.issn:1672-9072.2001.09.001 |
Arnold A E, Mejia L C, Kyllo D, et al. 2003. Fungal endophytes limit pathogen damage in a tropical tree. The Proceedings of the National Academy of Sciences USA, 100(26): 15649-15654. DOI:10.1073/pnas.2533483100 |
Bailey J K, Deckert R, Schweitzer J A, et al. 2005. Host plant genetics affect hidden ecological players: links among Populus, condensed tannins and fungal endophyte infection. Canadian Journal of Botany, 83(4): 356-361. DOI:10.1139/b05-008 |
Freeman S, Rodriguez R J. 1993. Genetic conversion of a fungal plant pathogen to a nonpathogenic, endophytic mutualist. Science, 260: 75-78. DOI:10.1126/science.260.5104.75 |
Hammond-Kosach K, Jones J D G. 1996. Resistance gene-dependant plant defense responses. The Plant Cell, 8: 1773-1791. DOI:10.1105/tpc.8.10.1773 |
Herre E A, Van Bael S A, Maynard Z, et al. 2005. Tropical plants as chimera : some implications of foliar endophytic fungi for the study of host-plant defence, physiology and genetics//Burslem D F R P, Pinard M A, Hartley S E. Biotic Interaction in The Tropics: Their Role in the Maintenance of Species Diversity. Cambridge University Press, 226-237.
|
Koga H. 1994. Hypersensitive death, autofluorescence, and ultrastructural changes in cells of leaf sheaths of susceptible and resistant near-isogenic lines of rice(Pi-zt) in relation to penetration and growth of Pyricularia oryzae. Canadian Journal of Botany, 72: 1463-1477. DOI:10.1139/b94-180 |
Promputtha I, Lumyong S, Dhanasekaran V, et al. 2007. A phylogenetic evaluation of weather endophytes become saprotrophs at host senescence. Microbial Ecology. DOI:10.1007/s00248-006-9117-x |
Redman R S, Freeman S, Clifton D R, et al. 1999. Biochemical analysis of plant protection afforded by a nonpathogenic endophytic mutant of Colletotrichum magna. Plant Physiology, 119(2): 795-804. DOI:10.1104/pp.119.2.795 |
Rakotoniriana E F, Munaut F, Decock C, et al. 2007. Endophytic fungi from leaves of Centella asiatica: occurrence and potential interaction within leaves. Antonie van Leeuwenhoek. DOI:10.1007/s10482-007-9176-0 |
Saikkonen K, Faeth S H, Helander M, et al. 1998. Fungal endophytes: a continuum of interactions with host plants. Annual Review of Ecology and Systematics, 29: 319-343. DOI:10.1146/annurev.ecolsys.29.1.319 |
Schulz B, Boyle C. 2005. The endophytic continuum. Mycological Research, 109(6): 661-686. DOI:10.1017/S095375620500273X |
Stone J K, Bacon C W, White J F. 2000. An overview of endophytic microbes: endophytism defined//Bacon C W, White J F. Microbial Endophytes. New York: Marcel Dekker Inc., 3-29.
|
Weber R W S, Anke H. 2006. Effects of endophytes on colonization by leaf surface microbiota//Bailey M J, Lilley A K, Timms-Wilson, et al. Microbial Ecology of Aerial Plant Surfaces. CABI International, 209-222.
|
Wilson D. 2000. Ecology of woody plant endophytes//Bacon C W, White J F. Microbial Endophytes. New York: Marcel Dekker Inc., 389-420.
|
Yoshida K, Takeda Y. 2006. Evaluation of anthracnose resistance among tea genetic resources by wound-inoculation assay. JARQ, 40(4): 379-386. DOI:10.6090/jarq.40.379 |
 2008, Vol. 44
2008, Vol. 44

