文章信息
- 范国强, 曾辉, 翟晓巧.
- Fan Guoqiang, Zeng Hui, Zhai Xiaoqiao.
- 泡桐丛枝病发生特异相关蛋白质亚细胞定位及质谱鉴定
- Subcellular Localization and Mass Spectrum Identification of the Protein Related to Paulownia Witches' Broom Phytoplasma Infection
- 林业科学, 2008, 44(4): 83-86.
- Scientia Silvae Sinicae, 2008, 44(4): 83-86.
-
文章历史
- 收稿日期:2007-09-13
-
作者相关文章
植物丛枝病是由一类无细胞壁、目前仍不能进行体外培养的植原体引起的传染性病害。世界范围内植原体可导致600余种植物发病,给农业、林业、园艺等造成了巨大的经济损失(何放亭等,1997;田国忠等,1994a; 王蕤等,1981;容向东等, 1989;许晓风,1989;王焯等, 1992;张锐等, 1993;杨俊秀等,2005;Agrios, 1997; Davies et al., 1994; Nishigawa et al., 2002;Sears et al., 1989;Wongkaew et al., 2004)。泡桐(Paulownia)是我国重要的速生用材和庭院绿化树种,种植泡桐对于改善木材短缺、改善生态环境和提高人民生活水平具有重要的生态、经济和社会意义。但由于泡桐丛枝病的危害,我国林业每年的直接经济损失就高达数千万元,并且严重影响了农民种植泡桐的积极性(杨俊秀等,2007)。自泡桐丛枝病病原发现以来,人们曾试图利用剔除病株或砍掉病枝、抗生素治疗和种植抗病新品种等方法消除或减小丛枝病发生造成的损失(杜涛等,2005;范国强等,2007;李秀生,1983;李加友,1997;林木兰等,1993;任国兰等, 1991;田国忠等,1994a; 1994b;王蕤等,1981;王瑶等,2001;张春立等,1994;张锡津等,1994),但都没有达到预期的效果。研究发现,泡桐丛枝病发生与寄主细胞内pI 6.8, m 24 ku蛋白质变化密切相关(范国强等,2003;2006;2007)。为深入探讨该蛋白质的生物学功能,分析与其对应基因的结构及功能,从而阐明泡桐丛枝病发生机制和解决林业生产中的实际问题,本文进行了该蛋白质的亚细胞定位及功能分析研究。
1 材料与方法 1.1 试验材料豫杂一号泡桐(Paulownia tomentosa × P. fortunei)丛枝病苗和健康苗为河南农业大学泡桐研究所林木生物技术实验室用叶片通过器官发生途径获得(翟晓巧等,2004;范国强等,2005),在不含任何植物激素1/2MS培养基上生长30 d的组培苗。
1.2 试验方法 1.2.1 丛枝病发生特异相关蛋白质制备、纯化和回收健康泡桐组培苗叶片蛋白质干粉制备及蛋白质双向电泳采用范国强等(1997;2003)方法。制备特异相关蛋白质时,第一向等电聚焦(IEF)管的长度为120 mm,直径为5 mm, 第二向SDS-PAGE凝胶厚度为2 mm。电泳结束后,收集适量经染色和脱色的SDS-PAGE凝胶上特异相关蛋白质(m 24 ku, pI 6.8)胶块,用无离子水洗净切碎后,电洗脱(100V恒压电泳6 h)回收特异相关蛋白质。最后分别用IEF、SDS-PAGE方法检测回收蛋白质的分子质量(m)和等电点(pI), 确定其纯度。
1.2.2 抗体制备将100~200 μg回收纯化后的特异相关蛋白质(抗原)与弗氏完全佐剂充分乳化,然后在适龄纯种Balb/c小鼠(购于河南省试验动物中心)背部皮下多点注射, 每点0.1~0.2 mL。此后,每隔14 d用等量弗氏不完全佐剂与抗原乳化物重复注射, 3~4次后取血得抗血清(一抗)。二抗为羊抗鼠胶体金制剂,对照组不加一抗,直接在免疫前收集同只小鼠血清中加二抗孵育。
1.2.3 泡桐丛枝病特异相关蛋白质亚细胞定位蛋白质亚细胞定位试验在南京林业大学电镜实验室进行。具体试验步骤:1)分别将组培苗叶片和顶芽切成1 mm3的小块快速投入4%戊二醛中,4 ℃下固定4 h后,分别用0.1 mol·L-1磷酸盐缓冲液(pH 7.2)和蒸馏水洗3次(每次10 min),在4 ℃下,再用2%锇酸固定2 h,然后用0.1 mol·L-1磷酸盐缓冲液(pH 7.2)和蒸馏水各洗3次(每次10 min)。冲洗的样品用低温丙酮进行系列(30%、50%、75%、90%、100%)脱水后,放入丙酮和Epon812树脂等量混合液中浸透2 h,再移入纯包埋剂Epon812树脂中渗透24 h后,在35 ℃条件下,包埋于紫外线通透良好的包埋囊中过夜,之后在温度45 ℃下紫外聚合24 h、60 ℃下聚合36 h,最后用超薄切片机切片。2)先将置于100目铜网上的切片放入温度为37 ℃的0.1 mol·L-1 PBS(含1% BSA,pH 7.2)溶液中1 h后,转移至以PBST(0.1 mol·L-1 PBS +1% BSA +0.05% Tween-20,pH 7.2)稀释的一抗中(1:100),于4 ℃孵育过夜。再用0.1 mol·L-1PBS(1% BSA,pH 7.2)洗3次(每次10min),吸干后,在1:500倍稀释的金标羊抗鼠抗体(胶体金颗粒直径10 nm)中37 ℃下孵育1 h。然后,用PBST(0.1 mol ·L-1PBS +0.05% Tween-20,pH 7.2)冲洗3次(每次10 min)后,再用蒸馏水洗3次(每次10 min),切片干燥后,用醋酸铀染色10 min,柠檬酸铅染色5 min,蒸馏水洗3次(每次5 min),最后将干燥的切片于日立H-600透射电子显微镜下观察照相,以确定该特异蛋白质的位置(对照染色程序同上)。
1.2.4 丛枝病特异相关蛋白质的质谱分析质谱鉴定在中国科学院上海生命科学研究院上海生化与细胞所蛋白质组研究分析中心进行。健康泡桐组培苗叶片蛋白质双向电泳方法见1.2.1。电泳结束后,凝胶经染色和脱色后,用干净的解剖刀将胶块切成约1~2 mm3小块,用ddH20洗3~4次后,加入100~200 μL含50%乙睛和25 mmo1·L-1 NH3HCO3溶液,在涡旋混合器上振荡30 min,重复此操作至胶块蓝色完全褪净。将脱色胶块放入真空干燥器内干燥20 min后,加入3~7 μL胰蛋白酶液(0.0l μg·μL-1,25 mmol·L-1 NH4HCO3),4 ℃放置15 min,再加入5μL的25 mmo1·L-1 NH4HC03溶液,37 ℃温育18~20 h。然后,室温条件5 000 g离心3 min, 上清转移到一心离心管内后,在沉淀中加入50~100 μL 5% TFA溶液于40 ℃温育1 h, 如上条件离心后,上清液转到前面的离心管,在沉淀中再加入50~100 μL的2.5% TFA(含50%乙睛)溶液于30 ℃温育1 h,离心后收集上清。将上述上清液合并,于室温条件下5 000 g离心10 min,弃沉淀,收集上清液。然后用2~7 μL的0.5% TFA溶解真空干燥后上清液内物质。取0.5~1 μL该溶液与等体积饱和基质溶液混合加至不锈钢靶上,用基质辅助激光解吸飞行时间质谱仪(MALDI-TOF-MS)在20 kV、阳离子模式下进行分析。质谱峰的精确度以胰酶自切峰为内标进行校正。通过Mascot查询MSDB数据库对特异蛋白质进行鉴定。
2 结果与分析 2.1 泡桐丛枝病特异相关蛋白质的制备、纯化及鉴定存在健康叶片中的m 24 ku, pI 6.8的蛋白质在发生丛枝病的泡桐叶片中检测不到(范国强等,2005),当丛枝病幼苗经抗生素处理、并且在处理后检测不到植原体的幼苗叶片中又出现此蛋白质(范国强等,2007)。因此,认为此蛋白质为泡桐丛枝病发生特异相关蛋白质。利用蛋白质制备电泳技术,用无菌刀片将含足量泡桐丛枝病特异相关蛋白质点(m 24 ku, pI 6.8)点的凝胶块切下,经电洗脱后浓缩回收。取部分回收的特异蛋白质,经IEF电泳后,回收的特异蛋白质在凝胶条上呈现一条谱带;经SDS-PAGE双向电泳后,SDS-PAGE凝胶上只有一个蛋白质斑点,并且分子质量(m)和等电点(pI)分别为24 ku和6.8(图 1)。因此,可以判断试验回收的蛋白质为泡桐丛枝病发生特异相关的蛋白质,可用于抗体制备和质谱鉴定。

|
图 1 特异相关蛋白电泳 Figure 1 Electrophoresis of the specific protein A单向电泳IEF,B双向电泳2-DSDS-PAGE |
利用胶体金免疫电镜对特异相关蛋白质在豫杂一号泡桐叶片细胞中的位置进行了研究。从图版Ⅰ可以看出,健康组培苗叶片加入丛枝病发生特异相关蛋白抗体后,胶体金颗粒主要分布于叶片细胞的细胞壁(图版Ⅰ-A)、液泡(图版Ⅰ-C)和叶绿体(图版Ⅰ-E),不加特异相关蛋白抗体,直接加入羊抗鼠胶体金制剂的叶片细胞(对照组),相应亚细胞部位未见胶体金颗粒(图版Ⅰ-B、D和F),而在丛枝病幼苗叶片细胞中加入丛枝病发生特异相关蛋白抗体后,未见胶体金颗粒(图版Ⅰ-G、H)。可见,豫杂一号泡桐丛枝病发生特异相关蛋白定位于健康泡桐幼苗叶片细胞的细胞壁、液泡和叶绿体部位,发病幼苗相应组织内检测不到此蛋白。
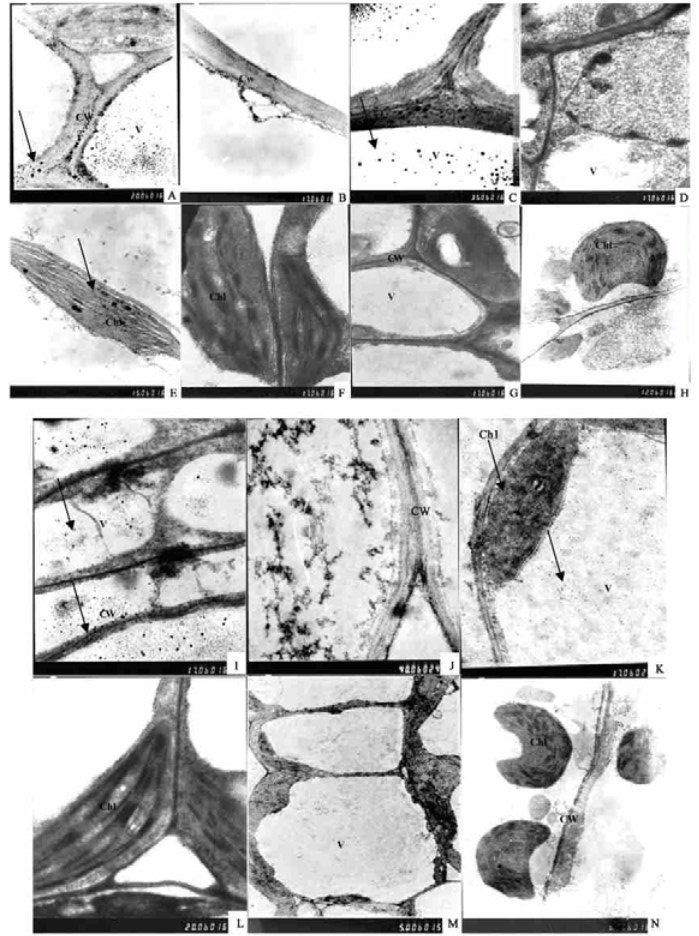
|
图版Ⅰ Plate Ⅰ A~H:豫杂一号泡桐幼苗叶片细胞特异蛋白质免疫胶体金电镜亚细胞定位;I~N:豫杂一号泡桐幼苗茎尖细胞特异蛋白质免疫胶体金电镜亚细胞定位 A~H:Subcellular localization of specific protein in leaf cells by immuno-gold electron microscopy;I ~ N:Subcellular localization of specific protein in stem apexes cells by immuno-gold electron microscopy. A × 8 000,C × 8 000 和 E × 8 000 ,健苗;B × 8 000、D × 8 000 和 F × l0 000,对照;G × 8 000 和H × 8 000,病苗;I × 8 000和K × 6 000, 健康苗;J × 8 000和L × 8 000,健康苗对照:M × 6 000和N × 6 000, 病苗,CW:细胞壁;V:液泡;Chl: 叶绿体. A × 8 000 , C × 8 000 and E × 8 000, healthy seedling ;B × 8 000, D × 8 000 and F × 10 000;CK;G × 8 000 and H × 8 000, disease seedling; I × 8 000 and K × 6 000, healthy seedling;J × 8 000 and L × 8 000, CK with healthy seedling;M × 60 000 and N × 6 000 ,diseased seedling . CW:ccll wall ; V: vacuole ;CW :chloroplast. |
胶体金免疫电镜对特异相关蛋白在豫杂一号泡桐幼苗茎尖细胞定位的结果表明,将丛枝病发生特异相关蛋白抗体加入到健康幼苗茎尖细胞时,胶体金颗粒主要分布在细胞的细胞壁、液泡(图版Ⅰ-I)和叶绿体(图版Ⅰ-K)部位,不加入特异相关蛋白抗体、直接加入羊抗鼠胶体金制剂的细胞内,各亚细胞器内未见胶体金颗粒(图版Ⅰ-J、L),而对丛枝病幼苗茎尖细胞来说,加入丛枝病发生特异相关蛋白抗体后,也未见胶体金颗粒(图版Ⅰ-M、N)。该结果表明,丛枝病发生特异相关蛋白主要分布于健康幼苗茎尖细胞的细胞壁、液泡和叶绿体部位,与叶片定位结果一致。
2.3 泡桐丛枝病发生特异相关蛋白质的质谱鉴定提取豫杂一号健康泡桐苗幼苗叶片蛋白质,通过SDS-PAGE双向电泳分离、考马斯亮蓝染色后,切下m 24 ku, pI 6.8丛枝病特异蛋白点,经脱色、还原、酶解等处理后,进行MALDI-TOF-MS质谱分析,得到相应的肽段酶解MALDI质谱图(图 2)。利用Mascot软件在MSDB数据库搜寻25个肽段,结果发现,该泡桐丛枝病发生特异相关蛋白质与水稻(Q6K822-ORYSA)叶绿体分子伴侣蛋白相匹配,得分为73, 远大于具有明显差异的59 (p<0.05)。因此,初步推断该特异蛋白为水稻叶绿体分子伴侣(Q6K822-ORYSA)的同源蛋白质。
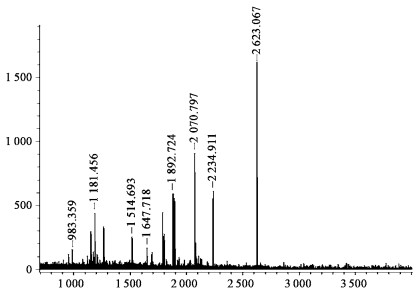
|
图 2 特异相关蛋白质MALDI质谱图 Figure 2 MALDI mass spectrum of the protein related to the witches' broom |
泡桐丛枝病是由植原体引起的一种严重林木传染性病害。过去研究人员对丛枝病发生机制和防治方法进行了大量研究工作,但效果并不理想。其原因一方面与植原体的生物学特性有关,另一方面可能与人们过去研究过于集中于泡桐丛枝病发生下游工作(发病后生物小分子的生理生化变化),而对病害发生的上游工作(植原体引起寄主本身DNA及其相关物质变化)重视不够有关。蛋白质是基因表达的最终直接产物,是生命活动的执行体,蛋白质的变化直接反映生物基因表达水平的变化。研究发现,泡桐植原体的侵入减弱或者关闭了寄主m 24 ku, pI 6.8蛋白质对应基因的表达,以至于目前技术水平无法检测出基因表达产物的存在;当丛枝病幼苗内的植原体被清除、幼苗形态呈现健康状态时,该基因表达水平增强或又重新被激活,该蛋白质又重新出现(范国强等,2003;2006;2007)。这表明开展该蛋白质的研究工作对阐明泡桐丛枝病发生机制具有重要作用。本研究用胶体金电镜技术首次证明该蛋白质主要存在于健康幼苗叶片和顶芽细胞的细胞壁、液泡和叶绿体部位,并且具有叶绿体分子伴侣的功能。根据蛋白质分子伴侣的特性(张伟等,2006),可以推断该蛋白质参与了健康幼苗细胞中其他重要蛋白质的折叠或合成。丛枝病泡桐幼苗细胞因缺失该蛋白质,导致细胞内其他蛋白质不能正确折叠或合成,导致细胞内代谢活动的紊乱,最后出现丛枝症状。至于该蛋白质的亚细胞合成部位或运输情况还有待于深入研究。
杜涛, 郭剑华, 张海州, 等. 2005. 转基因泡桐shiva-1基因遗传与表达分析. 西北植物学报, 25(12): 2386-2390. DOI:10.3321/j.issn:1000-4025.2005.12.004 |
范国强, 冯志敏, 翟晓巧, 等. 2006. 植物生长调节物质对泡桐丛枝病株幼苗形态和叶片蛋白质含量变化的影响. 河南农业大学学报, 40(2): 137-141. DOI:10.3969/j.issn.1000-2340.2006.02.007 |
范国强, 蒋建平. 1997. 泡桐叶片蛋白质提取方法研究. 植物学通报, 14(3): 61-64. |
范国强, 李有, 郑建伟, 等. 2003. 泡桐丛枝病发生相关蛋白质的电泳分析. 林业科学, 39(2): 119-122. DOI:10.3321/j.issn:1001-7488.2003.02.020 |
范国强, 翟晓巧, 秦河锦, 等. 2005. 泡桐丛枝病株体外植株再生系统研究. 河南农业大学学报, 39(3): 254-258. DOI:10.3969/j.issn.1000-2340.2005.03.004 |
范国强, 张胜, 翟晓巧, 等. 2007. 抗生素对丛枝病泡桐植原体和特异相关蛋白质的影响. 林业科学, 43(3): 138-142. |
何放亭, 武红巾, 陈子文, 等. 1997. C/A值与甘薯丛枝病症状发生的关系. 植物病理学报, 27(1): 43-46. DOI:10.3321/j.issn:0412-0914.1997.01.012 |
李加友. 1997. 抗生素对组培条件下植物枝原体作用的初探. 南京农专学报, 13(4): 25-31. |
李秀生. 1983. 泡桐丛枝病防治技术的研究. 河南农学院学报, 17(2): 49-58. |
林木兰, 陈维纶. 1993. 泡桐丛枝病类菌原体单克隆抗体的研制及初步应用. 植物学报, 35(9): 710-715. |
任国兰, 李秀生, 郑兰长, 等. 1991. 新农药"去丛灵"的应用效果研究. 河南农业大学学报, 2: 51-55. |
容向东, 张景宁. 1989. 木麻黄黄化丛枝病的研究. 植物病理学报, 19(4): 217-221. |
许晓风. 1989. 土霉素对桑树黄化萎缩病治疗机理的探讨. 植物保护学报, 16(2): 87-92. DOI:10.3321/j.issn:0577-7518.1989.02.005 |
王蕤, 孙秀琴, 王守宗, 等. 1981. 激素对泡桐丛枝病发生的影响. 林业科学, 17(3): 281-286. |
王焯, 周佩珍, 郭裕新, 等. 1992. 四环素消毒枣疯病接穗研究. 植物保护学报, 19(1): 62. |
王瑶, 柳晟, 杜涛, 等. 2001. 根癌农杆菌对健康和患丛枝病泡桐的遗传转化. 西北植物学报, 21(3): 406-412. DOI:10.3321/j.issn:1000-4025.2001.03.003 |
田国忠, 黄钦才, 袁巧平, 等. 1994a. 感染MLO泡桐组培苗代谢变化与致病机理的关系. 中国科学B辑, 24: 484-490. |
田国忠, 张锡津, 熊耀国, 等. 1994b. 泡桐筛管内胼胝质与抗丛枝病关系的研究. 植物病理学报, 24(4): 352. |
张春立, 林木兰. 1994. 泡桐丛枝病植原体DNA的分子克隆与序列分析. 植物学报, 36(4): 278-282. DOI:10.3321/j.issn:1000-4025.1994.04.008 |
张锐, 王敏, 金开璇, 等. 1993. 土霉素对山楂丛枝病的治疗试验. 北京农业科学, 6(11): 29-31. |
张锡津, 田国忠, 黄钦才. 1994. 温度处理和茎尖培养结合脱除泡桐丛枝病类菌原体(MLO). 林业科学, 30(1): 34-38. DOI:10.3321/j.issn:1001-7488.1994.01.005 |
杨俊秀, 张刚龙, 樊军锋, 等. 2005. 泡桐属不同种和种源对丛枝病抗性调查. 西北林学院学报, 20(4): 115-116. DOI:10.3969/j.issn.1001-7461.2005.04.028 |
杨俊秀, 张刚龙, 樊军锋, 等. 2007. 泡桐丛枝病与泡桐生长量的关系. 西北林学院学报, 22(2): 109-110. DOI:10.3969/j.issn.1001-7461.2007.02.027 |
翟晓巧, 王政权, 范国强. 2006. 泡桐体外器官直接发生的植株再生. 核农学报, 18(5): 357-360. |
Agrios G N. 1997. Plant diseases caused by mollicutes: phytoplasmas and spiroplasmas//Agrios G N. Plant Pathology(4th Edition). New York: Academic Press.
|
Davies D L, Clark M F. 1994. Maintenance of mycoplasma-like organisms occurring in Pyrus species by micropropagation and their elimination by tetracycline therapy. Plant pathology, 43: 819-823. DOI:10.1111/ppa.1994.43.issue-5 |
Nishigawa H, Oshima K, Kakizawa S, et al. 2002. A plasmid from a non-insect-transmissible line of a phytoplama lacks two open reading frames that exist in the plasmid from the wild-type line. Gene, 298: 195-201. DOI:10.1016/S0378-1119(02)00975-7 |
Sears B B, Klomparens K L. 1989. Leaf tip cultures of the evening primrose allow stable, aseptic culture of mycoplasmas-like organism. Canada Journal of Plant Pathology, 11: 343-348. DOI:10.1080/07060668909501077 |
Wongkaew P, Fletcher J. 2004. Sugarcane white leaf phytoplasma in tissue culture: long-term maintenance, transmission, and oxytetracycline remission. Plant Cell Reports, 23: 426-434. DOI:10.1007/s00299-004-0847-2 |
 2008, Vol. 44
2008, Vol. 44
