文章信息
- 杜小刚, 唐明, 陈辉, 张海涵, 张永安.
- Du Xiaogang, Tang Ming, Chen Hui, Zhang Haihan, Zhang Yong'an.
- 黄土高原不同树龄刺槐丛枝菌根与根际微生物的群落多样性
- Mycorrhizae and Diversity of Microbial Community in Rhizosphere Soils of Robinia pseudoacacia at Different Ages on the Loess Plateau
- 林业科学, 2008, 44(4): 78-82.
- Scientia Silvae Sinicae, 2008, 44(4): 78-82.
-
文章历史
- 收稿日期:2007-10-31
-
作者相关文章
2. 西北农林科技大学生命科学学院 杨凌 712100;
3. 中国林业科学研究院森林生态环境与保护研究所 北京 100091
2. College of Life Sciences, Northwest Sci-Tech University of Agriculture and Forestry Yangling 712100;
3. Research Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091
土壤微生物是生态系统的重要组成部分,在有机质分解、养分循环和植物养分利用过程中发挥着关键作用(Steenwerth et al., 2002),并通过微生物之间的相互竞争和相互协调,驱动养分循环影响着植物多样性(Clay et al., 1999)。丛枝菌根(arbuscular mycorrhizae, AM)作为植物根系与土壤密切联系的桥梁,能够促进宿主植物生长和土壤物质转化,选择合适的树种和菌根真菌,是衰退土壤生态系统恢复的有效途径(Miller et al., 1990)。以微孔板碳源利用为基础的BIOLOG定量分析,能够反映微生物群落水平的生理代谢轮廓,简单快捷地描述微生物群落功能多样性,目前已被广泛应用(Zheng et al., 2005; 李忠佩等, 2007)。
黄土高原植被恢复一直是生态研究的热点,但是目前该领域多注重植被恢复后土壤理化性质的研究,对土壤微生物研究较少(薛萐等, 2007)。生态系统的恢复在考虑植物多样性的同时更应该考虑土壤微生物的多样性(Zheng et al., 2005)。本文采用BIOLOG检测法,从丛枝菌根角度出发研究其与黄土高原不同树龄刺槐人工林及次生林根际微生物群落多样性的关系,旨在为黄土高原退化生态系统的恢复和西部地区退耕还林工程的实施提供科学依据。
1 材料与方法 1.1 研究地概况研究地点为中国科学院安塞水土保持实验站纸坊沟流域,位于109°13′46″—109°16′3″ E,36°46′42″—36°46′28″ N,属于黄土丘陵沟壑第2副区,流域面积8.27 km2,土壤类型为黄绵土,海拔1 010~1 400 m,属暖温带半干旱季风气候,年均气温8.8 ℃,年均降雨量505.3 mm(薛萐等, 2007)。流域内植被稀疏,主要为刺槐(Robinia pseudoacacia)、小叶杨(Populus simonii)、柠条(Caragana korshinkii)、沙棘(Hippophae rhamnoides)、铁杆蒿(Artemisia sacrorum)和白羊草(Bothriochloa ischaemum)等,其中刺槐为主要造林树种。该区域自20世纪50年代以来在不同坡地上营造生态恢复林,已建立起不同恢复年限的刺槐人工林。
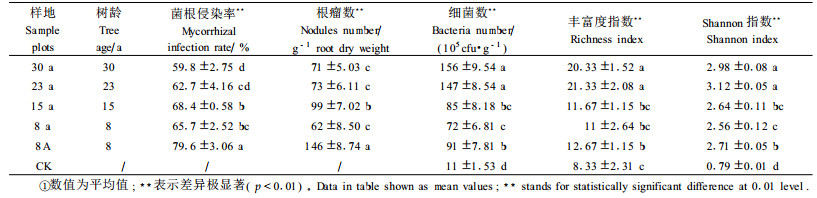
1.2 样品采集采用时空互代法(薛萐等, 2007)在流域内选择营造和管理方法一致、土壤与成土母质类型相同、地形要素(坡度, 坡向, 海拔)相似的30、23、15、8年刺槐人工林及8年刺槐次生林地为取样地,在每个样地内随机选择5株刺槐采集细根及根际土样,每株刺槐在东西南北分别取4份土样,将20份土样混合后作为该林地测定土样,每个样地重复3次。取样时除去土壤表面动植物残体,在0~20 cm深的土壤中采集刺槐根系,轻轻抖落附在根上的土壤,剪取带有细根的根系,洗净后装入盛有FAA固定液的小瓶,将剩下的根系和土壤在无菌自封袋中轻轻抖动大约1 min,作为根际土(Clegg et al., 1997),置于小冰箱内,4 ℃保存。同时选取裸地采集同样深度的土壤作为对照(CK)。采样于2006年11月进行。不同采样地状况如表 1所示。
|
|
用PHS-3B型精密pH计测定土壤pH值(水土比为5:1, v/m)(严昶升, 1988)。称取10.0 g新鲜土壤放入铝盒中,105 ℃干燥至恒重后称重,计算土壤含水量。
1.3.2 菌根侵染状况测定将根系剪成0.5~1.0 cm长的根段,采用透明压片法用10%KOH透明后,进行Trypan blue染色(弓明钦等, 1997),显微镜下观察菌根结构特征并计算菌根侵染率。
1.3.3 土壤细菌计数采用牛肉膏-蛋白胨培养基,稀释平板涂布法进行土壤细菌培养,重复3次,以菌落形成单位(colony forming units, CFU)对细菌计数。统计刺槐根系根瘤数,换算为每克根干质量所带根瘤数。
1.3.4 微生物群落水平生理轮廓(community level physiological profiles, CLPPs)测定1) BIOLOG ECO Microplate反应原理 BIOLOG ECO Microplate是一种多底物酶联反应(enzyme-linked immunosorbent assay, ELISA)平板,该生态板在同一块板上有96孔,分为3组(3次重复),每组32孔,除对照孔仅有指示剂和水外,其余31孔都装有不同的单一碳源和四唑染料,碳源分为糖类、羧酸类、氨基酸类、多胺类、多聚物和芳香化合物6大类。土壤微生物在BIOLOG ECO Microplate代谢过程中,氧化还原作用能够使四唑染料变成紫色,根据每孔颜色变化程度检测土壤微生物对31种不同单一碳源的代谢能力(Choi et al., 1999)。2)BIOLOG ECO Microplate接种液制备准确称取相当于10.0 g干质量(按含水量换算,见表 1)的新鲜土样,加入到装有90 mL 0.85% NaCl无菌溶液三角瓶中,封口后在摇床上震荡(200 r·min-1)30 min,按照10倍稀释法用0.85% NaCl无菌溶液将其稀释至原来的1/1 000。3)多底物酶联反应(ELISA)在超净工作台上,接种悬浮液于ECO板中,每孔150 μL,置于25 ℃暗箱培养;连续培养240 h,期间每隔12 h用ELISA反应微平板读数器在590 nm处读数,记录微生物群落水平生理代谢轮廓(CLPPs)。
1.4 数据分析采用孔平均颜色变化率(average well color development, AWCD)、丰富度指数(S)和多样性指数进行数据分析(Zheng et al., 2005)。其中:AWCD =∑(Ci-R)/31,式中Ci为各反应孔在590 nm下的光密度值,R是对照孔的光密度值(下同);丰富度指数(S)用碳源代谢孔数目表示;多样性指数用Shannon指数(H)表示,H=-∑(Pi×lnPi),式中Pi=(Ci-R)/∑(Ci-R),表示有碳源孔与对照孔光密度值之差与整板总差的比值。数据采用Excel(Ⅴ2003)、SAS(Ⅴ8.1)和SPSS(Ⅴ12.0)软件进行统计分析。
2 结果与分析 2.1 BIOLOG分析 2.1.1 ELISA反应碳源平均颜色变化率(AWCD)平均颜色变化率(AWCD)是反映土壤微生物活性即利用单一碳源能力的一个重要指标(徐秋芳等, 2007)。由图 1可见,CK对单一碳源利用能力始终最低;不同树龄间刺槐根际微生物群落对单一碳源的利用能力存在差异,前24 h AWCD值均较低,碳源基本未被利用,48 h后AWCD值出现差异,30年人工林AWCD值增长斜率最大,为0.05;8年人工林最小,为0.02。随着树龄增加,刺槐人工林根际土壤微生物活性(AWCD值)增大,碳源利用能力增强,以树龄最长的30年人工林最好;相同树龄(8年)的次生林和人工林相比,次生林AWCD值增长斜率(0.04)大于人工林(0.02),且180 h后8年次生林AWCD值高于树龄更长的15年人工林,说明刺槐次生林较同龄人工林根际微生物活性强。

|
图 1 不同土壤平均颜色变化率 Figure 1 Average well color development of different soils |
丰富度指数(S)和Shannon指数(H)反映土壤微生物群落的功能多样性。8、15、23、30年刺槐人工林指数S和H (培养144 h)随着树龄的增长而递增,23年达到高峰,后趋于稳定,并逐渐降低;8年次生林指数H优于8年人工林,并与15年人工林处于同一水平(p<0.01),说明刺槐次生林微生物功能多样性较同龄人工林好;5块林地微生物功能多样性均好于裸地(表 2)。
|
|
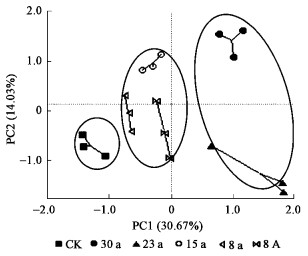
对培养144 h数据进行主成分分析(图 2),可以看出刺槐根际土壤微生物群落代谢特征与树龄的相关性主要体现在PC1轴上,方差分析表明不同树龄刺槐林地和裸地按照土壤微生物群落功能分差可以区分为3个水平(图 2) (p<0.01),表现为15、8年人工林和8年次生林为一类,30、23年人工林为一类,裸地独为一类,前2个类群在PC1上顺次排列反映出刺槐人工林根际微生物群落结构与功能随着树龄的增加存在时间上的连续性;PC2主要体现了刺槐个体之间的分异,由于PC1在区分微生物群落代谢特征的方差贡献率(30.67%)大于PC2(14.03%) (图 2),因此认为在区分刺槐根际微生物群落特征时,树龄作用的权重较大,即与个体差异相比刺槐根际微生物群落代谢特征主要与树龄有关。次生林和同龄人工林相比,8年次生林在PC1轴上靠近23、30年刺槐人工林一侧,在碳源利用上表现为与树龄更长的人工林相近,优于同龄人工林,与AWCD值、丰富度指数(S)及Shannon指数(H)测定结果一致。
|
图 2 微生物群落功能主成分分析 Figure 2 Principal component analysis of microbial community function |
对刺槐丛枝菌根形态观察发现,各林分刺槐根部均能形成典型的泡囊丛枝结构,但不同树龄菌根侵染率不同,表现为人工林随着树龄的增加侵染率先增加后降低,以15年人工林最高,30年人工林最低;8年次生林侵染率最高,为79.6%(表 2)。菌根侵染率与微生物功能多样性指数的相关性分析表明,8年次生林、8和15年人工林菌根侵染率与丰富度指数(S)、Shannon指数(H)呈正相关(r=0.974, 0.929),23、30年人工林三者变化相同,都呈降低趋势,说明丛枝菌根对刺槐林微生物群落功能影响均较大。8年次生林侵染率最高,其主成分分析与AWCD值、丰富度指数(S)及Shannon指数(H)均表明次生林较相同树龄人工林根际微生物活性强,功能多样性增加。
2.2.2 丛枝菌根对根瘤菌和细菌群落的影响不同树龄刺槐根际微生物群落见表 2。所采集的刺槐植株根部结瘤率均达到100%,但根瘤数随着菌根侵染率的变化呈现差异。菌根侵染率与根瘤数呈显著正相关(y=414.82x-188.73, r=0.927, p<0.05),说明刺槐林AM真菌与根瘤菌存在协同作用。这是因为根瘤的形成与氮素的固定需要较高的磷素水平,丛枝菌根促进了刺槐对磷元素的吸收与利用,改善了根瘤菌磷素营养,同时根瘤菌固氮也促进了AM真菌的侵染。此外,AM真菌与根瘤菌在豆科植物根部的定殖过程存在相同的信号传导途径,对两者的互作也产生重要影响(赵丹丹等, 2006)。
刺槐根际细菌量随着树龄的增加而增加(表 2),以30年人工林最大,8年人工林最小,8年次生林根际细菌量高于15年人工林;树龄较短的8年次生林、8、15年人工林,菌根侵染率和细菌量的变化趋势均为8年(次生林)>15年>8年,两者呈正相关(r=0.853),说明丛枝菌根对树龄较短的刺槐根际细菌群落影响较大,能够促进细菌的生长;而树龄较长的的23、30年人工林,菌根侵染率降低,细菌数量增加。
3 结论与讨论目前关于林地微生物群落变化研究多集中在林木发育阶段(焦如珍等, 2005)根系生物量及分泌物不同(Rutigliano et al., 2004)造成微生物群落演替,或土壤质地(杨承栋等, 1999)与微生物群落变化的关系上。本文利用BIOLOG检测法,研究丛枝菌根与黄土高原不同树龄刺槐人工林及次生林根际微生物群落多样性的关系。BIOLOG代谢多样性的差异反映了微生物群落组成的变化(群落演替) (Haack et al., 1995)。8~30年刺槐人工林随着树龄的增加菌根侵染率先增加后降低,微生物活性增大,代谢多样性指数在23年达到峰值后趋于稳定,并逐渐降低,菌根侵染率与根瘤数呈显著正相关(p<0.05);菌根侵染率与根瘤数、细菌量、丰富度指数(S)、Shannon指数(H)的相关性分析表明:从造林年限上,丛枝菌根对较短树龄(8年次生林、8和15年人工林)刺槐根际微生物群落影响较大,从造林措施上对刺槐次生林微生物群落影响较大。
本研究发现AM真菌能够通过与根瘤菌和细菌的相互作用,使土壤微生物群落结构及功能发生改变。相关研究表明丛枝菌根庞大的生物量作为土壤重要的有机质库(Soderstrom, 1992),能够为土壤微生物提供丰富的营养来源;菌丝远离根际在林地内延伸,菌丝桥在不同植物间传递营养物质(Graves et al., 1997),使得菌根对刺槐林微生物群落的影响可能不仅局限于植物根际,而是对整个林地的土壤系统及微生物群落产生作用。薛萐等(2007)的研究认为自身衰老的刺槐林地由于对土壤的长期改良作用,导致代谢途径多样化,有利于后续物种的生长,这可能也是次生林微生物群落多样性增强的原因。
土壤微生物由于其组成与功能上的多样性,已被用作评价退化生态系统中生物类群与功能恢复相关关系的指标(Harris, 2003),而菌根真菌在植物群落发生、演替及维持物种多样性、稳定性(Marcel et al., 1998)、逆境造林(唐明等, 1999)等方面起着重要作用,本研究也表明丛枝菌根对刺槐根际土壤微生物存在重要影响,因此后续工作应从传统的植被及水分养分循环研究转移至侧重土壤微生物多样性研究上,揭示陆地生态系统“植物-土壤-微生物”三者之间的关系。建议在造林时采用合适的树种和合适的菌根真菌组合,如刺槐与Glomus mosseae(何兴元等, 2002),以提高林木成活率及生长率;植被恢复以次生林营造和抚育为主,加大微生物活性和功能多样性研究,充分发挥丛枝菌根真菌在黄土高原生态退化区植被恢复中的作用。
弓明钦, 陈应龙, 仲崇禄. 1997. 菌根研究及应用. 北京: 中国林业出版社, 133-149.
|
何兴元, 吴清凤, 周玉芝, 等. 2002. 刺槐共生菌盆栽接种试验. 林业科学, 38(4): 78-84. DOI:10.3321/j.issn:1001-7488.2002.04.013 |
焦如珍, 杨承栋, 孙启武, 等. 2005. 杉木人工林不同发育阶段土壤微生物数量及其生物量的变化. 林业科学, 41(6): 163-165. DOI:10.3321/j.issn:1001-7488.2005.06.028 |
李忠佩, 吴晓晨, 陈碧云. 2007. 不同利用方式下土壤有机碳转化及微生物群落功能多样性变化. 中国农业科学, 40(8): 1712-1721. DOI:10.3321/j.issn:0578-1752.2007.08.017 |
唐明, 陈辉, 商鸿生. 1999. 丛枝菌根真菌(AMF)对沙棘抗旱性的影响. 林业科学, 35(3): 48-52. DOI:10.3321/j.issn:1001-7488.1999.03.009 |
徐秋芳, 姜培坤, 邬奇峰, 等. 2007. 集约经营板栗林土壤微生物量碳与微生物多样性研究. 林业科学, 43(3): 15-19. |
薛萐, 刘国彬, 戴全厚. 2007. 侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征. 生态学报, 27(3): 909-917. DOI:10.3321/j.issn:1000-0933.2007.03.010 |
严昶升. 1988. 土壤肥力研究方法. 北京: 农业出版社, 358-363.
|
杨承栋, 焦如珍. 1999. 杉木人工林根际土壤性质变化的研究. 林业科学, 35(6): 2-9. DOI:10.3321/j.issn:1001-7488.1999.06.001 |
赵丹丹, 李涛, 赵之伟. 2006. 丛枝菌根真菌-豆科植物-根瘤菌共生体系的研究进展. 生态学杂志, 25(3): 327-333. DOI:10.3321/j.issn:1000-4890.2006.03.020 |
Choi K H, Dobbs F C. 1999. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods, 36(3): 203-213. DOI:10.1016/S0167-7012(99)00034-2 |
Clay K, Holah J. 1999. Fungal endophyte symbiosis and plant diversity in successional fields. Science(Washington), 285(5434): 1742-1744. DOI:10.1126/science.285.5434.1742 |
Clegg S, Gobran G R. 1997. Rhizospheric P and K in forest soil manipulated with ammonium sulfate and water. Canadian Journal of Soil Science, 77(4): 525-533. DOI:10.4141/S95-069 |
Graves J D, Watkins N K, Fitter A H, et al. 1997. Intraspecific transfer of carbon between plants linked by a common mycorrhizal network. Plant and Soil, 192(2): 153-159. DOI:10.1023/A:1004257812555 |
Haack S K, Garchow H, Klug M J, et al. 1995. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns. Applied and Environmental Microbiology, 61(4): 1458-1468. |
Harris J A. 2003. Measurements of the soil microbial community for estimating the success of restoration. European Journal of Soil Science, 54: 801-808. DOI:10.1046/j.1351-0754.2003.0559.x |
Marcel G A, Heijden V D, Klironomos J N, et al. 1998. Mycorrhizal fungal diversity determines plants biodiversity, ecosystem variability and productivity. Nature, 396(5): 69-72. |
Miller R M, Jastrow J D. 1990. Hierarchy of root and mycorrhizal fungal interactions with soil aggregation. Soil Biology and Biochemistry, 22(5): 579-584. DOI:10.1016/0038-0717(90)90001-G |
Rutigliano F A, Ascoli R D, Virzo De Santo A. 2004. Soil microbial metabolism and nutrient status in a Mediterranean area as affected by plant cover. Soil Biology and Biochemistry, 36(11): 1719-1729. DOI:10.1016/j.soilbio.2004.04.029 |
Soderstrom B. 1992. The ecological potential of the ectomycorhizal mycelium//Read D J, Lewis D H, Fitt A H, eds. Mycorrhizas in ecosystems. Cambridge: Cambridge University Press, 77-83.
|
Steenwerth K L, Jackson L E, Calderon F J, et al. 2002. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California. Soil Biology and Biochemistry, 34(11): 1599-1611. DOI:10.1016/S0038-0717(02)00144-X |
Zheng H, Ouyang Z Y, Wang X K, et al. 2005. Effects of regenera ting forest cover on soil microbial communities: A case study in hilly red soil region, Southern China. Forest Ecology and Management, 217(2-3): 244-254. DOI:10.1016/j.foreco.2005.06.005 |
 2008, Vol. 44
2008, Vol. 44