文章信息
- 曹言勇, 施艳, 范在丰, 宋丽敏, 田国忠.
- Cao Yanyong, Shi Yan, Fan Zaifeng, Song Limin, Tian Guozhong.
- 长春花花叶病病原物的分离和鉴定
- Isolation and Identification of the Pathogen That Causes Mosaic on Periwinkle
- 林业科学, 2008, 44(4): 60-68.
- Scientia Silvae Sinicae, 2008, 44(4): 60-68.
-
文章历史
- 收稿日期:2007-02-09
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 国家林业局森林保护学重点实验室 北京 100091
2. Research Institute of Forest Ecology, Environment and Protection, CAF Key Lab. of Forest Protection, State Forestry Administration Beijing 100091
长春花(Catharanthus roseus)又名五瓣梅,为夹竹桃科长春花属植物,是常见的盆栽观赏植物。长春花株型整齐、叶片对生、翠绿具光泽,花瓣5,有玫瑰红、黄或白色。花期长,最佳观赏时间可达4~6周。长春花植株体内含多种生物碱,特别是长春花碱和长春花新碱,经临床验证具有明显的抗癌功效,无副作用(蔡连捷等,2005;云青柳, 2005)。在我国的广东、云南、海南和广西等省区有大量栽培。
引起长春花的病害主要有长春花疫病(朱纯等,2002)、长春花黄化病(蔡红等,2003)以及花叶病(Duarte et al., 2001)等。孔宝华等(2000)通过电镜观察、酶联免疫吸附测定(enzyme linked immunology adsorb assay,ELISA)和生物侵染试验从“99云南世博会”期间海南带到云南的长春花上检测出黄瓜花叶病毒(cucumber mosaic virus, CMV),但迄今未见对我国南方长春花主栽区病毒病的系统调查与分子鉴定的研究报道。作者自2004年开始对广东和海南等地长春花病毒病进行了调查,并从海南省琼海市博鳌镇的长春花栽培基地和广东省广州市星海公园采集了发病的长春花植株,通过生物学、血清学和分子生物学的方法进行了病原系统鉴定。
1 材料与方法 1.1 试验材料发病的长春花植株采自海南省琼海市博鳌镇长春花栽培基地和广东省广州市星海公园,种植在实验室防虫温室中。供试接种植物包括茄科、藜科、豆科、葫芦科、番杏科以及禾本科共计6科15种植物,种植在实验室防虫温室。本研究使用的抗血清有23种,其中芜菁花叶病毒(turnip mosaic virus,TuMV)、西瓜花叶病毒(watermelon mosaic virus,WMV)、马铃薯Y病毒(potato Y virus,PVY)、甘蔗花叶病毒(surgarcane mosaic virus,SCMV)、小西葫芦黄花叶病毒(zucchini yellow mosaic virus,ZYMV)、烟草花叶病毒(tobacco mosaic virus,TMV)、白草花叶病毒(pennisetum mosaic virus,PenMV)、玉米线条病毒(zea mosaic virus,ZeMV)、莴苣花叶病毒(lettuce mosaic virus,LMV)、紫藤脉花叶病毒(wisteria mosaic virus,WVMV)抗血清由实验室保存,辣椒轻斑驳病毒(pepper mottle virus,PepMoV)、大豆花叶病毒(soybean mosaic virus,SMV)、南方菜豆花叶病毒(southern bean mosaic virus,SBMV)、南瓜花叶病毒(squash mosaic virus,SqMV)、马铃薯黄矮病毒(potato yellow dwarf mosaic virus,PYDV)、黄瓜花叶病毒、南芥菜花叶病毒(arabis mosaic virus,ArMV)、花生矮化病毒(peanut stunt virus,PSV)、马铃薯X病毒(potato X virus,PVX)、李属坏死环斑病毒(prunus necrotic ringspot virus,PNRSV)、番茄斑萎病毒(tomato spotted wilt virus,TSWV)、葡萄扇叶病毒(grapevine fanleaf virus,GFLV)抗血清购自Agdia公司,齿兰环斑病毒(odontoglossum ringspot virus,ORSV)抗血清由新加坡国立大学王锡民博士惠赠,酶标A蛋白购自Sigma公司,CMV和TMV免疫胶体金层析试纸条购自Agdia公司。纤维素粉购自Watman公司,TRIzol试剂购自Invitrogen公司,M-MLV反转录酶为Promega公司产品,EX-Taq、pMD18-T及RNA酶抑制剂购自TaKaRa公司,10 mmol·5-1 dNTPs购自Tiangen公司。常规生化试剂为北京化学试剂公司产品。引物由赛百盛公司合成。测序由三博远志公司完成。
1.2 染病长春花的组织培养与低温保存剪取长春花幼梢,用75%的乙醇和0.1%升汞溶液表面消毒。移入长春花生长培养基上,配方为在MS培养基附加6-苄氨基腺嘌呤5 mg·L-1和萘乙酸0.2 mg·L-1。培养温度25 ℃,光照强度1 000~1 500 lx, 光照时间为14 h·d-1。获得无杂菌的组织培养苗以具节茎段进行定期继代培养繁殖保存。低温保藏时,将组培苗切段,接种在装有培养基试管的斜面上,约一半茎段埋入培养基中。将试管在正常条件下培养一段时间后(约7 d),然后放入6~10 ℃冰箱内保藏(1~2月取出1~2次于光照条件下培养1~2 d后重新放回冰箱内保存)(田国忠等,2005;2006)。
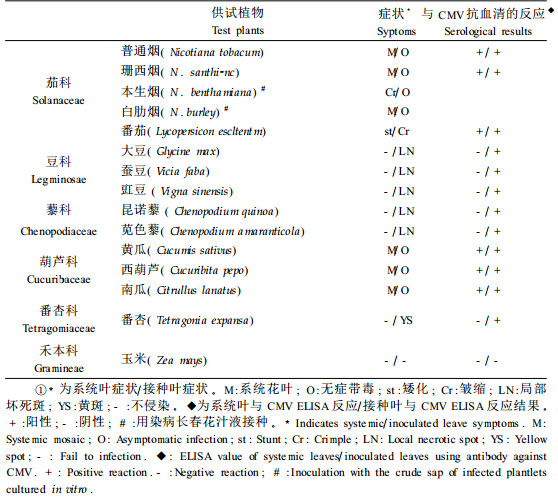
1.3 寄主范围测定取症状明显的长春花叶片于0.01 mol·L-1磷酸接种缓冲液中研磨,然后用金刚砂摩擦接种供试植物,所有接种植物都在接种适合期接种。每种植物接种3~5株,重复2次。接种过的植株放在18~25 ℃的防虫温室中生长,7 d后隔天观察并记录症状,ELISA检测接种的叶片。对于不表现症状的植物用摩擦接种的方法进行回接,回接的植物同样用ELISA检测(Dijkstra et al,1998)。
1.4 介体昆虫传播试验将桃蚜(Myzus persicae)放在白菜(Brassica chinensis)上饲养,连续进行2~3代的接种鉴定,确认无病毒症状后大量饲养繁殖获得无毒蚜。将无毒的桃蚜在培养皿中饥饿1 h,然后取症状明显的长春花幼嫩叶片,剪成条状饲喂蚜虫,待蚜虫饲喂5~10 min后将蚜虫转移到组培的长春花幼苗上,每株至少放5头。饲喂2 h后用杀虫剂灭蚜。另设不杀灭蚜虫组作为对照。7 d后隔天观察并记录症状,并进行ELISA检测(张鹏飞等,2001)。
1.5 酶联免疫吸附测定采集长春花发病叶片和接种的供试植物显症叶片用包被缓冲液研磨后,以健康的长春花叶片作为阴性对照。用上述23种抗血清通过抗原包被(antigen coat plate,ACP)ELISA进行检测(Clark et al., 1977)。
1.6 CMV免疫胶体金层析试纸条的检测称取感病和健康的长春花叶片各0.15 g,分别装入缓冲液包,用玻璃磨槌把缓冲液包内的样品磨碎,取出CMV免疫胶体金层析试纸条,按ImmunostripTM箭头指示方向,把有箭头的一头插入缓冲液和样品的混合液中,箭头大约浸湿0.5 cm。3~5 min后观察并记录结果。
1.7 病毒粗提纯及免疫沉淀病毒粒体电子显微镜观察取症状明显的长春花幼嫩叶片100 g,在液氮中研磨至粉状;加入0.5 mol·L-1的柠檬酸缓冲液(pH 7.0)200 mL(含1%巯基乙醇),氯仿200 mL。搅拌混匀,4 ℃下3 000 r·min-1离心15 min;吸取上层水相,加入7.5%的聚乙二醇6000(PEG 6000)和4%的NaCl,溶解后在4 ℃下静置2 h,4 ℃下9 000 r·min-1离心20 min;沉淀4 ℃下悬浮于0.05 mol·L-1的柠檬酸缓冲液中2 h(按初提纯液体积的1/5加缓冲液);4 ℃下9 000 r·min-1离心20 min,上清液中加入质量分数7.5%的PEG6 000和质量分数4%的NaCl,溶解后在4 ℃下静置2 h;沉淀4 ℃下重新悬浮于0.05 mol·L-1的柠檬酸缓冲液中2 h(按初提纯液体积的1/20加缓冲液);4 ℃下9 000 r·min-1离心20 min,上清液即为CMV病毒粗提纯液。
按照体积比1/50在CMV病毒粗提纯液加入效价为1/512的CMV抗血清,4 ℃下12 000 r·min-1离心5 min,吸取管底部分的病毒粗提液进行电镜观察。用镊子夹持铜网边缘,把铜网放在病毒粗提液液滴上,使铜网正面与液滴接触,3 min后,用干净的滤纸从铜网边缘吸去余液,再用蒸馏水轻轻冲洗铜网,用干净的滤纸从铜网边缘吸去蒸馏水,冲洗3次。在封口膜上滴上2%醋酸铀[UA,UO2(CH3COO)2·2H2O]溶液(pH 4.0~5.2),用镊子夹持铜网边缘,把铜网放在醋酸铀液滴上,使铜网正面与液滴接触,3 min后,用干净的滤纸从铜网边缘吸去余液,重复3次。将负染好的铜网正置于底部铺有干净滤纸的培养皿中,30 min后,在日立(Hitachi)透射电镜下观察(电镜型号H-7500)(郝宏京等,2006)。
1.8 发病植物叶片dsRNA提取参照Moris等(1979)、Cashdollar等(1982)的方法提取发病的长春花叶片dsRNA,同时以健康的长春花叶片作为对照。提取的dsRNA经1%琼脂糖凝胶电泳分离,并在Alpha凝胶成像仪下观察并记录结果。
1.9 植物总RNA提取以发病的长春花叶片为材料,用TRIzol试剂提取总RNA。具体方法参照Invitrogen公司TRIzol说明书(Chomczynski et al., 1987)。
1.10 病毒CP基因克隆及序列分析根据NCBI上登录的CMV CP基因的核苷酸序列设计一对引物,引物序列分别为:CMVCPF,5’-ATG GAC AAA TCT GAA TCA ACC A-3’;CMVCPR,5’-TCA GAC TGG G AG CAC CCC AGA CGT-3’。以提取的长春花叶片总RNA为模板,用CMVCPR为反转录引物进行反转录,反应体系(20 μL)为:4 μL DEPC处理的H2O,4 μL 5×反转录缓冲液,1 μL 10 mmol·L-1 dNTPs,1 μL CMVCPR(20 mmol·L-1),1 μL(40 U)RNA酶抑制剂,3 μL总RNA,1 μL(200 U)M-MLV反转录酶。65 ℃水浴5 min,42 ℃水浴60 min。以反转录产物为模板,用引物CMVCPF,CMVCPR进行PCR扩增。同时以另一对引物(扩增CP部分片段)进行扩增作对照,引物序列分别为:CMV5F,5’-ACG TTA GCA GCT GGT CGT CC-3’,5’-TCA GAC TGG GAG CAC CCC AGA C-3’。反应条件为:94 ℃,3 min;94 ℃,30 s,59 ℃,30 s,72 ℃,1 min,30次循环;72 ℃,10 min。
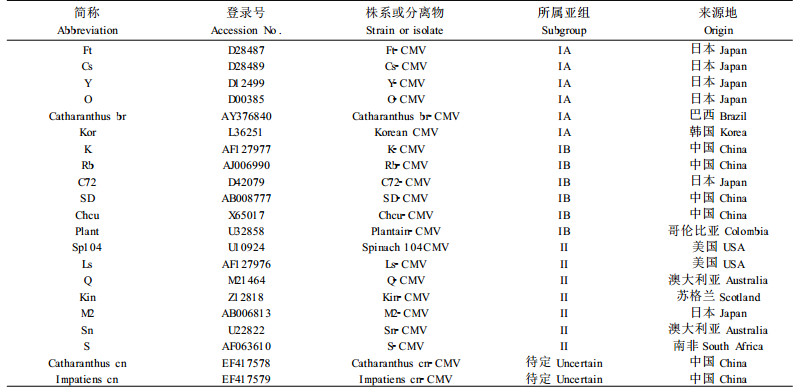
将PCR产物用1%琼脂糖凝胶电泳,切下凝胶中与预期大小相符的片段,用DNA凝胶回收试剂盒回收后与pMD18-T连接后转化大肠杆菌DH5α,碱裂解法提质粒,进行PCR、酶切验证,将验证正确的阳性克隆送公司进行测序,用DNAMAN和BLAST软件(NCBI,http://www.ncbi.nlm.nih.gov/BLAST)(Altschul et al., 1990)对序列进行生物信息学分析。本文引用的CMV株系或分离物的CP基因序列信息如表 1所示。
|
|
在同一地块,不同植株可能因感染时期不同而表现出不同的症状(图 1)。主要表现有:1)普通花叶:叶片褪绿、疱斑;2)叶片畸形:叶片皱缩、扭曲、向背面卷曲、叶尖变窄或整个叶片变窄,呈蕨叶状;3)植株矮化:节间缩短、植株矮化、丛生或簇生;4)花小、变形或杂色:花瓣由心形变为窄条状或花变小至退化,玫瑰红色花瓣上嵌有深红色或浅色条斑,严重时不开花,病株一般不能结实。病害严重影响长春花植株的生长,不但失去观赏价值,同时也明显降低或使其失去其药用价值,在生产上造成严重危害。

|
图 1 长春花花叶病田间症状 Figure 1 The periwinkle mosaic disease symptoms A~D为染病长春花症状,E、F为健康长春花。 Infected plants(A~D) andhealthy plants(E, F). |
用采自海南的长春花花叶病外植体,通过组织培养获得了染病的长春花组织培养苗。组培苗叶片表现出与田间病株类似的叶片皱缩、扭曲或疱斑花叶等症状,但叶片明显比田间病株黄化,症状也相对较轻;在组培过程中有部分苗易出现玻璃化现象(图 2)。

|
图 2 长春花染病组织培养苗表现花叶症状 Figure 2 Infected periwinkle plants cultured in vitro showing mosaic symptoms |
染病苗以茎段继代培养1年以上,病苗的症状维持稳定。将茎段转移至装有组培培养基的试管斜面上,在低温下冷藏可长期保藏染病组培苗作为毒原。
2.3 血清学测定感病的长春花叶片用23种抗血清ELISA检测结果显示,与CMV抗血清有较强的阳性反应,与其他22种抗血清无反应(表 2)。感病的长春花叶片汁液摩擦接种的供试植物用CMV抗血清ELISA检测,也呈较强的阳性反应。经蚜虫传毒的长春花植株发病后ELISA检测也与CMV抗血清有较强阳性反应。
|
|
分别将适量的感病和健康的长春花叶片装入缓冲液包研碎后,将病毒免疫胶体金试纸条插入混合液中,3~5 min后,在感病长春花叶片混合液中的试纸条在检测区和对照区各形成一条红色线,而健康样品混合液中的试纸条和TMV试纸条只在对照区形成一条红色线(图 3)。该结果进一步说明感病长春花叶片中含有CMV而不含有TMV,与ELISA测定结果一致。用CMV免疫胶体金试纸条也从染病的长春花组织培养苗中检测出CMV的存在,说明病毒在组培苗中得到有效地保存。

|
图 3 病毒免疫胶体金试纸条检测长春花病组织 Figure 3 CMV assay using ImmunostripTM from infected periwinkle tissues A:试纸条检测方法Indicating assay method;B:用长春花病叶的检测结果(下条)与健康叶片对照(上条) Assay results of infected(upper strip) and healthy periwinkle(lower strip). |
该病原物接种6科15种植物后的症状表现及接种后与CMV抗血清的反应见表 3。在茄科和葫芦科植物上症状主要表现为系统花叶,在豆科和藜科植物上症状表现主要表现局部坏死斑。不侵染禾本科植物。
|
|
试验结果显示,长春花病原物不仅极易通过摩擦接种传播,也可以通过桃蚜传播。桃蚜传播后发病周期为8~12 d。
用染病长春花组培苗汁液磨擦接种普通烟、本生烟和白肋烟皆表现典型的花叶症状(图 4)。

|
图 4 用染病长春花组培苗汁液摩擦接种烟草 Figure 4 Nicotiana spp. seedlings rub-inoculated with the crude sap from the infected periwinkl in tissue culture seedlings A:本生烟接种病汁液; B:白肋烟清水对照; C:白肋烟接种病汁液。 Symptoms of N. benthamiana(A) and N. tabacum white burley (C) rub-inoculated with crude sap, mock-inoculated white burley (B) was as a control. |
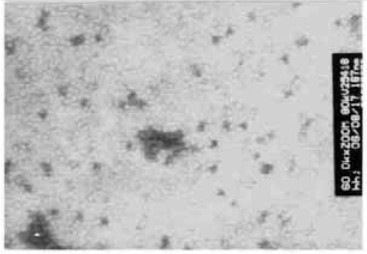
粗提纯的病毒粒体经CMV抗血清免疫沉降后进行负染,在透射电镜下观察到典型的球状病毒粒体,平均直径为28~30 nm,病毒粒体中央有致密电子心(图 5)。
|
图 5 病毒粒子的电子显微镜观察结果 Figure 5 Observation of viral particles by electron microscopy |
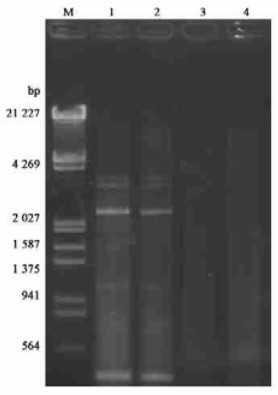
从发病的幼嫩长春花叶片提取dsRNA,从提取的dsRNA凝胶电泳结果(图 6)可以看出,有5条dsRNA条带,大小分别为3.3、3.0、2.2和0.9 kb,还有一条0.3 kb左右的dsRNA条带,健康对照长春花叶片没有检测到任何dsRNA条带。这与CMV产生的dsRNA大小相符,而0.3 kb左右的dsRNA条带可能是病毒卫星RNA。
|
图 6 染病长春花dsRNA Figure 6 Electrophoresis of dsRNA from infected periwinkle leaves M:λDNA EcoRⅠ/HinⅢ marker。1:海南长春花病叶dsRNA; 2:广州长春花病叶dsRNA; 3:海南长春花健康叶dsRNA; 4:广州长春花健康叶dsRNA。 M:λDNA EcoRⅠ/HinⅢ marker. Infected periwinkle leaves(1, Hainan and 2, Guangzhou) and healthy leaves (3, Hainan and 4, Guangzhou) dsRNA. |
提取发病长春花叶片的总RNA,以反转录后的cDNA为模板,2对引物均扩增出预期大小的条带,引物CMVCPF、CMVCPR扩增出大小为650 bp左右的条带。作为对照的一对引物CMV5F、CMV3R扩增出大小为520 bp左右的条带(图 7)。

|
图 7 CMV CP基因RT-PCR结果 Figure 7 RT-PCR products of CMV gene M:DL2000 DNA ladder。1:海南长春花病叶PCR扩增(引物CMV5F&3R); 2:广州长春花病叶PCR扩增(引物CMV5F&3R); 3:海南长春花叶PCR扩增(引物CMVCPF&R); 4:广州长春花病叶PCR扩增(引物CMVCPF&R)。 M, DL2000 DNA ladder. CMV gene in total RNA from Hainan(1 and 3) and Guangzhou(2 and 4) infected periwinkle leaves, amplifying by primers CMV5F&3R(1 and 2) and CMVCPF&R(3 and 4). |
PCR产物回收后克隆到pMD18-T,挑选验证好的阳性克隆测序。对测序结果用DNAMAN和NCBI的BLAST软件分析发现,侵染长春花的CMV的CP基因(登录号,EF417578)在核苷酸水平上与GenBank中已登录CMV的CP基因的序列同源性最高为97.26%(CMV243株系,登录号AJ585521.1),最低为93%(CMV BAR96/1分离物,登录号AJ829777.1);而与国外报道的侵染长春花的CMV的CP基因同源性为93.91%。在氨基酸水平上,与其他CMV株系或分离物的同源性为98%~99%。
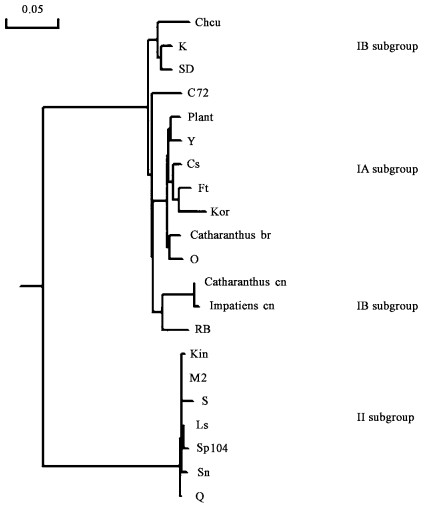
2.8 CMV中国长春花分离物分类地位的确定将CMV长春花中国分离物(catharanthus cn-CMV)CP基因的核苷酸序列与CMV的3个亚组19种分离物或株系(表 1)CP基因的核苷酸序列在DNAMAN中进行比对并生成系统进化树(图 8),从系统进化树上可以看出,Catharanthus cn-CMV与CMV IB亚组的K、Rb、C72、SD、Chcu株系有较近的亲缘关系,与Rb-CMV(赤豆中国分离物)(周雪平等,1994;刘勇等,1999)亲缘关系最近,而与IA亚组和Ⅱ亚组亲缘关系较远,因此,CMV中国长春花分离物应初步归为IB亚组。
|
图 8 CMV中国长春花分离物与CMV 3个亚组18个分离用DNAMAN比对后生成的系统进化树 Figure 8 Phylogenetic tree of CMV CP gene sequences of CMV Catharanhus isolates and other 18 CMV strains/strains using the DNAMAN(version, 5.2.2) program (Bar, 5% sequence divergence) |
长春花是我国一种重要的园艺观赏植物,也是重要的药源植物。通过生物学和分子生物学的方法进行病原物鉴定发现,广东和海南长春花花叶病主要为CMV侵染所致,与以前的报道吻合(孔宝华等,2000)。本研究首次对我国CMV的长春花分离物的CP基因进行了测序与dsRNA分离,基于CP基因的生物信息将其初步归为CMV IB亚组,国外报道的侵染长春花的CMV株系为IA亚组成员,说明二者的亲缘关系较远。本文研究发现,Catharanthus cn-CMV与Rb-CMV的亲缘关系较近(图 8),周雪平等(1994)将从豆科植物上分离到的CMV的5个分离物分为两个型,分型的依据是这5个分离物在豇豆、豌豆、菜豆和蚕豆上的症状反应,将在该4种豆科植物上症状表现为局部枯斑的定为Ⅰ型,产生系统症状的定为Ⅱ型,根据此定型依据,Rb-CMV属于Ⅰ型。Catharanthus cn-CMV接种豆科植物亦表现局部枯斑症状(表 3),同时,Rb-CMV与Catharanthus cn-CMV在茄科、藜科、葫芦科、番杏科上的症状亦一致。这进一步表明了二者较近的亲缘关系。同时二者在地理分布上也较为相近,与IB亚组的在核苷酸同源性相对较低的中国分离物如,K、Rb、SD、Chcu地理分布较远。
Roosinck等(1999)根据CMV RNA3的5’端非翻译区(5’Nontranslated region,5’NTR)将CMV的26个株系划分在IA、IB和Ⅱ 3个亚组,为了证明这一观点,作者将CMV 53个株系的CP基因进行系统进化分析,发现I亚组可以划分为IA和IB 2个亚组。RNA病毒往往进化很快,很高的突变率是一个重要原因,不同基因组之间的重排以及RNA与RNA间的重组也是不可忽视的因素,在黄瓜花叶病毒属中由于重排产生新种的例子很多(White et al., 1995)。在雀麦花叶病毒属中,RAN1、RNA2的5’端非编码区相对于RNA3的5’NTR更为保守,而RNA3的5’NTR易发生重排或重组、缺失、插入,而RNA3的5’NTR发生的重排或重组、缺失、插入正是CMV各亚组病毒辐射进化的首要原因(Roosinck et al., 1999)。本研究用Catharanthus cn-CMV的CP基因与其他CMV的CP基因进行比对,根据比对结果将Catharanthus cn-CMV初步划为IB亚组,因此,克隆Catharanthus cn-CMV RNA3的5’NTR,和其他株系或分离物的RNA3的5’NTR进行比对,根据比对结果明确其分类地位是非常必要的。
金免疫层析法是近几年来国外兴起的一种快速诊断技术,已经在肿瘤标志物、生育指标及部分动植物疾病检测方面得到了相当普及和推广。从本试验测定结果来看,与传统的ELISA检测相比,金免疫层析法不需要任何特殊的仪器设备,而且检测快速,整个操作时间少于15 min,操作简便、快速、准确、自带质控对照、不需任何附加试剂。而其敏感性与特异性与ELISA几乎无差别(王玉金等,2003;徐葛林等,2004;Choi et al., 1999)。因此在病毒病的田间快速诊断方面有相当大的优势;然而,由于每张试纸条只能用于一个样品一种病原的检测,因此采用国外进口产品进行大量样品检测时其成本高于ELISA。而且,目前的试纸条只能进行定性检测,还不能定量。因而,国内开发此类产品的目标应考虑试纸条的定量检测和降低成本方面进行探索。
由于CMV的病毒粒体比较小,如果在病组织中的滴度比较低时,电镜观察时不易观察到;同时由于其粒体小、杂蛋白混淆,在电镜下病毒粒子少时难以辨认。过去对于粒体直径为30 nm或更小的病毒粒子,常用超速离心或梯度密度离心方法获得纯病毒粒体进行观察,但在电镜下观察高密度的病毒粒子也比较困难。作者在进行电镜观察之前对病毒粗提液里的病毒粒体用CMV抗血清进行免疫沉降,然后负染观察,达到了理想的效果。本文将效价为1/512的CMV抗血清加入CMV病毒粗提液中对病毒粒体免疫沉降后,在电镜下观察,几乎每个视野下都能看见病毒粒子,甚至有成堆的病毒粒子(图 5)。
长春花花叶病病株在组培时有黄化现象,与本实验室保存的感染植原体的长春花变叶病组培苗症状相比,二者是有明显差异的,后者表现为叶片变小、叶色淡或脉间褪绿黄化、多数有腋芽分化和丛生等症状(田国忠等,2005;2006)。长春花组培苗冷藏时,冷藏温度比本实验室保藏的感染植原体的枣树(Ziziphus jujuba)和泡桐(Paulownig fortunei)组培苗冷藏温度高1~2 ℃,温度范围在8~10 ℃为宜。这可能与长春花为南方热带适生植物、对低温更敏感有关。
已知CMV能侵染1 000多种植物,其中许多寄主植物为园艺植物(Chen,2003),它有一系列的自然寄主,何氏凤仙(Impatiens wallerana)是其中一种(Loebenstein et al., 1995; Herold,1964)。有趣的是,作者在采集长春花病样时,在发病长春花植株旁边有表现花叶症状的何氏凤仙,通过生物学何分子生物学的方法鉴定其病原物也为CMV,而且发现侵染何氏凤仙和长春花的CMV的CP基因(登录号,EF417579)在核苷酸水平上几乎没有差异(图 8)。因此推测二者可能互为传染源。
从病害调查与病毒鉴定结果分析,此病害的发生和流行,与病害的初侵染源、蚜虫介体密度、栽植与管理方式、病毒的株系以及品种的抗性等都有关系。病害的初侵染源可能来自带毒的种子,也可能通过扦插育苗带毒或在人工修剪、采收过程中传病。比如,在三亚鹿回头公园边的山坡下和儋州市的一些地块,分布着野生的紫花和白花长春花,2004和2005年2次调查都未发现明显的病毒病症状的病株,而在三亚市区的庭院内的长春花则发现典型的病毒病危害。说明初侵染源的存在是病害发生和流行的关键。种子或种苗带毒可能是长春花集约栽培过程中病害流行的重要因子。比如在琼海博鳌镇,病害的严重发生可能与种子带菌、密植、所栽植的紫花长春花感病、扦插育苗、多次收割茎叶造成接触传染有关。所以,从病害防治角度,加强种子和种苗检验与检疫、及时清除少量病株毒原、避免人为损伤引起的汁液传染、控制蚜虫危害、栽种抗病品系等措施是病害防治的重要措施。无CMV毒源的地区,选用不带毒种子和种苗是控制病害关键的措施。
蔡红, 孔宝华, 陈海如. 2003. 长春花黄化植原体(PY)株系的检测与鉴定. 微生物学报, 43(1): 116-119. DOI:10.3321/j.issn:0001-6209.2003.01.018 |
蔡连捷, 闫有旺. 2005. 长春花的栽培及其利用. 特种经济动植物, 6(5): 19. DOI:10.3969/j.issn.1001-4713.2005.05.020 |
郝宏京, 高强, 李元, 等. 2006. 浅谈负染色技术及其应用. 天美科技通讯:电镜专刊, (10): 10-11. |
孔宝华, 蔡红, 陈海如, 等. 2000. 99世博会植物病毒种类的调查与鉴定初报. 植物检疫, 14(3): 132-134. DOI:10.3969/j.issn.1005-2755.2000.03.002 |
刘勇, 周雪平, 薛朝阳, 等. 1999. 黄瓜花叶病毒赤豆分离物外壳蛋白序列分析及原核表达. 农业生物技术学报, 7(1): 51-55. DOI:10.3969/j.issn.1674-7968.1999.01.009 |
田国忠, 李建民, 朴春根, 等. 2006. 不同来源植原体组织培养苗的长期保藏研究//彭友良. 中国植物病理学会2006年学术年会论文集. 北京: 中国农业科技出版社, 137-139. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=6316543
|
田国忠, 温秀军, 李永, 等. 2005. 枣疯病和泡桐丛枝病原植原体分离物的组织培养保藏和嫁接传染研究. 林业科学研究, 18(1): 1-9. DOI:10.3321/j.issn:1001-1498.2005.01.001 |
王玉金, 王玉珠, 杨书豪, 等. 2003. 胶体金免疫层析法检测血清癌胚抗原标记. 免疫分析与临床, 10(3): 167-169. DOI:10.3969/j.issn.1006-1703.2003.03.012 |
徐葛林, 胡巧玲, 吴杰, 等. 2004. 检测狂犬病毒的胶体金免疫层析法的建立及应用. 中国人兽共患病杂志, 20(3): 236-238. DOI:10.3969/j.issn.1002-2694.2004.03.020 |
云青柳. 2005. 长春花的栽培及观赏利用. 热带林业, 33(4): 45-47. DOI:10.3969/j.issn.1672-0938.2005.04.016 |
张鹏飞, 陈建群, 张闲, 等. 2001. 棉蚜获得黄瓜花叶病毒的行为与取食过程的关系. 昆虫学报, 44(4): 395-401. DOI:10.3321/j.issn:0454-6296.2001.04.002 |
周雪平, 濮祖芹, 方中达. 1994. 豆科植物上分离的黄瓜花叶病毒(CMV)五个分离物的比较研究. 中国病毒学, 9(3): 232-238. |
朱纯, 阮琳, 卢树洁, 等. 2002. 长春花疫病的发生危害与防治. 植物保护, 28(4): 36-39. DOI:10.3969/j.issn.0529-1542.2002.04.013 |
Altschul S F, Gish W, Meyers E W, et al. 1990. Basic local alignment search tool. J Mol Biol, 215: 403-410. DOI:10.1016/S0022-2836(05)80360-2 |
Chomczynski P, Sacchi N, Kingston R E, et al. 1987. Single-step methods of RNA isolation by acid guanidinum thiocyanate-phenol-chloroform extraction. Anal Biochem, 162: 156-159. |
Cashdollar L W, Esparza J, Hudson G R, et al. 1982. Cloning the double-stranded RNA genes of reovirus: sequence of the cloned S2 gene. Proc Nati Acda Sci, 79: 7644-7688. DOI:10.1073/pnas.79.24.7644 |
Chen Y K. 2003. Occurrence of cucumber mosaic virus in ornamental plants and perspectives of transgenic control. Ph D dissertation Wageningen University, Wageningen, the Netherlands 25-28.
|
Choi M J, Kim S Y, Choi J, et al. 1999. Digoxin antibody with Colloidal gold and ferrocene for its use in a membrane immunostrip and immunosensor. Microchemical Journal, 63: 92-99. DOI:10.1006/mchj.1999.1770 |
Clark M F, Adams A N. 1977. Characteristis of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses. J Gen Virol, 34: 475-483. DOI:10.1099/0022-1317-34-3-475 |
Dijkstra J, de Jager C. 1998. Practical plant virology: protocols and exercises. Berlin; Heidelberg; New York: Springer (Springer lab manual).
|
Duarte L M, Rivas E B, Alexandre M A, et al. 2001. Serological and molecular comparison among CMV strains from ornamental plants. Virus Rev Res, 6: 155. |
Herold F. 1964. Natural infection of Impatiens sultani with Cucumber mosaic virus. Plant Disease Reporter, 48(8): 603-605. |
Loebenstein G, Lawson R H, Brunt A A. 1995. Virus and virus-like diseases of bulb and flower crops. New York: John Wiley & Sons, 543.
|
Moris T J, Dodds J A. 1979. Isolation and analysis of double-stranded RNA from virus infected plant and fungal tissue. Phytopathology, 67: 854-858. |
Roosinck M J, Zhang L, Hellwald K H. 1999. Rearrangements in the 5' nontranslated region and phylogenetic analyses of cucumber mosaic virus RNA 3 indicate radial evolution of three subgroups. Journal of Virology, 73(8): 6752-6758. |
White P S, Morales F J, Roossinck M J. 1995. Interspecific reassortment in the evolution of a cucumovirus. Virology, 207: 334-337. DOI:10.1006/viro.1995.1088 |
 2008, Vol. 44
2008, Vol. 44