文章信息
- 杜丽, 庞振凌, 周索, 曾晓慧, 包满珠.
- Du Li, Pang Zhenling, Zhou Suo, Zeng Xiaohui, Bao Manzhu.
- 香樟胚性愈伤组织遗传转化体系建立
- Establishment of Agrobacterium-Mediated Transformation System of Embryogenic Calli of Cinnamomum camphora
- 林业科学, 2008, 44(4): 54-59.
- Scientia Silvae Sinicae, 2008, 44(4): 54-59.
-
文章历史
- 收稿日期:2007-09-19
-
作者相关文章
2. 华中农业大学园艺林学学院 教育部园艺植物生物学重点实验室 武汉 430070
2. Key Laboratory of Horticultural Plant Biology of Ministry of Education College of Horticulture and Forestry Sciences, Huazhong Agricultural University Wuhan 430070
香樟(Cinnamomum camphora),樟科(Lauraceae),常绿乔木,是贵重家具、高级建筑、造船和雕刻等理想的用材, 近年来,香樟在园林绿化中的应用越来越多,成为城市中重要的园林绿化树种。作者利用未成熟的香樟合子胚诱导获得胚性愈伤组织,历经3年继代保存,胚性愈伤组织仍具有发育成体胚、体胚再形成植株的能力。香樟的植株再生通常是经过体细胞胚胎发生途径来完成的(杜丽等,2006;Du et al., 2007),但国内外迄今为止尚无关于香樟的胚性愈伤组织遗传转化体系的报道。本文利用现有保存的香樟胚性愈伤组织细胞系,对影响香樟遗传转化的几个因素进行了研究,建立了高效的农杆菌遗传转化体系,为香樟的基因工程育种奠定了基础。
1 材料与方法 1.1 植物材料香樟可通过体细胞胚发生途径获得再生植株,本文利用这个再生系统进行遗传转化的研究。以香樟继代保持3年的胚性愈伤组织(胚性系L9)(杜丽等,2006;Du et al., 2007)为试验材料和转化受体。
1.2 胚性愈伤组织对潮霉素的敏感性试验将胚性愈伤组织接种于附加不同浓度潮霉素的保持增殖培养基上(MS+1.0 mg·L-1 BA + 0.1 mg·L-1 2, 4-D + 700 mg·L-1 CH,蔗糖30 g·L-1, 琼脂粉为7.5 g·L-1)(CH:水解酪蛋白),1个月后比较不同浓度抗生素对外植体增殖的抑制作用,以确定合适的选择压力。试验的潮霉素浓度梯度为10、30、50、70、100 mg·L-1。试验外植体数不少于30团(直径约5 mm)。
1.3 根癌农杆菌菌株及质粒试验中所用根癌农杆菌菌株为EHA105,它含有pCAMBIA1301质粒,该质粒携带GUS报告基因和HPT选择基因,其中GUS基因含有一个内含子,以确保GUS基因只在植物细胞中表达,而不在农杆菌中表达。含有该质粒的农杆菌对潮霉素有抗性。质粒中T-DNA区域的结构简图如图 1所示。

|
图 1 质粒pCAMBIA1301的T-DNA区结构简图 Figure 1 Construction of T-DNA region of plasmid pCAMBIA1301 |
收集培养好的农杆菌菌体用共培养介质(AB + 100 μmol·L-1 AS,表 1)(AS:乙酰丁香酮)重新悬浮至OD600 0.2~1.2左右,将愈伤组织置于悬浮液中侵染10~60 min,用灭菌滤纸吸干表面液体,一段时间后取出并用无菌滤纸吸去表面多余的菌液,并在超净工作台上将浸泡后的材料吹至半干(20~30 min),后接入胚性愈伤组织共培养培养基(MS + 1.0 mg·L-1 NAA + 1 000 mg·L-1 ME + 100 μmol·L-1 AS)(ME:麦芽提取物)中,将上述接种物置于黑暗条件下培养1~6 d。
|
|
对于胚性愈伤组织的转化条件优化,本研究试验了根癌农杆菌EHA105/pCAMBIA1301的菌液浓度(OD600= 0.2、0.4、0.6、0.8、1.0、1.2),共培养天数(1、2、3、4、5、6 d),侵染时间(10、20、30、40、50、60 min),对遗传转化的影响。检测其中的某个因素时,其他因素的水平采用OD600为0.6,共培养天数为3 d,侵染时间为40 min,共培养结束后用外植体GUS的瞬间表达量的多少确定转化条件的适宜程度。
1.5 脱菌和选择培养试验中测试了不同浓度的潮霉素(50 mg·L-1和70 mg·L-1)和300 mg·L-1头孢霉素组成的选择培养基(MS + 1.0 mg·L-1 NAA + 1 000 mg·L-1 ME)对诱导GUS基因转化的抗性愈伤组织的影响,该试验设计2次重复,每次重复采用至少50个外植体(5个培养皿,10团外植体/皿),25 ℃黑暗条件下选择培养,6周后进行抗性愈伤组织诱导率(产生新鲜愈伤组织的外植体数/每个重复的外植体总数×100%)统计。此后,诱导出的新鲜抗性愈伤组织在含有50 mg·L-1潮霉素和300 mg·L-1头孢霉素的选择培养基上每3周继代1次进行抗性愈伤组织的增殖培养,25 ℃暗培养。
1.6 抗性愈伤组织的GUS基因瞬间表达及PCR检测转化共培养后对转化受体进行GUS染色,检测转化瞬时表达率,可初步判断农杆菌对受体组织的侵染效率。检测GUS基因在转基因愈伤组织中的表达,取未转化的同步材料为阴性对照。胚性愈伤组织反应后可直接观察,GUS基因瞬间表达呈阳性者可在肉眼下观察到蓝色反应,然后统计GUS基因瞬间表达率(有蓝色反应的外植体数/外植体总数)。试验重复3次,每次外植体总数不少于30粒。
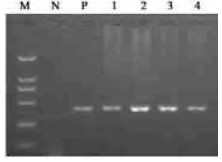
香樟胚性愈伤组织DNA的提取采用CTAB少量提取法。根据HPT基因序列,设计一对特异引物为:5′-CGT, CTG, TCG, AGA, AGT, TTC-3′和5′-TAC, TTC, TAC, ACA, GCC, ATC-3′,琼脂糖凝胶电泳检测扩增片段范围如图 5所示。
|
图 5 GUS基因遗传转化的潮霉素抗性愈伤组织的PCR检测 Figure 5 PCR amplification results of hygromycin resistant embryogenic calli after GUS gene transformation M. Marker(DL200);N.未转化愈伤组织DNA阴性对照Non-transgenic embrogenic calli negative control;P.质粒DNA阳性对照Plasmid DNA positive control;1~4.抗性愈伤组织DNA hygromycin-resistant embryogenic calli. |
研究了10~100 mg·L-1不同潮霉素浓度对胚性愈伤组织增殖的影响。将继代培养的胚性愈伤组织接种到含潮霉素的保持培养基上,观察和记录在不同选择压力下培养4周后的生长结果。随着培养基中潮霉素浓度的增加,具有新生长的愈伤组织的比例显著降低,10~30 mg·L-1压力下,4周后虽然有部分愈伤组织逐渐死亡,但仍有部分愈伤组织存活下来并能继续生存下去。当潮霉素浓度达到70 mg·L-1或更高时,从接种10 d后立即抑制了胚性愈伤组织生长,生长缓慢。这个结果表明潮霉素在选择压力低时,即使长时间选择亦有部分愈伤组织存活,当压力提高达到一定值时,经短时间的选择即可达到抑制生长的效果。可见潮霉素对于香樟胚性愈伤组织的生长抑制是速效的。在观察中发现,当潮霉素浓度为50 mg·L-1时,虽然能够观察到新的愈伤组织以很低的频率发生(<15%),但大多数愈伤组织颜色发暗,呈现黄褐色,表面干涩,缺乏活力;潮霉素浓度为70 mg·L-1时,愈伤组织呈褐色,有极少量新的愈伤组织发生,愈伤组织体积增大不明显;当潮霉素浓度为100 mg·L-1,愈伤组织呈黑褐色,体积无增大,生长完全受到抑制。因此认为50 mg·L-1潮霉素已表现出对香樟胚性愈伤组织生长的明显抑制,故将潮霉素浓度50 mg·L-1作为选择压力。
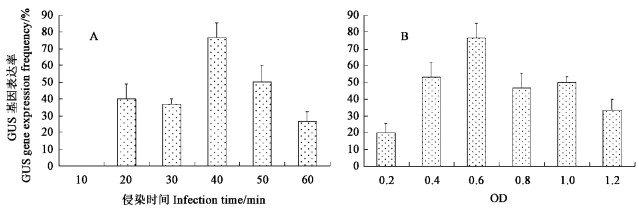
2.2 侵染时间对胚性愈伤组织遗传转化的影响农杆菌侵染植物外植体首先进行农杆菌细胞与植物细胞间的相互作用,足够的侵染时间有利于农杆菌通过趋化作用或其他作用充分吸附到植物外植体伤口或愈伤组织表面,一般农杆菌的侵染时间为5 min到1 h之间。本文研究了10~60 min这6个水平(10、20、30、40、50、60 min),其中每个处理的共培养时间均为3 d, 侵染用农杆菌的OD600值都调整为0.6,GUS数据是3次独立重复试验的平均结果。结果显示:当侵染时间为10 min时,胚性愈伤组织的GUS基因瞬间表达率为0(图 2A),而侵染时间延长至20 min时,GUS基因瞬间表达率突增至40%以上;最高的表达率出现在侵染时间为40 min的处理中,GUS基因瞬间表达率可达76.67%;侵染时间超过40 min表达率开始下降,可能是过长的侵染时间使农杆菌对外植体的生长造成了伤害,所以40 min的侵染时间适于香樟胚性愈伤组织的遗传转化。
|
图 2 侵染时间、农杆菌侵染浓度对香樟胚性愈伤组织遗传转化的影响 Figure 2 Effect of infection time and OD value on gene transformation in embryogenic calli of C. camphora |
菌液浓度在农杆菌介导的遗传转化中是影响转化效率的重要因素之一,因此试验在40 min的侵染时间、共培养3 d的同样条件下,测试了在0.2~1.2的6个水平OD600值(OD600= 0.2、0.4、0.6、0.8、1.0、1.2)对转化效率的影响(图 2B)。结果显示,不同浓度的菌液对香樟胚性愈伤组织的转化效率不同。OD600值为0.2时,结束共培养后的GUS瞬间表达率只有20%左右,随着菌液浓度的增加,表达率逐渐增加,当浓度达到0.6时,表达率最高,随后开始降低。同时发现,在浓度高的菌液处理中,结束共培养时,细菌过度生长,几乎包裹了整个外植体,转入选择培养后,有的细菌竟然继续生长,不容易被清除干净,影响外植体的生长,因此认为OD600值大于0.8的菌液浓度处理的外植体GUS基因表达率下降,可能是过度生长细菌的毒害作用造成的。所以在对香樟胚性愈伤组织侵染中,农杆菌最适宜的浓度为OD600值0.6。
2.4 共培养时间对胚性愈伤组织遗传转化的影响理论上说,农杆菌与植物共培养时间越长,农杆菌侵入的机会越多、基因转化的频率越高。然而,实际操作中如果共培养的时间越长,植物的外植体会因过度感染而中毒死亡, 达不到转化效果。因此确定合适的共培养时间是提高转化率的重要因素之一。本试验使用农杆菌OD600值为0.2和0.6、侵染时间为40 min的转化条件,在共培养1~6 d后(1、2、3、4、5、6 d),检查GUS基因在外植体中的瞬间表达情况,结果如图 3。从图 3可见,共培养1 d后,使用较高浓度的菌液(OD600=0.6)GUS基因在外植体内即有表达,随着培养时间的延长,GUS基因的表达率增高,在共培养3 d时表达率达到最高(76.67%),然而随着时间的延长,GUS基因的表达开始下降,原因是植物的外植体过度感染死亡。OD600值为0.2的所有处理中,GUS表达率均明显低于高浓度(OD600=0.6)的菌液侵染效果。可见,低浓度菌液、长时间共培养不能达到和高浓度菌液侵染的同样效果。所以,适宜的菌液浓度为OD600=0.6,共培养时间为3 d。

|
图 3 共培养时间对胚性愈伤组织遗传转化的影响 Figure 3 Effect of co-cultivation time on gene transformation in embryogenic calli of C. camphora |
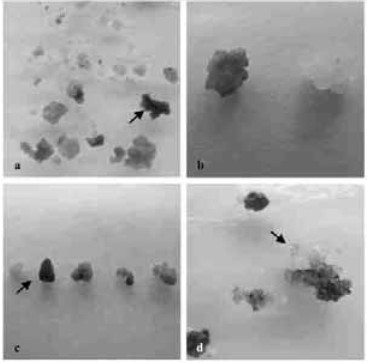
本试验根据GUS基因瞬间表达结果(图 4a~c),确立了农杆菌介导香樟胚性愈伤组织遗传转化的合适条件, 即菌液浓度为OD600=0.6, 侵染时间为40 min, 共培养时间为3 d。按照这一条件进行侵染,共培养3 d后直接转入各自的选择培养基上进行选择培养,6周后获得抗性愈伤组织。
|
图 4 香樟胚性愈伤组织GUS基因表达染色反应 Figure 4 Histological assay of GUS gene expression in embryogenic calli of C. camphora a.共培养3 d后胚性愈伤组织的GUS基因瞬间表达; b. GUS阳性反应愈伤组织(左)和对照愈伤组织(右); c. GUS基因的不同表达量(左为对照); d.抗性愈伤组织。 a. GUS gene transient expression after 3-day co-culture GUS spots; b. GUS spots (left) and control calli (right); c. Different expression of GUS gene (control on the left); d. Hygromycin resistant calli after 6-week selection culture. |
诱导获得的抗性愈伤组织继续转接到选择培养基上,每隔3周继代1次,进行抗性愈伤组织的增殖和假阳性转化的剔除。从转入GUS基因的抗性愈伤组织(图 4d)上可以看出,抗性愈伤组织生长较快,呈新鲜的淡黄色,而其他愈伤组织色彩黯淡,呈褐色,无生活力。选择培养基中300 mg·L-1头孢霉素能有效抑制农杆菌的生长,并对愈伤组织的增殖无影响。到目前为止,这些抗性愈伤组织正在进行再生植株的诱导试验。
2.6 胚性愈伤组织GUS基因瞬间表达及稳定表达检测共培养结束后,将无菌水清洗过的胚性愈伤组织放入GUS反应缓冲液,37 ℃水浴保温过夜。反应结果可以直接用肉眼观察。从图 4a~c可以看出, 香樟胚性愈伤组织的GUS基因表达比较强,被检测的抗性愈伤组织上呈现出不同程度的蓝色,说明GUS在不同的愈伤组织中的表达强弱不同;有的愈伤组织只是局部出现蓝斑,可能是外植体局部被转化的结果。虽然一些研究表明,GUS基因瞬间表达主要是由未整合的T-DNA引起的,与稳定的转化事件并无严格的相关关系,但是差异较大的GUS瞬间反应对于遗传转化条件的确定还是具有一定的指导意义。在本试验中,使用GUS基因瞬间表达的结果进行转化条件优化,以优化的条件进行转化,最终得到了抗性愈伤组织(图 4d),目前,导入GUS基因的抗性胚性愈伤组织正在进行体胚诱导,然后进行再生植株的诱导。
2.7 含有GUS基因的抗性愈伤组织的PCR检测进行选择培养6周后,经含有GUS基因的农杆菌菌液侵染过的胚性愈伤组织上,可以观察到有黄色新鲜的胚性愈伤组织出现。含有潮霉素50 mg·L-1的选择培养基上的抗性愈伤组织诱导率为17.5%;抗生素提高至70 mg·L-1抗性愈伤组织诱导率降至12%,而且这些新诱导的愈伤组织个体都比较细小,直径不足2 mm(表 2)。抗性愈伤组织在选择培养基上生长较正常的胚性愈伤组织在不添加抗生素的培养基上缓慢,可见高浓度的潮霉素对于抗性愈伤组织的生长仍然具有抑制作用。
|
|
将多次选择继代(4个月)的抗性愈伤组织按照外植体来源编号,提取DNA,进行PCR检测,检测结果如图 5所示,4团测试的潮霉素的抗性愈伤组织中编号为1、2、3、4的愈伤组织使用HPT基因设计的引物均扩增出约500 bp的片段,与质粒DNA扩增的片段大小相同,而以未转化愈伤组织DNA为阴性对照的扩增产物中无目标片段,说明外源基因已稳定整合到这些被检测抗性愈伤组织细胞的核基因组中。PCR检测选用的DNA取自在选择培养基(潮霉素:50 mg·L-1)上多次(4个月)继代的抗性愈伤组织,4团抗性愈伤组织在PCR检测中均呈现阳性反应,阳性比率为100%,可见长期使用高浓度潮霉素处理抗性愈伤组织能够有效剔除假阳性的愈伤组织,这可能与香樟的胚性愈伤组织的生长对潮霉素的作用比较敏感有一定的关系。
3 结论与讨论 3.1 影响香樟胚性愈伤组织遗传转化的因素根据试验研究,香樟胚性愈伤组织是比较适宜的遗传转化材料。在试验中,使用子叶期的体胚来侵染,其效果差于胚性愈伤组织(数据未显示)。通常当体胚经过侵染后,在选择培养时,外植体材料非常容易褐化死亡,这可能是因为基因成功转化部分占整个体胚体积比例太小,产生的对抗生素的抵抗力不足以保证整个外植体的存活,所以香樟体胚的转化效率较差。在许多物种农杆菌介导的遗传转化中,胚性愈伤组织是较多使用的转化材料,如NFDB2柑(Citrus reticulata)(Li et al., 2002)、棉花(Gossypium hirsutum)(谢德意等,2007)、杂交月季(Rosa hybrid)(Gao et al., 2004; Kim et al., 2004)、匍匐剪股颖(Agrostis tenuis)(Chai et al., 2004)等都是使用胚性愈伤组织进行遗传转化的,香樟在进行农杆菌介导的遗传转化中,胚性愈伤组织同样是比较适宜的转化试材。
本文研究了在农杆菌菌液侵染胚性愈伤组织时,菌液浓度、侵染时间和共培养时间对T-DNA转化的影响。许多研究表明菌液浓度在农杆菌介导的遗传转化中是影响转化效率的重要因素之一(Dohm et al., 2001; Gao et al., 2004; 苏晓华等,2003), 单位体积中的细菌含量增加,使得农杆菌和胚性愈伤组织相遇的机会增加,T-DNA转入外植体的机会也大大增加;但并不是菌液浓度越高,转化效果越好,因为外植体对于农杆菌的忍耐也是有限度的,过高的细菌浓度如果毒害外植体,显然会降低T-DNA的转化效率。就香樟胚性愈伤组织的转化而言,OD600为0.6的菌液浓度是最佳的转化菌液浓度,这与王爱菊等(2006)的研究结果也是一致的。足够的侵染时间有利于农杆菌通过趋化作用或其他作用充分吸附到植物外植体伤口或愈伤组织表面,10~60 min是农杆菌转化中经常被使用的时间范围,不过侵染时间过长同样会造成转化效率降低,所以香樟胚性愈伤组织的最佳侵染时间是40 min。农杆菌与植物共培养时间越长,农杆菌侵入的机会越多、基因转化的频率越高,通常可能会认为较低浓度的菌液侵染后,适当延长共培养时间就能够获得较好的转化效率。实际上在本研究中发现,此种设想不能成立,OD600为0.2的侵染,即使共培养时间延长至6 d,所得转化效果仍大大低于高浓度在较短共培养时间的结果,显然农杆菌的转化效果在侵染结束后,就已经基本确定。可见在香樟的农杆菌介导的遗传转化中,侵染浓度跟共培养时间相比较而言,侵染浓度对转化效果的影响更显著。
3.2 胚性愈伤组织的植株再生在进行植株再生的过程中,抗生素是选择再生植株的关键。它虽然是得到阳性转化材料再生植株的保证,但也可能是植株再生困难的根源。在本试验中观察到,同样进行体胚诱导(附加不同抗生素的诱导培养基),卡那霉素抗性愈伤组织诱导获得体胚后(转化含有NPTⅡ的质粒,数据未列出),而潮霉素抗性愈伤组织没有体胚的形成。试验中观察到香樟胚性愈伤组织对于这2种抗生素刺激的反应不同,对潮霉素刺激的敏感很有可能就是使之发育迟缓的原因。转化细胞是因为含有抗性基因来抵抗抗生素的刺激,抗生素对这些材料生长的抑制作用是一直存在的,这种抑制作用就可能是导致抗性愈伤组织再生困难的原因之一。所以,在使用抗生素进行选择和再生培养时,应该将抗生素浓度设定为先低后高再低或无,这样既保证了转化的有效性,又能使植株再生不再受阻。目前本试验的香樟潮霉素抗性愈伤组织正在进行植株再生的诱导。
杜丽, 叶要妹, 包满珠. 2006. 香樟未成熟合子胚体胚发生及影响因素的研究. 林业科学, 42(6): 37-39. |
苏晓华, 张冰玉, 黄秦军, 等. 2003. 我国林木基因工程研究进展及关键领域. 林业科学, 39(5): 111-118. DOI:10.3321/j.issn:1001-7488.2003.05.017 |
王爱菊, 张凤美, 鹿金颖, 等. 2006. 农杆菌介导的百合遗传转化体系的建立. 园艺学报, 33(3): 664-666. DOI:10.3321/j.issn:0513-353X.2006.03.045 |
谢德意, 金双侠, 郭小平, 等. 2007. 棉花胚性愈伤组织的转化及转基因胚状体的有效萌发与成苗技术研究. 作物学报, 33(5): 751-756. DOI:10.3321/j.issn:0496-3490.2007.05.009 |
Chai M L, Senthil K K, Kim D H. 2004. Transgenic plants of colonial bentgrass from embryogenic callus via Agrobacterium-mediated transformation. Plant Cell, Tissue and Organ Culture, 77: 165-171. DOI:10.1023/B:TICU.0000016823.94547.c7 |
Dohm A, Ludwig C, Schilling D, et al. 2001. Transformation of roses with genes for antifungal proteins. Acta Horticulturae, 547: 27-34. |
Du Li, Zhou Suo, Bao Manzhu. 2007. Effect of plant growth regulators on direct somatic embryogenesis in camphor tree (Cinnamomum camphora L.) from immature zygotic embryos and induction embryogenic calli. Forestry Studies in China, (4): 21-25. |
Gao Liping, Bao Manzhu. 2004. Optimization of the uidA gene transfer of Rosa hybrida via Agrobacterium tumefaciens: an assessment of factors influencing the efficiency of gene transfer. Forestry Studies in China, (3): 9-14. |
Kim C K, Chung J D, Park S H, et al. 2004. Agrobacterium tumefaciens-mediated transformation of Rosa hybrida using the green fluorescent protein (GFP) gene. Plant Cell, Tissue and Organ Culture, 78: 107-111. DOI:10.1023/B:TICU.0000022529.16697.90 |
Li Dongdong, Shi Wei, Deng Xiuxin. 2002. Agrobacterium-mediated transformation of embryogenic calluses of Ponkan mandarin and the regeneration of plants containing the chimeric ribonuclease gene. Plant Cell Rep, 21: 153-156. DOI:10.1007/s00299-002-0492-6 |
 2008, Vol. 44
2008, Vol. 44



