文章信息
- 刘高强, 魏美才, 刘卫星.
- Liu Gaoqiang, Wei Meicai, Liu Weixing.
- 从马尾松毛虫蛹中制备甲壳素和壳聚糖
- Preparation of Chitin and Chitosan from the Pupae of Dendrolimus punctatus
- 林业科学, 2008, 44(3): 107-112.
- Scientia Silvae Sinicae, 2008, 44(3): 107-112.
-
文章历史
- 收稿日期:2007-02-02
-
作者相关文章
甲壳素(chitin)又名几丁质、甲壳质等,是许多低等动物特别是节肢动物如虾、蟹、昆虫等外壳的重要成分(约含10%~30%),也存在于低等植物如菌藻类和真菌的细胞壁中,它是由2-乙酰氨基-2-脱氧-D-葡萄糖的基本单元经β(1→4)糖苷键连接的聚合物,是迄今为止唯一发现的阳离子动物纤维和唯一的碱性多糖(Synowiecki et al., 2003; Tharanathan et al., 2003)。甲壳素脱去乙酰基后的产物为壳聚糖(chitosan)。壳聚糖的溶解性能较甲壳素有很大改善,在医药、化工、生物、农业、纺织、印染、造纸、环保等众多领域中均具有极其重要的用途(Synowiecki et al., 2003; Tharanathan et al., 2003; Kartal et al., 2005; Masuoka et al., 2005; Gades et al., 2005)。目前,国内外对几丁质的研究日趋活跃,但目前我国壳聚糖的年产量为200 t,远不能满足市场需要(吴长青, 2001)。
昆虫是生物中种类最多、数量最大的生物类群,现已被认为是潜在的蛋白质资源(Bukkens, 1997; 魏美才等, 2001; Liu et al., 2003)。事实上,昆虫还是潜在的甲壳素资源,如蝇蛆中的甲壳素含量为10%~15% (Liu et al., 2003)。因此,在当前壳聚糖市场供不应求的形势下开发昆虫壳聚糖资源具有十分重要的意义。
松毛虫(Dendrolimus)是我国最严重的森林害虫,堪称不冒烟的森林火灾。上世纪70年代以来,我国松毛虫发生面积约为每年150万~200万hm2,其造成的直接经济损失超过10亿元(狄升, 1995)。松毛虫在自然界中的资源十分丰富,据韩剑众等(1991)估计,浙江省每年可收140万kg松毛虫蛹。马尾松毛虫(Dendrolimus punctantus)是松毛虫中资源量较大的一种。近年来,我们从化害为宝的角度,对松毛虫资源化利用技术已进行了一些研究(刘高强等, 2003; 2005a; 2006; 2007)。作者前期对马尾松毛虫蛹中甲壳素的提取进行了初步研究(刘高强等, 2007),本文则在此基础上进一步深入研究了马尾松毛虫蛹中甲壳素的提取工艺,以及虫蛹壳聚糖的制备技术。
1 材料与方法 1.1 材料和仪器马尾松毛虫蛹(以下简称虫蛹),采自湖南省岳阳市汩罗郊区。主要仪器:KDN-08B消化炉/定氮仪,上海新嘉电子有限公司;PZ-88X电热恒温真空干燥箱,上海跃进医疗器械厂;SRJX3-9型箱形电阻炉,长沙远东电炉厂;NDJ-1旋转黏度计,上海精科仪器公司。
1.2 试验方法 1.2.1 单因素法提取甲壳素马尾松虫蛹中甲壳素提取的基本工艺为:样品→盐酸脱矿物质→氢氧化钠脱有机物质→双氧水脱色→甲壳素产品(蒋挺大, 2003; 詹永乐等, 2001)。
各工艺参数的确定采用单因素试验法。各因素及水平的设计如表 1。测定某一因素时,其他条件为非测定因素。试验所选择的基本条件为:盐酸质量分数为3%,盐酸浸泡时间为20 h,盐酸浸泡温度为30 ℃;氢氧化钠质量分数为4%,氢氧化钠浸泡温度为70 ℃,氢氧化钠浸泡时间为8 h,双氧水质量分数为11%,双氧水浸泡时间为2.5 h,浸泡温度为85 ℃。
|
|
甲壳素产品依次用95%、70%、50%、30%的酒精溶液和蒸馏水清洗后,置于白瓷点滴试验板上,加1滴0.03%碘-碘化钾溶液,再加1滴1%硫酸,观察产生的反应(陈长琨, 1991)。
1.2.3 虫蛹壳聚糖的制备虫蛹壳聚糖的制备采用浓碱法(蒋挺大, 2003)。各工艺参数的优化采用单因素递进优化法(以脱乙酰度为优化指标)。影响壳聚糖制备的因素主要有NaOH质量分数、处理温度和处理时间。因此本试验以NaOH质量分数、处理温度和处理时间3个因素进行试验。各因素需要考察的水平见表 2。试验起始试验水平为:NaOH质量分数45%;处理时间为4 h;处理温度为90 ℃。试验结果为3次试验的平均值。
|
|
1) 将所制得的壳聚糖溶解于1%乙酸水溶液中,配制成1%含量的溶液;2)滴加几滴甲基橙指示剂或几滴甲基红指示剂,观察其颜色变化(蒋挺大, 2003)。
1.2.5 甲壳素和壳聚糖产品指标的测定甲壳素的灰分含量采用干法灰化法(侯曼玲, 2004);甲壳素的N含量采用微量凯氏定氮法(侯曼玲, 2004);甲壳素/壳聚糖产品水分的测定采用常压加热干燥法(侯曼玲, 2004);壳聚糖产品脱乙酰度的测定采用酸碱滴定法(蒋挺大, 2003);壳聚糖产品的黏度采用NDJ-1型旋转黏度计进行(蒋挺大, 2003)。
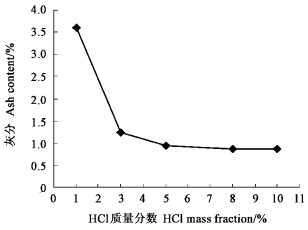
2 结果与分析 2.1 虫蛹甲壳素的提取 2.1.1 盐酸质量分数对虫蛹脱矿物质的影响不同质量分数(1%、3%、5%、8%和10%)的盐酸对松毛虫蛹脱矿物质的影响见图 1。由图 1可以看出,盐酸质量分数越高,脱矿物质的效果越好。盐酸质量分数在3%以上时,所得产品甲壳素的灰分都符合食品级的指标要求(灰分≤1%)(蒋挺大, 2003)。但当盐酸质量分数高于3%时,盐酸的质量分数对脱矿物质的效果差异并不明显,这与张亦飞(1996)报道的结果一致。由于当盐酸质量分数大于3%时,脱钙效果并不是很明显,而且高质量分数的盐酸会加快甲壳素的降解,考虑到甲壳素的得率,因此采用3%的盐酸脱矿物质比较合适。
|
图 1 盐酸质量分数对脱矿物质的影响 Figure 1 The effects of HCl mass fraction on ash content |
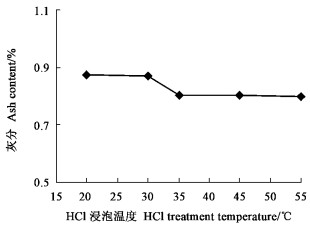
不同的盐酸浸泡温度(20、25、35、45和55 ℃)对松毛虫蛹脱矿物质的影响见图 2。图 2中显示,所有温度下,所得产品甲壳素的灰分都符合食品级的指标要求(灰分%≤1%)(蒋挺大, 2003)。当温度达到35 ℃以上时,脱矿物质的效果差别不大。考虑到产品质量和经济成本,以室温35 ℃脱矿物质为宜。
|
图 2 盐酸浸泡温度与脱矿物质含量的关系 Figure 2 The relationship between HCl treatment temperature and ash content |
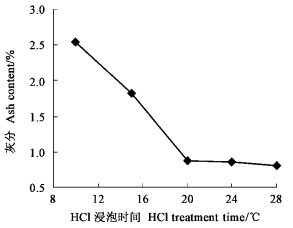
盐酸浸泡时间(10、15、20、24和28 h)对松毛虫蛹脱矿物质的影响见图 3。由图 3可见,盐酸浸泡的时间越长,脱矿物质的效果越好。在20 h以上时就可达到食品级甲壳素的标准(灰分≤1%)。如果时间再长,容易导致甲壳素的降解,因此盐酸的浸泡时间以20 h为宜。
|
图 3 盐酸浸泡时间与产品脱矿物质含量的关系 Figure 3 The relationship between HCl treatment time and ash content |
不同质量分数(2%、4%、5%、7%和9%)的NaOH溶液对虫蛹脱有机物质(蛋白质)的影响见图 4。图 4表明,NaOH的质量分数越高脱有机物质(蛋白质)的效果也越好,在NaOH的质量分数为5%时,产品含N量(6.18%)达到食品级甲壳素指标(6.2%~6.9%)(蒋挺大, 2003)。当质量分数继续升高时,含N量变化不大,因此以6%的NaOH溶液脱有机物质(蛋白质)为宜。

|
图 4 NaOH质量分数对产品脱有机物质(蛋白质)的影响 Figure 4 The effects of NaOH mass fraction on removing proteins from the pupae of D. punctatus |
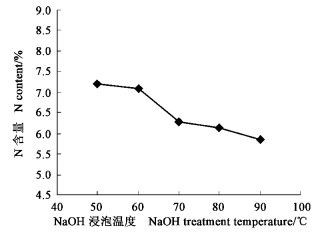
在不同温度(50、60、70、80和90 ℃)下,NaOH溶液对虫蛹脱有机物质(蛋白质)的影响见图 5。由图 5可以看出,温度越高,脱有机物质(蛋白质)的效果越好,当温度为70 ℃时产品的含N量(6.28%)就能达到食品级甲壳素的质量指标(6.2%~6.9%)(蒋挺大, 2003),从能耗角度考虑,以70 ℃浸泡脱有机物质(蛋白质)为宜。
|
图 5 NaOH温度对产品脱有机物质(蛋白质)的影响 Figure 5 The effects of NaOH treatment temperature on removing proteins from the pupae of D. punctatus |
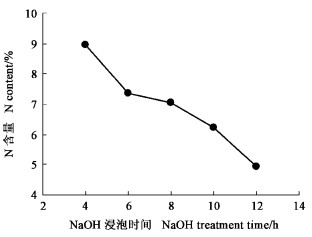
NaOH不同浸泡时间(4、6、8、10和12 h)对虫蛹脱有机物质(蛋白质)的影响见图 6。由图 6可以看出,浸泡时间对脱有机物的影响差异极显著。处理时间越长,脱有机物质(蛋白质)的效果越好。当浸泡时间为10 h时脱有机物质(蛋白质)就能使产品含N量达到食品级甲壳素(6.2%~6.9%)(蒋挺大, 2003)的要求,浸泡时间越长,含N量越低,考虑到时间过长会导致产品的水解,因此NaOH溶液脱有机物质(蛋白质)的浸泡时间以10 h为宜。
|
图 6 NaOH浸泡时间对产品脱有机物质(蛋白质)的影响 Figure 6 The effects of NaOH treatment time on removing proteins from the pupae of D. punctatus |
综上所述,马尾松毛虫蛹中甲壳素的最佳提取工艺为——1)脱矿物质:盐酸质量分数为3%,处理温度为35 ℃,处理时间为20 h;2)脱有机物质(蛋白质):NaOH质量分数为5%,处理温度为70 ℃,处理时间为10 h。在该工艺条件下,对虫蛹中甲壳素进行3次重复提取,结果获得白色片状物甲壳素产品。
在提取的甲壳素中加入1滴0.03%碘-碘化钾溶液和1滴1%H2SO4,在白瓷点滴试样板上显示紫褐色,再加数滴75% H2SO4,发现紫色逐渐消失,表明测试物为甲壳素。
经测定,其水分含量为8.31%,灰分为1.03%,含氮量为6.79%。甲壳素产品的产率为30.72%。产品的质量指标达到食品级甲壳素标准(蒋挺大, 2003)。
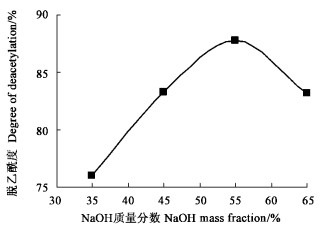
2.2 由甲壳素制备壳聚糖 2.2.1 不同NaOH质量分数对壳聚糖产品脱乙酰度的影响采用不同质量分数的NaOH(35%、45%、55%、65%)对虫蛹甲壳素脱乙酰基进一步制备昆虫壳聚糖进行了研究,结果见图 7。由图中可见,NaOH质量分数对壳聚糖的脱乙酰度有显著影响。当NaOH质量分数在35%~55%范围时,随着质量分数的提高,脱乙酰度显著增加,在55%时,脱乙酰度为87.71%;而当NaOH质量分数高于55%时,脱乙酰度反而降低,这可能与浓碱破坏了甲壳素/壳聚糖的主链结构有关。因此,以下试验中NaOH的处理采用55%。
|
图 7 NaOH质量分数对脱乙酰度的影响 Figure 7 Effects of NaOH mass fraction on the degree of deacetylation |
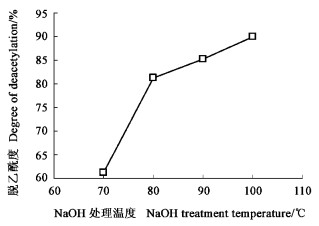
在不同的NaOH处理温度(70、80、90、100 ℃)下,对虫蛹甲壳素脱乙酰基进一步制备昆虫壳聚糖进行了研究,结果见图 8。从图中可以看出,NaOH处理温度对壳聚糖的脱乙酰度也有显著影响。脱乙酰度随着处理温度的升高而升高(100 ℃时,脱乙酰度达90.11%)。结果表明,采用NaOH对甲壳素脱乙酰基需要较高的温度。由于温度的影响很显著,因此,下面的试验温度采用100 ℃。
|
图 8 NaOH处理温度对脱乙酰度的影响 Figure 8 Effects of NaOH treatment temperature on the degree of deacetylation |
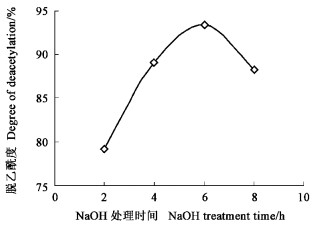
上面的试验结果表明:当NaOH质量分数为55%,处理温度为100 ℃时,壳聚糖产品的脱乙酰度最高。因此,本试验采用上面优化的工艺,并进一步研究不同NaOH处理时间(2、4、6、8 h)对壳聚糖产品脱乙酰度的影响(图 9)。从图可知,NaOH处理时间对壳聚糖产品的脱乙酰度有显著影响。在6 h之内,处理时间越长,产品的脱乙酰度越高;但时间过长,如接近8 h时,脱乙酰度反而降低,这可能是浓碱长时间处理时,破坏了昆虫甲壳素/壳聚糖的主链结构。因此,NaOH处理时间不宜过久,以6 h效果最好。此时壳聚糖产品的脱乙酰度高达93.22%。因此,由虫蛹甲壳素脱乙酰基进一步制备昆虫壳聚糖的最佳工艺为:NaOH质量分数为55%;处理温度为100 ℃;处理时间为6 h。本试验获得的马尾松毛虫蛹中壳聚糖的制备工艺参数与其他昆虫壳聚糖的制备工艺参数并不一致(刘高强, 2005b)。
|
图 9 NaOH处理时间对脱乙酰度的影响 Figure 9 Effects of NaOH treatment time on the degree of deacetylation |
将所得壳聚糖产品溶解于1%乙酸水溶液中,配制成1%含量的壳聚糖溶液,滴加甲基橙指示剂后,指示剂立即由棕黄色转变为橙红色;而且,当滴加几滴甲基红指示剂,指示剂立即由棕黄色转变成深红色,表明所得产品为壳聚糖(蒋挺大, 2003)。
本试验最佳条件下获得的壳聚糖产品为白色片状固体。其水分含量为3.73%,灰分为0.89%,脱乙酰度为93.22%,黏度为22.6 mPa·s。由甲壳素获得壳聚糖产品的产率为86.31%。产品的质量指标达到食品级甲壳素标准(蒋挺大, 2003)。
3 讨论甲壳素和壳聚糖由于其天然无毒和在许多领域的广泛用途(Synowiecki et al., 2003; Tharanathan et al., 2003),已引起许多国家的重视。然而,目前壳聚糖的生产原料来源有限,生产成本较高(Tharanathan et al., 2003;刘高强, 2005b)。昆虫资源量大、生长繁殖快、壳聚糖含量较高。因此,昆虫壳聚糖资源的开发具有较好的市场前景(刘高强, 2005b)。
目前已有蚕蛹、蜣螂、蟋蟀等昆虫中壳聚糖的提取报道(刘高强, 2005b; 王敦等, 2004),但尚未见有关害虫马尾松毛虫蛹中壳聚糖资源开发的信息。
本试验结果发现,马尾松毛虫甲壳素和壳聚糖的制备工艺参数和其他已研究昆虫的参数并不一致。如从蜣螂壳中提取甲壳素时,充分脱去灰分所需要的最适温度是本试验中采用温度的2倍(70 ℃,本试验为35 ℃,两试验所用盐酸的质量分数接近);此外,在由甲壳素制备壳聚糖时(脱乙酰基),蜣螂甲壳素脱乙酰基最适合的温度为130 ℃(较高),本试验为100 ℃;最适NaOH处理质量分数,蜣螂为40%~45%,本试验为55%(较高);最适处理时间,蜣螂为3 h,本试验为6 h(较高);脱色工艺中,适合蜣螂的工艺为KMnO4和草酸分步法/两步法处理;本试验中采用H2O2一步处理。因此,从生产实际来看,二者的工艺各有优缺点。以上结果也表明,不同昆虫的物理质构和化学组成不同,因而其甲壳素和壳聚糖的制备工艺不同;另外,由于甲壳素本身是由2-乙酰氨基-2-脱氧-D-葡萄糖的基本单元构成的高分子化合物,因此,分子量的大小,以及脱乙酰度和黏度的不同,决定了壳聚糖性质的不同,这是甲壳素和壳聚糖具有许多功能和广泛用途的结构基础。因此不同昆虫中甲壳素/壳聚糖的制备虽有类似的基本工艺,但生产特定性状的壳聚糖(如特定分子量大小、脱乙酰度和黏度)的具体工艺仍需要摸索。本文确定的最佳工艺适合制备食品级甲壳素和脱乙酰度为93.22%、黏度为22.6 mPa·s的虫源壳聚糖。
松毛虫是一类林业大害虫,自然资源量较大,如能对其进行开发利用,则可变害为宝。何剑中等(1998a; 1998b)对云南松毛虫和思茅松毛虫的资源化利用进行了研究。笔者近年来对马尾松毛虫资源化利用和资源化管理进行了探讨。目前我们已解决了马毛松毛虫毒素的影响(刘高强等, 2003; 2005a),并对马尾松毛虫中的蛋白质和油脂进行了提取研究(刘高强等, 2006; 杨青, 2008)。本文则在以上研究的基础上进一步对马尾松毛虫蛹中甲壳素的提取及其壳聚糖的制备进行了全面研究。研究结果将为害虫的多维、多途径开发模式提供借鉴,同时也为我们今后进一步研究松毛虫的“资源化综合管理”模式提供理论支撑(刘高强等, 2004)。
4 结论本试验采用经典的酸碱法,研究了从害虫马尾松毛虫蛹中制备食品级甲壳素和壳聚糖的技术。单因素试验结果表明,从虫蛹中提取甲壳素的最佳工艺参数为——1)脱矿物质:盐酸质量分数为3%,处理温度为35 ℃,处理时间为20 h;2)脱有机物质(蛋白质):NaOH质量分数为5%,处理温度为70 ℃,处理时间为10 h;3)脱色:H2O2质量分数为11%,处理时间为2.5 h,处理温度为85 ℃,一步法脱色。由虫蛹甲壳素制备壳聚糖的最佳工艺为:NaOH质量分数为55%,浸泡时间为6 h,浸泡温度为100 ℃。所得壳聚糖产品为白色片状固体,其水分含量为3.73 %,灰分为0.89%,脱乙酰度为93.22%,黏度为22.6 mPa·s。
本研究提出了一种从马尾松毛虫蛹中制备食品级甲壳素,以及制备具有一定特性的虫源壳聚糖(脱乙酰度为93.22%,黏度为22.6 mPa·s)的应用技术。今后需要对不同脱乙酰度和黏度的虫源壳聚糖的制备技术进行深入研究。
陈长琨. 1991. 昆虫生理生化实验. 北京: 中国农业出版社, 4-6.
|
狄升. 1995. 松毛虫综合防治效益分析. 林业经济, (4): 48-54. |
韩剑众, 马茂高, 梁细第. 1991. 森林害虫的蛋白质资源的开发及饲用研究. 饲料工业, 12(5): 34-35. |
何剑中, 卢南. 1998a. 云南松毛虫蛹和成虫化学成分及其比较研究. 林业科学研究, 11(2): 130-134. |
何剑中, 崔永忠, 黄茵, 等. 1998b. 云南松毛虫蛹和蛾蛋白饲料价值的研究. 饲料工业, 19(3): 38-40. |
侯曼玲. 2004. 食品分析. 北京: 化学工业出版社, 1-222.
|
蒋挺大. 2003. 甲壳素. 北京: 化学工业出版社, 1-290.
|
刘高强, 魏美才, 王晓玲. 2003. 松毛虫作为新资源食品的可行性及其前景分析. 中国食品学报, 3(增): 504-507. |
刘高强, 魏美才, 王晓玲. 2004. 松毛虫资源开发及其资源化管理的初步设想. 西北林学院学报, 19(4): 119-123. DOI:10.3969/j.issn.1001-7461.2004.04.034 |
刘高强, 魏美才, 王晓玲. 2005a. 马尾松毛虫幼虫中毒素的提取及其基本性质. 湖南农业大学学报:自然科学版, 31(2): 153-155. |
刘高强, 刘卫星, 魏美才, 等. 2005b. 虫类甲壳素/壳聚糖的研究及其开发前景. 西北林学院学报, 20(4): 143-146. |
刘高强, 魏美才, 王晓玲, 等. 2006. 稀碱法提取昆虫马尾松毛虫幼虫中蛋白质的研究. 食品科技, (5): 57-59. |
刘高强, 刘卫星, 魏美才, 等. 2007. 从害虫马尾松毛虫中提取甲壳素的初步研究. 西北林学院学报, 22(2): 38-41. |
王敦, 胡景江, 刘铭汤. 2004. 从臭蜣螂中提取甲壳素P壳聚糖的研究. 林业科学, 40(5): 180-185. DOI:10.3321/j.issn:1001-7488.2004.05.030 |
魏美才, 刘高强. 2001. 昆虫蛋白质资源的开发与研究进展. 中南林学院学报, 21(2): 86-90. DOI:10.3969/j.issn.1673-923X.2001.02.025 |
吴长青. 2001. 壳聚糖在果汁澄清工艺上的应用. 饮料工业, (43): 9-11. |
杨青. 2008.马尾松毛虫油脂的提取及其多不饱和脂肪酸的富集研究.中南林业科技大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10538-1011063816.htm
|
张亦飞. 1996. 壳聚糖制备工艺改进. 精细化工, 13(4): 50-52. DOI:10.3321/j.issn:1003-5214.1996.04.020 |
詹永乐, 黄春芳, 陈复生. 2001. 家蚕蛹皮制取壳聚糖的最佳工艺条件. 化学通报, (7): 450-453. DOI:10.3969/j.issn.0441-3776.2001.07.015 |
Bukkens S G F. 1997. The nutritional value of edible insects. Ecology of Food and Nutrition, 36: 287-319. DOI:10.1080/03670244.1997.9991521 |
Gades M D, Stern J S. 2005. Chitosan supplementation and fat absorption in men and women. Journal of the American Dietetic Association, 105: 72-77. DOI:10.1016/j.jada.2004.10.004 |
Kartal S N, Imamura Y. 2005. Removal of copper, chromium, and arsenic from CCA-treated wood onto chitin and chitosan. Bioresource Technology, 96: 389-392. DOI:10.1016/j.biortech.2004.03.004 |
Liu G Q, Zhang K C, Wang X L. 2003. Advances in insects as food resources in China//The 5th International Conference on Food Science & Technology Proceedings (Volume Ⅱ), Beijing: Chinese Books Press, 263-266.
|
Masuoka K, Ishihara M, Asazuma T, et al. 2005. The interaction of chitosan with fibroblast growth factor-2 and its protection from inactivation. Biomaterials, 26: 3277-3284. DOI:10.1016/j.biomaterials.2004.07.061 |
Synowiecki J, Al-Khateeb N A. 2003. Production, properties, and some new applications of chitin and its derivatives. Critical Review in Food Science and Nutrition, 43(2): 145-171. DOI:10.1080/10408690390826473 |
Tharanathan R N, Kittur F S. 2003. Chitin-The undisputed biomolecule of great potential. Critical Review in Food Science and Nutrition, 43(1): 61-87. DOI:10.1080/10408690390826455 |
 2008, Vol. 44
2008, Vol. 44