文章信息
- 侯建华, 高宝嘉, 董建新, 高立杰, 刘颖华, 李兰会.
- Hou Jianhua, Gao Baojia, Dong Jianxin, Gao Lijie, Liu Yinghua, Li Lanhui.
- 内蒙古高原东南缘森林-草原交错带节肢动物群落多样性特征
- Community Diversity of Arthropod in Forest-Steppe Ecotone in Southeast Edge of Inner Mongolia Tableland
- 林业科学, 2008, 44(3): 94-101.
- Scientia Silvae Sinicae, 2008, 44(3): 94-101.
-
文章历史
- 收稿日期:2006-12-21
-
作者相关文章
2. 承德民族师范学院 承德 067000
2. Chengde Teachers Colloge for Nationalities Chengde 067000
生态交错带(ecotone)是特定尺度下生态实体(群落、生态系统、景观等)之间的过渡地带(Odum, 1983;Turner et al., 1991;Dicastri et al., 1992;Forman et al., 1992;Hansen, 1992),而空间尺度(spatial scale)是指所研究生态实体的面积大小, 它在植被格局层面上可分为小尺度(<1 km2)、中尺度(1~100 km2)、大尺度(100~100万km2)和超大尺度(>100万km2)4个尺度(肖笃宁等,1997)。生态交错带往往因边缘效应而成为生物多样性富集区(Terborgh, 1971;Gate et al., 1978;Odum, 1983;Harris, 1988;牛文元,1990;Dicastri et al., 1992;Hansen, 1992;Swanson, 1992)。目前,国际上对生态交错带特别关注,认为生态交错带是全球变化的最敏感地区(Dicastri et al., 1992;Gosz, 1992;Hansen, 1992;Lubchenco, 1992;Neilson, 1992),对群落交错区的研究是人类进行早期生态预警和生态管理理论探索与实践的核心问题(孙濡泳, 2001)。
森林-草原交错带作为一种典型的生态交错带而成为当前生态研究和保护的热点(Saunders et al., 1991;Niemela et al., 1993;Davies et al., 1998;Heliola et al., 2001;Magura, 2002);然而,与其他生物类群相比,对森林-草原交错带节肢动物群落的研究还不系统,仍然处在数据积累阶段(Didham et al., 1996)。节肢动物是生态系统中最为庞大的动物类群,由于它们对生境变化高度敏感,某些节肢动物已成为监测环境和生物多样性变化的指示类群(Eyre et al., 1996;Lovei et al., 1996;Bohac,1999),因此,研究交错带节肢动物群落多样性特征对理解交错带及其边缘效应十分重要(Haila et al., 1994)。通过比较交错带与森林、草原内部的节肢动物组成和数量差异,就能了解节肢动物群落的空间分布特征,并判断边缘效应对节肢动物空间分布的影响。从目前研究看,处于森林边缘的森林-草原交错带由于边缘效应而使物种多样性得到提高,但这些结论集中来自于对中小尺度的林分边缘和群落交错区的研究(Holland et al., 1991;Duchesne et al., 1999;Kotze et al., 1999;Heliola et al., 2001;Magura, 2002;于晓东等,2006),而对大尺度森林-草原交错带研究很少(牛文元,1990;Dicastri et al., 1992)。
内蒙古高原东南缘森林-草原交错带位于河北省北部与内蒙古东部的接壤处(116°32′—117°33′ E,42°10′—43°18′ N),属内蒙古高原东南缘与大兴安岭和冀北山地的交汇地带(王建中,1984),在约2万km2的范围内,植被呈森林和草原镶嵌排列,呈典型的大尺度森林破碎化格局, 为研究大尺度生态交错带提供了理想的环境。根据该地区生物群区(biome)的特点和景观特征,可将该地区划分为森林带、交错带(森林-草甸区、草甸-草原区)和草原带4个植被地带(王庆锁等,2000;王庆锁,2004;黄永梅等,2001)。本研究以植被生态梯度为主线,通过比较以上4个植被地带的节肢动物群落组成、物种和个体数量、多样性和均匀度、优势集中度以及天敌类群的组成,来探讨大尺度生态交错带节肢动物群落的地带性分布和变化规律,以及边远效应对该地区节肢动物群落多样性的影响,以为进一步深入研究森林-草原交错带生物、环境现状和生物多样性的关系以及该生态类型条件下复杂生态系统内部的自我调节、相互协调的能力提供资料。
1 材料与方法 1.1 研究样地研究地区位于河北省围场县三乡,经母子沟、塞罕坝、军马场、元宝山、蔡木山至内蒙古达里诺尔一线,面积约200 km×50 km=1万km2,海拔1 100~1 900 m。其中,以坝缘山地为界,坝下为森林带,坝上依次为交错带(森林-草甸区、草甸-草原区)和草原带。
森林带:森林覆盖率为65%,面积约2 500 km2(50 km×50 km),典型的植物群落为华北落叶松(Larix principis-rupprechtii)林、樟子松(Pinus sylvestris var. mongolica)林、桦木(Betula spp.)林和落叶松-桦木-山杨(Populus davidiana)混交林;林下灌木较少,主要是忍冬(Lonicera sp.)、榛(Corylus spp.)等;草本植物主要有龙牙草(Agrimonia pilosa)、委陵菜(Potentilla sp.)等。
森林草甸区:森林覆盖率为33%,面积约2 500 km2(50 km×50 km),典型的植物群落为落叶松林、樟子松林、桦木林和落叶松-桦木-山杨混交林;林下灌木稀少,主要是绣线菊(Spiraea spp.)、山荆子(Malus baccata)等;草本植物主要有羊草、针茅、细叶苔草(Carex rigescens)、蒿(Artemisia spp.)等。
草甸草原区:森林覆盖率为5%,面积约2 500 km2(50 km×50 km),典型的植物群落为落叶松林和樟子松林;林下灌木稀少,主要是绣线菊、山荆子等;草本植物主要有羊草、针茅、细叶苔草、蒿等。
草原带:面积约2 500 km2(50 km×50 km),典型的植物群落为针茅(Stipa spp.)-羊草(Leymus chinensis)草原。
根据Meiners等(1999)及Heliola等(2001)研究边缘效应的建议,以距离梯度形式研究以上4个不同植被地带的差异。在设计调查样带时,笔者根据该地区植被地带的特点,利用当地地形林相图(1:2.5万),以交错带为中心,在交错带的森林草甸区和草甸草原区沿植被梯度变化的方向,分别每隔10 km等距离设置4条平行的调查样带(样带长10 km,每个样带均覆盖所在植被地带内的全部的典型植物群落类型);同时,由交错带向两侧的森林带和草原带各延伸40 km,以每隔10 km的距离设置同样的调查样带。这样每个植被地带包括4个调查样带, 共计16个样带。
1.2 调查方法样带调查时,采用人工网捕法(捕虫网直径0.4 m,柄长1.5 m)调查林间、地表植被上的节肢动物,即对样带内不同的植物群落分别由边缘至中心上下左右随机扫网100个来回,统计网内收集到的节肢动物的种类和数量;并在该植物群落边缘至中心等距离设置5个1 m×1 m小样方,采集小样方内枯枝落叶及地表上的所有节肢动物,然后统计其种类和数量。森林带和森林-草甸区每条样带扫网400[4(植物群落类型)×100]个来回,小样方设20个[4 (植物群落类型)×5];为便于比较,草甸-草原区和草原带每条样带亦扫网400个来回和设置20个小样方。将每条样带网捕和小样方采集到的标本数据汇总并作为统计分析的依据。
调查顺序按森林带-森林草甸区-草甸草原区-草原带进行:分别于2006年5月25日—6月10日、6月25日—7月10日、7月28日—8月14日和9月14日—9月28日,对不同植被地带中的样带进行4轮循环调查,每个样带重复4次,共计16(样带)×4(次)=64次重复。定位工具为GPS(GARMIN-Venture),交通工具为BJ2020S吉普车。
为了研究大尺度环境因子对节肢动物分布的影响,作者利用当地地形林相图(1:2.5万),以样带为轴心,统计每条样带所在区域范围(10 km×10 km)的森林覆盖率、森林斑块数和森林斑块平均面积。
1.3 分析方法用单因素方差分析法比较不同植被地带节肢动物个体数和物种数,天敌类群的个体数和物种数;同时,计算天敌类群的比例,天敌类群包括捕食性种类、寄生性种类和蜘蛛。
不同植被地带节肢动物群落的相似性采用Jaccard指数(CJ)(马克平等,1995):CJ=j/(a+b-j),式中:j为2个群落的共有种数,a和b分别为群落A和群落B的物种数。
群落多样性特征值指数:Shannon-Wiener多样性指数(H′)(马克平,1994):H′=-∑PilnPi,式中:Pi是群落中第i个物种的个体数(Ni)与所有物种个体总数(N)的比值。
Pielou均匀度指数(J)(马克平等,1994):J=H′/lnS,式中:S为群落中的物种数。
Simposon优势集中度指数(C)(Simposon,1949):C =∑(Ni/N)2,式中:Ni是群落中第i个物种的个体数,N是所有物种个体总数。
环境因子分析:采用多元线性回归分析检验节肢动物个体数、物种数、多样性、均匀度和优势集中度与环境因子的之间的关系。
统计分析均采用SPSS12.0数据处理软件进行。
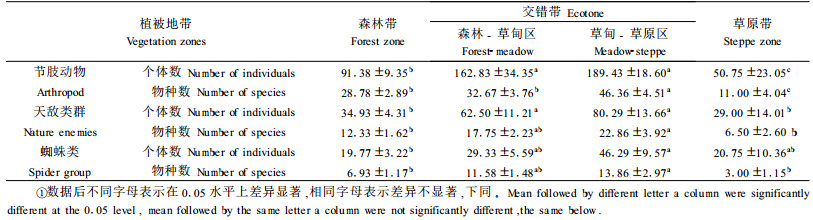
3 结果与分析 3.1 节肢动物群落组成共采集到节肢动物标本8 316号,分属于昆虫纲、蛛形纲和多足纲,共计15目77科326种。其中,蜘蛛目、双翅目、同翅目、膜翅目4目个体数量居多,均占个体总数的10%以上,合计占该地区节肢动物个体总数的67.09%,为该地区的优势类群。半翅目、弹尾目、鞘翅目、鳞翅目、直翅目和脉翅目6目的个体数量在1%~10%之间,为该地区的常见类群。蜱螨目、地蜈蚣目、蜉游目、长翅目、革翅目5目的个体数量均少于1%,为该地区的不常见类群(表 1)。
|
|
节肢动物的个体数和物种数在森林带、森林草甸区、草甸草原区和草原带4个植被地带之间有极显著差异(个体数:df=3, F=8.208, P<0.001;物种数: df=3, F=6.857, P<0.001)。从森林带到草原带节肢动物的个体数和物种数逐渐增多,至草甸-草原区达到最大,到草原带降至最低,呈现为草甸-草原区>森林-草甸区>森林带>草原带的变化趋势。其中,交错带森林-草甸区、草甸-草原区的个体数和物种数均显著高于两侧比邻的森林带和草原带(森林-草甸区物种数高于森林带,但没达到显著差异)(表 2)。
|
|
天敌类群的个体数和物种数在4个植被地带之间亦有极著异差显(个体数:df=3, F=6.286, P=0.001;物种数: df=3, F=6.857, P=0.006),亦呈现出草甸-草原区>森林-草甸区>森林带>草原带的变化趋势。其中,草甸-草原区具有最高的天敌个体数和物种数,交错带森林-草甸区、草甸-草原区天敌个体数和物种数均显著高于两侧比邻的森林带和草原带(森林-草甸区物种数高于森林带,但没达到显著差异)。
蜘蛛类是该地区天敌类群中的一个重要类群,它的个体数和物种数在4个植被地带之间亦有显著差显(个体数:df=3, F=4.169, P=0.010;物种数: df=3, F=4.085, P=0.011),其物种数亦呈现为草甸-草原区>森林-草甸区>森林带>草原带的变化趋势,个体数呈现为草甸-草原区>森林-草甸区>草原带>森林带的变化趋势。其中,草甸-草原区具有最高的蜘蛛个体数和物种数,交错带森林-草甸区、草甸-草原区蜘蛛个体数和物种数虽高于两侧比邻的森林带和草原带,但多没达到显著差异,仅草甸-草原区的物种数显著高于草原带。
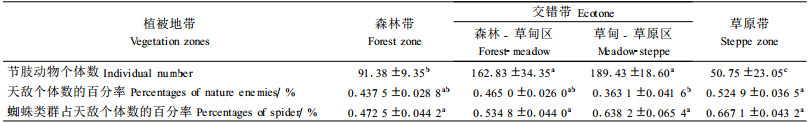
不同植被地带的节肢动物个体数和天敌个体数、蜘蛛个体数的比例关系列于表 3。由表 3可见,不同植被地带天敌个体数百分率为(0.363 1±0.041 6)%~(0.524 9±0.036 5)%,其中,蜘蛛占到天敌个体数的百分率为(0.472 5±0.044 2)%~(0.667 1±0.043 2)%。天敌个体数百分率和蜘蛛占天敌个体百分率在4个植被地带间无显著性差异(df=3, F=2.166, P=0.099;df=3, F=2.101, P=0.107),仅草原带天敌个体数百分率显著高于草甸-草原区。
|
|
节肢动物群落的物种多样性、均匀度和优势集中度在4个植被地带之间有极显著差异(H′:df=3, F=342.438, P<0.001;J:df=3, F=16.198, P<0.001;C:df=3, F=21.238, P<0.001),物种多样性和均匀度呈现出森林-草甸区>草甸-草原区>森林带>草原带的变化趋势,优势集中度呈现出草甸-草原区>森林-草甸区>草原带>森林带的变化趋势。其中,森林-草甸区具有最高的物种多样性和均匀度,草原带最低。交错带森林-草甸区、草甸-草原区的物种多样性、均匀度和优势集中度均显著高于两侧比邻的森林带和草原带。在交错带内部,虽然草甸-草原区具有最高的节肢动物个体数和物种数,但因具有较低的均匀度和最高的优势集中度,而表现为低于森林-草甸区的物种多样性,且达到显著水平(表 4)。
|
|
从不同植被地带间节肢动物群落的相似性比较结果(表 5)可以看出,不同植被地带间节肢动物群落的相似性均较低(CJ≤0.406 3),表明不同植被地带间节肢动物的群落组成差异很大。森林带与森林-草甸区、草甸-草原区和草原带的相似性逐级减小,这说明随着环境梯度的变化,交错带、草原带节肢动物群落组成已与森林带发生明显分化,且分化越来越大;在交错带内部,2个区相似性亦较小,表明2个区的群落组成亦有显著分化;2个区与两侧比邻的森林带、草原带的相似性均较低。
|
|
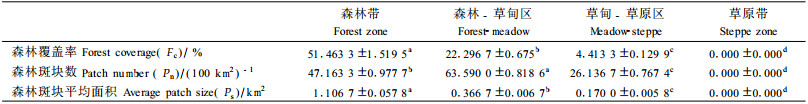
不同植被地带环境因子差异较大,在森林覆盖率(df=3, F=608.197, P<0.001)、每百平方公里森林斑块数(df=3, F=477.413, P<0.001)、森林斑块平均面积(df=3, F=213.841, P<0.001)等方面有极显著差异(表 6)。
|
|
对节肢动物个体数、物种数、多样性、均匀度、优势集中度以及天敌类群、蜘蛛类的个体数和物种数与这3种环境变量进行多元回归检验(表 7),发现森林斑块数、森林斑块平均面积和森林覆盖率是个体数(r2=0.792,F=15.277,P<0.001)、物种数(r2=0.794,F=15.456,P<0.001)和优势集中度(C)(r2=0.790,F=15.046,P<0.001)的决定因素;而森林斑块数和森林覆盖率是多样性(H′)(r2=0.982,F=357.255,P<0.001)和均匀度(J)(r2=0.802,F=26.348,P<0.001)的决定因素。
|
|
对天敌类群和蜘蛛类的个体数和物种数与这3种环境变量进行多元回归检验,同样可以看出,天敌类群个体数(r2=0.732,F=10.907,P=0.001)、物种数(r2=0.718,F=10.190,P=0.001)和蜘蛛类个体数(r2=0.606,F=6.076,P=0.009)、物种数(r2=0.603,F=6.082,P=0.009)亦是由这3种环境因素决定的。
4 结论与讨论内蒙古高原东南缘森林-草原交错带节肢动物群落由15个目的动物组成,其中蜘蛛目、双翅目、同翅目、膜翅目为该地区的优势类群,半翅目、弹尾目、鞘翅目、鳞翅目、直翅目和脉翅目为该地区的常见类群。
由森林向草原过渡的过程中,节肢动物的个体数、物种数、物种多样性和均匀度随环境梯度变化而呈现出明显的梯度变化。交错带具有最高的节肢动物个体数、物种数和物种多样性,且显著高于两侧的森林带和草原带,这表明大尺度森林草原交错带具有显著的边缘效应,这与中小尺度森林草原交错带的研究结果(Lenski, 1982;Niemela et al., 1988; 1993;Haila et al., 1994;Duchesne et al., 1999;Heliola et al., 2001;Magura et al., 2001;Molnár et al., 2001;Magura, 2002)相一致。然而在不同生境间的相似性方面,本研究与以往中小尺度的研究结果有很大差异,以往研究表明,交错带往往与两侧的森林带、草原带均具有较高的相似性(Kotze et al., 1999;Helila et al., 2001;Magura et al., 2001;Molnár et al., 2001;Magura, 2002;于晓东等,2006),而本研究结果表明,交错带与森林带、草原带的相似性均较低,这与中小尺度交错带有较多的物种可以通过扩散作用来源于周围生境(Kotze et al., 1999;Heliola et al., 2001;Magura et al., 2001;Molnár et al., 2001;Magura, 2002),而大尺度交错带则可能由于大尺度的空间因素阻碍了这种扩散作用有关。
交错带的边缘效应可能与交错带生境特点以及干扰水平密切相关。从生境特点来看,森林带、交错带和草原带在3个大尺度环境因子上都存在显著差异(表 8),由森林带、交错带到草原带森林覆盖率、森林斑块平均面积逐步降低,而森林斑块数则在交错带达到最高。通过多元回归检验证实:物种多样性、均匀度与森林斑块数和森林覆盖率密切相关,且与森林斑块数呈显著正相关关系(t=24.133, P<0.001;t=3.735, P<0.001),与森林覆盖率呈显著负相关关系(t=-7.424, P<0.001;t=-2.446, P=0.029),由此导致了交错带物种多样性和均匀度的升高。而节肢动物个体数、物种数与森林斑块数、森林斑块平均面积和森林覆盖率密切相关,其中与森林斑块数(t=6.688, P<0.001;t=6.550, P<0.001)、森林斑块面积(t=3.415, P=0.005;t=5.240, P<0.001)呈显著正相关关系,而与森林覆盖率呈显著负相关关系(t=-4.146, P=0.001;t=-5.587, P<0.001),其综合结果导致了交错带个体数和物种数的升高。另外,从干扰水平上看,内蒙古高原东南缘森林-草原交错带呈典型的大尺度森林破碎化格局,属于中度干扰形成的景观格局(肖笃宁等,1997),因此,本研究支持了中度干扰提高物种多样性的假设(Levin et al., 1974)。
环境特征的复杂性与昆虫的多样性密切相关,决定了陆生节肢动物的丰度和多样性(Murdoch et al., 1972;Southwood et al., 1979)。以往研究多从中小尺度的林冠层、灌木层、草本层或枯落物层等方面去探讨节肢动物与环境的相关性,但由于这些环境因子在决定物种数、个体数、多样性、均匀度方面所起的作用存在较大差异,因此,在用环境变量解释节肢动物的物种数、个体数、多样性和均匀度等方面并不一致(Rieske et al., 2001),而本研究在用大尺度空间的环境变量解释节肢动物群落特征时却取得了较高的一致性,即物种多样性、均匀度均与森林斑块数和森林覆盖率密切相关,而个体数、物种数(无论全部节肢动物,还是天敌类群或蜘蛛)均与森林斑块数、森林斑块平均面积和森林覆盖率密切相关。
以上结果表明,由森林向草原过渡过程中,大尺度森林-草原交错带已经显著改变了森林节肢动物群落的组成,因此,大尺度森林破碎化格局可以明显改变节肢动物群落特征。
此外,该地区不同植被地带天敌个体数百分率达到(0.363 1±0.041 6)%~(0.524 9±0.036 5)%,天敌物种在维护森林-草原交错带生态系统平衡中起着重要的作用。随着天敌个体数量的增加,可有效控制有害种类的种群密度,减少害虫的发生与危害。因此,建议当地主管部门应减少用飞机进行大面积化学防治的频次,以保护天敌,充分发挥群落内部的自我调控能力,维护生态平衡。
黄永梅, 刘鸿雁, 崔海亭. 2001. 内蒙古高原东南缘森林草原过渡带景观的若干特征. 植物生态学报, 25(3): 257-264. DOI:10.3321/j.issn:1005-264X.2001.03.001 |
马克平, 刘灿然, 刘玉明. 1995. 生物群落多样性的测度方法Ⅱ. β多样性的测度方法. 生物多样性, 3(1): 38-43. DOI:10.3321/j.issn:1005-0094.1995.01.007 |
马克平, 刘玉明. 1994. 生物群落多样性的侧度方法Ⅰ.α多样性的测度方法(下). 生物多样性, 2(4): 231-239. DOI:10.3321/j.issn:1005-0094.1994.04.009 |
牛文元.1990.生态环境脆弱带(Ecotone)的基础判定.现代生态学透视.北京: 科学出版社, 46-53.
|
孙儒泳. 2001. 动物生态学原理. 3版. 北京: 北京师范大学出版社.
|
王建中.1984.塞罕坝森林草原交错带植物区系组成及多样性研究//铁铮.林业科学家论丛.北京: 中国林业出版社.
|
王庆锁, 冯宗炜, 罗菊春. 2000. 河北北部、内蒙古东部森林-草原交错带生物多样性研究. 植物生态学报, 24(2): 141-146. DOI:10.3321/j.issn:1005-264X.2000.02.003 |
王庆锁. 2004. 河北北部、内蒙古东部森林-草原交错带森林景观格局初步研究. 生态学杂志, 23(3): 11-15. DOI:10.3321/j.issn:1000-4890.2004.03.003 |
肖笃宁, 布仁仓, 李秀珍. 1997. 生态空间理论与景观异质性. 生态学报, 17(5): 453-461. DOI:10.3321/j.issn:1000-0933.1997.05.001 |
于晓东, 罗天宏, 周红章, 等. 2006. 边缘效应对卧龙自然保护区森林-草地群落交错带地表甲虫多样性的影响. 昆虫学报, 49(2): 277-286. DOI:10.3321/j.issn:0454-6296.2006.02.018 |
Bohac J. 1999. Staphylinid beetles as bioindicators. Agric Ecosyst Environ, 74: 357-372. DOI:10.1016/S0167-8809(99)00043-2 |
Davies K, Margules C R. 1998. Effects of habitat fragmentation on carabid beetles: experimental evidence. J Anim Ecol, 67: 460-471. DOI:10.1046/j.1365-2656.1998.00210.x |
Dicastri F, Hansen, A J. 1992.The environment and development crises as determinants of landscape dynamics//Hansen A J, Dicastri F. Landscape Boundarie.New York: Springer-Verlag, 3-18 https://link.springer.com/chapter/10.1007%2F978-1-4612-2804-2_1
|
Didham R K, Ghazoul J, Stork N E, et al. 1996. Insects in fragmented forests: a functional approach. Tree, 11: 255-260. |
Duchesne L C, Lautenschlager R A, Bell F W. 1999. Effects of clear-cutting and plant competition control methods on carabid (Coleoptera:Carabidae) assemblages in Northwestern Ontario. Environ Monit Assess, 56: 87-96. DOI:10.1023/A:1005963508085 |
Eyre M D, Lott D A, Garside A. 1996. Assessing the potential for environmental monitoring using ground beetles (Coleoptera: Carabidae) with riverside and Scottish data. Ann Zool Fennici, 33: 157-163. |
Forman R T T, Moore P V.1992.The theoretical functions for understanding boundaries in landscape mosaics//Hansen A J, Dicastri F.Landscape Boundaries.New York: Springer-Verlag, 236-258. https://link.springer.com/chapter/10.1007%2F978-1-4612-2804-2_11
|
Gate J E, Gysel L V J. 1978. Avain nest dispersionand fledging success in field-forest ecotones. Ecology, 59(5): 871-881. DOI:10.2307/1938540 |
Gosz J R. 1992.Ecological functions in a biome transition zone; translating local responses to broad-scale dynamics//Hansen A J, Dicastri F. Landscape Boundaries. New York: Springer-Verlag, 56-74. https://link.springer.com/chapter/10.1007/978-1-4612-2804-2_3
|
Haila Y, Hanski I K, Niemela J, et al. 1994. Forestry and boreal fauna: matching management with natural forest dynamics. Ann Zool Fennici, 30: 17-30. |
Hansen A J. 1992.Epilogue: biodiversity and ecological flows across ecotones//Hansen A J, Dicastri F. Landscape Boundaries. New York: Springer-Verlag, 424-438. https://link.springer.com/chapter/10.1007/978-1-4612-2804-2_22
|
Harris L D. 1988. Edge effects and conservation of biotic diversity. Conseru Biol, 2(4): 330-332. DOI:10.1111/cbi.1988.2.issue-4 |
Heliola J, Koivula M, Niemela J. 2001. Distribution of carabid beetle(Celeoptera, Carabidae) across a boreal forest-clearcut ectone. Conserv Biol, 15: 370-377. DOI:10.1046/j.1523-1739.2001.015002370.x |
Holland M M, Risser P G, Naiman R J. 1991.Ecotones. The role of landscape boundaries in the management and restoration of changing environments. London: Chapman & Hall, 1-142.
|
Kotze D J, Samways M J. 1999. Invertebrate conservation at the interface between the grassland matrix and natural afromontane forest fragments. Biodivers Conserv, 8: 1339-1363. DOI:10.1023/A:1008945302029 |
Lenski R E. 1982. The impact of forest cutting on the diversity of ground beetles (Coleoptera: Carabidae) in southern Appalachians. Ecol Entomol, 7: 385-390. DOI:10.1111/j.1365-2311.1982.tb00680.x |
Levin S A, Paine R T. 1974. Disturbance, patch formation, and community structure. Proc Nat Acad Sci, 71: 2744-2747. DOI:10.1073/pnas.71.7.2744 |
Lovei G L, Sunderland K D. 1996. Ecology and behavior of ground beetles (Coleoptera: Carabidae). Ann Rev Entomol, 41: 231-256. DOI:10.1146/annurev.en.41.010196.001311 |
Lubchenco J. 1992. The sustainable biosphere initiative:an ecological research agenda-a report from the Ecological Society of American. Ecology, 72(2): 371-412. |
Magura T. 2002. Carabids and forest edge:spatial pattern and edge effect. Forest Ecol Manage, 157: 23-37. DOI:10.1016/S0378-1127(00)00654-X |
Magura T, Tóthmérész B, Molnár T. 2001. Forest edge and diversity: carabids along fores-grassland transects. Biodivers Conserv, 10: 287-300. DOI:10.1023/A:1008967230493 |
Meiners S J, Pickett S T A. 1999. Changes in community and population responses across a forest-field gradient. Ecography, 22: 261-267. DOI:10.1111/ecog.1999.22.issue-3 |
Molnár T, Magura T, Tóthmérész B, et al. 2001. Ground beetles (Carabidae) and edge effect in oak-hornbeam forest-grassland transects. Eur J Soil Biol, 37: 297-300. DOI:10.1016/S1164-5563(01)01103-7 |
Murdoch W W, Evans F C, Peterson C H. 1972. Diversity and pattern in plants and insects. Ecology, 53: 819-829. DOI:10.2307/1934297 |
Neilson R P.1992.Regional and local vegetation patterns: The responses of vegetation diversity to subcontinental air mass//Hansen A J, Dicastri F. Landscape Boundaries. New York: Springer-Verlag, 129-149. https://link.springer.com/chapter/10.1007/978-1-4612-2804-2_6
|
Niemela J, Haila Y, Halme E, et al. 1988. The distribution of carabid beetles in fragments of old coniferous taiga and adjacent managed forest. Ann Zool Fennici, 25: 107-119. |
Niemela J, Langor D, Spence J R. 1993. Effects of clear-cut harvesting on boreal ground-beetle assemblages (Coleoptera: Carabidae) in western Canada. Conserv Biol, 7: 551-561. DOI:10.1046/j.1523-1739.1993.07030551.x |
Odum E P. 1983. Basic ecology. Saunders College Publishing, 429-437.
|
Rieske L K, Buss L J. 2001. Influence of site on diversity and abundance of ground-and litter-dwelling Coleoptera in Appalachian oak-hickory forests. Environ Entomol, 30: 484-494. DOI:10.1603/0046-225X-30.3.484 |
Saunders D A, Hobbs R J, Margules C R. 1991. Biological consequences of ecosystem fragmentation:a review. Conserv Biol, 5: 18-22. DOI:10.1111/cbi.1991.5.issue-1 |
Simposon E H. 1949. Measurement of diversity. Nature, 163: 688. DOI:10.1038/163688a0 |
Southwood T R E, Brown V K, Reader P M. 1979. The relationships of plant and insect diversities in succession. Biol J Linn Soc, 12: 327-348. DOI:10.1111/bij.1979.12.issue-4 |
Swanson F J. 1992.Landform, disturbance and ecotones//Hansen A J, Dicastri F. Land-scape Boundaries. New York: Springer-Verlag, 304-323.
|
Terborgh J. 1971. Distribution on environmental gradients:theory and a preliminary interpretation of distributional pattern in the avifauna of the Cordiliera Vilcahamba, Peru. Ecology, 52(1): 23-39. DOI:10.2307/1934735 |
Turner M G, Gardner R H. 1991. Quantitative methods in landscape ecology. New York: Spring-Verlag, 216-218.
|
 2008, Vol. 44
2008, Vol. 44