文章信息
- 胡冬南, 陈晓阳, 李伟, 骈瑞琦, 赵杨.
- Hu Dongnan, Chen Xiaoyang, Li Wei, Pian Ruiqi, Zhao Yang.
- 农杆菌介导BADH基因转化美丽胡枝子的研究
- Transformation of Lespedeza formosa with BADH Gene Mediated by Agrobacterium tumefaciens
- 林业科学, 2008, 44(3): 76-80.
- Scientia Silvae Sinicae, 2008, 44(3): 76-80.
-
文章历史
- 收稿日期:2007-01-25
-
作者相关文章
2. 北京林业大学林木花卉遗传育种教育部重点实验室 北京 100083;
3. 贵州大学林学院 贵阳 550025
2. Key Laboratory of Genetics and Breeding in Forest Trees and Ornamental Plants, Ministry of Education Beijing Forestry University Beijing 100083;
3. Forestry College of Guizhou University Guiyang 550025
豆科(Leguminosae)胡枝子属(Lespedeza)植物约有100种,我国约有60余种,广泛分布于我国东北地区及内蒙古、山东、山西、河南、湖北及陕西等省区(孙秀殿等,1999)。胡枝子具有许多优良特性,在多方面为人们所利用,如水土保持和改良土壤、青饲料和干饲料源、绿肥和薪炭材等,有的胡枝子还具有药用功能。但是,多数胡枝子耐盐性不强,如果将其进行改良,使其能在盐渍地上生长,则一方面可扩大胡枝子的栽培利用面积,另一方面又可起到改良盐渍地和利用盐渍地的目的。
甜菜碱是植物抗盐过程中一种重要的渗透调节物质,而甜菜碱醛脱氢酶基因(BADH)又是调控甜菜碱合成的一个关键基因。众多试验已证明,植物中导入BADH基因,其耐盐性能得到明显提高(刘凤华等,1997;Kishitani et al., 2000;陈传芳等,2004;刘永军等,2005;付光明等,2006;邹维华等,2006)。本研究把BADH基因导入到胡枝子体内,以期获得耐盐性有所提高的胡枝子新品种。
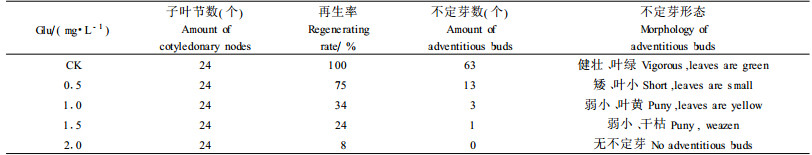
1 材料与方法 1.1 材料植物材料为引自美国密西西比州的美丽胡枝子(Lespedeza formosa),根癌农杆菌(Agrobacterium tumefaciens)菌株为LBA4404,所带质粒为pBIBADHbar,该质粒抗性标记基因为卡那霉素基因(Kan),T-DNA区含35S启动子、目的基因BADH、植物抗性筛选标记基因bar(图 1)。
|
图 1 质粒pBIBADHbar的结构 Figure 1 Diagram of plant expression vector pBIBADHbar |
分化培养基:MS+6-BA 0.5 mg·L-1+2, 4-D 1.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖3%;
增殖培养基:MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖3%。
培养基经高压灭菌,待其温度降至45 ℃以下但未凝固之前加入抗生素或草丁膦(Glu),充分摇匀后分装,冷凝后待用。
1.3 方法 1.3.1 外植体的获得本试验之前,以茎段、叶片和子叶节3种材料为外植体进行了离体再生试验,结果发现只有子叶节能高效再生,茎段和叶片很难分化出不定芽。因此,遗传转化时选用了无菌实生苗的子叶节作为外植体。无菌条件下将美丽胡枝子种子接种于MS基本培养基上,苗龄约5 d时取其子叶节(去除上胚轴,保留0.5 cm下胚轴),沿胚轴纵切成两半,供进一步试验用。
1.3.2 草丁膦敏感性试验将外植体置于添加不同浓度草丁膦(0.5,1.0,1.5,2.0 mg·L-1)的分化培养基上,观察草丁膦对外植体生长情况和诱导不定芽的影响。
1.3.3 农杆菌的活化及转化挑取单菌落,于含50 mg·L-1Kan的YEB液体培养基中28 ℃振荡培养过夜,次日取1.0 mL菌液加至40 mL新鲜液体YEB培养基中(不含抗生素),28 ℃继续振荡培养致OD600约为0.8。将预培养1 d的美丽胡枝子子叶节(沿胚轴纵切)浸入菌液,再用无菌滤纸稍微吸干菌液,共培养后进行脱菌培养和选择培养。
1.3.4 影响转化效果的因素研究以影响转化效果的因素为变量,设置不同处理,各处理均设5次重复,每重复10个子叶节,转化30 d后统计抗性芽数量,计算转化率,转化率=抗性芽数/子叶节数。主要因素为:侵染时间(10、20、30 min)、共培养时间(2、3、4 d)、延迟选择时间(0、2、4、6、8 d)。
1.3.5 转化植株的检测1) 分子检测 采用CTAB法提取植株总DNA,对其进行PCR和PCR-Southern检测及Southern-blot分析,检测分析时参照《植物基因工程》(王关林等,2002)中的方法进行,杂交时使用的标记为地高辛。2) NaCl胁迫下转基因植株甜菜碱含量分析 将转基因美丽胡枝子和对照同期分别接入含有6 mg·L-1NaCl的生长培养基中,在第6、12、18天时分别取样,采用高效液相色谱法测定其甜菜碱含量。
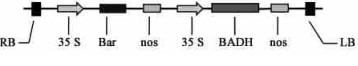
2 结果与分析 2.1 草丁膦对子叶节不定芽分化的影响草丁膦(Glu)作为选择剂,在子叶节与农杆菌共培养2~3 d,即侵染之后才使用,故该试验中的子叶节均经过了3 d的预培养。从表 1 Glu处理的结果可看出,美丽胡枝子对Glu非常敏感,在试验浓度范围内所有含Glu的培养基对其子叶节不定芽的诱导均有抑制作用,随浓度的提高,子叶节的分化频率逐渐降低,分化的不定芽数量也渐少,当Glu浓度大于或等于1.0 mg·L-1时,子叶节的分化率明显降低,大于1 cm芽数量也明显减少,且芽弱小色黄。所以在用Glu作为选择剂筛选转化植株时,其临界浓度定为1.0 mg·L-1。
|
|
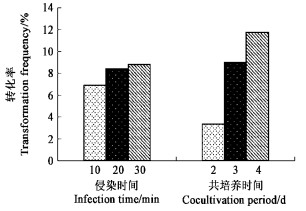
农杆菌侵染外植体需要一个时间过程,如果浸泡时间太短,则共培养过程中无农杆菌生长,无法转化,而浸泡时间太长,外植体又会因农杆菌毒害缺氧而软腐。从本试验结果可知,侵染20 min或30 min比侵染10 min获得的转化率稍微高一些,而20 min和30 min之间差别很小,且均未出现软腐现象。因此,侵染时间应控制在20~30 min。
菌株接种到外植体上后,在共培养的过程中进行增殖。如果共培养时间过短,外植体切口边缘只有很少的农杆菌生长,则细胞被转化的机率就很小;而且农杆菌接种到外植体上后,往往要在创伤部位生存16 h后才能实现转化。但如果培养时间过长,农杆菌在外植体四周过度增殖,会对外植体产生毒害,使其腐烂死亡。因此,共培养时间对转化率有着重要的影响。本试验结果显示,共培养3 d或4 d的处理转化效果明显优于共培养2 d的处理,而以共培养4 d的转化率最高(图 2)。因此,在侵染过程中,共培养时间以4 d较为合适。
|
图 2 侵染时间和共培养时间对转化效果的影响 Figure 2 Effects of infection time and cocultivation period on transformation frequencies |
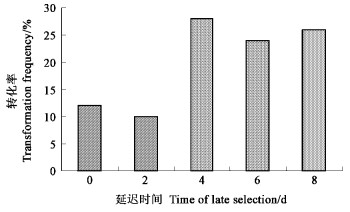
延迟选择是在不定芽诱导培养一定时间后、不定芽形成前加入选择压,采用这种方法进行选择既有利于转化细胞生长又不会产生较多的嵌合体。本试验设计了延迟0、2、4、6、8 d处理,结果表明,延迟选择有利于提高转化率,但延迟时间不能太长,以4 d较好,转化率能达到28%(图 3)。
|
图 3 延迟选择对转化效果的影响 Figure 3 Effect of late selection on transformation frequencies |
通过上述转化试验,共获得43个抗性株系。提取转化植株的基因组DNA,以其为模板进行PCR扩增,产物经1%琼脂糖凝胶电泳。图 4是部分株系PCR鉴定的结果,从图中可以看出,参与试验的5个转化株和质粒阳性对照均出现约1 520 bp的特异性条带,这与目的基因BADH的大小相一致;而阴性对照非转化植株则无任何特异性条带出现,说明目的基因BADH已被转化到美丽胡枝子体内。对其他38个抗性株系先后检测,结果均呈阳性。
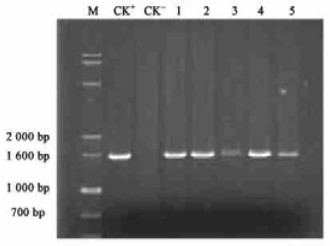
|
图 4 转化植株BADH基因PCR检测 Figure 4 PCR detection of BADH gene in transgenic plants M:DNA marker;CK-:未转化植株Non-transgenic plant;CK+:质粒Plasmid;1~5:转化植株Transgenic plants.下同。The same below. |
为了进一步证明PCR扩增产物是目的基因片段,将PCR扩增产物进行PCR-Southern杂交检验。从图 5杂交结果可以看出,质粒扩增的片段和转化植株扩增的片段均出现杂交信号。由此可证明,转化植株中检测到的序列与目的基因的序列是一致的,这进一步说明BADH基因已被转化到美丽胡枝子体中。
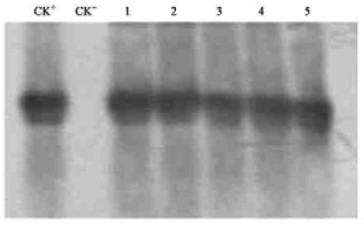
|
图 5 转BADH基因植株的PCR-Southern杂交结果 Figure 5 PCR-Southern bloting analysis of BADH gene in transgenic plants M:DNA marker;CK-:未转化植株Non-transgenic plant;CK+:质粒Plasmid;1~5:转化植株Transgenic plants.下同。The same below. |
由于PCR扩增十分灵敏,有时会出现假阳性扩增,所以PCR-Southern的结果只能证明转化植株体内存在目的基因,而目的基因是否整合到植物的基因组中,还需要进行Southern杂交来最后确定。提取PCR检测为阳性的转化植株的DNA,分别用SacⅠ和BamHⅠ进行双酶切9 h以上,电泳分离后进行Southern杂交。结果显示,阴性对照和1、2、4号株系没有出现杂交信号,阳性对照和3、5号株系在同一位置出现了杂交带,由于阳性对照加的是质粒的PCR产物,因此,阳性对照的杂交信号很强,而3号和5号株系的杂交信号相对较弱(图 6)。由此可判断,目的基因BADH已整合到3号和5号2个株系的基因组中。
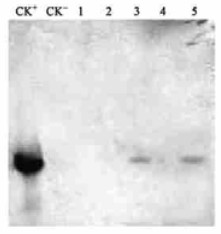
|
图 6 转BADH基因植株的Southern印迹分析 Figure 6 Southern bloting analysis of BADH gene in transgenic plants |
从图 7中可看出,无论是转基因植株还是对照植株,都能够检测到甜菜碱,在没有胁迫的情况下,两者体内甜菜碱的含量均较低,使用盐胁迫后,则表现出不同的变化趋势。胁迫6 d后,转基因植株与对照的甜菜碱含量都有所上升,但上升幅度不大,转基因植株的含量稍微比对照大些。胁迫12 d后,无论是对照还是转基因植株,体内的甜菜碱含量大幅度上升,且上升的幅度有明显差异,对照增加了0.960 mg·g-1,转基因株系则增加了1.385 mg·g-1,其甜菜碱含量是对照的1.4倍;此时对照植株已表现出一定程度的损伤。随着胁迫时间的延长,对照植株的损伤程度加剧,逐渐呈枯萎状,转基因株系中有个别植株出现叶片损伤现象(图 8),18 d时,测定各自体内的甜菜碱含量,发现转基因植株和对照体内的甜菜碱含量均有一定程度的下降,但转基因植株下降幅度较小,减少量为0.122 mg·g-1,而对照则下降了0.845 mg·g-1,此时转基因植株体内的甜菜碱含量是对照的5.7倍。由此可见,转基因美丽胡枝子具有更强的耐盐能力,这应该是外源BADH基因在其体内表达的结果。
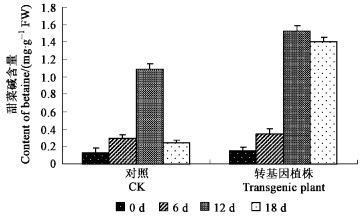
|
图 7 NaCl胁迫下转基因美丽胡枝子甜菜碱含量变化 Figure 7 Changes of betaine content in transgenic plants under NaCl stress |

|
图 8 转基因美丽胡枝子的抗性(6 mg·L-1 NaCl胁迫15 d) Figure 8 Resistances of transgenic L. formosa (stressed under 6 mg·L-1 NaCl for 15 d) |
本研究以美丽胡枝子子叶节为外植体,采用根癌农杆菌介导的方法,借助于bar基因作为标记,将甜菜碱醛脱氢酶基因(BADH)成功地导入到了美丽胡枝子的基因组中,获得了耐盐性增强的转基因美丽胡枝子。
nptⅡ基因是目前植物基因工程中最广泛使用的筛选标记基因,该基因编码新霉素磷酸转移酶(nptⅡ),它能使Kan(卡那霉素)等氨基糖苷类抗生素磷酸化,使转化细胞具有抗氨基糖苷类抗生素的能力。以Kan作为选择剂已在很多植物的转化中成功运用,但不同植物对卡那霉素的敏感性不同。研究表明,美丽胡枝子对Kan具有较高水平的抗性,Kan浓度必须大于350 mg·L-1才能有效抑制其子叶节分化,以Kan为选择剂筛选效率较低(杜金友,2005)。据此原因,本研究没有采用nptⅡ基因,而使用了抗草丁膦的bar基因作为选择标记基因。不同植物不同品种对草丁膦的敏感性差异也较大,其使用浓度一般为5~15 mg·L-1(莽克强等,1998),从本试验研究的结果来看,美丽胡枝子对草丁膦非常敏感,1.0 mg·L-1Glu即能抑制其子叶节的分化与生长,以其为选择剂能获得较好的效果。
遗传转化是一个非常复杂的过程,其间涉及许许多多的环节,转化方法是否得当直接影响着外源基因的转化效率。本试验对影响转化效果的主要因素进行了研究,确定了适宜的侵染时间、共培养时间和选择剂加入时间。有效的转化方法为:以美丽胡枝子子叶节为外植体,预培养1 d,用OD600约为0.8的菌液侵染20~30 min,共培养4 d,脱菌培养4 d后加入1.0 mg·L-1Glu进行选择,最高转化率达到了28%。
Southern杂交是将转基因株系的基因组与目的基因同源的探针杂交,其检测结果比PCR-Southern更可靠,但该方法对DNA纯度、长度和浓度都有一定的要求,当用于杂交的样品纯度不合格或浓度过小时,杂交常无信号。本试验中5个转化株系的PCR和PCR-Southern结果均呈阳性,但Southern杂交却只有2个株系出现杂交信号,另3个株系和对照都没有杂交信号,分析其原因,可能是样品中DNA浓度太小所致,也有可能这3个株系是假阳性,BADH基因虽然进入了植株体内但没有整合到其基因组中。
许多研究表明,甜菜碱的积累与盐胁迫密切相关,盐浓度的变化影响着甜菜碱生物合成过程中相关基因的表达(McCue et al., 1992;肖岗等,1995;Weretilnyk et al., 1990),而其中响应最为明显的是BADH(Holmstrom et al., 2000)。本试验对转化植株和非转化植株都进行盐胁迫的结果显示,当存在盐胁迫时,转基因植株合成的甜菜碱量明显要比非转化植株多,且随着胁迫时间延长,非转化植株合成的甜菜碱急剧减少,而转基因植株仍然能够维持较高的水平,这说明BADH基因的转入能明显增加甜菜碱的合成量和积累量,使植株具有更强的抗盐能力。
本研究中,转基因美丽胡枝子的耐盐性试验是以试管苗为材料在组培室进行的,且胁迫时只用了NaCl这一种盐,这与大田(盐碱地)的实际情况有很大差别。转基因植株移栽后,其耐盐性如何?它们能在什么样的盐碱地上生长?获得的耐盐性是否能稳定遗传?这一系列的问题都有待于后续作更为深入的研究。
陈传芳, 李义文, 陈豫, 等. 2004. 通过农杆菌介导法获得耐盐转甜菜碱醛脱氢酶基因白三叶草. 遗传学报, 31(1): 97-101. |
杜金友. 2005.胡枝子干旱胁迫下渗透物质变化以及外源基因Sac B对美丽胡枝子的遗传转化研究.北京林业大学博士学位论文. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y797014
|
付光明, 苏乔, 吴畏, 等. 2006. 转BADH基因玉米的获得及其耐盐性. 辽宁师范大学学报:自然科学版, 29(3): 344-347. |
刘凤华, 郭岩, 谷冬梅, 等. 1997. 转甜菜碱醛脱氢酶基因植物的耐盐性研究. 遗传学报, 24(1): 54-58. |
刘永军, 孙耀中, 东方阳, 等. 2005. 转甜菜碱醛脱氢酶基因水稻种子萌发和苗期耐盐性研究. 种子, 24(9): 19-21. |
莽克强, 陈受宜, 李季伦, 等. 1998. 农业生物工程. 北京: 化学工业出版社.
|
孙秀殿, 李纯丽, 张峰下. 1999. 胡枝子的栽培利用. 经济植物, (2): 33-35. |
王关林, 方宏筠. 2002. 植物基因工程. 2版. 北京: 科学出版社.
|
肖岗, 张耕耘, 刘风华, 等. 1995. 山菠菜甜菜碱醛脱氢酶基因研究. 科学通报, 40(8): 741-745. DOI:10.3321/j.issn:0023-074X.1995.08.019 |
邹维华, 赵强, 崔德才, 等. 2006. 反义磷脂酶  基因与几丁质酶基因转化美洲黑杨G2. 林业科学, 24(1): 37-42. 基因与几丁质酶基因转化美洲黑杨G2. 林业科学, 24(1): 37-42. |
Holmstrom K, Somersalo S, Mandal A, et al. 2000. Improved tolerance to salinity and low temperature in transgenic tobacco producing glycine betaine. Journal of Experimental Botany, 343: 177-185. |
Kishitani S, Takanami T, Suzuki M, et al. 2000. Compatibility of glycinebetaine in rice plants evaluation using transgenic rice plants with a gene for peroxisomal betaine aldehyde dehydrogenase from barley. Plant Cell Environ, 23: 107-114. DOI:10.1046/j.1365-3040.2000.00527.x |
McCue K F, Hanson A D. 1992. Salt-inducible betatine aldehyde dehydrogenase from sugar beet: cDNA cloning and expression. Plant Molecular Biology, 18: 1-11. DOI:10.1007/BF00018451 |
Weretilnyk E A, Hanson A D. 1990. Molecular cloning of a plant betaine aldehyde dehydrogenase, an enzyme imptlicated in adaptation to satinity and drought. Proc Natl Acad Sci USA, 87: 2745-2749. DOI:10.1073/pnas.87.7.2745 |
 2008, Vol. 44
2008, Vol. 44