文章信息
- 王媛, 梁军, 张星耀.
- Wang Yuan, Liang Jun, Zhang Xingyao.
- 植物抗病过程中的细胞程序性死亡
- The Programmed Cell Death in Plant Disease Resistance
- 林业科学, 2008, 44(2): 143-149.
- Scientia Silvae Sinicae, 2008, 44(2): 143-149.
-
文章历史
- 收稿日期:2006-11-09
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 国家林业局森林生态与保护学重点实验室 北京 100091
2. Research Institute of Forest Ecology, Environment and Protection, CAF Key Lab of Forest Ecology and Protection of State Forestry Administration Beijing 100091
细胞程序性死亡(programmed cell death, PCD)是细胞死亡2种基本类型之一,是细胞接受某种信号或受到某些因素刺激后主动发生的由基因调控的死亡过程,与坏死(necrosis)有本质区别。植物细胞PCD在许多胁迫条件下普遍发生,如干旱、低温、病原侵染、营养缺乏等均可诱导细胞PCD。植物与病原菌互作过程中发生的过敏性反应(hypersensitive reaction, HR)即是PCD的重要表现形式之一(Garcia et al., 1997; Liu et al., 2004),是植物抵抗微生物入侵的早期重要抗性反应之一,对于植物抗病性十分重要。植物与病原物互作过程中的HR涉及了互作识别、寄主细胞死亡、抗病防卫反应激活及病原菌生长受抑制等多方面(Greenberg, 1994; Shirasu et al., 2000),是植物与病原菌不亲和互作的最常见表型,最初表现为植物受不亲和病原菌侵染后,受侵细胞及邻近组织发生快速和局部的死亡,一般在寄主细胞受到病原菌侵染后24 h内发生,从而限制了病原菌的进一步扩展(Goodman et al., 1994),是寄主的抗病基因与病原菌的无毒基因相互识别后的早期事件(Flor, 1971)。进一步的研究表明,HR细胞死亡并不是病原菌侵染直接导致的结果,而是在植物细胞内在基因调控下的一种细胞自主死亡形式(Jabs, 1999)。目前的研究认为植物发生PCD及HR与细胞的多重防卫功能密切相关,需要经过植物细胞对病原菌的识别、识别信号传导及执行细胞死亡机制的激活等系列程序来完成,这些功能包括活性氧爆发、植保素积累、细胞壁结构变化及防卫基因激活等,并且使植物个体产生局部获得抗性(local acquired resistance, LAR)和系统获得抗性(systemic acquired resistance, SAR),对植物抗病性有重要意义,可为抗病品种筛选提供依据,相关研究有较强的理论意义和实践意义。本文综述了植物抗病过程中的PCD和HR,主要对HR特征、可能的信号传导因子、检测方法、产生的分子机制等方面的研究进展进行了分析和总结,并结合研究进展对林木抗病中的PCD研究进行了展望。
1 病原菌诱导的PCD和HR特征植物PCD与动物PCD有许多相似之处,发生时均在形态和生化特征上与坏死细胞有较大区别。而植物抗病过程中发生的HR,有时表现为典型的PCD,有时又不同于PCD的特征。
1.1 形态学特征发生PCD的植物细胞先以细胞质和细胞核浓缩、染色质边缘化为特征,随后由膜包围DNA片段形成凋亡小体,主要表现为:细胞骨架破坏,体积缩小,密度增大;染色质凝集、断裂、趋于边缘化;内质网起泡,并与细胞膜融合,形成细胞质气泡(Gunawardena et al., 2001)。
韩笑冰(1998)等的研究表明,被疫霉菌(Phytophthora melonis)侵染的黄瓜(Cucumis sativus)抗病品种出现过敏性反应,叶肉细胞与入侵菌丝一同解体死亡,胞间菌丝向细胞内穿透处形成壁附加物。白志英等(2003)的研究发现,小麦(Triticum aesetivum)与叶锈菌(Puccinia recondita f.sp tritici)不亲和组合的互作过程中,寄主细胞呈现PCD的典型特征。而坏死最早期的变化发生在细胞膜和细胞器(尤其是线粒体)上,细胞核仅有轻微变化。
就现有文献来看,林木病害系统中PCD和HR的研究相对较少。厉艳(2004)曾分析了松材线虫病早期寄主薄壁细胞的死亡方式,使用PI荧光单染色法观察到线虫侵染松树后寄主薄壁细胞凋亡(apoptosis)的部分典型形态特征,通过分析细胞核的变化认为松材线虫(Bursaphelenchus xylophilus)侵染后诱发了寄主细胞程序性死亡,同时还发现松苗接种线虫后,其皮层薄壁细胞的细胞核出现了明显的凋亡现象,并且在线虫未达到的茎段组织细胞中也出现了不同程度的细胞凋亡,似乎信号传导在调控细胞死亡形式上起到了一定作用,并且认为皮层薄壁细胞发生程序性死亡的数量和程度随着时间的推移和线虫在松苗体内不断扩散分布而逐步显著增加。该研究首次确认了松材线虫病发生过程中伴随着寄主细胞的过敏性反应。
1.2 分子生物学特征植物细胞发生PCD后,核内DNA被诱导产生的核酸内切酶从核小体间降解断裂,出现带有3'-OH端、大小不同的寡聚核小体片段(TUNEL阳性,即末端脱氧核苷酸转移酶介导的dUTP切口末端标记阳性),这些片断在凝胶电泳上表现为180 bp倍增的梯状“DNA条带”(DNA ladder)(Wyllie et al., 1984)。在一些农作物与病原菌互作的研究中,发现HR过程中有脱氧核糖核酸酶的活跃表达,并伴有核DNA的片段化(Mittler et al., 1995; Ryerson et al., 1996; Wang et al., 1996),在拟南芥(Arabidopsis thaliana)中还发现HR中死亡的细胞表现为细胞质浓缩,最终出现了类似于凋亡小体的结构(Levine et al., 1996; Pennell et al., 1997)。
2 PCD和HR的检测方法将发生PCD或HR的细胞与坏死细胞正确区分是开展植物抗病性研究的必要步骤。检测方法借助了人类医学及动物PCD检测的方法,并且根据植物组织细胞的特点加以修改。一般根据死亡细胞的形态学、生物化学和分子生物学特点进行鉴定。
2.1 形态学检测 2.1.1 光学显微镜观察用苏木素-伊红(HE)染色:细胞核固缩碎裂、呈蓝黑色、胞浆呈淡红色(PCD细胞),正常细胞核呈均匀淡蓝色或蓝色,坏死细胞核呈很淡的蓝色或蓝色消失。也可用Trypan Blue染色,死细胞能被染成蓝色,而活细胞不被染色。
2.1.2 荧光显微镜观察Hoechst 33342、Hoechst 33258、荧光双醋酸酯(FDA)、啶橙-溴化乙锭(AO-EB)双重染色等染色方法可用于荧光显微镜观察。Hoechst荧光染料与DAN的结合是非嵌入式的,主要结合在DNA的A-T碱基区,紫外光激发时发射明亮的蓝色荧光。荧光双醋酸酯(FDA)染色后在荧光显微镜下呈绿色荧光。
形态学观察鉴定PCD细胞,优点是简便易行,经济,可定性定位。但特异性差,无法定量,尤其在死亡类型复杂时,难以准确判断。
2.1.3 电镜观察细胞死亡的某些特性,特别是早期核和细胞器的变化,在光镜下不能发现,应借助于电镜观察。透射电镜是观察细胞PCD和HR较为精确的方法,细胞核和细胞器亚显微结构清晰易辨,可同时反映细胞膜的完整性、细胞核的改变等,能发现早期细胞死亡事件。
2.2 分子生物学方法检测 2.2.1 DNA ladder法DNA ladder是PCD诊断的经典方法之一。发生PCD的细胞经电泳染色后,可观察到DNA ladder现象。该法操作简单,定性准确,并可定量检测,但植物发生的HR不表现为典型的PCD特征时,无法用该方法检测。
2.2.2 末端转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase mediated dTUP nick end labeling, TUNEL)这是目前原位检测细胞凋亡最敏感、快速、特异性强的新方法,具有广泛的应用前景。其原理是:细胞PCD的重要特点是DNA断裂降解成不同倍数碱基对的核苷酸片段(Wyllie, 1980)。末端转移酶TdT可催化在DNA片段的3'-OH末端合成多核苷酸聚合物的反应,即DNA片段加尾。利用末端转移酶TdT将标记的脱氧核苷酸转移到DNA缺口或末端的3'-OH上,通常所用核苷酸为dUTP,标记物为地戈辛、生物素、荧光素等(Gavrieli et al., 1992),发生PCD或HR的细胞核染为深蓝色,少量坏死细胞可呈阳性反应,但位于坏死灶内,阴性对照切片中无阳性反应物。该法可检出早期凋亡细胞,具有较高灵敏性。缺点是坏死细胞亦呈现TUNEL反应阳性,使其特异性降低(Gorczyca et al., 1994)。该方法广泛用于医学检测,已有生物公司生产用于凋亡细胞检测的TUNEL试剂盒,近年来在植物病害研究中也开始使用(孙晓丽等, 2006),使检测更为方便和准确。
2.3 生物化学方法酶联免疫法(enzyme-linked immunosorbent assay, ELISA)可以定量测定凋亡细胞胞浆中与组蛋白相联的DNA片段——核小体或寡聚核小体。当细胞发生凋亡时,Ca2+、Mg2+依赖的内源性核酸内切酶激活,在核小体连接区切开双链DNA,产生带有单个或寡聚核小体的DNA片段,可利用ELISA法在群体水平上对PCD细胞进行检测(Ning et al., 2000)。
植物HR细胞检测很少单独采用某一种方法,而是多种方法结合相互验证,有时HR并不表现出典型的PCD特征,因此,增加了准确判别HR的难度。随着新技术的发展,快速、便捷、准确、经济的检测方法正在应运而生,也将为植物PCD及HR研究建立更稳定快捷的平台。
3 植物HR反应的信号物质病原菌在入侵植物前能产生无毒基因产物、细菌毒素、病毒编码的外壳蛋白等致病信号(pathogenicity factor)(Bent, 1996),与寄主进行互作识别,破坏寄主组织细胞并引起病变。而寄主在遭受病原菌攻击后,某些物质也会传递信号,引起寄主的防卫反应,活性氧(reactive oxygen species, ROS)、一氧化氮(nitric oxide, NO)、水杨酸(salicylic acid, SA)、Ca2+和小分子G-蛋白等都可以起重要的信号作用(Lam et al., 1999)。
3.1 活性氧与植物HR在植物与病原菌大多数不亲和互作中,伴随HR的一个最显著特征就是活性氧爆发,在短时间内积累大量的ROS(Gozzo, 2003),并且发现只有H2O2积累到能检测的程度寄主才会发生HR反应,在寄主-病原菌互作中使用抗氧化酶和自由基清除剂可阻止细胞死亡,如果抑制氧化酶活性,促使ROS浓度增加则可加深细胞死亡程度(Durner et al., 1998)。1983年,Doke等(1983)发现无毒菌系Phytophthora infestans接种马铃薯(Solanum tuberosum)块茎可以引起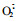
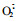
Levine(1996)发现HR中的细胞死亡是由于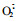
在对拟南芥、番茄和烟草的研究中,发现SA也可促进病原菌侵染引起的细胞死亡,而某些情况下,SA也限制细胞死亡的扩展(Helene et al., 2001)。拟南芥的模拟枯斑突变体lsd和acd在表现类似HR细胞死亡时含有高水平的SA积累(Alvarez, 2000)。有研究也表明,SA对由R基因RPW8介导的拟南芥HR反应必不可少(Xiao et al., 2001; 2003)。
关于SA和ROS的关系已有不少报道。很多试验结果表明,SA在PCD过程中,有抑制过氧化物酶的作用,并认为SA通过抑制抗氧化酶间接调节ROS,尤其是H2O2的水平(Chen et al., 1993; Heo et al., 1999)。但也有相反的例子认为,在病原菌侵染烟草后氧化暴发导致的活性氧升高、细胞壁加厚和防御基因的激活非常迅速,而SA则在感染后8~24 h后才明显增加(Dong et al., 1998)。
3.4 NO与植物HR植物体内NO的研究是最近几年才开始的,因此对其在植物体中的存在形式和抗病中的功能了解甚少。1998年,Durner等(1998)首次确立了NO在调控植物生理病理反应中的地位。他发现外源NO释放剂在H2O2存在下能诱导大豆和烟草细胞中调控PAL和PR等防卫基因的表达。NO也可诱导拟南芥细胞死亡(Clarke et al., 2000)。Delledonne等(2001)在大豆细胞HR中发现,单独NO或ROS的产生都不能引起细胞的HR,只有当NO和ROS的产生处于一定程度的平衡时才会激活HR。另外,他还发现与NO互作引起HR的信号分子是由SOD催化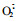
NO和一氧化氮合酶(nitrate oxide synthesis, NOS)在激活植物抵御病原菌的抗病反应中可能起主导作用。但到目前为止, 还没有克隆到任何相关基因,植物基因文库中也找不到与哺乳动物NOS基因相似的序列,有关NO在植物体内的产生机制也存在很多争议(Bolwell et al., 1997; Murphy et al., 1998)。
3.5 其他信号分子与植物HR乙烯能促进细胞中Ca2+流动,而Ca2+的变化可影响蛋白质磷酸化,激活核酸内切酶,导致DNA降解,因此,乙烯诱导Ca2+重新分布也许是植物PCD的机制之一(于惠敏, 1998)。另外,由于赤霉素(GA)也能刺激植物细胞PCD,乙烯和GA的作用又可被细胞分裂素及ABA所逆转(Kuo et al., 1996),因此,乙烯很可能与其他信号分子协同作用来控制细胞死亡。Fukuda(1994)及Mori(1986)等在研究松材线虫与感病松树的互作中均发现松苗细胞死亡的同时伴随乙烯释放量的增加,但并未进一步研究乙烯与细胞PCD变化之间的关系,也没有找到充分的证据证明其细胞发生了PCD。
阿拉伯半乳糖蛋白(arabinogalactan proteins, AGPs)是普遍存在于植物体中的胞间质富含羟脯氨酸蛋白家族(Wu et al., 2000),可破坏质膜和细胞壁的联系,激活某一信号传导途径,并被发现可能通过扰乱质膜和细胞壁间的信号传递而参与植物PCD调控(Gao et al., 1999)。
4 植物HR的分子机制研究证据表明,HR反应需要包括转录和翻译在内的代谢途径的参与(He et al., 1994),而且表达不同外源基因的植物和大量的能够表现自发或有条件死亡的植物突变体所表现的死亡方式都与HR反应非常类似(Dangl et al., 1996; Mittler et al., 1996),所以HR反应不是由病原物的破坏能力直接激发的,而是植物内在基因程序被激活的结果(Pontier et al., 1998)。
近年来,一些细胞死亡突变体的发现促进了PCD相关基因的鉴定与克隆,并在玉米(Zea mays)、大麦(Hordeum vulgare)和拟南芥等植物中克隆到了多个PCD相关基因(于惠敏, 1998)。Fabienne等(2002)从拟南芥中克隆了与PCD相关的一个基因AtMYB30,发现在AtMYB30过量表达的情况下能够加速和增强对病原菌的抗性,在病原菌入侵时诱导类似HR的反应。对玉米中突变的rpl基因及大麦中突变的mlo基因进行定位发现其位于抗病基因(R)座位处(Dangl et al., 1996)。大麦中的mlo基因对真菌的侵染具有抗性,在植物细胞凋亡过程中起负调控作用,其等位基因可使受真菌侵染的植物在侵染部位形成细胞壁基质沉积(Baker et al., 2000)。此外,对于黄瓜花叶病毒(CMV)在豆科植物上引起HR的研究发现,CMV2a基因上的631和641位氨基酸共同决定细胞的HR反应(陶小荣等, 2002)。
5 展望植物PCD存在于生长发育的各个阶段,如根冠细胞死亡、木质部导管分化、植物衰老、体胚发生、抗病中的过敏反应等等,对于植物的正常生长发育和抵御不良环境十分重要。目前植物PCD许多机制虽然并不十分清楚,但在细胞死亡的相关基因与调控、信号传导、与细胞死亡有关的分子互作机制等方面已取得一些重要进展(Jones, 2001),这些进展有利于植物抗病过程中的HR研究,有利于阐明植物病害机制和鉴定病原菌致病性,并为持续有效地控制病害进行新的探索。
目前,植物HR研究大多在农作物上进行,如利用悬浮细胞系对拟南芥、烟草(Nicotiana spp)、胡萝卜(Daucus carota)、西芹(Apium graveolens var. dulce)、水稻(Oryza sativa)等抗病过敏性反应相关的PCD进行研究(Desikan et al., 1996; Dorey et al., 1999; Glazener et al., 1996; Naton et al., 1996; 李红玉等, 1999),得到了许多有意义的结果,从细胞学和分子生物学角度揭示了病害发生机制和植物的抗病机理。目前在松材线虫病害体系中也发现了线虫侵染能引起植物细胞发生PCD,然而从现有文献看,有关林木与病原物互作中的PCD及HR的研究仍然较少,对其是否产生、何时产生、产生的机理及分子机制、HR过程是由什么基因调控的、调控途径和机制是什么、活性氧跃变在HR及PCD中的作用研究等几乎都是空白,这些都成为林木病害系统中亟待解决的问题。对这些悬而未决的问题进行探索,有利于对植物抗病潜力的挖掘与利用,并在植物抗病育种方面发挥积极作用。
白志英, 王冬梅, 路丙社, 等. 2003. 小麦与叶锈菌互作过程中细胞程序性死亡的细胞学观察. 实验生物学报, 36(5): 357-360. |
陈玉惠, 叶建仁, 魏初奖, 等. 2002. 松材线虫对黑松、湿地松幼苗活性氧代谢的影响. 南京林业大学学报:自然科学版, 26(4): 19-22. |
韩笑冰, 利容千, 王建波. 1998. 黄瓜不同抗病品种与疫霉菌相互作用的超微结构研究. 植物学报, 40(10): 895-900. DOI:10.3321/j.issn:1672-9072.1998.10.003 |
李红玉, 吴健胜, 宋从凤, 等. 1999. 水稻IR26悬浮细胞与白叶枯病菌互作的过敏反应现象. 植物病理学报, 29(4): 299-303. DOI:10.3321/j.issn:0412-0914.1999.04.003 |
厉艳. 2004. 松材线虫病早期寄主薄壁细胞死亡方式的研究. 南京林业大学硕士学位论文. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y606591
|
孙晓丽, 周荣华, 贾继增. 2006. 白粉菌诱导的小麦叶片程序性细胞死亡. 扬州大学学报:农业与生命科学版, 27(2): 21-25. |
陶小荣, 周雪平, 李桂新, 等. 2002. 黄瓜花叶病毒2α基因上的两个氨基酸共同决定其在豆科植物上引发的过敏反应. 中国科学:C辑, 32(4): 313-320. |
杨秀娟, 陈福如, 占志雄, 等. 2005. 叶斑病胁迫对枇杷叶片活性氧代谢和叶绿素含量的影响. 江西农业大学学报, 27(5): 667-669. DOI:10.3969/j.issn.1000-2286.2005.05.006 |
于惠敏. 1998. 植物中的细胞程序性死亡. 植物学通报, 15(6): 30-37. DOI:10.3969/j.issn.1674-3466.1998.06.003 |
郑国华. 2001. 炭疽病对枇杷叶片活性氧代谢和解剖结构的影响. 福建农业大学学报, 30(2): 175-179. |
Akutsu K, Dorak K, Yora K. 1980. Elementary analysis of papillae and cytoplasmic vesicles formed at the penetration site by Erysiphe graminis f. sp. Hordei in epidermal cells of barley leaves. Ann Phytopathol Soc Jpn, 46(4): 667-671. |
Alvarez M E. 2000. Salicylic acid in the machinery of hypersensitive cell death and disease resistance. Plant Mol Biol, 44: 429-442. DOI:10.1023/A:1026561029533 |
Baker C J, Orlandi E W. 1995. Active oxygen in plant pathogenesis. Annu Rew Phytopathol, 33: 299-321. DOI:10.1146/annurev.py.33.090195.001503 |
Baker S J, Newton A C, Gurr S J. 2000. Cellular characteristics of temporary partial breakdown of mlo-resistance in barley to powdery mildew. Physiological and Molecular Plant Pathology, 56(1): 1-11. DOI:10.1006/pmpp.1999.0242 |
Bent A F. 1996. Plant disease resistance genes: function meets structure. Plant Cell, 8(10): 1757-1771. DOI:10.1105/tpc.8.10.1757 |
Bolwell G P, Wojtaszek P. 1997. Mechanisms for the generation of reactive oxygen species in plant defence-abroad perspective. Physiol Mol Plant Pathol, 51: 347-366. DOI:10.1006/pmpp.1997.0129 |
Chen Y, Sliva H, Klessing D F. 1993. Active oxygen species in the induction of plant system acquired resistance by salicylic acid. Science, 263: 1883-1886. |
Clarke A, Desikan R, Hurst R D, et al. 2000. NO way back: nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures. Plant J, 24: 667-677. DOI:10.1046/j.1365-313x.2000.00911.x |
Convay W S, Sams C E, Abbott J A, et al. 1991. Postharvest calcium treatment of apple fruit to provide broad-spectrum protection against postharvest pathogens. Plant Disease, 75(6): 620-622. DOI:10.1094/PD-75-0620 |
Dangl J L, Dietrich R A, Richberg M H. 1996. Death don't have no mercy: cell death programs in plant-microbe interactions. Plant Cell, 8(10): 1793-1807. DOI:10.1105/tpc.8.10.1793 |
Delledonne M, Zeier J. 2001. Signal interaction between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response. PNAS, 98: 13454-13459. DOI:10.1073/pnas.231178298 |
Desikan R, Hancock J T, Coffey M J, et al. 1996. Generation of active oxygen in elicited cells of Arabidopsis thaliana is mediated by a NADPH oxidase-like enzyme. FEBS Lett, 382: 213-217. DOI:10.1016/0014-5793(96)00177-9 |
Doke N. 1983. Involvement of superoxide anion generation in hypersensitive response of potato tuber tissues to infection with an incompatible race of Phytophthora infestans. Physiol Plant Pathol, 23: 345-347. DOI:10.1016/0048-4059(83)90019-X |
Dong X. 1998. SA, JA, ethylene, and disease resistance in plants. Curr Opin Plant Biol, 1(4): 316-323. DOI:10.1016/1369-5266(88)80053-0 |
Dorey S, Kopp M, Geoffroy P, et al. 1999. Hydrogen peroxide from the oxidative burst is neither necessary nor sufficient for hypersensitive cell death induction, phenylalanine ammonia lyase stimulation, salicylic acid accumulation, or scopoletin consumption in cultured tobacco cells treated with elicitin. Plant Physiol, 121: 163-171. DOI:10.1104/pp.121.1.163 |
Durner J, Wendehenne D, Klessig D F. 1998. Defense gene induction in tobacco by nitric oxide, cyclic GMP, and cyclic ADP-ribose. Proc Natl Acad Sci USA, 95(17): 10328-10333. DOI:10.1073/pnas.95.17.10328 |
Fabienne V, Xavier D, Maurice T, et al. 2002. A R2R3-MYB gene, AtMYB30, acts as a positive regulator of the hypersensitive cell death program in plants in response to pathogen attack. Proc Natl Acad Sci USA, 99: 10179-10184. DOI:10.1073/pnas.152047199 |
Flor H H. 1971. Current status of the gene-for-gene concept. Annu Rev Phytopathol, 9: 275-296. DOI:10.1146/annurev.py.09.090171.001423 |
Fukuda K, Hogetsu T, Suzuki K. 1994. Ethylene production during symptom development of pine wilt disease. Eur J Path, 24(4): 193-202. DOI:10.1111/efp.1994.24.issue-4 |
Gao M S, Howalter A M. 1999. Reagent treatment induces programmed cell death in Arabidopsis cell cultures and implicate arabinogalactan protein involvement. Plant J, 19(3): 649-657. |
Garcia A, Conzalez M C. 1997. Morphological markers for the early selection of drought-tolerant rice varieties. Cultivate Tropical, 18(2): 47-50. |
Gavrieli Y, Sherman Y, Ben-Sasson S A. 1992. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. Journal of Cell Biology, 119(3): 493-501. DOI:10.1083/jcb.119.3.493 |
Glazener J A, Orlandi E W, Baker C J. 1996. The active oxygen response of cell suspensions to incompatible bacteria is not sufficient to cause hypersensitive cell death. Plant Physiol, 110: 759-763. DOI:10.1104/pp.110.3.759 |
Goodman R N, Novacky A J. 1994. The hypersensitive reaction in plants to pathogens. St. Paul, MN: APS Press.
|
Gorczyca W, Gong J P, Darzynkiewicz Z. 1994. Detection of DNA strand breaks in individual apoptotic cells by the in situ terminal deoxynuleotidyl transferase and nick translation assay. Cancer Res, 53: 1945-1951. |
Gozzo F. 2003. Systemic acquired resistance in crop protection: from nature to a chemical approach. Journal Agricultural Food Chemical, 51(16): 4487-4503. DOI:10.1021/jf030025s |
Greenberg J T, Guo A, Klessig D F, et al. 1994. Programmed cell death in plants: A pathogen-triggered response activated coordinately with multiple defense functions. Cell, 77(4): 551-563. DOI:10.1016/0092-8674(94)90217-8 |
Gunawardena A H, Pearce D M, Jackson M B, et al. 2001. Characterization of programmed cell death during aerenchyma formation induced by ethylene or hypoxia in roots of maize (Zea mays L.). Planta, 212: 205-214. DOI:10.1007/s004250000381 |
Hancoock J G, Stanghellini M E. 1968. Calcium localization in Hyphomyces-infected squash hypocotyls and effect of calcium on pectatelyase activity and tissue maceration. Can J Bot, 46(4): 405-409. DOI:10.1139/b68-062 |
He S Y, Bauer D W, Collmer A, et al. 1994. Hypersensitive response elicited by Erwinia amylorora harpin requies active plant metabolism. Mol Plant Microbe Interact, 7: 289-293. DOI:10.1094/MPMI-7-0289 |
Heath M C. 2000. Hypersensitive response-relatived death. Plant Mol Biol, 44(3): 321-334. DOI:10.1023/A:1026592509060 |
Helene V, Hua L, Debra N R, et al. 2001. A role for salicylic acid NPR1 in regulating cell growth in Arabidopsis. Plant J, 28(2): 209-219. DOI:10.1046/j.1365-313X.2001.01158.x |
Heo W D, Lee S H, Kim J C, et al. 1999. Involvement of specific calmodulin isoforms in salicylic acid-independent activation of plant disease resistance response. Proc Natl Acad Sci USA, 96(2): 766-771. DOI:10.1073/pnas.96.2.766 |
Jabs T. 1999. Reactive oxygen intermediates as mediators of programmed cell death in plants and animals. Biochem Pharmacol, 57: 231-245. DOI:10.1016/S0006-2952(98)00227-5 |
Jones A M. 2001. Programmed cell death in development and defense. Plant Physiol, 125: 94-97. DOI:10.1104/pp.125.1.94 |
Kuo A, Cappelluti S, Cervantes-Cervantes M S, et al. 1996. Okadaic acid, a protein phosphatase inhibitor, blocks calcium changes, gene expression and cell death induced by gibberellin in wheat aleurone cells. Plant Cell, 8(2): 259-269. DOI:10.1105/tpc.8.2.259 |
Lam E, Pontier D, del Pozo O. 1999. Die and let live-programmed cell death in plants. Curr Opin Plant Biol, 2: 502-507. DOI:10.1016/S1369-5266(99)00026-6 |
Levine A, Pennell R I, Alvarez M E, et al. 1996. Calcium-mediated apoptosis in a plant hypersensitive disease resistance response. Curr Biol, 4: 427-437. |
Liu F L, Andersen M N, Jensen C R. 2004. Root signal controls pod growth in drought-stressed soybean during the critical, abortion-sensitive phase of pod development. Field Crops Research, 85: 159-166. DOI:10.1016/S0378-4290(03)00164-3 |
Mittler R, Lam E. 1995. Identification, characterization and purification of a tobacco endonuclease activity induced upon hypersensitive response cell death. Plant Cell, 7(11): 1951-1962. DOI:10.1105/tpc.7.11.1951 |
Mittler R, Lam E. 1996. Sacrifice in the face of foes: pathogen-induced programmed cell death in plants. Trends Mocrobiol, 4: 105-115. |
Mori T, Inoue T. 1986. Pine-wood nematode-induced ethylene production in pine stems and cellulose as an inducer. J Jpn For Soc, 68: 43-50. |
Murphy T M, Asard H, Cross A R. 1998. Possible sources of reactive oxygen during the oxidative burst in plants//Asard H, Brczi A, Caubergs R J, et al. Plasma Membrane Redox Systems and their Role in Biological Stress and Disease. Dordrecht: Kluwe Academic Press, 215-246.
|
Naton B, Hahlbrock B, Schmelzer E. 1996. Correlation of rapid cell death with metabolic changes in fungus-infected cultured parsley cells. Plant Physiol, 112: 433-444. DOI:10.1104/pp.112.1.433 |
Ning S B, Wang L, Song Y C. 2000. Elisa assays for detection of apoptosis in plant cells. Development and Reproductive Biology, 9(2): 61-68. |
Pennell R I, Lamb C. 1997. Programmed cell death in plants. Plant Cell, 9(7): 1157-1168. DOI:10.1105/tpc.9.7.1157 |
Pontier D, Balague C, Roby D. 1998. The hypersensitive response. A programmed cell death associated with plant resistance. C R Acad Sci, 321(9): 721-734. DOI:10.1016/S0764-4469(98)80013-9 |
Ryerson D E, Heath M C. 1996. Cleavage of nuclear DNA into oligonucleosomal fragments during cell death induced by fungal infection or by abiotic treatments. Plant Cell, 8(3): 393-402. DOI:10.1105/tpc.8.3.393 |
Shirasu K, Schulze-Lefert P. 2000. Regulators of cell death in disease resistance. Plant Mol Biol, 44(3): 371-385. DOI:10.1023/A:1026552827716 |
Wang H, Li J, Bostock R M, et al. 1996. Apoptosis: A functional paradigm for programmed plant cell death induced by a host-selective phytotoxin and invoked during development. Plant Cell, 8(3): 375-391. DOI:10.1105/tpc.8.3.375 |
Wu H, Cheung A Y. 2000. Programmed cell death in plant reproduction. Plant Mol Biol, 44(3): 267-281. DOI:10.1023/A:1026536324081 |
Wyllie A H, Morris R G, Smith A L, et al. 1984. Chromatin cleavage in apoptosis: association with condensed chromatin morphology and dependence on macromolecular synthesis. J Pathol, 142: 67-77. DOI:10.1002/(ISSN)1096-9896 |
Wyllie A H. 1980. Glucocorticoid-induced thymocyte apoptosis is associated with endogenous endonuclease activation. Nature, 284(5756): 555-556. DOI:10.1038/284555a0 |
Xiao S, Brown S, Patrick E, et al. 2003. Enhanced transcription of the Arabidopsis disease resistance genes RPW8.2 via a salicylic acid-dependent amplification circuit is required for hypersensitive cell death. Plant Cell, 15: 33-45. DOI:10.1105/tpc.006940 |
Xiao S, Ellwood S, Calis O, et al. 2001. Broad-spectrum mildew resistance in Arabidopsis thaliana mediated by RPW8. Science, 291: 118-120. DOI:10.1126/science.291.5501.118 |
Xu H X, Heath M C. 1998. Role of calcium in signal transduction during the hypersensitive response caused by basidiospore-derived infection of the cowpea rust fungus. Plant Cell, 10(10): 585-597. |
 2008, Vol. 44
2008, Vol. 44

