文章信息
- 张云霞, 石勇, 王瑞刚, 陈少良, 李妮亚, 邵杰, 张华, 李静, 孙健.
- Zhang Yunxia, Shi Yong, Wang Ruigang, Chen Shaoliang, Li Niya, Shao Jie, Zhang Hua, Li Jing, Sun Jian
- 初始盐胁迫下ABA与CaM对胡杨叶片气体交换的调控
- Effects of ABA and CaM on Leaf Gas Exchange of Populus euphratica in the Process of Initial Salinity
- 林业科学, 2008, 44(1): 57-64.
- Scientia Silvae Sinicae, 2008, 44(1): 57-64.
-
文章历史
- 收稿日期:2007-02-06
-
作者相关文章
2. 湖北民族学院生物资源保护与利用湖北省重点实验室 恩施 445000
2. Key Laboratory of Biological Resources Protection and Utilization in Hubei Province Hubei Institute for Nationalities Enshi 445000
高等植物在胁迫环境下,会响应外界生境的变化,通过胁迫信号转导,进行适应性调节。在植物胁迫信号转导研究领域,ABA和第二信使Ca2+及其受体钙调素(CaM)倍受关注。植物在受到干旱、低温、高温、盐渍等环境胁迫时, 细胞迅速积累大量的ABA,作为一种重要的胁迫信使的观点已被人们广泛接受。植物抗盐性的研究结果表明:ABA可以调控盐胁迫所诱导的很多生理反应。例如,在菜豆(Phaseolus vulgaris)上发现,外源ABA的使用能在很大程度上限制Na+和Cl-由根向茎的运输(Karmoker et al., 1979),并且由盐预处理所引起的内源ABA水平的提高可以降低菜豆中盐离子的积累(Montero et al., 1997)。另外一个重要的发现是A BA能促进Na+向大麦(Hordeum vulgare)根细胞的液泡中的转运,同时,还很强烈地抑制盐离子通过质膜向胞内的转运(Behl et al., 1981)。在树木方面的试验表明:耐盐的胡杨(Populus euphratica)对初始盐胁迫的反应非常敏感,在低盐胁迫下,胡杨苗木的根部就能增加ABA的生物合成(Chen et al.,2002a;2003),而不抗盐的其他杨树则没有反应。进一步探究盐胁迫下胡杨ABA增加合成的原因,发现除了盐处理造成的渗透胁迫的作用外,离子胁迫也是很重要的原因(Chen et al., 2002b),同时,Na+和Cl-促进胡杨根系合成ABA的机制也有所不同(Chen et al., 2003)。此外,胡杨在长期增加的盐胁迫条件下也能保持较高的ABA浓度(Chen et al., 2001;Chang et al., 2006)。
作者的前期研究结果还显示:在盐诱导胡杨木质部ABA水平提高的同时,伴随有气孔导度的下降(Chen et al., 2003)。目前普遍认为:ABA作为重要的根源化学信号,在水分、干旱、盐等逆境胁迫下,根细胞产生的ABA传递到根质外体中,然后随蒸腾流经由木质部输送到叶片,促进气孔关闭(Hansen et al., 2003;Kang et al., 2004;Liu et al., 2005)。而叶片合成的ABA也可以通过韧皮部运转到根部,在根系中有一部分ABA存储在组织中,另一部分ABA通过木质部导管进行循环(Hartung et al., 2002)。在ABA调控气孔方面,前人做了大量研究。Schroeder等(2001)认为:ABA诱导气孔关闭过程涉及3种离子通道,即阴离子通道(anion channel)、钾离子通道(K+ channel)和钙离子通道(Ca2+ channel)。ABA调控气孔开度的模式为:1)ABA与保卫细胞上受体结合,增加细胞质中Ca2+浓度→抑制质膜H+泵和K+内流通道、激活Cl-外流的通道→质膜去极性化→激活K+外流通道、进一步抑制K+内流通道;2)ABA诱导磷脂酸(PA)产生→K+内流通道失活;3)ABA诱导胞质中pH升高→激活K+外流通道、抑制了质膜上的H+泵。总之,目前人们通常认为:ABA引起胞质Ca2+浓度增加,通过调控Ca2+通道、Cl-通道和K+通道,最终引起气孔关闭(MacRobbie et al., 2006)。
自植物中发现CaM以来, Ca2+作为植物生长发育的第二信使日益受到关注,其中Ca2+·CaM信使系统是目前研究较多、了解最清楚的一个Ca2+信使系统(孙大业,1996)。研究表明:盐胁迫所引起的脯氨酸积累、H2O2诱导的玉米(Zea mays)幼苗耐冷性的提高、高温下茄子(Solanum melongena)幼苗抗氧化酶活性提高、膜脂过氧化水平降低及柑橘(Citrus reticulata)原生质体抗冻能力的变化等许多植物抗逆反应都有Ca2+·CaM系统参与(汪良驹等,1999;李春光等,2003;宗会等,2000;李卫等,1997)。
在气孔调控方面,CaM也具有重要作用。许多研究表明:Ca2+·CaM复合物参与气孔调节。最早使用CaM拮抗剂研究Ca2+·CaM复合物在气孔运动中的作用始于1985年。随后,Kinoshita等(1995)观察到蚕豆(Vicia faba)保卫细胞Ca2+使H+-ATPase活性下降;Cottele等(1996)用多种抑制剂TFP、FLP、W7、W5、compound 48/80证明CaM促进气孔关闭;Sarah等(1999)也证明TFP、W7、W5、Prenylamine、HT-74抑制了蓝光诱导的蚕豆保卫细胞气孔开放;此外,Ca2+·CaM也参与了乙酰胆碱调控气孔运动的信号转导(王恒彬等,2003)。以上是通过使用CaM拮抗剂证明CaM参与气孔运动的调节。报道里所提到的CaM,主要是指胞内作为Ca2+受体的CaM。然而,早在上世纪80年代初就发现CaM也存在于植物和动物细胞外。到目前为止,已经在多种植物细胞壁中检出CaM(孙大业等,2001;Chen et al., 2003;肖玉梅等,2004)。陈玉玲等(2003a;2003b)通过对CaM精确定位,提出了胞外CaM调控气孔运动的可能模式:胞外CaM可能通过激活保卫细胞G蛋白打开质膜Ca2+通道,诱导胞外Ca2+内流,促进气孔关闭。尚忠林等(2001)的研究结果也显示:内源胞外钙调素可能在维持和促进花粉细胞质中游离钙离子方面具重要作用。Fang等(2003)和刘银谦(2006)认为Ca2+·CaM参与了NO诱导的拟南芥(Arabidopsis thaliana)气孔关闭。还有试验显示:保卫细胞内钙调素分布在2个保卫细胞连接处,说明CaM可能参与了保卫细胞间的信号传递过程(陶文菁等, 2003)。作者最近的研究显示:NaCl处理后胡杨叶片CaM水平的提高,可能参与盐胁迫诱导的气孔关闭(Chang et al., 2006),但这一推论尚待实验证实。
总之,作为第二信使,Ca2+·CaM本身已受到广泛而深入的研究,多集中在Ca2+对ABA调节气孔开闭过程。作者前期的试验结果证实:耐盐的胡杨能非常迅速地响应初始盐胁迫,对气孔开度进行调控,从而控制通过蒸腾流进行的根冠离子运输,这对其适应盐胁迫环境至关重要,但关于盐胁迫下胡杨气孔的调控机制少有研究。因此,本文拟研究胁迫信号物质ABA与Ca2+及其受体钙调素(CaM)对盐胁迫下胡杨气孔的调控,主要利用ABA合成抑制剂钨酸钠来抑制盐胁迫植株体内ABA水平(Zhou et al., 2005),使用胞外Ca2+螯合剂EGTA和Ca2+通道抑制剂LaCl3处理来限制Ca2+与CaM的作用,通过监测各种抑制剂对内源ABA和CaM水平以及叶片气体交换的影响,进一步讨论ABA和Ca2+·CaM信使系统在胡杨气孔调控及耐盐中的作用。
1 材料和方法 1.1 植物材料4月中旬,将取自新疆的胡杨实生苗栽于10 L塑料桶中。栽培基质为细沙:壤土=2:1,在北京林业大学苗圃的温室中培养苗木。培养期间,每周浇水3~4次以保持土壤湿度,并且每2周浇1次Hoagland完全营养液(每桶1.0 L)。培养4个月后,待苗木高为60~80 cm,单株叶量50~70片时,选择生长一致的40~50株苗木进行试验。
1.2 方法 1.2.1 抑制剂+盐处理试验从早晨8:30—9:00开始,先分别用10 mmol·L-1 EGTA、5 mmol·L-1 LaCl3或5 mmol·L-1钨酸钠溶液(W)处理材料根部,每桶浇1 L;对照苗木浇灌同样量的自来水。24 h后再用50 mmol·L-1 NaCl溶液(渗透势为-0.24 MPa)处理,每桶浇盐溶液1 L;未浇盐溶液的苗木作对照处理,即只浇自来水。试验中共有以下4种组合:灌水对照,灌水+抑制剂,盐处理,盐处理+抑制剂,各种处理如下:1)Control:苗木→灌水(1 L,24 h)→灌水(1 L,4 h);2)NaCl:苗木→灌水(1 L,24 h)→50 mmol·L-1 NaCl (1 L,4 h);3)W:苗木→5 mmol·L-1钨酸钠(1 L,24 h)→灌水(1 L,4 h);4)W+NaCl:苗木→5 mmol·L-1钨酸钠(1 L,24 h)→50 mmol·L-1 NaCl (1 L,4 h);5)EGTA:苗木→10 mmol·L-1 EGTA (1 L,24 h)→灌水(1 L,4 h);6)EGTA+NaCl:苗木→10 mmol·L-1 EGTA (1 L,24 h)→50 mmol·L-1 NaCl (1 L,4 h);7)LaCl3:苗木→5 mmol·L-1 LaCl3 (1 L,24 h)→灌水(1 L,4 h);8)LaCl3+NaCl:苗木→5 mmol·L-1 LaCl3 (1 L,24 h)→50 mmol·L-1 NaCl (1 L,4 h)。
1.2.2 气体交换测定分别在各种抑制剂处理24 h和NaCl处理后的4 h后,用CIRAS-2便携式光合仪(PP Systems, Ltd. U.K.)测定以上8种处理苗木的蒸腾速率(EVAP)、气孔导度(Gs)和净光合速率(Pn)。试验期间,环境温度为26~30 ℃,并用镝灯补充光照,使有效光合辐射(PAR)达到800~1 000 μmol·m-2s-1。
1.2.3 外源ABA处理外源ABA导入试验在实验室内进行,利用人工光源(1 kW的镝灯)控制光照,室内温度控制在26~28 ℃,选取生长一致的胡杨苗木,将1年生带叶枝条从基部切断,迅速插入去离子水中,在人工光源下适应2 h(200 mmol·m-2s-1),先从茎部导入5 mmol·L-1 EGTA或5 mmol·L-1 LaCl3,4 h后再导入10 μmol·L-1 ABA,未导入ABA溶液的苗木作对照处理(只导入去离子水),各种处理如下:1) Control:苗木枝条→导入去离子水(4 h)→导入去离子水(8 h); 2) ABA:苗木枝条→导入去离子水(4 h)→导入10 μmol·L-1 ABA (8 h);3) EGTA+ ABA:苗木枝条→导入5 mmol·L-1 EGTA (4 h)→导入10 μmol·L-1 ABA (8 h);4) LaCl3+ ABA:苗木枝条→导入5 mmol·L-1 LaCl3(4 h)→导入10 μmol·L-1 ABA (8 h)。
1.2.4 气体交换测定分别在各种抑制剂处理4 h和ABA导入后的4、8 h用CIRAS-2便携式光合仪测定叶片的蒸腾速率(EVAP)、气孔导度(Gs)和净光合速率(Pn)。测定条件同上1.2.2。
1.2.5 采样盐处理4 h和ABA导入4、8 h后采集叶片,每个处理为3个重复。所采叶片在液氮中速冻后置于-70 ℃冰箱中保存,用来进行ABA和CaM的分析。
1.2.6 ABA和CaM分析ABA测定采用吴颂如等(1988)的方法, CaM检测采用赵升皓等(1988)的方法并加以改进,即在酶标板反应孔内准确加入包被好的植物钙调素100 μL (10 μg·mL-1),37 ℃湿盒中温浴3 h(不需过夜),其他步骤同赵升皓等(1988)。
1.2.7 数据分析对所有数据均进行单因素方差分析。
2 结果 2.1 钨酸钠和盐处理对胡杨叶片气体交换的影响对照胡杨苗木经钨酸钠处理后,苗木叶片的蒸腾速率(EVAP)、气孔导度(Gs)和净光合速率(Pn)未受到明显影响(表 1)。50 mmol·L-1 NaCl处理后,胡杨叶片的EVAP、Gs和Pn虽然显著低于对照,但钨酸钠处理显著提高了盐胁迫苗木叶片的气体交换。W+NaCl处理后胡杨叶片EVAP、Gs和Pn分别高出NaCl处理65%、115%和58%(表 1)。
|
|
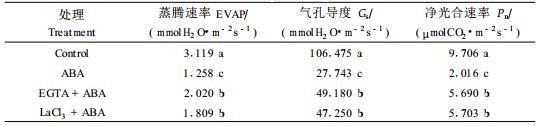
钨酸钠处理对胡杨对照苗木叶片的ABA含量没有明显影响(图 1)。NaCl处理后,胡杨叶片ABA含量比对照有显著提高,但钨酸钠显著抑制了ABA升高的幅度(图 1)。
|
图 1 钨酸钠处理对盐胁迫胡杨叶片ABA和CaM含量的影响 Figure 1 Effect of tungstate on leaf ABA and CaM levels of NaCl-stressed P. euphratica plants 每个数值均表示3个重复样品的平均值,标有相同字母的表示差异不显著。下同。 Each column is the mean of three plants and values with the same letters are not significantly different. The same below. |
胡杨苗木经NaCl处理后,叶片CaM含量比对照有显著提高,而钨酸钠显著增加了CaM升高的幅度(图 1)。
2.3 EGTA、LaCl3和盐处理对胡杨叶片气体交换的影响对照胡杨苗木经EGTA或LaCl3处理后,苗木叶片的EVAP、Gs和Pn未受到明显影响(表 2)。NaCl处理后,胡杨叶片的气体交换较对照有所降低(表 2),但EGTA和LaCl3处理显著提高了盐胁迫苗木叶片的EVAP和Gs,使之达到了对照苗木的水平(表 2)。
|
|
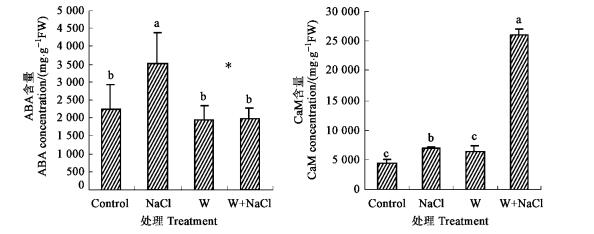
胡杨苗木经NaCl处理后,叶片ABA含量比对照有显著提高(图 2)。EGTA或LaCl3处理对苗木叶片ABA水平的提高具有促进作用,显著增加了对照及盐处理苗木叶片ABA的浓度(图 2)。

|
图 2 EGTA或LaCl3处理对盐胁迫胡杨叶片ABA和CaM含量的影响 Figure 2 Effect of EGTA or LaCl3 on leaf ABA and CaM levels of NaCl-stressed P. euphratica plants |
值得注意的是,EGTA或LaCl3对CaM的影响与对ABA的作用相反。胡杨苗木经NaCl处理4 h后,叶片CaM水平比对照有显著提高(图 2)。EGTA或LaCl3处理对苗木叶片CaM水平的提高具有抑制作用,显著降低了对照及盐处理苗木叶片CaM的浓度:未经NaCl处理的苗木,EGTA或LaCl3处理株CaM含量仅为对照的4%和11%(图 2);经NaCl处理的苗木,EGTA或LaCl3处理株的CaM含量分别为NaCl处理株的27%和10%(图 2)。
2.5 茎导入外源ABA、EGTA和LaCl3对胡杨叶片气体交换的影响对照胡杨苗木经EGTA或LaCl3处理后,苗木叶片的EVAP、Gs和Pn均未受到明显影响。10 μmol·L-1ABA处理4~8 h后,对照苗木叶片的气体交换明显下降,蒸腾速率(EVAP)、气孔导度(Gs)和净光合速率(Pn)分别下降了60%、74%和79% (表 3),但EGTA或LaCl3处理显著降低了ABA对叶片气体交换的限制作用(表 3)。
|
|
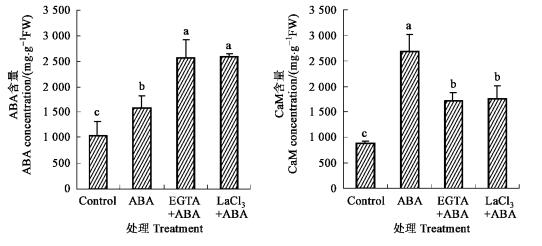
胡杨苗木经10 μmol·L-1 ABA处理4~8 h后,叶片ABA和CaM含量比对照有显著提高(图 3),而且EGTA或LaCl3处理对苗木叶片ABA水平的提高具有促进作用(图 3)。值得注意的是:EGTA或LaCl3对CaM的影响与对ABA的作用相反,即显著降低了ABA处理苗木叶片的CaM含量:EGTA+ABA或LaCl3+ABA处理株的CaM含量仅分别为ABA处理株的59%和60%(图 3)。
|
图 3 EGTA或LaCl3预处理对ABA处理胡杨叶片ABA和CaM含量的影响 Figure 3 Effect of EGTA or LaCl3 on leaf ABA and CaM levels of ABA-treated P. euphratica plants |
试验结果显示,在初始盐胁迫下(50 mmol·L-1 NaCl,4 h),胡杨能做出快速响应,叶片ABA、CaM含量迅速增加,气体交换立即下降(图 1、2,表 1、2)。通过茎部导入外源ABA(10 μmol·L-1 ABA,4~8 h),得到类似结果:在叶片ABA和CaM含量增加的同时,叶片气体交换下降(表 3,图 3),这表明ABA和Ca2+·CaM参与了初始盐胁迫诱导的胡杨气孔关闭。ABA促进气孔关闭的效应主要是通过调控离子通道实现的。以叶片保卫细胞为模式的研究发现,ABA对离子运输过程至少有4种效应,即抑制内向运输的K+通道,激活外向运输的K+通道,促进Ca2+通道的开放和膜的去极化(Assmann et al., 1993)。而且,有人推测ABA对离子运输的影响是通过Ca2+来传递的,已有充分证据表明:Ca2+在植物信号转导过程中具有第二信使的作用。Gilroy等(1990;1991)和McAinsh等(1997)应用Ca2+荧光指示剂对鸭跖草(Commelina communis)表皮保卫细胞Ca2+进行了定量分析,发现ABA处理后,保卫细胞胞质Ca2+浓度显著提高。Ca2+浓度的提高能活化保卫细胞阴离子通道(Assmann et al., 1993)。最近的研究发现,CaM也参与了气孔运动的调控。存在于蚕豆保卫细胞质外体的CaM可以通过激活G蛋白,打开质膜Ca2+通道,诱导细胞外Ca2+内流,导致气孔关闭。在胡杨上应用各种抑制剂的试验表明:盐诱导胡杨叶片气孔的关闭需要ABA和Ca2+·CaM的共同参与。
1) 钨酸钠处理:经钨酸钠处理的胡杨,在盐胁迫下降低了叶片中ABA的升高幅度(图 1), 说明钨酸钠确实抑制了ABA的合成, 这是因为钨酸钠可以抑制ABA合成过程中的ABA醛氧化酶, 使ABA醛不能转化为ABA, 从而抑制了ABA的生物合成(Zhou et al., 2005)。钨酸钠处理虽然降低了ABA水平,但胡杨叶片中CaM的含量却增加了(图 1)。尽管在盐胁迫下CaM的含量有所提高,但胡杨叶片的气体交换未受到影响,究其原因,可能是盐胁迫导致胞质Ca2+浓度瞬时增加,进而激活CaM基因的表达。由此可以说明:ABA在盐诱导的胡杨气孔关闭中起重要作用。
2) EGTA或LaCl3处理:EGTA能够通过螯合作用降低胞外Ca2+浓度从而限制其生理作用(Jiang et al., 2001)。La3+对细胞的负面影响归因于La3+阻碍了质膜上的Ca2+通道, 并且较高浓度的La3+能够完全抑制胞外的Ca2+通过质膜进入细胞。本试验结果显示:EGTA或LaCl3处理显著降低了胡杨的CaM水平(图 2),这与渗透胁迫下小麦的反应不同。PEG胁迫下的小麦,EGTA处理能促进CaM水平的提高(李孟军等,2001;郭秀林等,2001;2002)。而在本试验中,盐胁迫下的胡杨经EGTA处理后,CaM水平降低,这暗示由Ca2+·CaM参与的干旱信号和盐胁迫信号传递机制有所差异。但在EGTA或LaCl3处理下,ABA变化与CaM相反,胡杨ABA水平显著升高(图 2), 这与渗透胁迫下小麦的反应相似。PEG胁迫下的小麦,EGTA处理能促进ABA水平的提高(郭秀林等,2002)。综合以上结果:EGTA或LaCl3处理提高了ABA水平,却使CaM水平下降,胡杨叶片的气体交换未受到盐胁迫影响,可能是保卫细胞胞质Ca2+浓度不能显著提高,原因有2点:①胞外的Ca2+被EGTA螯合,自由水平的Ca2+浓度下降;②La3+阻碍了通过质膜Ca2+通道的内流。尽管EGTA和La3+作用机理不同,但都能不同程度地降低胞内Ca2+浓度,由此影响了Ca2+与CaM复合物的形成,从而导致CaM对气孔的调控能力下降。因此,EGTA或LaCl3处理的试验结果说明,盐诱导胡杨的气孔关闭需要CaM的参与。
3) 通过茎部导入ABA来模拟盐胁迫,进一步证明了上述的推论。试验中使用的10 μmol·L-1的ABA浓度是模拟盐诱导的胡杨内源ABA水平而设置的(Chen et al., 2001)。结果显示:茎部导入ABA使叶片CaM含量增加,叶片气体交换下降(表 3,图 3),而先导入的5 mmol·L-1 EGTA或LaCl3显著降低了ABA处理苗木的CaM水平(图 3),ABA对叶片气体交换的限制也显著下降(表 3),这与上述的试验结果相同。因而进一步证明了初始盐胁迫诱导胡杨叶片气孔关闭的过程需要ABA和CaM共同参与。
总之,在初始盐胁迫下,胡杨ABA和CaM水平提高,叶片气孔导度和蒸腾速率下降,在提高水分利用率的同时,也降低了盐分的根冠运输,这是胡杨对盐胁迫生境产生的适应性调控。钨酸钠、EGTA和LaCl3等抑制剂的使用,都能抑制盐诱导胡杨的气孔关闭,因此得出结论:初始盐胁迫诱导胡杨叶片的气孔关闭需要ABA/Ca2+·CaM的共同参与。
陈玉玲, 李建华, 王学臣. 2003a. 蚕豆保卫细胞中钙调素的免疫电镜定位. 植物生理学通讯, 39(6): 609-612. |
陈玉玲, 肖玉梅, 王学臣, 等. 2003b. G蛋白可能参与细胞外钙调素促进蚕豆气孔关闭的过程. 自然科学进展, 13(4): 343-348. |
郭秀林, 李孟军, 关军锋, 等. 2002. PEG胁迫下小麦幼苗ABA与Ca2+/CaM的关系. 作物学报, 28(4): 537-540. DOI:10.3321/j.issn:0496-3490.2002.04.019 |
郭秀林, 李广敏, 王睿文, 等. 2001. Ca2+/CaM对渗透胁迫下小麦幼苗根和叶中ABA含量的影响(简报). 植物生理学通讯, 37(2): 124-125. |
李春光, 李海燕, 龚明. 2003. Ca2+-CaM对H2O2诱导玉米幼苗耐冷性的影响. 植物生理学通讯, 39(3): 197-200. |
李孟军, 郭秀林, 王春祥. 2001. 渗透胁迫下CaM合成与胞质Ca2+关系初步研究. 河北农业科学, 5(4): 36-39. DOI:10.3969/j.issn.1088-1631.2001.04.009 |
李卫, 孙中海, 章文才, 等. 1997. 钙与钙调素对柑橘原生质体抗冻性的影响. 植物生理学报, 23(3): 262-266. |
黎锡扬, 吴亚华, 王育启. 1988. 植物体内脯氨酸累积和γ-谷氨酰磷酸合成活力的关系. 植物生理学报, 14(3): 301-303. |
刘银谦. 2006. NO参与细胞外CaM调控拟南芥气孔运动机理的研究.河北师范大学硕士学位论文.
|
尚忠林, 马力耕, 王学臣, 等. 2001. 细胞外钙调素对百合花粉细胞内钙离子浓度的影响. 植物学报, 43(1): 12-17. DOI:10.3321/j.issn:1672-9072.2001.01.003 |
孙大业. 1996. 植物细胞信号转导研究进展. 植物生理学通讯, 32(2): 81-91. |
孙大业, 马力耕. 2001. 细胞外钙调素——一种植物中的多肽信使?. 中国科学, 31: 289-297. |
陶文菁, 梁述平, 吕应堂. 2003. 采用GUS标记技术研究钙调素在转基因烟草中的分布. 武汉植物学研究, 21(3): 187-192. DOI:10.3969/j.issn.2095-0837.2003.03.002 |
王恒彬, 张蜀秋, 王学臣, 等. 2003. Ca2+/CaM参与乙酰胆碱调控气孔运动的信号转导. 科学通报, 48(2): 154-156. DOI:10.3321/j.issn:0023-074X.2003.02.011 |
汪良驹, 刘友良, 马凯. 1999. 钙在无花果细胞盐诱导脯氨酸积累中的作用. 植物生理学报, 25(1): 38-42. DOI:10.3321/j.issn:1671-3877.1999.01.006 |
吴颂如, 陈婉芬, 周燮. 1988. 酶联免疫固相吸附法ELISA测定内源植物激素. 植物生理学通讯, 24(5): 53-57. |
肖玉梅, 陈玉玲, 黄荣峰, 等. 2004. 拟南芥保卫细胞微丝骨架解聚可能参与细胞外钙调素诱导的气孔关闭. 中国科学:C辑, 34(2): 129-135. |
赵升皓, 于宏林, 张明志. 1988. 钙调素的酶联免疫吸附测定法. 徐州医学院学报, 8(1): 54-58. |
宗会, 刘娥娥, 郭振飞, 等. 2000. Ca2+/CaM信使系统与水稻幼苗抗逆性研究初报. 华南农业大学学报, 21(1): 63-67. DOI:10.3969/j.issn.1001-411X.2000.01.019 |
Assmann S M. 1993. Signal transduction in guard cells. Annu Rev Cell Biol, 9: 345-375. DOI:10.1146/annurev.cb.09.110193.002021 |
Behl R, Jeschke W D. 1981. Influence of abscisic acid on unidirectional fluxes and intracellular compartmentation of K+ and Na+ in excised barley root segments. Physiol Plant, 53: 95-100. DOI:10.1111/ppl.1981.53.issue-2 |
Bray E A. 2002. Abscisic acid regulation of gene expression during water-deficit stress in the era of the Arabidopsis genome. Plant Cell Environ, 25: 153-161. DOI:10.1046/j.1365-3040.2002.00746.x |
Chang Y, Chen S L, Yin W L, et al. 2006. Growth, gas exchange, abscisic acid and calmodulin response to salt stress in three poplars. Journal of Integrative Plant Biology, 48(3): 286-293. DOI:10.1111/jipb.2006.48.issue-3 |
Chen S, Li J, Wang S, et al. 2001. Salt, nutrient uptake and transport, and ABA of Populus euphratica: a hybrid in response to increasing soil NaCl. Trees, 15: 186-194. DOI:10.1007/s004680100091 |
Chen S, Li J, Wang T, et al. 2003. Gas exchange, xylem ions and abscisic acid response to Na+-salts and Cl--salts in Populus euphratica. Acta Bot Sin, 45: 561-566. |
Chen S, Li J, Wang T, et al. 2002a. Osmotic stress and ion-specific effects on xylem abscisic acid and the relevance to salinity tolerance in poplar. J Plant Growth Regul, 21: 224-233. DOI:10.1007/s00344-002-1001-4 |
Chen S, Wang S, Hüttermann A, et al. 2002b. Xylem abscisic acid accelerates leaf senescence by modulating polyamines and ethylene synthesis in water-stressed intact cuttings of poplar. Trees, 16: 16-22. DOI:10.1007/s00468-001-0138-2 |
Chen Y L, Zhang X Q, Chen J, et al. 2003. Existence of extracellular calmodulin in the lower epidermis of the leaves of Vicia faba and its role in regulating stomatal movements. Acta Bot Sin, 45: 40-46. |
Cottele V, Forestier C, Vavasseur A. 1996. A reassessment of the intervention of calmodulin in the regulation of stomatal movement. Physiol Plant, 98: 619-628. DOI:10.1111/ppl.1996.98.issue-3 |
De Silva D L R, Cox R C, Hetherongton A M, et al. 1985. Suggested involvement of calcium and calmodulin in the response of stomata to abscisic acid. New Phytol, 101: 555-564. DOI:10.1111/nph.1985.101.issue-4 |
Fang Q G, Mamoru Okamoto, Nigel M C. 2003. Identification of a plant nitric oxide synthase gene involved in hormonal signalling. Science, 302: 100-103. DOI:10.1126/science.1086770 |
Finkelstein R R, Gampala S S L, Rock C D. 2002. Abscisic acid signaling in seeds and seedlings. Plant Cell, 14: S15-S45. DOI:10.1105/tpc.010441 |
Finkelstein R R, Rock C D. 2002. Abscisic acid biosynthesis and response. American Society of Plant Biologists: 1-48. |
Gilroy S, Fricker M D, Read N D, et al. 1991. Role of calcium in signal transduction of Commelina guard cells. Plant Cell, 3: 333-334. DOI:10.1105/tpc.3.4.333 |
Gilroy S, Read N D, Trewavas A J. 1990. Elevation of cytoplasmic calcium by caged calcium of caged inositol trisphosphate initiate stomatal closure. Nature, 343: 769-771. |
Guan L M, Zhao J, Scandalios J G. 2000. Cis-element and transfactors that regulate expression of maize Catl antioxidant gene in response to ABA and osmotic stress: H2O2 is the likely intermediary signaling molecule for the response. Plant J, 22: 87-95. DOI:10.1046/j.1365-313x.2000.00723.x |
Guan L, Scandalios J G. 1998a. Effects of the plant growth regulator abscisic acid and high osmoticum on the developmental expression of the maize catalase genes. Physiol Plant, 104: 413-422. DOI:10.1034/j.1399-3054.1998.1040317.x |
Guan L, Scandalios J G. 1998b. Two structurally similar maize cytosolic superoxide dismutase genes, Sod4 and Sod4A, respond differentially to abscisic acid and high osmoticum. Plant Physiol, 11: 217-224. |
Hansen H, Dorffling H. 2003. Root-derived trans-zeatin riboside and abscisic acid in drought-stressed and rewatered sunflower plants: interaction in the control of leaf diffusive resistance?. Functional Plant Biol, 30: 365-375. DOI:10.1071/FP02223 |
Hartung W, Sayter A, Eleonore H. 2002. Abscisic acid in the xylem: where does it come from, where does it go?. J Exp Bot, 366: 27-32. |
Hasegawa P M, Bressan R A, Zhu J K, et al. 2000. Plant cellular and molecular responses to high salinity. Annu Rev Plant Physiol Mol Biol, 51: 463-499. DOI:10.1146/annurev.arplant.51.1.463 |
Jiang Y W, Huang B R. 2001. Effects of calcium on antioxidant activities and water relations associated with heat-tolerance in two cool-season grasses. Journal of Experimental Botany, 35: 341-349. |
Kang S Z, Zhang J. 2004. Controlled alternate partial root-zone irrigation: its physiological consequences and impact on water use efficiency. J Exp Bot, 55: 1-10. |
Karmoker J L, Von Steveninck R F M. 1979. The effect of abscisic acid on the uptake and distribution of ions in intact seedlings of Phaseolus vulgaris cv. Redland Pioneer. Physiol Plant, 45: 453-459. DOI:10.1111/ppl.1979.45.issue-4 |
Kinoshita T, Nishimra M, Shimazaki K. 1995. Cytosolic concentration of Ca2+ regulates the plasmamembrane H+-ATPase in guard cells of fava bean. Plant Cell, 7: 1333-1342. |
Larkindale J, Knight M R. 2002. Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium, abscisic acid, ethylene, and salicylic acid. Plant Physiology, 128: 682-695. DOI:10.1104/pp.010320 |
Liu F, Christian R J, Ali S, et al. 2005. ABA regulated stomatal control and pholosynthetic water use efficiency of potato (Solanum tuberosum) during progressive soil drying. Plant Science, 168: 831-836. DOI:10.1016/j.plantsci.2004.10.016 |
Montero E, Cabot C, Barceló J, et al. 1997. Endogenous abscisic acid levels are linked to decreased growth of bush bean plants treated with NaCl. Physiol Plant, 101: 17-22. DOI:10.1111/ppl.1997.101.issue-1 |
MacRobbie E A. 2006. Osmotic effects on vacuolar ion release in guard cells. Proc Natl Acad Sci USA, 103(4): 1135-1140. DOI:10.1073/pnas.0510023103 |
McAinsh M R, Browniee C, Hetherington A M. 1997. Calcium ions as second messengers in guard cell signal transduction. Physiol Plant, 100: 16-25. DOI:10.1111/ppl.1997.100.issue-1 |
Sarah M A, Shimazaki K. 1999. The multisensory guard cell. Stomatal responses to blue light and abscisic acid. Plant Physiology, 119: 809-815. DOI:10.1104/pp.119.3.809 |
Schroeder J I, Allen G J, Hugouvieux V, et al. 2001. Guard cell signal transduction. Annu Rev Plant Mol Boil, 52: 627-658. DOI:10.1146/annurev.arplant.52.1.627 |
Shimazaki K, Kinoshita T, Nishimura M. 1992. Involvement of calmodulin and calmodulin-dependent myosin light chain kinase in blue light-dependent H+ pumping by guard cell protoplasts from Vicia faba L. Physiol Plant, 99: 1416-1421. DOI:10.1104/pp.99.4.1416 |
Shinozaki K, Yamaguchi-Shinozaki K. 2000. Molecular responses to dehydration and low temperature: Differences and cross-talk between two stress signaling pathways. Curr Opin Plant Biol, 3: 217-223. DOI:10.1016/S1369-5266(00)00067-4 |
Xiong L M, Ishitani M, Lee B H, et al. 2001. The Arabidopsis LOS5/ABA3 locus encodes a molybdenum cofactor sulfurase and modulates cold stress- and osmotic stress-responsive gene expression. Plant Cell, 13: 2063-2083. DOI:10.1105/tpc.13.9.2063 |
Xiong L, Schumaker K S, Zhu J K. 2002. Cell signaling during cold, drought and salt stresses. Plant Cell, 277(14(suppl.)): S165-S183. |
Zhou B Y, Guo Z F. 2005. Effects of abscisic acid and abscisic acid biosynthesis inhibitor to the cold resistance and antioxidant enzymes activity in Stylosanthes guianensis. Acta Pratacul Turae Sinica, 14(6): 94-99. |
Zhu D, Scandalios J G. 1994. Differential accumulation of manganese-superoxi de dismutase transcripts in maize in response to abscisic acid and high osmoticum. Plant Physiol, 106: 173-178. DOI:10.1104/pp.106.1.173 |
 2008, Vol. 44
2008, Vol. 44