2. 上海交通大学材料科学与工程学院,上海 200240
3. 上海交通大学轻合金精密成型国家工程研究中心,上海 200240
4. 玉柴芯蓝新能源动力科技有限公司,南宁 530007
氢能是一种来源丰富、绿色低碳、应用广泛的二次能源。氢能的利用形式包括将水、风、光能等一次能源以氢的形式进行再存储,通过燃料电池发电的形式满足电力供应的需求,最大限度地跨地区、跨季节利用可再生能源,与绿色能源发电协同互补,满足交通、建筑、储能等领域需求。在氢能产业环节中,氢气的储存与运输是连接上游制氢和下游用氢的关键环节。目前,氢气的储存和运输方式主要有高压气态储运氢、液态储运氢、固态储运氢[1-2]。其中,MgH2/Mg储氢体系因其储氢密度高(质量储氢密度为7.6%(wt),体积储氢密度为110 kg/m3)、镁储量丰富(地壳中Mg元素丰度排在第8位)、安全性高等优点[3-5],适用于楼宇/园区/家用燃料电池热电联供系统、燃料电池氢源、氢储能系统、氢冶金/氢化工等应用场景,是极具潜力的储氢体系。MgH2最常见的稳定结构是β-MgH2,其具有很高的结构稳定性,放氢反应焓变为75 kJ/mol H2,在1 bar H2压下自280℃开始热分解放氢[6]。除了热分解放氢外,MgH2还可发生水解放氢反应,理论产氢量高达15.2 wt%。但是,在热解过程中,MgH2的放氢温度较高,放氢动力学较差;水解过程中,由于水解产物Mg(OH)2逐渐包裹在MgH2表面,阻隔了MgH2与水的接触,导致水解反应产率低、速率慢。因此,近年来有大量研究工作致力于对MgH2/Mg储氢体系的材料改性与性能提升,也有一部分研究工作对MgH2/Mg储氢体系的实际应用系统作系统模拟与评测。本文针对镁基储氢体系水解产氢和热分解储氢的材料改性、性能提升,以及纳米镁基储氢材料的研究进展进行总结评述,并指出今后研究的重点和方向。
1 镁基储氢材料水解产氢MgH2水解产氢是一种简易、高效的制氢手段。MgH2与液态水反应生成Mg(OH)2和H2;在高温下与水蒸气反应生成MgO和H2(反应温度高于330℃条件下):

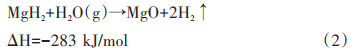
可以发现,MgH2水解反应可以在较为温和的条件下(室温、常压)进行,且理论产氢量是MgH2热解放氢的2倍,为15.2%(wt)。然而,随着水解反应的进行,水解产物Mg(OH)2逐渐包裹在MgH2表面,阻隔了MgH2与水的接触,从而抑制了水解反应的进行。一般可通过改变水解环境、加入催化剂、减小颗粒尺寸等方式来改善MgH2的水解性能。
1.1 水解环境的影响在溶液中加入酸能够有效地溶解Mg(OH)2,从而达到破坏保护层的目的。Tayeh等[7]通过在溶液中加入HCl、H2SO4、HNO3等酸类物质,研究了MgH2在不同pH值下的水解速率(图 1[7]),结果表明,随着pH值下降,水解速率有显著提升;而在相同的pH值下,二元酸(H2SO4)要比一元酸(HCl、HNO3)的提升效果更明显。但加入强酸会致使环境污染且经济效益低,因此可选用弱酸来替代强酸。Kushch等[8]对比了分别加入弱酸和强酸时MgH2的水解产氢性能。研究表明,当多次加入9.2%(wt)H2SO4时,放氢主要在加入强酸的一瞬间发生。而当加入柠檬酸,多次加入等量水,可以发现放氢反应均匀进行,因此弱酸性柠檬酸也可有效破坏Mg(OH)2保护层,使放氢反应持续进行。
 |
图 1 MgH2水解曲线 |
在溶液中添加盐(如NH4Cl[9]、MgCl2[10]等)也可以提升MgH2的水解性能。Zhao等[10]使用氢化燃烧法(HCS)制备了MgH2,经球磨后分别在水和0.5 mol/L MgCl2水溶液中进行水解。实验表明,MgH2在纯水中水解时,最初的3 min产氢速度很快,共释放出192 mL的氢气,但随后产氢速度变得十分缓慢,表明Mg(OH)2已经在Mg颗粒表面形成。而MgH2放入0.5 mol/L MgCl2溶液中时,在最初的3 min内H2的产率达到927 mL/g,为纯水环境水解产氢速率的5倍,50 min内的总放氢量达到1635 mL/g,可见MgCl2显著提升了MgH2的水解性能,反应方程式如(3)~(5)
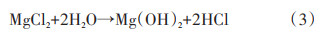
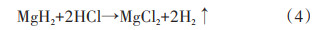
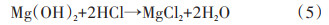
研究表明,在反应的过程中,MgCl2起到了转移Mg(OH)2的作用,即原本在MgH2表面形成的Mg(OH)2转移到溶液中生成,从而避免了保护层的形成,使水解反应能够迅速进行[11-12]。Verbovytskyy等[13]研究了不同金属氯化物MCln(FeCl3、TiCl3、Mg⁃Cl2、ZrCl4)盐溶液对MgH2水解性能的影响。研究表明,FeCl3、TiCl3、MgCl2、ZrCl4等盐溶液提升MgH2水解性能的机理主要是通过金属离子的水解反应,生成M(OH)n沉淀和H+,H+能够溶解表面沉积的Mg(OH)2从而提升MgH2的水解产氢效率。此外,有研究者提出在水解环境中加上超声振动也能松动Mg(OH)2层[14],使MgH2和Mg(OH)2层更加分散,提升MgH2水解性能。
1.2 添加剂的影响除了改变水解环境,通过电弧等离子体法、高能球磨法将过渡金属单质、氧化物、卤化物等与MgH2复合对其表面进行改性,也可显著提升MgH2水解性能。Huang等[15]比较了MoO3、Fe2O3、Fe3O4这3种金属氧化物对MgH2水解性能的影响。研究发现,3种金属氧化物在与MgH2球磨混合过程中可作为助磨剂,增加了MgH2颗粒的新鲜表面,从而有效提升了MgH2水解产氢效率。Tegel等[16]通过球磨法将多种金属卤化物(NaCl、NaBr、MgCl2、MgBr2、Zr⁃Cl4、ZrBr4、FeCl3)与MgH2复合,并探究了金属卤化物对MgH2水解性能的影响规律,研究发现,高价金属卤化物(如FeCl3、MgCl2)能通过形成不溶于水的氢氧化物(Fe(OH)3、Mg(OH)2)和H+,降低水解溶液的pH值,明显提升了MgH2的水解速率。Yang等[17]通过直流电弧等离子体法在MgH2中掺入了TiO2、Al2O3等两性氧化物,研究结果同样表明水解过程中可以产生H+离子,抑制了Mg(OH)2在颗粒表面的形成从而提升复合材料的水解产氢性能。此外,该研究工作发现,当加入Fe2O3作为水解添加剂时,其在电弧过程中产生的Fe单质能在溶液中形成微型原电池,加速反应进行。Mao等[18]采用电弧等离子体气相合金化法制备了Mg-In及Mg-Ag过饱和固溶体超细粉体,两者在后续氢化过程中原位自生为MgH2@MgIn及MgH2@MgAg的特殊微结构(图 2)。25℃时,MgH2@MgIn和MgH2@MgAg样品的实际总产氢量分别为1439和1428 mL/g,而相同条件制得的纯MgH2实际产氢量为1080 mL/g。研究表明,嵌入在MgH2壳层的MgIn或MgAg也参与了水解反应:
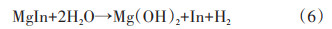
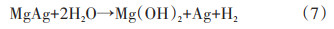
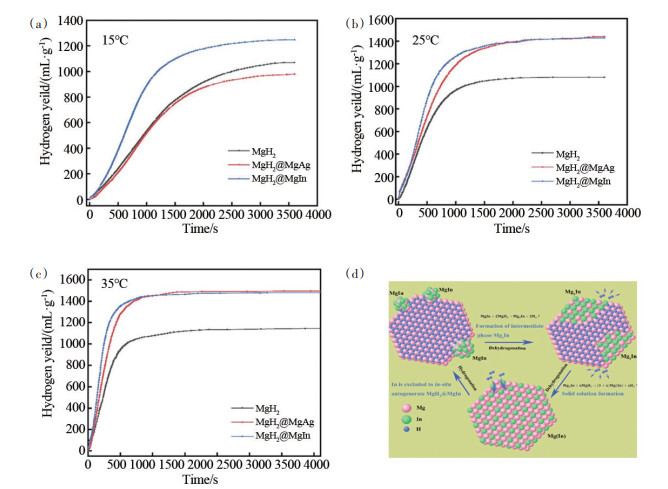 |
(a)~(c)为在不同温度下MgH2、MgH2@MgAg和MgH2@MgIn的水解曲线;(d)为MgH2@MgIn的氢化态结构[18] 图 2 水解曲线及氢化态结构 |
MgIn或MgAg的水解反应吉布斯自由能低于MgH2,因此,MgIn或MgAg更易于与水发生水解反应放出氢气。此外,Huang等[19]用球磨法制备了Mg和10 wt%Mo、MoS2、MoO2、MoO3的复合粉末,探究了复合材料在25℃海水中的水解放氢曲线。添加Mo、MoS2、MoO2和MoO3均能明显提高Mg的水解性能,这主要是因为在Mg和Mo、MoS2、MoO2、MoO3之间形成了微观原电池,加速了放氢反应。并且,电极电位与Mo元素的价态有关,价态越高,电极电位越高,所以相比其他添加物,MoO3表现出最优的水解性能。
1.3 颗粒尺寸的影响减小MgH2颗粒尺寸使有效水解面积增加也会提升镁基储氢材料的水解产氢性能,其微观反应机制主要是颗粒尺寸越小,与水的接触面积越大,水解反应更加剧烈。此外,水解生成的Mg(OH)2对小颗粒的包覆作用更小,也会有助于水解的完成(图 3[11])得到了粒径更细小的MgH2颗粒,水解速率相较未球磨样品有明显提升(图 4(a))。Pighin等[21]在H2气氛下球磨6 h制备得到了纳米结构的MgH2,它由5~100 μm的MgH2团簇组成,每个团簇又由100 nm左右的MgH2颗粒构成,在0.6 mol/L MgCl2溶液中、室温下能达到1390 mL/g的水解产量。Huang等[22]研究了不同粒径MgH2-LaH3复合材料的水解放氢性能(图 4(b)),发现随着粒径从38 μm以上降低到12 μm以下,水解放氢速率有显著的提升,放氢总产量也从187 mL/g提升到了863 mL/g。)]。Ouyang等[20]通过机械球磨市售的MgH2,得到了粒径更细小的MgH2颗粒,水解速率相较未球磨样品有明显提升(图 4(a))。Pighin等[21]在H2气氛下球磨6 h制备得到了纳米结构的MgH2,它由5~100 μm的MgH2团簇组成,每个团簇又由100 nm左右的MgH2颗粒构成,在0.6 mol/L MgCl2溶液中、室温下能达到1390 mL/g的水解产量。Huang等[22]研究了不同粒径MgH2-LaH3复合材料的水解放氢性能(图 4(b)),发现随着粒径从38 μm以上降低到12 μm以下,水解放氢速率有显著的提升,放氢总产量也从187 mL/g提升到了863 mL/g。
 |
图 3 降低颗粒尺寸对MgH2水解性能的影响示意 |
 |
图 4 水解放氢曲线 |
MgH2产氢系统主要包括水解反应器、氢气纯化、热交换器、防爆阀等安全辅助系统等。水解反应器主要是为了控制MgH2产氢流速。例如,陈明等[23]利用反应器内水解反应所产生氢气压力的变化,自动调节反应器内的液位,通过储水器上部的稳压口排出或补充气体自动调节反应器内的液位,达到自动控制水解反应程度的目的,从而获得稳定的氢气产生速率,避免反应快速发生、氢气压力过大导致的安全隐患。邹建新等[24]利用打水泵通过控制水的流速实现氢气流速的控制,同时在反应器中填充多孔材料(硅酸铝陶瓷棉等)防止堵塞管道,储氢材料反应罐如图 5所示。徐波等[25]设计了冷却系统以排出水解反应所放出的大量热,避免高温环境时水解反应太过激烈而产生的安全隐患,所利用的反应体系为MgH2的柠檬酸水溶液。此外,由于MgH2水解反应为放热反应,产出的氢气会携带大量的水蒸气,因此需对氢气作进一步提纯除水来满足高密度氢燃料电池的需要。
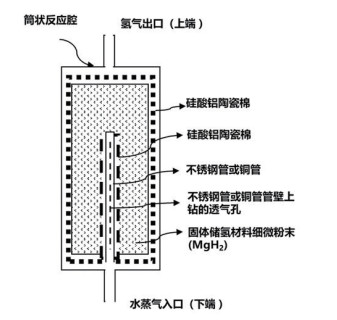 |
图 5 镁储氢材料水解反应罐 |
典型的MgH2水解制氢燃料电池系统如图 6所示。该系统通过MgH2水解制取氢气,再将氢气导入氢燃料电池发电,其优点在于能量密度高、安全性高,且产物Mg(OH)2无毒并可回收利用,适用于千瓦量级以下的中小型备用电源、无人机、水下潜航器等。该水解产氢-燃料电池系统开发的主要难点在于水解反应控制和装置集成,其中涉及到实际耗水量大、产氢不稳定、反应难控制等问题。虽然目前已有研究致力于MgH2水解产氢系统的开发与优化,但未来的研究关键点依旧会在利用材料优化、精确控制加水速率使氢气平稳可控生成,氢净化系统进一步提升供氢纯度以提高工程适用性。
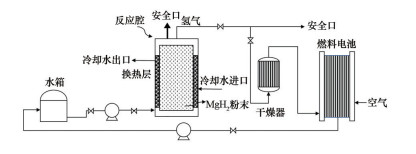 |
图 6 典型的MgH2水解制氢燃料电池系统 |
Mg在300~400℃和2.4~4 MPa氢压下可与氢气直接反应生成MgH2[26]。相应地,MgH2在高温、真空或者低氢压的条件下会发生分解放氢。反应方程式为

MgH2质量和体积储氢密度高,分别可达7.6 wt%和110 kg/m3。Mg与氢气的反应是完全可逆的,反应焓变ΔH为-75 kJ/mol,吸氢时放热,反之放氢时吸热。MgH2热解过程可以分为4步:(1)MgH2发生相变转变为固溶体;(2)氢原子从固溶体层中扩散到表面;(3)氢原子从化学吸附态转变为物理吸附态;(4)氢原子结合成氢分子从Mg颗粒表面释放[27-29]。MgH2放氢反应的初始能垒高达2.52 eV[30],决定MgH2放氢反应的关键因素是Mg—H键的断裂。
2.1.1 MgH2/Mg体系吸放氢过程中的热力学MgH2吸放氢过程是氢、Mg、MgH2三相动态平衡过程。Mg基储氢材料在吸氢初期形成固溶体时吸氢容量极少,在等温状态下当氢压以及氢固溶度升高至特定数值,固溶体(α相)开始向MgH2(β相)转变,β相氢化物形核长大,而此过程随着相变进行氢压不变,直到α相完全转变为MgH2(β相),氢压继续升高,氢化反应完成[30]。随着温度升高,相同材料的相变平台压也越高,随之温度继续升高,平台不断变窄,最终消失。
PCT曲线中的平台压P与温度T的关系,可以通过van't Hoff方程来描述:
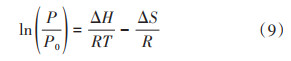
其中,P0为大气压力(1.01×105 Pa),ΔH和ΔS分别为吸放氢反应的焓变和熵变,T为吸放氢反应的绝对温度。
吸放氢反应焓变(ΔH)是衡量Mg—H键强度的重要指标,MgH2的放氢反应焓变较高(75 kJ/mol H2),温度需升高至300℃时才能实现快速放氢[31]。
2.1.2 MgH2/Mg体系吸放氢过程中的动力学Mg基储氢材料的综合吸放氢性能不仅与热力学性能有关,还与动力学性能有关。动力学性能评估主要聚焦于材料吸放氢反应速率方面,而这主要由材料自身结构以及特定条件吸放氢反应机制来决定[1]。金属储氢体系的动力学性能可以通过Arrhenius关系表示:
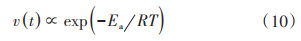
式中,v代表反应速率,Ea代表反应活化能,R为标准气体常数(8.314 J·mol-1·K-1)。
由此可知,当体系具有较高的反应温度和较小的反应活化能时,反应速率较快。因此,为了在较低温度下获得较快的反应速率,需要降低体系的反应势垒。
图 7为镁吸放氢过程相变及活化能变化示意。可以看出,体系由金属初始态向具有较低能态的金属氢化物终态转变前,需要越过一个激发能态。该激活态自由能E即体系吸氢反应活化能,可以直观反映相变过程难易程度,是氢气吸放过程中各个步骤反应发生难易程度的综合体现,活化能越高证明反应越不易进行[32]。在一定温度下,系统自发翻越能垒Ea时将发生动力学失稳。
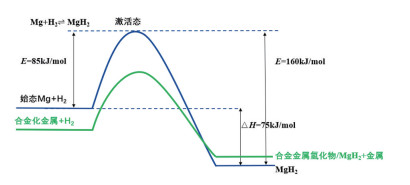 |
图 7 镁基储氢材料吸放氢过程中从初始态经过激发态转变为终态的活化能 |
综上,Mg基储氢材料尚存在以下问题限制其实际应用:(1)热力学上,MgH2的放氢焓变高,热力学稳定性较高;(2)动力学上,Mg/MgH2储氢体系在低温(< 300℃时)吸/放氢动力学较慢;(3)在循环应用中,MgH2/Mg颗粒的团聚和长大导致循环稳定性差。
2.2 Mg基储氢材料研究进展目前针对Mg/MgH2热力学及动力学改性的主要途径包括合金化、添加催化剂和纳米化。
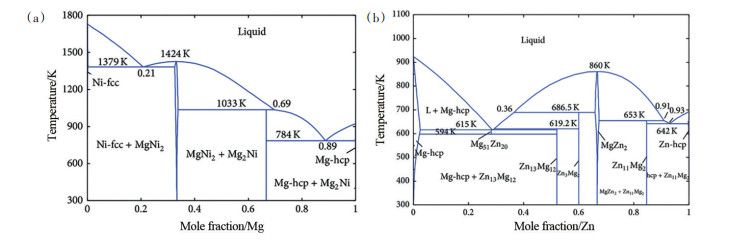
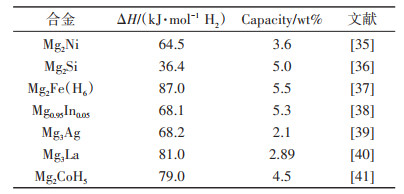
2.2.1 合金化MgH2热力学性质稳定不易分解。如图 8[33]所示,Mg和Ni等其他金属元素可形成合金,可与Zn等其他金属元素形成合金或固溶体[34]。合金化改性即通过Mg与其他合金元素形成金属间化合物或Mg基固溶体来提升体系的储氢性能,是一种提升Mg基储氢材料热力学性能的有效手段。一般地,MgH2的热分解产物为Mg和H2,而氢化态Mg合金的分解产物为更稳定的Mg基合金/固溶体和H2,从而改变了反应路径,降低了体系分解放氢所需要的理论能量。
多种过渡金属元素(Fe、Co、Ni、Pd、Ag等)、部分主族元素(Si等)及稀土元素(La、Ga等)被用于MgH2合金化改性研究。其中Mg-Ni合金以其突出的储氢性能得到了广泛的研究。1968年,Reilly等[35]利用熔炼法制备Mg2Ni,并在氢气氛围下氢化得到Mg2NiH4。测试结果表明,Mg2NiH4的放氢焓变为64.5 kJ/mol H2,相比较纯Mg的75 kJ/mol H2显著降低,这是由于Mg2NiH4中Ni—H的键能比Mg—H的键能更弱。与Ni类似,非金属Si可与Mg形成更稳定的Mg2Si相,在氢化条件下形成MgH2和Si,在热力学上大幅降低Mg基材料的吸氢焓值[36]。不同Mg基储氢合金的储氢容量及形成焓如表 1所示。
|
表 1 Mg基合金储氢性能 |
由于Mg属于轻质金属,高比例重金属掺入合金化会大幅降低系统的储氢容量。此外,值得注意的是,并不是所有的合金化改性策略都可以降低体系的热力学焓值。
2.2.2 添加催化剂氢分子在Mg表面的解离能较高,在MgH2晶格中的扩散速率慢,添加催化剂可以降低氢分子在Mg表面的解离能及扩散势垒,改善吸氢反应的动力学性能[42]。同时,金属的外层电子与H价电子之间的强相互作用会削弱Mg—H键[43],从而改善Mg基储氢材料的放氢性能。因此,添加催化剂是提升Mg基储氢体系综合储氢性能的常用手段。
Mg基储氢材料体系的常见催化剂一般为过渡金属单质及其化合物(包括碳化物、氮化物、氧化物、卤化物等),常规的催化剂按元素分类主要包括Ti基、V基、Nb基、Fe基、Co基、Ni基等。1999年,Liang等[44]对比了Ti、V、Mn、Fe、Ni等单质催化剂对MgH2放氢过程的影响,研究结果发现MgH2—Ti放氢动力学性能最为优异。类似地,Cui等[45]利用湿法化学合成了一系列具有核壳结构的Mg-TM(TM =Ti、Nb、V、Co、Ni等)复合材料,结果表明氢化态复合物的放氢性能按下述趋势减弱:Mg-Ti>Mg-Nb> Mg-Ni>Mg-V>Mg-Co>Mg-Mo。在吸放氢过程中,Ti可以促进其表面的氢分子解离从而加速H元素进入基体,同时弱化Mg—H键,有利于Mg基储氢体系放氢。
Cui等通过在四氢呋喃溶液(THF)中球磨Mg与TiCl3,原位反应生成了Ti(0)、TiH2(2+)等多价态Ti物相,多价Ti共同作为电子转移的中间催化剂,促进了MgH2的分解(图 9)[46-47],大幅降低了MgH2的脱氢温度。Lan等[47]合成在N掺杂的Nb2C表面负载Nb2O5的复合催化剂,其中活性催化相NbN和Nb2O5共同作用弱化了Mg—H的结合力,提供了更多的H原子扩散通道,初始放氢温度降至178℃,材料的循环稳定性明显提升。
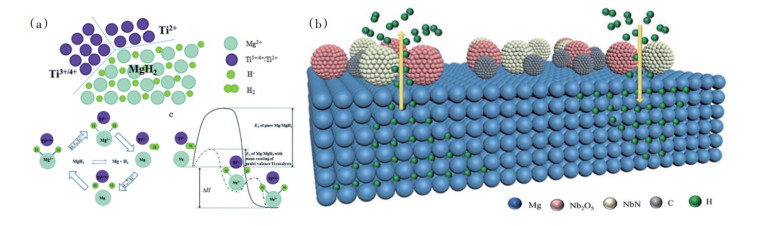 |
图 9 多价Ti物相(a)和多价Nb物相对MgH2动力学改性示意(b) |
为进一步提高催化剂的催化效率,一系列双金属甚至多金属的催化剂得到广泛开发以改善MgH2的储氢性能。2019年,Liu等[48]开发出双向Co/Pd催化剂均匀负载在竹节状碳纳米管上的Co/Pd@BCNT,催化剂呈现出优异的催化性能。复合材料初始放氢温度降至198.9℃,同时实现了在较低温度下的吸氢,在250℃下、10 s吸氢量达到6.68 wt%。TEM、XPS等检测表明,在吸氢过程中,元素Pd加快了H在Pd和Mg原子界面的扩散;而在放氢的过程中,Mg2Co和Mg2CoH5之间的相互转变有效降低了扩散能垒从而促进H原子的释放(图 10[48])。 类似地,Nb-V[49]、Ni-Cu[50]、Nb-Ti[51]等多种双金属催化剂得到广泛研究。
 |
图 10 Co/Pd复合催化剂作用机理示意 |
当块体MgH2尺寸被减小至纳米级别时,材料的比表面积、表面能、晶界密度都将发生显著改变。高的表面能有利于氢分子的解离,纳米颗粒表面与H2反应的活性位点大量增加;由于尺寸的减小,H原子的扩散距离随之缩短,避免了H的长程扩散;大量的晶界为H原子的快速扩散提供了通道。因此,尺寸的纳米化可以同时调控MgH2的热力学和动力学性能。
2.3 Mg固态储氢系统研究进展及应用场景Mg基储氢材料体系的质量储氢密度为4~7.6 wt%,可以在常温常压下进行氢气的存储和运输。与高压气态储氢方式相比,固态储氢具有高储氢密度和高安全的优势,这也降低了对附属设备的要求。图 11为典型的固态储氢罐,主要包括固态储氢材料、壳体、气体管道及过滤器、鳍片、金属泡沫、加热管等强化传热介质,预置空余空间等。
 |
图 11 常见固态储氢罐 |
由于镁基储氢材料在吸氢时会放出大量的热量,在放氢时又需要吸收大量热量,导致储氢容器吸/放氢过程中发生温度骤变的情况,从而限制了金属氢化物的吸/放氢动力学,进一步导致固态储氢容器的吸/放氢速率降低。因此,国内外许多研究人员针对吸/放氢过程中的热效应问题,对固态储氢系统的传热传质过程及其优化设计、数值模型等多方面展开了一系列研究。对于固态储氢系统的设计思路主要分为3种:(1)对固态储氢容器进行结构设计,优化储氢容器热管理系统;(2)提高固态储氢材料床体的热导率;(3)优化固态储氢容器吸放氢过程的操作条件。
固态储氢系统的设计方法主要分为实验方法和数值模拟方法。实验方法是指通过设计并制造一系列固态储氢系统实体,测量系统在不同实验条件下的流量、压强、测点温度等实验数据,进而根据实验数据进行固态储氢系统吸放氢性能的研究及固态储氢系统优化设计。实验方法可获得可靠的数据,但存在成本高、耗时长等缺点,其发展具有局限性。数值模拟是指通过偏微分方程和数学函数的形式表示储氢材料吸/放氢的热力学、动力学性能以及储氢系统中传热传质过程,进一步将方程变量耦合形成描述固态储氢容器吸/放氢过程的数学模型,并采用有限元等方法对数学模型进行求解,用于研究储氢系统吸放氢过程的方法。数值模拟方法具有成本低、效率高等优点,并且可以获得更加全面、直观的数据,逐渐成为目前进行固态储氢系统优化设计的主流方法。但是,目前发展的数学模型大多未考虑吸放氢过程的物性参数动态变化的情况,模拟结果难以直接用于大容量镁基固态储氢系统的优化设计。
在镁基固态储氢系统方面,法国McPhy公司在2010年前后开发了以Mg基合金为储氢介质的Mc⁃Store储氢系统,单罐储氢量可达5 kg。澳大利亚的Hydrexia公司在2015年设计出了基于Mg基合金的储运氢装备,单车储运氢量700 kg,可用于氢气的大规模安全储运。上海交通大学与氢储(上海)能源科技有限公司合作研制出中国首个70 kg级Mg基固态储氢装置原型(图 12),并与宝武清洁能源有限公司合作开发了名为“氢行者”的“太阳能发电-电解水制氢-Mg基固态储/供氢”撬装式一体化氢能源系统,首次实现了Mg基储氢合金体系的示范化应用。
 |
图 12 70 kg级Mg基固态储氢装置原型 |
中国镁年产量占全球85%以上,原料来源丰富且成本低。因此,Mg系储氢合金适合用于氢气的规模储运应用场景,可用于氢冶金、规模储能、加氢站等应用场景的氢气储存与运输。目前国内外正在开发面向应用场景的Mg基固态储运氢技术,但技术水平仍处于产业化初期阶段,仍需解决材料的规模低成本制备、大容量储氢罐设计、高温余热耦合集成等技术,实现储氢合金的高效安全吸放氢。
3 纳米储氢材料开发大量研究表明,镁基储氢材料纳米化可以提高材料的比表面积、缩短氢气的扩散路径、提高材料的表面能、引入具有较高反应活性的缺陷等,从而显著改善镁基储氢材料的动力学及热力学性能。如图 13[4, 54]所示,纳米材料可以分为三维(颗粒、粉末)、二维(薄膜、纳米片)、一维(纳米线、纳米管)和零维(量子点、纳米球、团簇)材料[4, 54]。纳米材料的性能与其维度息息相关,在不同维度的纳米材料中,不同约束方向的电子密度不同,从而导致其材料性能也大不相同,促使研究人员开发不同结构的纳米镁基储氢材料来改善Mg/MgH2体系在储氢领域应用的局限性。
 |
图 13 不同维度的纳米材料分类示意 |
近年来,国内外研究者们尝试用不同技术制备纳米镁基材料,主要包括高能球磨法、化学还原法、氢化法、气相沉积法和熔融法等,取得了卓有成效的研究成果。
3.1 纳米镁基储氢材料的制备方法 3.1.1 三维纳米镁基储氢材料的制备方法高能球磨法具有成本低、效率高的特点,被认为是最简便的将块体MgH2转化为3D纳米级MgH2的方法。在球磨过程中,通过对块体颗粒进行精准可控的机械铣磨,降低颗粒大小、减小Mg/MgH2晶粒尺寸、增加表面缺陷和形核位点、降低氢气扩散距离,同时提高催化剂的均匀弥散分布,从而改善MgH2的储氢性能。
1999年,Huot等[55]通过高能球磨法制备了镁纳米晶,发现经过2 h的球磨就会导致亚稳态的γ- MgH2相的形成,球磨后MgH2的放氢温度与球磨前相比降低了64 K,且动力学得到了明显的提升。全自动比表面与孔隙度分析仪(BET)结果显示,球磨能够增加MgH2的比表面积,通过对比样品球磨前后的显微形貌,发现比表面积的增加主要是由于球磨后,MgH2颗粒更加细小,而大的颗粒是由更小的颗粒聚集而成的,且表面较为粗糙。
近年来,大多数研究集中于将催化剂与MgH2共同球磨制备3D纳米镁基复合储氢材料来进一步改善材料储氢性能。Zhu等[56]将负载有Ni纳米颗粒的Ti3C2与MgH2球磨,得到的纳米镁基复合材料在室温下,5 h内吸氢量可达到4%(wt)H2,在250℃下15 min内可以释放4%(wt)H2,该复合材料优异的吸放氢性能主要得益于球磨过程中颗粒尺寸的减小、催化剂的均匀弥散分布以及多相催化剂成分的形成。Zhang等[57]通过高能球磨法,将花状TiO2@C掺入MgH2使得MgH2的起始放氢温度降低到了180.3℃,花状TiO2@C(fl-TiO2@C)掺杂的MgH2复合材料在250℃时可在7 min内释放6.0%(wt)的H2。此外,与原始的MgH2相比,TiO2@C掺杂MgH2的活化能明显下降到67.10 kJ/mol。样品的显微结构显示,球磨后MgH2+fl-TiO2@C复合材料的尺寸约为200~400 nm。通过高能球磨以及催化剂的掺杂制备的纳米镁基复合储氢材料吸放氢动力学性能得到了明显的改善。
然而,对于三维纳米镁基储氢材料,无论有无催化剂的添加,都只会改善材料吸氢反应的动力学性能,热力学性能的变化并不明显。因此,为了进一步改善材料的综合储氢性能,其他维度的镁基储氢材料的合成也受到广泛的关注。
3.1.2 二维纳米镁基储氢材料的制备方法镁基薄膜是镁基储氢材料中最常见的二维纳米材料,其合成方法主要包括电子束蒸发法[58-59],磁控溅射沉积法[60]以及等离子溅射和脉冲激光沉积[61]等方法。
Barawi等[58]通过电子束蒸发法在熔融二氧化硅基底上制备了厚度在45~900 nm的纳米晶镁薄膜,并在280℃下进行氢化,研究了MgH2薄膜的吸放氢性能。结果表明,氢的解吸过程是由成核和生长过程控制的,镁基薄膜放氢温度(Td=425℃)低于块状MgH2,且脱氢温度随着薄膜厚度的减小而降低。Kumar等[62]利用射频和直流磁控溅射沉积法制备了覆盖有Pd纳米颗粒的Mg薄膜,并通过理论计算和实验数据分析了薄膜的吸放氢动力学行为,提出了Pd纳米颗粒在Mg薄膜上与Mg形成局部的金属-金属界面,这些界面被认为是氢气的快速解离扩散通道,且不同厚度的薄膜吸放氢动力学行为明显不同(图 14)。
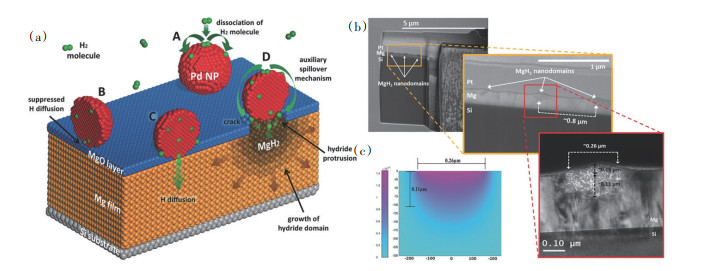 |
(a)Pd/Mg薄膜的氢化机制示意;(b)Pd/MgH2薄膜的TEM及SEM照片;(c)基于菲克第二定律的扩散模型预测氢气在Pd/Mg薄膜中的表观扩散系数[62] 图 14 Pd/Mg薄膜的吸放氢研究结果 |
2007年,Li等[63]利用气相沉积法,通过控制氩气流量制备了不同尺寸(直径为30~50 nm、80~ 100 nm和150~170 nm)的镁纳米线。测试结果表明,随着镁纳米线直径的降低,材料的吸放氢速率逐渐加快,相同温度下的储氢容量也呈上升趋势。如图 15所示,当镁纳米线直径低于50 nm时,样品在373 K下、30 min可吸收2.93%(wt)的氢气,在573 K下、30 min可吸收7.60%(wt)的氢气。在脱氢过程中,该样品在473 K下、30 min内的氢释放量高达3.28%(wt)。值得一提的是,虽然这些纳米线具有优异的吸放氢动力学性能,但是由于纳米线结构的不稳定性,经过10次循环后,纳米线坍塌为纳米粒子,储氢容量仍保持不变。
 |
(a)镁纳米线性能改善示意;(b)30~50 nm镁纳米线的SEM图;(c)80~100 nm镁纳米线的SEM图;(d)150~170 nm镁纳米线的SEM图;(e)镁纳米线的吸氢动力学性能;(f)镁纳米线的放氢动力学性能(三角形:30~50 nm;圆形:80~100 nm;方形:150~170 nm)[63] 图 15 镁纳米线的制备及其储氢性能 |
纳米团簇或粒径小于10 nm的镁基储氢材料的制备方法主要有化学还原法、纳米限域、纳米封装等。
化学还原法常用来通过还原Mg2+前驱体获得金属Mg纳米晶体。Jeon等[64]借助对氢气具有选择性的聚甲基丙烯酸甲酯(PMMA),使用萘基锂还原二茂镁(MgCp2),合成了Mg/PMMA纳米复合材料,Mg纳米颗粒的平均直径约为5 nm。Mg/PMMA复合材料在200℃下30 min内吸氢量达4%(wt)H2。此外,PMMA可以有效防止Mg/MgH2的氧化和团聚,保持纳米镁基储氢材料的循环稳定性。
镁基储氢材料纳米化可以大幅度提升MgH2的储氢性能,但是当纳米尺寸的MgH2在高温下经历长期的吸放氢循环后,由于MgH2自身体积的收缩与膨胀以及高温下颗粒的长大和团聚,导致其容量大幅度衰减,因此纳米尺寸的MgH2通常都不具备优异的循环稳定性。然而,美国能源部对于车载储氢材料制定的目标是至少能够稳定循环1500圈,因此研究者尝试利用纳米限域/纳米封装手段,通过引入稳定的框架材料来限域/封装MgH2纳米颗粒,从而提升镁基储氢材料的循环稳定性。
Nielsen等[65]以二丁基镁为前驱体,将其浸渍到碳凝胶中,并通过随后的高压氢化手段,制备了限域到碳凝胶中的MgH2纳米颗粒。微观结构表征显示MgH2纳米颗粒均匀地分布在碳气凝胶中(图 16(a)[65]),吸放氢测试发现在523 K就可释放2.2%(wt)H2,而在相同条件下球磨所得MgH2的放氢量仅为0.12%(wt)。通过碳凝胶限域的方法制备MgH2纳米颗粒可以显著提高MgH2的放氢动力学性能和循环稳定性。Jia等[66]利用氢化法将纳米MgH2限域在CMK-3孔道内部,并研究了MgH2- CMK-3界面处的电荷转移,提出了一种通过纳米尺寸效应和MgH2-C界面处Mg—C键的形成来降低Mg—H键结合能的新机制。程序升温测试(TPD)结果表明,装载量为37.5%(wt)的MgH2@CMK-3复合材料的起始放氢温度降低到了50℃(图 16(b))。除三维碳材料常被用做纳米限域的框架材料外,二维石墨烯材料也可用来负载MgH2纳米颗粒。Xia等[67]在温和的反应条件下(200℃和3.5 MPa H2)通过氢化法合成石墨烯负载MgH2和Ni纳米颗粒(图 16(c))。MgH2-Ni-石墨烯复合材料的吸/放氢性能和微观结构如图 16(d)~(f)[67]所示。该复合材料在100个循环后的储氢量仍为5.35%(wt)。SEM及TEM结果表明,制得的MgH2纳米粒子尺寸较小(2~5 nm)且分散性较高,因此具有优异的热/动力学性能。
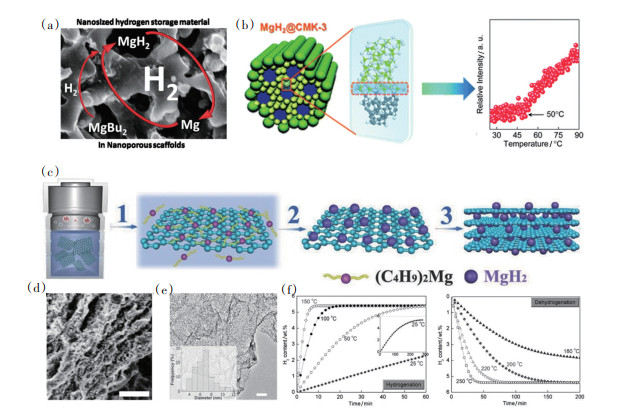 |
(a)碳凝胶限域MgH2纳米颗粒[65];(b)MgH2@CMK-3纳米限域机理及TPD测试结果[66];(c)石墨烯负载MgH2纳米颗粒合成示意;(d)MgH2/Ni@Gr的SEM形貌;(e)MgH2/Ni@Gr的TEM形貌;(f)MgH2/Ni@Gr吸放氢动力学测试[67] 图 16 MgH2纳米颗粒及其吸放氢动力学测试 |
传统的碳材料凭借其优异的稳定性和较大的比表面积而被广泛应用于纳米限域的框架材料,但由于碳材料自身对MgH2的吸放氢过程不具备催化效应,导致MgH2纳米颗粒的储氢动力学性能改善不明显。基于此,Zhu等[68-70]进一步拓宽了框架材料的选取范围,开发了MXene(MX)、MOF等具备催化活性的材料限域的纳米镁基复合材料体系。MOF具备丰富的孔径、较大的比表面积和具有催化活性的金属位点,但由于大多MOF材料均为微孔分布,极大限制了MgBu2的浸渍。Zhu等[68]利用煅烧处理的三维褶皱Ti3C2Tx作为基体成功的对纳米MgH2颗粒进行了均匀负载(图 17(a)~(b)),获得的复合储氢材料(MgH2@Ti-MX)具有较高的储氢容量(4.1%(wt)),起始放氢温度降低到140℃,并表现出快速的吸放氢动力学(图 17(c))及优异的循环稳定性能。在整个材料体系中,Ti-MX不仅为Mg/MgH2纳米颗粒提供大量的限域位点,而且原位形成的TiH2对Mg/MgH2的吸放氢表现出显著催化作用。Ma等[69]利用NaS对金属有机框架材料(ZIF- 67)进行可控刻蚀,合成了一种空心的CoS立方体,通过氢化浸渍在CoS-Nano Boxes(NB)框架中的MgBu2成功制备尺寸约为3 nm的MgH2颗粒(图 17(d)~(e)),氢化后CoS-NB与Mg反应原位生成MgS/Co纳米催化剂,热/动力学性能显著提升。此外,CoS-NB的限域效应有效防止了Mg/MgH2颗粒团聚,从而提高其循环性能。经过PCI(pressurecomposition-isotherm)曲线拟合后,可以看出MgH2@CoS-NB复合材料的吸放氢焓变分别降低到65.6和68.1 kJ/mol H2,如图 17(f)~(g)所示。
 |
(a)MXene限域MgH2纳米颗粒机理示意;(b)MgH2@Ti-MX复合储氢材料的TEM形貌;(c)MgH2@Ti-MX复合储氢材料的TPD结果[68];(d)MgH2@CoS-NBs合成流程;(e)MgH2@CoS-NBs的BF图;(f)MgH2@CoS-NBs的PCI曲线;(g)MgH2@CoS-NBs的van's Hoff方程拟合曲线[69] 图 17 具备催化活性材料限域的纳米镁基复合材料体系 |
此外,Zhang等[71]在THF溶液中利用超声驱动的液-固置换反应利用LiH作还原剂成功合成了粒径约为4~5 nm的纳米MgH2颗粒。该纳米MgH2在30℃的低温下的储氢量高达6.7%(wt),且循环50周后的储氢量仍高达99%。MgH2的储氢热/动力学都得到大幅改善(放氢焓变为59.5 kJ/mol H2,吸/放氢活化能分别为28和80 kJ/mol)。TEM分析表明超声处理有助于抑制MgH2晶体的长大,从而获得超细纳米颗粒。此外,超声法制备的MgH2颗粒的表面较稳定,因此纳米MgH2颗粒具有优异的循环稳定性。
3.2 纳米镁基材料的储氢性能及机制分析根据van't Hoff方程绘制MgH2吸放氢的van't Hoff图(图 18(a)),可以看出,为了降低氢化镁的吸放氢温度,就需要对相应的ΔH和ΔS进行调节,对于大多数氢化物,其ΔS几乎不变(~130 J·K-1· mol-1 H2),因此大多数研究致力于改善MgH2的热力学焓值。而纳米化是一种可以有效降低ΔH的手段,随着MgH2颗粒尺寸的逐渐减小,材料表面积增加,暴露于表面的原子逐渐增多,导致材料表面能提高,因此,当纳米级的MgH2脱氢时,如果氢化物的表面能大于金属的表面能,部分生成热将被储存为多余的表面能,这将导致热力学焓值降低(图 18(b))。
 |
图 18 MgH2体系吸放氢特性 |
前文介绍了纳米结构的Mg/MgH2在储氢应用中的优势和不同尺寸纳米镁基储氢材料的性能分析。镁因具有低成本效益、较高的储氢容量、循环稳定性和可逆性以及较低的毒性,已被认为是一种具有商业应用前景的储氢材料,而新型纳米镁基储氢材料是未来清洁、可再生和可持续能源储存系统最有潜力的选择。Mg/MgH2较高的解吸温度和迟缓的吸附动力学的热力学障碍可以通过先进的合成技术和Mg/MgH2的尺寸纳米化来克服。镁基储氢材料纳米化,不仅可以有效降低MgH2的稳定性,改善其热力学性能,在纳米化过程中引入的缺陷位点及多界面可以有效缩短氢气的扩散路径,提高氢化镁的动力学性能。
4 结论氢化镁具备高储氢密度和低成本,可通过热解和水解2种方式来供氢,因此被认为是一种极具应用潜力的储氢材料,但其商业化应用最大的挑战是热解吸放氢动力学缓慢、温度较高,而水解转化率较低。研究者们开发了包括材料组分改性、微观结构优化、反应条件改善等方法来提升镁基材料的吸放氢性能及水解产氢性能,取得了卓有成效的研究成果。
1)改善MgH2的水解性能涵盖改善水解环境、加入催化剂、减小颗粒尺寸等3个方面。目前MgH2的水解性能实验研究已趋于完善,重点应关注MgH2水解产氢速率平稳可控,并进一步提升供氢纯度来提高工程适用性。
2)改善MgH2储氢性能的方法包括合金化、掺杂催化剂、纳米化等。在各种催化剂中,金属基催化剂与碳复合材料对镁基材料的循环稳定性也有显著改善作用,可以作为一类理想的催化添加剂提升镁基储氢材料的吸放氢动力学性能。在工程应用中,目前还处于初级验证阶段,特别是大规模应用阶段需要的氢热耦合理论模型及其系统优化设计技术,是研究的重点方向。
未来,为了助力实现碳达峰、碳中和的目标,构建清洁低碳、安全高效的能源体系,促进氢能产业高质量发展,需进一步开发高效、高安全的镁基固态储运氢技术。在镁基储氢材料方面,将开发低成本、长寿命的镁基储氢材料及其规模稳定制备技术,用于氢气大规模低成本安全运输;利用纳米限域与原位催化剂协同作用等手段,开发同时具备低放氢温度和高容量的新型镁基复合储氢材料,探索其在车载氢动力系统中的应用。在镁基储运氢系统方面,需要进一步改善其氢热耦合理论模型,优化设计高填充密度、高传热性能、低流阻的镁基固态储运氢系统,并结合加氢站、氢冶金、氢化工、氢储能等应用场景,展开示范应用与推广。通过利用风电、光电等清洁能源产生的电力来电解水产生绿氢并存放于镁基固态储运氢车,再运输至加氢站/氢-电储能站中,给氢燃料电池车供氢或进行氢-电转换后稳定地供电(图 19),是未来镁基固态储运氢技术重要的应用方向。镁基固态储运氢技术的发展,将为未来中国能源体系变革、交通运输方式低碳化转变奠定基础。
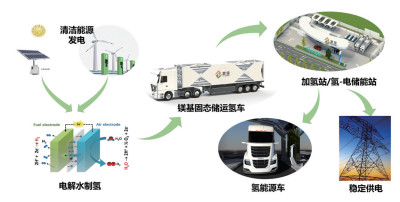 |
图 19 未来镁基固态储运氢技术的应用示意 |
| [1] | Lai Q W, Paskevicius M, Sheppard D A, et al. Hydrogen storage materials for mobile and stationary applications: Current state of the art[J]. Chemsuschem, 2015, 8(17): 2789-2825. |
| [2] | Lototskyy M V, Yartys V A, Pollet B G, et al. Metal hydride hydrogen compressors:A review[J]. International Journal of Hydrogen Energy, 2014, 39(11):5818-5851. |
| [3] | Jia Y, Sun C H, Shen S H, et al. Combination of nanosizing and interfacial effect:Future perspective for designing Mg-based nanomaterials for hydrogen storage[J]. Renewable and Sustainable Energy Reviews, 2015, 44:289-303. |
| [4] | Sadhasivam T, Kim H T, Jung S, et al. Dimensional effects of nanostructured Mg/MgH2 for hydrogen storage applications:A review[J]. Renewable and Sustainable Energy Reviews, 2017, 72:523-534. |
| [5] | Zhang J, Yan S, Qu H. Recent progress in magnesium hydride modified through catalysis and nanoconfinement[J]. International Journal of Hydrogen Energy, 2018, 43(3): 1545-1565. |
| [6] | Chen H P, Yu H, Zhang Q Q, et al. Enhancement in dehydriding performance of magnesium hydride by iron incorporation:A combined experimental and theoretical investigation[J]. Journal of Power Sources, 2016, 322:179-186. |
| [7] | Tayeh T, Awad A S, Nakhl M, et al. Production of hydrogen from magnesium hydrides hydrolysis[J]. International Journal of Hydrogen Energy, 2014, 39(7):3109-3117. |
| [8] | Kushch S D, Kuyunko N S, Nazarov R S, et al. Hydrogengenerating compositions based on magnesium[J]. International Journal of Hydrogen Energy, 2011, 36(1):1321-1325. |
| [9] | Huang M H, Ouyang L Z, Wang H, et al. Hydrogen generation by hydrolysis of MgH2 and enhanced kinetics performance of ammonium chloride introducing[J]. International Journal of Hydrogen Energy, 2015, 40(18):6145-6150. |
| [10] | Zhao Z L, Zhu Y F, Li L Q. Efficient catalysis by MgCl2 in hydrogen generation via hydrolysis of Mg-based hydride prepared by hydriding combustion synthesis[J]. Chemical Communications, 2012, 48(44):5509-5511. |
| [11] | Awad A S, El-Asmar E, Tayeh T, et al. Effect of carbons (G and CFs), TM (Ni, Fe and Al) and oxides (Nb2O5 and V2O5) on hydrogen generation from ball milled Mg-based hydrolysis reaction for fuel cell[J]. Energy, 2016, 95:175-186. |
| [12] | Chen J, Fu H, Xiong Y F, et al. MgCl2 promoted hydrolysis of MgH2 nanoparticles for highly efficient H2 generation[J]. Nano Energy, 2014, 10:337-343. |
| [13] | Verbovytskyy Y V, Berezovets V V, Kytsya A R, et al. Hydrogen generation by the hydrolysis of MgH2[J]. Materials Science, 2020, 56(1):1-14. |
| [14] | Hiroi S, Hosokai S, Akiyama T. Ultrasonic irradiation on hydrolysis of magnesium hydride to enhance hydrogen generation[J]. International Journal of Hydrogen Energy, 2011, 36(2):1442-1447. |
| [15] | Huang M H, Ouyang L Z, Chen Z L, et al. Hydrogen production via hydrolysis of Mg-oxide composites[J]. International Journal of Hydrogen Energy, 2017, 42(35): 22305-22311. |
| [16] | Tegel M, Schöne S, Kieback B, et al. An efficient hydrolysis of MgH2-based materials[J]. International Journal of Hydrogen Energy, 2017, 42(4):2167-2176. |
| [17] | Yang B, Zou J X, Huang T P, et al. Enhanced hydrogenation and hydrolysis properties of core-shell structured Mg-MOx (M=Al, Ti and Fe) nanocomposites prepared by arc plasma method[J]. Chemical Engineering Journal, 2019, 371:233-243. |
| [18] | Mao J W, Huang T P, Panda S, et al. Direct observations of diffusion controlled microstructure transition in Mg-In/Mg-Ag ultrafine particles with enhanced hydrogen storage and hydrolysis properties[J]. Chemical Engineering Journal, 2021, 418:129301. |
| [19] | Huang M H, Ouyang L Z, Ye J S, et al. Hydrogen generation via hydrolysis of magnesium with seawater using Mo, MoO2, MoO3 and MoS2 as catalysts[J]. Journal of Materials Chemistry A, 2017, 5(18):8566-8575. |
| [20] | Ouyang L Z, Ma M L, Huang M H, et al. Enhanced hydrogen generation properties of MgH2-based hydrides by breaking the magnesium hydroxide passivation layer[J]. Energies, 2015, 8(5):4237-4252. |
| [21] | Pighin S A, Urretavizcaya G, Bobet J L, et al. Nanostructured Mg for hydrogen production by hydrolysis obtained by MgH2 milling and dehydriding[J]. Journal of Alloys and Compounds, 2020, 827:154000. |
| [22] | Huang J M, Duan R M, Ouyang L Z, et al. The effect of particle size on hydrolysis properties of Mg3La hydrides [J]. International Journal of Hydrogen Energy, 2014, 39 (25):13563-13568. |
| [23] | 陈明, 汪元奎, 马祥, 等. 一种固定式氢化镁水解自动控制装置及方法:202010177226.4[P]. 2020-07-07. |
| [24] | 邹建新, 秦悦, 谷杰人. 一种以氢化镁为储氢材料的制氢方法及装置:201811160760.3[P]. 2019-01-22. |
| [25] | 徐波, 沈煜遥, 马冯琪, 等. 一种氢化镁水解制氢装置: 202221165281.2[P]. 2022-07-26. |
| [26] | Yu X B, Tang Z W, Sun D L, et al. Recent advances and remaining challenges of nanostructured materials for hydrogen storage applications[J]. Progress in Materials Science, 2017, 88:1-48. |
| [27] | Chen H P, Han Z Y, Feng X, et al. Solid-phase hydrogen in a magnesium-carbon composite for efficient hydrogenation of carbon disulfide[J]. Journal of Materials Chemistry A, 2018, 6(7):3055-3062. |
| [28] | Sun Y H, Shen C Q, Lai Q W, et al. Tailoring magnesium based materials for hydrogen storage through synthesis:Current state of the art[J]. Energy Storage Materials, 2018, 10:168-198. |
| [29] | Schlapbach L, Griessen R, Gupta M. Hydrogen in intermetallic compounds I:Electronic, thermodynamic, and crystallographic properties, preparation[M]. Berlin: Springer Verlag, 1988. |
| [30] | Dong S, Li C Q, Wang J H, et al. The "burst effect" of hydrogen desorption in MgH2 dehydrogenation[J/OL]. Journal of Materials Chemistry A, 2022, https://doi.org/10.1039/D2TA06458H. |
| [31] | Aguey-Zinsou K F, Ares-Fernandez J R. Hydrogen in magnesium:New perspectives toward functional stores [J]. Energy & Environmental Science, 2010, 3(5), 526-543. |
| [32] | Huang T P, Huang X, Hu C Z, et al. MOF-derived Ni nanoparticles dispersed on monolayer MXene as catalyst for improved hydrogen storage kinetics of MgH2[J]. Chemical Engineering Journal, 2021, 421:127851. |
| [33] | Okamoto H. Mg-Ni (Magnesium-Nickel)[J]. Journal of Phase Equilibria and Diffusion, 2007, 28(3):303. |
| [34] | Ghosh P, Mezbahul-Islam M, Medraj M. Critical assessment and thermodynamic modeling of Mg-Zn, Mg-Sn, Sn-Zn and Mg-Sn-Zn systems[J]. Calphad, 2012(36): 28-43. |
| [35] | Reilly J J, Wiswall R H. Reaction of hydrogen with alloys of magnesium and nickel and the formation of Mg2NiH4[J]. Inorganic Chemistry, 1968, 7:2254-2256. |
| [36] | Vajo J J, Mertens F, Ahn C C, et al. Altering hydrogen storage properties by hydride destabilization through alloy formation:LiH and MgH2 destabilized with Si[J]. Journal of Physical Chemistry B, 2004, 108(37):13977-13983. |
| [37] | Chen X, Zou J X, Zeng X Q, et al. Hydrogen storage in Mg2Fe(Ni)H6 nanowires synthesized from coarse-grained Mg and nano sized γ-Fe(Ni) precursors[J]. International Journal of Hydrogen Energy, 2016, 41(33):14795-14806. |
| [38] | Zhong H C, Wang H, Liu J W, et al. Altered desorption enthalpy of MgH2 by the reversible formation of Mg(In) solid solution[J]. Scripta Materialia, 2011, 65(4):285-287. |
| [39] | Si T Z, Zhang J B, Liu D M, et al. A new reversible Mg3Ag-H2 system for hydrogen storage[J]. Journal of Alloys and Compounds, 2013, 581:246-249. |
| [40] | Ouyang L Z, Qin F X, Zhu M. The hydrogen storage behavior of Mg3La and Mg3LaNi0.1[J]. Scripta Materialia, 2006, 55(12):1075-1078. |
| [41] | 马建丽, 王艳, 陶占良, 等. 具有18电子结构的Mg2CoH5纳米晶制备及其储氢性能研究[J]. 无机化学学报, 2012, 28(4):657-661. |
| [42] | Pozzo M, Alfè D. Hydrogen dissociation and diffusion on transition metal (=Ti, Zr, V, Fe, Ru, Co, Rh, Ni, Pd, Cu, Ag)-doped Mg(0001) surfaces[J]. International Journal of Hydrogen Energy, 2009, 34:1922-1930. |
| [43] | Liu T, Zhang T W, Zhang X Z, et al. Synthesis and hydrogen storage properties of ultrafine Mg-Zn particles[J]. International Journal of Hydrogen Energy, 2011, 36: 3515-3520. |
| [44] | Liang G, Huot J, Boily S, et al. Catalytic effect of transition metals on hydrogen sorption in nanocrystalline ball milled MgH2-Tm (Tm=Ti, V, Mn, Fe and Ni) systems[J]. Journal of Alloys and Compounds, 1999, 292(1/2):247-252. |
| [45] | Cui J, Liu J W, Wang H, et al. Mg-TM (TM:Ti, Nb, V, Co, Mo or Ni) core-shell like nanostructures:synthesis, hydrogen storage performance and catalytic mechanism [J]. Journal of Materials Chemistry A, 2014, 2(25): 9645-9655. |
| [46] | Cui J, Wang H, Liu J W, et al. Remarkable enhancement in dehydrogenation of MgH2 by a nano-coating of multi-valence Ti-based catalysts[J]. Journal of Materials Chemistry A, 2013, 1(18):5603-5611. |
| [47] | Lan Z Q, Fu H, Zhao R L, et al. Roles of in situ-formed NbN and Nb2O5 from N-doped Nb2C MXene in regulating the re/hydrogenation and cycling performance of magnesium hydride[J]. Chemical Engineering Journal, 2022, 431:133985. |
| [48] | Liu M, Xiao X, Zhao S, et al. Facile synthesis of Co/Pd supported by few-walled carbon nanotubes as an efficient bidirectional catalyst for improving the low temperature hydrogen storage properties of magnesium hydride [J]. Journal of Materials Chemistry A, 2019, 7(10): 5277-5287. |
| [49] | Meng Y, Ju S, Chen W, et al. Design of Bifunctional Nb/V Interfaces for Improving Reversible Hydrogen Storage Performance of MgH2[J]. Small Structures, 2022: 2200119. |
| [50] | Liu J C, Liu Y N, Liu Z B, et al. Effect of rGO supported NiCu derived from layered double hydroxide on hydrogen sorption kinetics of MgH2[J]. Journal of Alloys and Compounds, 2019, 789:768-776. |
| [51] | Xian K C, Wu M H, Gao M X, et al. A unique nanoflake-shape bimetallic Ti-Nb oxide of superior catalytic effect for hydrogen storage of MgH2[J]. Small, 2022: 2107013. |
| [52] | Anbarasu S, Muthukumar P, Mishra S C. Thermal modeling of LmNi4.91Sn0.15 based solid state hydrogen storage device with embedded cooling tubes[J]. International Journal of Hydrogen Energy, 2014, 39(28):15549-15562. |
| [53] | Dhaou H, Ben Khedher N, Mellouli S, et al. Improvement of thermal performance of spiral heat exchanger on hydrogen storage by adding copper fins[J]. International Journal of Thermal Sciences, 2011, 50(12):2536-2542. |
| [54] | Sajanlal P R, Sreeprasad T S, Samal A K, et al. Anisotropic nanomaterials:Structure, growth, assembly, and functions[J]. Nano Reviews, 2011, 2(1):5883. |
| [55] | Huot J, Liang G, Boily S, et al. Structural study and hydrogen sorption kinetics of ball-milled magnesium hydride[J]. Journal of Alloys and Compounds, 1999, 293: 495-500. |
| [56] | Zhu W, Panda S, Lu C, et al. Using a self-assembled two-dimensional mxene-based catalyst (2D-Ni@Ti3C2) to enhance hydrogen storage properties of MgH2[J]. ACS Applied Materials & Interfaces, 2020, 12(45):50333-50343. |
| [57] | Zhang M, Xiao X Z, Luo B S, et al. Superior de/hydrogenation performances of MgH2 catalyzed by 3D flowerlike TiO2@C nanostructures[J]. Journal of Energy Chemistry, 2020, 46:191-198. |
| [58] | Barawi M, Granero C, Díaz-Chao P, et al. Thermal decomposition of non-catalysed MgH2 films[J]. International Journal of Hydrogen Energy, 2014, 39(18):9865-9870. |
| [59] | Tan Z, Chiu C, Heilweil E J, et al. Thermodynamics, kinetics and microstructural evolution during hydrogenation of iron-doped magnesium thin films[J]. International Journal of Hydrogen Energy, 2011, 36(16):9702-9713. |
| [60] | Borsa D M, Gremaud R, Baldi A, et al. Structural, optical, and electrical properties of MgyTi1-yHx thin films[J]. Physical Review B, 2007, 75(20):205408. |
| [61] | Singh S, Eijt S W H, Zandbergen M W, et al. Nanoscale structure and the hydrogenation of Pd-capped magnesium thin films prepared by plasma sputter and pulsed laser deposition[J]. Journal of Alloys and Compounds, 2007, 441(1):344-351. |
| [62] | Kumar S, Pavloudis T, Singh V, et al. Hydrogen flux through size selected Pd nanoparticles into underlying mg nanofilms[J]. Advanced Energy Materials, 2018, 8 (4):1701326. |
| [63] | Li W Y, Li C S, Ma H, et al. Magnesium nanowires:Enhanced kinetics for hydrogen absorption and desorption [J]. Journal of the American Chemical Society, 2007, 129 (21):6710-6711. |
| [64] | Jeon K J, Moon H R, Ruminski A M, et al. Air-stable magnesium nanocomposites provide rapid and high-capacity hydrogen storage without using heavy-metal catalysts[J]. Nature Materials, 2011, 10(4):286-290. |
| [65] | Nielsen T K, Manickam K, Hirscher M, et al. Confinement of MgH2 nanoclusters within nanoporous aerogel scaffold materials[J]. ACS Nano, 2009, 3(11):3521-3528. |
| [66] | Jia Y, Sun C H, Cheng L N, et al. Destabilization of Mg -H bonding through nano-interfacial confinement by unsaturated carbon for hydrogen desorption from MgH2 [J]. Physical Chemistry Chemical Physics, 2013, 15(16): 5814-5820. |
| [67] | Xia G L, Tan Y B, Chen X W, et al. Monodisperse magnesium hydride nanoparticles uniformly self-assembled on graphene[J]. Advanced Materials, 2015, 27(39): 5981-5988. |
| [68] | Zhu W, Ren L, Lu C, et al. Nanoconfined and in situ catalyzed MgH2 self-assembled on 3D Ti3C2 MXene folded nanosheets with enhanced hydrogen sorption performances[J]. ACS Nano, 2021, 15(11):18493-18504. |
| [69] | Ma Z W, Panda S, Zhang Q Y, et al. Improving hydrogen sorption performances of MgH2 through nanoconfinement in a mesoporous CoS nano-boxes scaffold[J]. Chemical Engineering Journal, 2021, 406:126790. |
| [70] | Ma Z W, Zhang Q Y, Panda S, et al. In situ catalyzed and nanoconfined magnesium hydride nanocrystals in a Ni-MOF scaffold for hydrogen storage[J]. Sustainable Energy & Fuels, 2020, 4(9):4693-4703. |
| [71] | Zhang X, Liu Y F, Ren Z H, et al. Realizing 6.7 wt% reversible storage of hydrogen at ambient temperature with non-confined ultrafine magnesium hydrides[J]. Energy & Environmental Science, 2021, 14:2302-2313. |
| [72] | Sun Y H, Shen C Q, Lai Q W, et al. Tailoring magnesium based materials for hydrogen storage through synthesis:Current state of the art[J]. Energy Storage Materials, 2018, 10:168-198. |
2. School of Materials Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China
3. National Engineering Research Center of Light Alloys Net Forming & State Key Laboratory of Metal Matrix Composites, Shanghai Jiao Tong University, Shanghai 200240, China
4. Yuchai Synland Technology Co. Ltd., Nanning 530007, China