2019年底暴发的由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2,新冠病毒)导致的新型冠状病毒肺炎(COVID-19,新冠肺炎)在全球范围内广泛传播,对人类的生命健康造成了严重威胁,对公共卫生安全形成了巨大挑战。为了有效遏制疫情蔓延,疫苗的研发工作在各国被提上了议程。
mRNA(messenger RNA,信使核糖核酸)疫苗属于核酸疫苗,是在第1代减毒活疫苗或灭活疫苗和第2代亚单位疫苗或重组蛋白疫苗的基础上,发展起来的第3代疫苗[1]。核酸疫苗是将编码某种抗原蛋白的外源基因(DNA或RNA)直接导入到宿主细胞内,通过宿主细胞的表达系统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,以达到预防和治疗疾病的目的[2]。截至2022年4月19日,为应对新冠肺炎全球共有28种mRNA疫苗进入临床研究阶段,25种处于临床前的研究和开发状态[3]。mRNA疫苗技术被《麻省理工科技评论》评为2021年“全球十大突破性技术之一”[4],现已成为病毒疫苗研发领域的热点,或将开启疫苗研发的新时代。哈佛大学干细胞生物学家德约克·罗西(Derrick Rossi)预测,那将是能获得诺贝尔生理学或医学奖的重大成果[5]。
理想与现实以辩证的关系交织在个人的人生体验之中,而坚守是贯彻在一个积极乐观、不懈追逐真理的科研工作者人生中的方法论。mRNA疫苗的关键技术(利用假尿苷修饰mRNA的技术)突破者,宾夕法尼亚大学(简称宾大)兼职教授、BioNTech高级副总裁卡塔琳·卡里科(Katalin Karikó),和宾大佩雷尔曼医学院教授、传染病科主任、疫苗研究专家德鲁·魏斯曼(Drew Weissman),于2021年荣获了匈牙利最高科学奖——塞切尼奖,以及被誉为通往诺贝尔生理学或医学奖宽阔廊道的罗森斯蒂尔奖[6]。卡里科本人也因为对mRNA研究及其在疫苗和药物中的应用做出重大贡献,被授予瑞士科学院制药领域最高科学奖赖希施泰因奖章。日内瓦大学瑞士药物科学研究所院长格里特·博尔查德(Gerritl Borchard)说,卡里科的研究,体现了“漫长的学术研究对我们社会的巨大好处”[7]。卡里科等的工作得到大量关注和褒奖,但在此之前,相关研究并不那么受重视。
1 美好的设想,理想的开端20世纪50年代,随着DNA双螺旋结构的发现,分子生物学迎来了发展的新阶段。随着研究的深入,更多有关遗传科学的真相亟待揭示。
1961年,雅克·莫诺(Jacques Monod)和弗朗索瓦·雅各布(François Jacob)提出了mRNA假说,即细胞内存在一种可以将遗传信息从细胞核转移到细胞质中,使得蛋白质合成中心——核糖体可以合成不同蛋白质的非特异性成分,这一成分充当了信使的作用,因此被命名为信使核糖核酸,即mRNA。后续研究证明,mRNA具有代谢活跃、半衰期短的特点,在一种蛋白质合成结束以后,它的mRNA会离开核糖体,不影响基因表达[8]。随后,雅各布、悉尼·布伦纳(Sydney Brenner)和马修·梅瑟生(Matthew Meselson)的实验证明了这一点[9]。基于此,研究人员希望能对mRNA进行人工修饰再应用,如使用mRNA介入人体内蛋白质的合成等,进而在概念上产生其他应用的可能。
1973年,18岁的卡里科考入匈牙利名校塞格德大学,在一次讲座上,她了解到了mRNA,一幅有待实现的蓝图在她面前徐徐展开。从这时开始,卡里科对这种神奇的分子产生了浓厚的兴趣。读书期间,卡里科多次获得匈牙利最高级别的学业奖学金——人民共和国奖学金;1978年从塞格德大学毕业后,她又带着匈牙利科学院的奖学金来到塞格德生物研究中心(简称BRC)核苷酸化学实验室跟随简诺·托马斯(Jenő Tomasz)继续博士学业,在这里,她开始研究RNA的抗病毒活性,并尝试利用虫草素(cordycepin)对RNA进行修饰[10]。1982年,卡里科博士毕业,继续留在BRC从事博士后工作,致力于开发用于治疗人类疾病的特定RNA分子,并发表了第1篇修饰RNA的论文[11]。
《Nature》新闻特写板块曾对mRNA疫苗关键性技术节点的发展沿革做过梳理(图 1)[12],天然mRNA的脂质体递送[13]、体外合成mRNA[14]及其递送[15],在卡里科开展mRNA的工作前并不是完全的空白,凡是进行mRNA研究的科学家都曾对其应用前景抱有乐观态度,但现实是,虽然卡里科及前人锲而不舍地对mRNA进行基础研究,但是社会与学界在40余年间却对其鲜有问津、少有支持。关于mRNA的美好设想遇到了来自现实的阻力。
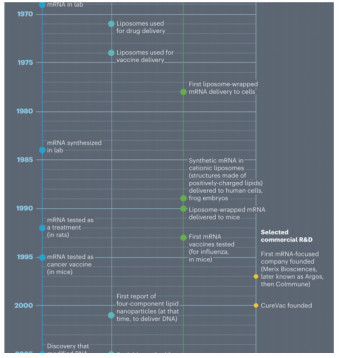 | 图 1 mRNA疫苗关键性技术节点发展沿革 |
卡里科最早关注的是RNA的治疗潜力[16]。她在实验中使用虫草素修饰RNA,希望将RNA输送到细胞中,最终开发出抗病毒化合物。但她很快意识到,将带负电荷的大分子运输到细胞中并不简单;与此同时,科研资金也已使用殆尽。1985年,由于研究经费耗尽且没有取得预期的科研成果,卡里科被解雇了,当时在国内她几乎没有合适的科研工作机会。同年,卡里科申请到了美国天普大学博士后,她和丈夫、女儿带着夹带在泰迪熊里的1200美元,远赴重洋。在天普大学期间,卡里科参与了利用双链RNA(dsRNA)治疗艾滋病、血液病和慢性疲劳患者的临床试验[17];1988年又前往健康科学统一服务大学工作,在那里初步接触了免疫学技术[16],但这两个工作团队对她关于RNA疗法的设想也不甚支持。
1989年,她来到宾大医学院心脏病学专家埃利奥特·巴纳森(Elliot Barnathan)的实验室,作为研究助理教授与巴纳森一起进行mRNA的研究。她和巴纳森计划将mRNA插入细胞中,以此诱导细胞产生出新的蛋白质,当伽马计数器追踪到新蛋白质的放射性分子时,他们意识到mRNA可以用来指导任何细胞产生任何蛋白质。得到这个结果后,卡里科说“我感觉就像是神”,mRNA也许可以用来改善心脏搭桥用的血管,甚至可以来延长人体细胞寿命,但对于外界来说,这是个过于超前的想法,“当时绝大部分人都在嘲笑我们”,巴纳森博士感慨道[18]。
事实证明,理论和实际之间还有很长的路要走。理论上mRNA无所不能:如果一个人可以设计出相应的RNA,那么他可以创造出任何所需的目标蛋白质,例如用于抗感染疫苗的抗体,用于逆转罕见疾病的酶,或用于修复受损心脏组织的生长剂;但在很长一段时间内,mRNA疗法由于mRNA的不稳定性、高天然免疫原性和在人体内传递低效性等问题,仅在实验室研究阶段就困难重重,又因为后续的研究没有达到预期的成果,mRNA疗法研究未能获得足够的投资,其应用研究也步履艰难[19]。
巴纳森博士在接受生物技术公司的职位后离开了宾大,卡里科失去了实验室的环境和资金的支持,虽然很快她又和大卫·兰格(David Langer)合作,尝试利用mRNA让血管中的细胞制造一氧化氮来治疗脑部手术后的中风,但几次实验都以失败告终,兰格离开宾大,卡里科再次失去了实验室和资金来源[20]。
1995年,卡里科因为接连申请不到科研基金而被降职降薪,又被检查出身患癌症需要进行手术。迫于生活压力,同时也由于对mRNA疗法的坚持和热爱,虽然宾大对她降职、降薪,但她继续留任,在一间动物房旁边的小屋里继续自己的研究。卡里科因为没有资金购买期刊,而不得不以复印论文的形式搜集科研工作中的所需的资料。正是在复印机前,卡里科遇到了科研生涯中最重要的合作伙伴,宾大的医学教授、免疫学家德鲁·魏斯曼(图 2)[21]。
 | 图 2 德鲁·魏斯曼(左)与卡塔琳·卡里科(右) |
魏斯曼是研究艾滋病病毒方面的杰出人士,致力于艾滋病病毒疫苗的研发。1997年,魏斯曼加入宾大,结识了身处艰难时期的卡里科。在这一次命运之神安排的相遇中,卡里科说:“魏斯曼博士告诉我,他想要一种抗艾滋病的疫苗。我说:‘行,当然行,我能做到。’”[18]卡里科自此开启了mRNA疫苗领域的研究历程[21]。对卡里科而言,魏斯曼的邀请无疑是雪中送炭,其带来的不仅是资金上的支持,还有精神上的鼓励,两人愉快地达成合作,共同踏上了mRNA疫苗研发之路。
mRNA疫苗的研发,首先要解决mRNA在体内效率低下和容易激发机体先天免疫系统的问题。卡里科设计的mRNA分子,可以使细胞在其指导下生成相应的蛋白质,但这仅限于培养皿中,活体中的mRNA并不奏效。“没人知道为什么”,魏斯曼博士说,“我们只知道小白鼠生病了:皮毛凌乱、身体蜷缩、不吃不喝不活动”[18]。这个问题卡里科最早在1999年时就已经发现——未经修饰的mRNA进入机体会导致免疫系统将其识别为外来异物,从而激发免疫反应[22];在随后的研究中,卡里科和魏斯曼通过实验证明了mRNA的结构特征是先天免疫系统Toll样受体(Toll-like receptors,TLRs)反应的主要原因[23];再然后,要解决的就是用什么修饰mRNA结构的问题。
卡里科和魏斯曼通过对比人体体内自然产生的tRNA和人工设计的IVTmRNA,发现前者存在着被称为假尿苷(pseudouridine)的分子,它具有显著降低RNA对免疫系统刺激性的功能。未经改良的mRNA分子通常无法躲避人体免疫系统的清除,但将假尿苷整合到mRNA中,经过修饰后的mRNA就可以免受免疫系统的攻击,从而在进入目标细胞后保持更持久的活性,并相应地产生抗原或其他对抗、治疗疾病的蛋白质。2005年,这项突破性研究成果正式发表[24]。
卡里科和魏斯曼的研究关键在于提高了mRNA的稳定性,同时减少了炎症,一举解决了mRNA在活体内表达所面临的两大难题,为进一步利用改良的mRNA开发各种潜在的疫苗奠定了基础。
2006年,卡里科和魏斯曼申请了mRNA的相关专利——含修饰核苷酸的mRNA制备及应用[25],并成立了一家名为RNARx的生物技术公司,以RNA修饰技术为基础开发新药物,并获得了美国政府的小企业资助。但当资助资金使用殆尽时,研究成果并未如期推广开来;与此同时,宾大和2位科学家就该技术的知识产权产生了分歧。最终,宾大将该专利权转卖,RNARx公司尚未进入临床实验阶段的项目也因此夭折,公司也因此于2013年倒闭。同年,卡里科仍旧怀揣着推广mRNA疗法的愿望,选择加入BioNTech,成为负责技术指导工作的副总裁。
4 疫情的考验,坚守的收获BioNTech由来自德国的土耳其夫妇乌古尔·萨欣(Ugur Sahin)和奥兹朗·图雷利(Oezlem Tuereci)于2008年成立。卡里科和魏斯曼的论文发表后,他们认为修饰后的mRNA可以用来帮助研发治疗癌症和其他重症的新型药物[26]。2013年,卡里科的加入为他们提供了极其重要的技术支撑,2019年卡里科被擢升为高级副总裁。
BioNTech的商业化道路也是从零开始的。最初5年,公司奉行萨欣的“潜艇模式”,专注于科学研究,该公司至今为止已发表科学论文150余篇,是一个学术积累扎实的科技公司[5]。卡里科加盟后,继续改进mRNA技术,针对mRNA稳定性差的问题。卡里科、魏斯曼和宾大医学系的同事诺伯特·帕迪(Norbert Pardi)等发现,用脂质纳米颗粒包裹mRNA,可防止其被RNA酶过快降解并促使它们顺利进入细胞[27]。在一个针对流感病毒的mRNA疫苗开发项目中,他们使用了该项技术[28]。
卡里科和BioNTech公司扎实的科研基础,为他们的实践之路奠定了良好的基础。2020年初,新冠肺炎暴发,新冠病毒蔓延全球。当年1月10日,中国疾病预防控制中心张永振研究团队在病毒学网站公布了新型冠状病毒全基因组序列[29],疫苗研发工作随之展开。萨欣基于已有研究认为,用在抗癌症药物的核糖核酸研究也能应用在病毒疫苗的研发工作上面,在卡里科的技术指导下,萨欣很快调派员工着力开展新冠病毒疫苗的研究工作,并与美国医药巨头辉瑞公司(Pfizer Inc.)和上海复星医药(集团)股份有限公司达成合作;2020年8月23日,辉瑞与BioNTech合作研发的新冠疫苗BNT162b2获得美国食品药品监督管理局的审批[30];Ⅲ期临床结果显示,该疫苗有效率超过90%(最终数据显示有效率可达95%)[31]。
随着新冠mRNA疫苗在临床上的结果逐渐显现,越来越多的人关注到了mRNA疫苗及其主要研究人员。正是研究人员在科研工作上的扎实积累,使BioNTech公司能迅速捕捉到mRNA疫苗在抵御新冠疫情上的可能性,最终使得新冠mRNA疫苗成为人类广泛接种的第1种mRNA疫苗,开创了mRNA疫苗的先河。
5 结论作为mRNA疫苗先驱者的卡里科,在过去40多年的研究生涯里都是“无名之辈”,卡里科40多年如一日的坚持令人敬佩,让我们不得不思考什么才是支撑她前进的动力。同时,本次mRNA疫苗的研发与应用案例,再一次引发了我们对基础研究深远意义的思考。
5.1 持之以恒导向最终成功1955年,卡里科出生于匈牙利东部小镇小新萨拉什(Kisújszállás),儿时所见父亲宰杀牲畜的记忆,成为她对生物机体的最初感知。在小学和中学阶段遇到的生化老师,是卡里科生物科研生涯的启蒙人,直接影响到了她大学的专业选择和后来的学术生涯。在大学阶段,卡里科对mRNA研究产生兴趣并对其发展潜力深信不疑,从此踏上了漫长而又孤独的mRNA疗法科研之路[32]。
在研究生涯的大多数时间里,卡里科的个人收入很低,科研经费也不充足,由于在很难得到科研成果的冷门领域内持续耕耘,她屡次被相关机构质疑,甚至降职降薪。但这些困苦的经历没有让她泄气,对她来说,能继续研究自己热爱且坚信的科研方向,在其中获得的快乐和成就感便是对现实生活最好的慰藉。“当时,我觉得我所做的一切都是闻所未闻的。从那时起,这种热情和责任感就一直陪伴着我。”[33“]在外界看来,我是一个疯狂、拼命的人,但是我在实验室很快乐”[34]。
在陈述对自我的认知时,卡里科说:“我更像是一个基础科学家,但我一直想做点什么来帮助患者。我(最初)没有考虑疫苗或传染病的,我一直在考虑开发用于治疗的mRNA。我希望,既然(社会现在)对这项研究有如此多的兴趣,那么可以继续开发和测试这种mRNA疫苗技术来预防和治疗其他疾病。”[33]她自认为是一个从事基础研究的学者,但她的研究切实地实现了巨大的社会和经济效益,并向学界和社会证明了mRNA疫苗技术的发展潜力,为预防传染性疾病和肿瘤的研究奠定了坚实的基础。
对学术怀有不变的热情,对研究抱有坚定的信心,是卡里科几十年如一日里不变的坚持,如果没有她的坚守,mRNA疫苗的制备与安全应用很可能只是理论上的“空中楼阁”,而无法最后发展成为一项能够抵御新冠病毒风暴的技术,也不会展现更长远的发展潜力。
5.2 基础研究涌现源头创新基础研究是整个科学体系的源头,是所有技术问题的总机关[35],卡里科的研究生涯启发我们应该对基础研究给予更大的重视。同时,也不难发现,基础研究的魅力往往在于,当其成为应用成果的先驱基础时,再回望其发展历程,它们在漫长时间里似乎起着未雨绸缪的作用。
2003年的SARS冠状病毒和2006年的中东呼吸综合征冠状病毒,2场冠状病毒疫情控制速度快、持续时间短、应用研究的热点消失迅速,但仍有王年爽等坚持对刺突蛋白进行持续地基础性研究。他们在当时开发出的或将无“用武之地”的稳定S蛋白的S-2P方法,即把2个辅氨酸叠加之后提升刺突蛋白的稳定性的方法,被应用到了新冠病毒的研究中,为新冠mRNA疫苗的开发做出了巨大贡献[36]。
重大的科学发现总是少数人打破旧的框架、提出新的概念、建立新的理论。但是,另辟蹊径、独树一格的源头创新研究却时常因为不能得到应有的支持而夭折,导致基础研究中难以涌现出源头创新[37]。卡里科与王年爽所从事的研究,曾经都属于冷门的基础研究,但最终他们的研究成果都体现出巨大的科学和社会价值,这充分说明基础研究是具有前瞻性的、属于未来的研究;同时我们不得不承认,低产出、高失误率,这是不少科学研究人员不愿意从事冷门基础研究的现实问题。若能组织专门的前瞻性基础研究团队,并对其科研成果采取更灵活的评价方式,将对新技术的开发具有深远意义。
| [1] | 胡瞬, 易有金, 胡涛, 等. mRNA疫苗的开发及临床研究进展[J]. 中国生物工程杂志, 2019, 39(11): 105-112. |
| [2] | Ertl P F, Thomsen L L. Technical issues in construction of nucleic acid vaccines[J]. Methods, 2003, 31(3): 199-206. |
| [3] | COVID-19 vaccine tracker and landscape[EB/OL]. [2022-04-21]. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. |
| [4] | MIT technology review presents 10 breakthrough technologies of 2021[EB/OL]. [2021-09-17]. https://www.technologyreview.com/press-releases/mit-technology-review-presents-10-breakthrough-technologies-of-2021/. |
| [5] | The story of mRNA: How a once-dismissed idea became a leading technology in the covid vaccine race[N/OL]. [2021-09-17]. https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/. |
| [6] | Katalin Karikó Awarded Reichstein Medal, Nobel Prize on the Horizon?[N/OL]. [2021-09-17]. https://hungarytoday.hu/katalin-kariko-nobel-prize-reichstein-medal-2021/. |
| [7] | Hohe schweizer auszeichnung für erfinderin des mRNA-impfstoffs[N/OL]. [2021-09-17]. https://www.20min.ch/story/hohe-schweizer-auszeichnung-fuer-erfinderin-des-mrna-impfstoffs-516386247251. |
| [8] | Jacob F, Monod J. Genetic regulatory mechanisms in the synthesis of proteins[J]. Journal of Molecular Biology, 1961, 3(3): 318-356. |
| [9] | Brenner S, Jacob F, Meselson M. An unstable intermediate carrying information from genes to ribosomes for protein synthesis[J]. Nature, 1961, 190(4776): 576-581. |
| [10] | Katalin Karikó, an alumna of the University of Szeged, is the founder of the most promising vaccine development against the coronavirus[N/OL]. [2021-09-17]. https://u-szeged.hu/news-and-events/2021/katalin-kariko-an-alumna. |
| [11] | Karikó K, Ludwig J. n-Decyl-NHpppA2'p5'A2'p5'A a phosphatase-resistant, active pppA2'p5'A2'p5'A analog [J]. Biochemical and Biophysical Research Communications, 1985, 128(2): 695-698. |
| [12] | Dolgin E. The tangled history of mRNA vaccines[J]. Nature, 2021, 597(7876): 318-324. |
| [13] | Dimitriadis G J. Translation of rabbit globin mRNA introduced by liposomes into mouse lymphocytes[J]. Nature, 1978, 274(5674): 923-924. |
| [14] | Melton D A, Krieg P A, Rebagliati M R, et al. Efficient in vitro synthesis of biologically active RNA and RNA hybridization probes from plasmids c[J]. Nucleic Acids Research, 1984, 12(18): 7035-7056. |
| [15] | Wolff J A. Direct gene transfer into mouse muscle in vivo[J]. Science, 1990, 247(4949): 1465-1468. |
| [16] | QnAs with Katalin Karikó[N/OL]. [2022-04-18]. https://www.pnas.org/doi/10.1073/pnas.2119757118?msclkid=36e23ca7be6b11ec9aa6676d063635c7. |
| [17] | Katalin Karikó“solver”and“saver”of synthetic mRNA (like that in some vaccines)[N/OL]. [2020-09-17]. https://thebumblingbiochemist.com/365-days-of-science/katalin-kariko-solver-and-saver-of-synthetic-mrna-like-that-in-some-vaccines/. |
| [18] | Kati Karikó helped shield the world from the Coronavirus [N/OL]. [2021-09-17]. https://www.nytimes.com/2021/04/08/health/coronavirus-mrna-kariko.html. |
| [19] | Pardi N, Hogan M J, Porter F W, et al. mRNA vaccines-a new era in vaccinology[J]. Nature Reviews Drug Discovery, 2018, 17(4): 261-279. |
| [20] | Katalin Karikó, hero scientist behind COVID-19 vaccines[N/OL]. [2021-09-17]. https://news.cgtn.com/news/2021-05-06/Katalin-Kariko-hero-scientist-behind-COVID-19-vaccines-103791imzuw/index.html. |
| [21] | Katalin Karikó, de inmigrante ignorada a“madre”de la vacuna contra el Covid-19[N/OL]. [2021-09-17]. https://www.latercera.com/la-tercera-domingo/noticia/katalin-kariko-de-inmigrante-ignorada-a-madre-de-la-vacuna-contra-el-covid-19/R4E7N7WLRFHSLPWKF6NVYQZGYE/. |
| [22] | Karikó K, Kuo A, Barnathan E. Overexpression of urokinase receptor in mammalian cells following administration of the in vitro transcribed encoding mRNA[J]. Gene Therapy, 1999, 6(6): 1092-1100. |
| [23] | Karikó K, Ni H, Capodici J, et al. mRNA is an endogenous ligand for Toll-like receptor 3[J]. The Journal of Biological Chemistry, 2004, 279(13): 12542-12550. |
| [24] | Karikó K, Buckstein M, Ni H, et al. Suppression of RNA recognition by toll-like receptors: The impact of nucleoside modification and the evolutionary origin of RNA[J]. Immunity, 2005, 23(2): 165-175. |
| [25] | Karikó K, Weissman D. RNA containing modified nucleosides and methods of use thereof: US, US8278036 B2 [P/OL]. [2021-09-17]. https://www.freepatentsonline.com/8278036.pdf. |
| [26] | Sahin U, Karikó K, Türeci Ö. mRNA-based therapeutics — developing a new class of drugs[J]. Nature Reviews Drug Discovery, 2014, 13(10): 759-780. |
| [27] | Pardi N, Tuyishime S, Muramatsu H, et al. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes[J]. Journal of Controlled Release, 2015, 217: 345-351. |
| [28] | Norbert P, Kaela P, Ericka K, et al. Nucleoside-modified mRNA immunization elicits influenza virus hemagglutinin stalk-specific antibodies[J]. Nature Communications, 2018, 9(1): 3361-3372. |
| [29] | Novel 2019 coronavirus genome[EB/OL]. [2021-09-17]. https://virological.org/t/novel-2019-coronavirus-genome/319. |
| [30] | FDA approves first COVID-19 vaccine[EB/OL]. [2020-09-17]. https://www.fda.gov/news-events/press-announcements/fda-approves-first-covid-19-vaccine. |
| [31] | The advisory committee on immunization practices' interim recommendation for use of Pfizer-BioNTech COVID-19 vaccine-United States, December 2020[EB/OL]. [2021-09-17]. https://www.cdc.gov/mmwr/volumes/69/wr/mm6950e2.htm?s_cid=mm6950e2_w(cdc.gov). |
| [32] | Magyar kutató tette le a készülő koronavírus-vakcinák alapjait[N/OL]. [2021-09-17]. https://g7.hu/elet/20200324/magyar-kutato-tette-le-a-keszulo-koronavirus-vakcinak-alapjait/. |
| [33] | University of pennsylvania mRNA biology pioneers receive COVID-19 vaccine enabled by their foundational research[N/OL]. [2021-09-17]. https://www.pennmedicine.org/news/news-releases/2020/december/penn-mrna-biology-pioneers-receive-covid19-vaccine-enabled-by-their-foundational-research. |
| [34] | BioNTech scientist Katalin Karikó risked her career to develop mRNA vaccines[N/OL]. [2021-09-17]. https://www.yahoo.com/now/scientist-katalin-karik-risked-her-183726650.html. |
| [35] | 中华人民共和国国家自然科学基金委员会. “十三五”国家基础研究专项规划[EB/OL]. [2021-04-20]. http://www.bdp.cas.cn/ztzl/sswgh/201709/t20170912_4614050.html. |
| [36] | Wrapp D, Wang N, Corbett K S, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367(5): 1260-1263. |
| [37] | 洪明苑. 关于增强基础研究源头创新活力的探讨[J]. 科技导报, 2001, 19(7): 35-38. |