DNA双螺旋结构被发现后,人类进入了分子生物学时代,生命科学的多个分支学科都开始从分子生物学角度进行研究。但是遗传物质如何将这些蕴含在双螺旋结构中的信息从DNA中转录到RNA,再翻译成蛋白质表达出来,就成为下一步研究的重点。1958年,DNA双螺旋结构的发现者之一克里克提出了生物遗传信息从DNA转录到RNA,再翻译成蛋白质的单向进行过程,被称之为“中心法则”。这也成为了生物体遗传的基本法则,因此俗称“生命的中心法则”“生命公式”。这一公式发表伊始是线形的形式,逐步完善成现在三角形的稳定形式,其中的过程一波三折。
1 遗传“中心法则”的发现在DNA的双螺旋结构被发现后,核酸尤其是DNA和蛋白质之间究竟存在着什么样的关系,成为学术界研究的重要课题。1953年4月,DNA双螺旋结构发现后的2个月内,遗传密码的研究设想被重新提上日程。当时的研究基于以下认知:第一,在DNA的核苷酸链上,碱基的排列顺序决定了基因的遗传信息;第二,基因携带的信息除了代表一种给定的多肽的一级结构外,不包含其他信息。这两点将生命中最重要的两大类物质——核酸和蛋白质联系了起来,但是二者之间的转录与翻译的机制究竟是什么,当时尚不明晰。
1954年,美籍俄国生化学家加莫夫(Gamov)提出了一种遗传密码的解读方案,这一方案也是第1次公开发表的关于遗传密码的猜想。他认为,在DNA的多核苷酸链上存在着一组组以相邻的3个核苷酸碱基作为一种氨基酸编码的密码。这种三联体的密码是有重叠的,因此,一个氨基酸可能存在几种不同的密码。
如果现在重新分析加莫夫当时提出的这种三联体密码方案,其实就是进行了一种抽丝剥茧似的简单思考:4种碱基的不同排列顺序如何编码蛋白质中的氨基酸。这是加莫夫第1次提出以三联体形式作为遗传密码的方案,具有一定的先进性,但是该方案仅仅是理论上的猜测,没有进行实验验证。
20世纪50年代,在研究DNA的同时,还有一部分科学家致力于研究RNA和蛋白质之间的编码关系。布拉舍特(Brachet)和卡斯帕森(Caspersson)提出了RNA控制蛋白质合成的观点。但是随后的发现证实,RNA合成蛋白质是在核糖体上进行的,同时DNA在受到酶的破坏之后,依然会有蛋白质的合成。因此可以看出蛋白质的合成是受细胞质中RNA直接控制的,所以可能是遵循着DNA到RNA再到蛋白质的过程[1]。
1955年,DNA双螺旋结构的发现者之一克里克(Crick)发现三联体密码的大小大约是10 Å,而氨基酸的分子大小是2~3 Å,存在明显的差异,说明它们之间一定还存在着一些中介物。在当时并不清楚中介物是什么的情况下,克里克提出了适配器学说。这一学说认为:氨基酸并不和模板直接结合,而是首先和一种特异的受体分子结合。这样,模板和受体分子的体积大小就能够完全匹配了。
1957年,美国生物化学家霍格兰(Hoagland)在大鼠的提取液中发现有一种RNA能够特异地和氨基酸结合,这一发现证实了克里克的配适器学说是完全正确的。
1958年,克里克总结之前实验得到的结论并提出了“中心法则”,他认为遗传信息只能从核酸流向蛋白质,传递是单方向进行的,也就是线形传递模式(图 1)。这一观点在当时有着重要的意义,初步捋清了生物遗传信息的传递方向。
 | 图 1线形的“中心法则” |
1961年,雅各布(Jacob)和莫诺(Monod)把这种能够将遗传信息从DNA转移到核糖体上的物质叫做“信使”,他们提出遗传信息都是先转录到RNA分子上,因此也确定了RNA的信使作用,说明克里克提出的“中心法则”是正确的。
2 三联体密码子的破译1961年是一个非常关键的年份,这一年是遗传三联体密码研究取得突破进展的一年。
克里克和布伦纳(S. Brenner)进行了一项重要实验,解决了遗传密码传递信息的问题。他们利用T4噬菌体nII基因做材料,应用原黄素类化学诱变剂处理,通过实现移码突变的方法进行证明。
他们在一条多核苷酸链的2个相邻的核苷酸中间,插入一个由核苷酸引起的突变,会使译码过程中读码的起点移位,结果在肽链之间插入了一段不正确的氨基酸。如果在该噬菌体的DNA中减去一个碱基,或者再加上2个碱基就会让编码蛋白质的结果恢复原来的样子,没有突变状态发生。这说明核酸的密码是由3个核苷酸组成的。
克里克和布伦纳根据实验得出3个正确的结论:第一,信息从基因的一端不重复地连续读出,信息阅读的正确与否,取决于信息的读取起点;第二,信息的读出是3个核苷酸一组;第三,大多数三联体密码都可以决定一个氨基酸的合成,只有少数是没有意义的,因此很多氨基酸都有一个以上的同义码。
1961年夏天,美国生物化学家尼伦伯格(M.W. Nirenberg)和德国科学家马太(H.Matthaei)也取得了突破性进展,他们建立了一个无细胞系统,把编码氨基酸的mRNA引入无细胞系统中,用来指导某一种多肽的合成。当他们把全部碱基都是尿嘧啶(U)的多聚尿苷引入后,产生的都是苯丙氨酸,说明苯丙氨酸的密码是“UUU”。随后,美籍西班牙生物学家奥乔阿(S.Ochoa)和同事进行了一系列破解实验,在一年时间内解析了多个氨基酸的密码子。1964年,美籍印度生物学家柯拉纳(H.G.Khorana)通过一系列双密码子的交替共聚物实验,确定了密码排列的顺序问题[2]。
1966年,克里克根据已经取得的成果,排列出遗传密码表,如表 1所示。
| 表 1遗传密码表 |
20世纪70年代,比利时肯特大学的菲尔斯(Fiers)等用MS2噬菌体做材料,对三联体密码进行了验证。他们分析了MS2噬菌体外壳蛋白的129个氨基酸的顺序,也分析了所对应外壳蛋白的390个核苷酸的顺序,结果发现完全符合遗传密码表上的对应关系。至此,三联体密码系统正式被认同。
到目前为止,三联体密码在整个生物界通用,这也从分子水平上证明了生物界是统一的有机体,也体现了有机体遗传信息传递的重要性。正是这一重大的突破,让“中心法则”中RNA的信息翻译成蛋白质的规律彻底明朗。
3朊病毒的发现对“中心法则”补充
1957年美国国立卫生研究院的盖达塞克(D. Carleton Gajdusek)在新几内亚地区库鲁人部落发现了一种称为“库鲁病”(Kuru disease)的怪病,这种病临床最先表现出协调功能丧失,随后发展到痴呆直至死亡,妇女和儿童的发病率最高[3]。盖达塞克在该部落调查,当时在脑组织标本中却没有发现任何常见的致病因子。盖达塞克与著名的神经病理学家克拉茨奥(I.Klatzo)博士合作,在库鲁病患者的脑组织标本中观察到大块失去生理功能的“淀粉样蛋白”(amyloid)。1963年,盖达塞克和他的同事吉布斯(Gibbs)合作继续用大猩猩进行动物模型实验,证实库鲁病能够跨越种属界限进行传播[4],其病原体不具有DNA或RNA的特性,可能是蛋白质。
与此同时,英国放射生物学家阿尔卑斯(T. Alpers)用能破坏DNA和RNA的放射性物质处理患羊瘙痒症的病羊感染组织后,发现其仍然保留感染性,进一步表明羊瘙痒症的致病因子不是核酸,可能是一种蛋白质。英国兽医哈德洛(William Hadlow)认为库鲁病和羊瘙痒症可能都是由一种称为慢病毒(slow virus)的病原体引起的,并写信将资料提供给盖达塞克,使盖达塞克深受启发[5]。不久盖达塞克便提出库鲁病、羊瘙痒症、克-雅氏症(Creutzfeldt-Jakob disease,CJD)以及貂脑病(Transmissible mink encephalopathy,TME)的致病因子可能都是同一种病毒。
循着盖达塞克的求索方向,美国加利福尼亚大学旧金山分校医学院的神经学、病毒学和生物化学教授普鲁塞纳(Stanley B.Prusiner)开始研究这种蛋白质因子的致病机理。普鲁塞纳阅读了所有可以搜索到的关于慢病毒的相关文献,并且开始了实验设计与安排,但是开局不利,以老鼠为实验动物模型的设计不仅花费昂贵而且进展缓慢,一度哈佛医学院中止了对他的支持,但是幸运的是此时又得到了R.J.Reynolds公司的资助。随后,他转以感染时间短的仓鼠为动物模型研究羊瘙痒症,经过长时间的努力,1982年4月普鲁塞纳终于在《Science》上报道他的实验结果。
普鲁塞纳利用生物化学和免疫学方法,将羊瘙痒症病原体颗粒用脂质体包裹,再通过抗体层析柱吸附进行纯化。他发现多种核酸酶处理均不能降低这些病原体的感染性;而使用蛋白变性剂等处理则可以减弱甚至灭活该病原体的感染能力,从而表明羊瘙痒症的病原体不属于核酸类病毒,而是一种新型的蛋白质病毒。普鲁塞纳还测算出羊瘙痒症病原体的分子量大约50000道尔顿,比当时所知的最小的感染颗粒——类病毒还要小。
在大量实验的基础上,普鲁塞纳明确指出人的克-雅氏病与羊瘙痒症以及库鲁病等疾病类似,同属于海绵状脑病,是由同一种蛋白质类的病原体所致。为了与核酸类病毒区分,他将这种蛋白质致病因子命名为朊病毒(Prion)[6]。普鲁塞纳还提出了朊病毒致病的“蛋白质构象致病假说”,该学说认为,朊病毒蛋白有细胞型(正常型PrPc)和搔痒型(致病型PrPsc)2种构象;致病型可胁迫正常型转化为致病型,实现自我复制,并产生病理效应;基因突变可导致细胞型中的α螺旋结构不稳定,达到一定量时便产生自发性转化使β片层增加,最终变为致病型,并通过多米诺效应倍增致病。这是一个与“中心法则”完全不同的全新假说,如果说这一假说成立的话,就证明了“中心法则”中遗传信息从DNA转录到RNA,再翻译成蛋白质表达的过程可能在生物界并不一定是通用的标准,这是难以想象的。这一假说当时并没有被认可,普鲁塞纳对自己的推测也无十足把握,他甚至认为尚不能排除在朊病毒病原体中仍然存在微量核酸的可能,于是他提出了朊病毒结构的3种可能性:一是蛋白质外壳里仍然严密包裹着核酸;二是蛋白质外壳上连有一小段核酸片段,是寄主用来编码朊病毒的;三是朊病毒仅由蛋白质组成,且合成是在缺乏核酸模板的情况下进行的。
无论如何,朊病毒的发现无疑是人类在生命科学研究中的一次重大突破,它的发现说明,蛋白质可能也能够通过自身构象的变化,实现遗传信息的传递,这是对“中心法则”的完善和补充[7]。
为什么普鲁塞纳能够在众多的研究者中脱颖而出,率先发现朊病毒呢?仔细分析可知,普鲁塞纳选用了合适的实验动物——病毒潜伏期仅为普通老鼠一半的仓鼠,这使得研究时间大大缩短。这与孟德尔选择豌豆、摩尔根选择果蝇、植物学家选择拟南芥为实验对象从而获得成功是一样的。只有选择正确的实验对象,才使实验有了成功的可能。此外,普鲁塞纳具有不因循守旧的创新思想,且敢于顶住压力挑战常规,这也是他获得成功的重要因素。普鲁塞纳在其自传中写道:“一个科学家应该具有一种怀疑精神,敢于对公认的科学领域提出质疑,最好的科学家往往对那些与常规不相符的结果怀有高度的敏感,同时还能够抵御住来自反对者的声音。”在论文发表后的10多年中,他顶住了来自学术界的巨大压力,直到他的学说被事实证实。有趣的是,当年盖达塞克在领奖后预测,将有第2位科学家因朊病毒研究而获得诺贝尔奖,普鲁塞纳实现了这个预言。普鲁塞纳也预言,将会有第3位科学家因研究朊病毒的复制机理而获得该领域的第3个诺贝尔奖。结果是否如此,大家拭目以待。
朊病毒的发现是对生物遗传规律的补充,是生命科学研究的一次重大进步。虽然朊病毒的神秘面纱正在被逐步揭开,但是仍有许多问题困扰着人们。例如,朊病毒的致病因子的性质究竟是什么?朊病毒在生物进化中扮演着什么样的角色?人类的免疫系统如何识别体内不同构象的朊蛋白,朊病毒如何突破种属障碍进行传播?朊病毒三维立体结构中的特殊位点作用机制是否可以从源头上真正治疗各类朊病毒疾病?不可否认的是,朊病毒也具有一些正面作用,如促进记忆形成和干细胞增殖,以及作为生物电子应用中的导线……朊病毒的发现和研究对于揭示相关疾病的致病机制、诊断和治疗等方面具有重要作用,此外,对于探索生命本质、生物进化、生物物质结构以及生物仿生学在实际生活中的运用也有十分重要的价值。
4 RNA酶的发现对“中心法则”补充除了朊病毒之外,酶的概念也在不断丰富。长期以来,人们认为酶的本质是蛋白质,RNA酶的发现宣告了酶的本质不是单一的。
中国人对酶的认识由来已久。早在公元前21世纪的夏禹时期,人们就已学会了酿酒;在3000年前的周朝,有人开始制作饴糖和酱;2000多年前的春秋战国时期,人们已经知道用麦曲来治疗消化不良等肠胃疾病。虽然那时候的人并不了解酶的本质,但是酶的利用较为广泛。现代生物化学研究表明,新陈代谢等基本生命活动,都是在酶的催化下通过生物大分子的合成和分解来完成的。生物体中的酶是一种生物催化剂,通过降低生物的活化能来加速和调节生物体内的生物化学反应。直到20世纪,才有研究揭示了酶的本质。1926年,美国化学家萨姆纳(Sumner)从刀豆中提取了脲酶并将其结晶,证明了它具有蛋白质的特性。1930—1936年,诺斯罗普(Northrop)和库尼茨(Kunitz)先后得到了胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶的结晶,并证实它们均属于蛋白质。从此,“酶的本质是蛋白质”成为生命科学的共识。因此,萨姆纳和诺斯罗普于1949年共同获得了诺贝尔化学奖[8]。
RNA病毒、RNA逆转录酶以及朊病毒陆续被发现,表明在一定条件下RNA和蛋白质都可以作为携带遗传信息的载体。RNA酶的发现再次证实了“中心法则”依然尚不完善。虽然绝大多数生物是以DNA为遗传物质的,但一些RNA病毒和噬菌体却以RNA作为遗传信息的载体,这显示了RNA功能的多样性和生命现象的多样性。人们似乎很难将RNA的功能与酶联系在一起。
在RNA酶的研究过程中有2位重要的科学家。其中一位是美国科学家切赫(Cech),切赫从小就对自然科学十分感兴趣。1975年,切赫获得了博士学位,随后前往麻省理工学院进行博士后研究,在帕杜(Mary Lou Pardue)的实验室中,切赫学到了很多生物学知识,对生物学逐渐产生了浓厚兴趣。1978年,切赫在科罗拉多大学担任教职时选择了四膜虫作为研究RNA拼接机制的对象。1986年,他在四膜虫rRNA前体中观察到一个有395个碱基的线状RNA分子组成的内含子,将其命名为L19RNA。经过深入研究,切赫发现L19RNA具有自我剪接的双向催化作用,既能将五聚胞苷酸(C5,Pentacytidylate)转化成较短的聚合物,降解为C4及C3,也能将C5聚合形成C6甚至达到30个胞苷酸残基的寡聚核苷酸片段。这表明L19RNA具有类似酶的作用,在一定条件下能够像酶一样以高度专一的方式催化寡聚核糖核苷酸底物的切割或连接,既有核糖核酸酶活性,又有RNA聚合酶活性。L19RNA所表现出的这种酶活性的意义在于可以通过自我剪接除去内含子。
另一位重要的科学家是奥尔特曼(Altman)。1967—1971年,奥尔特曼在剑桥大学利用大肠杆菌进行tRNA合成的研究。他提取到了纯化的tRNA的前体——一种生物合成tRNA的中间产物。按照生物化学代谢的规律,如果有一个中间产物,那么就意味着存在一种催化生成这种中间产物的酶。据此,他顺利地找到了核糖核酸酶P(RNaseP),其功能就是切开RNA链上的磷酸二酯键,释放出最终的tRNA。这种RNA酶在反应中不会被消耗,同时能够加速反应的进行,完全符合酶的特性。
切赫和奥尔特曼在不同的实验室用不同的实验材料均证明了某些RNA分子具有生物催化功能,按照酶的定义,可称之为RNA酶。RNA酶的发现意味着酶的本质不一定是蛋白质,从而向酶本质是蛋白质的传统观念提出了挑战。不久,越来越多的具有催化自我剪接功能的RNA被发现,1989年,核酸酶终于得到大家的认可并被写进教材,切赫和奥尔特曼也因此荣获1989年的诺贝尔化学奖。
2000年,一项科研成果再次间接地证实了RNA可能具有酶的功能。以前认为蛋白质肽键的合成是由核糖体的蛋白质所催化的,所以将其称为转肽酶。尼森(Niesen)等对核糖体的大小亚基的晶体进行X衍射分析,发现在距肽键形成处2 nm的范围内,没有蛋白质的电子云的存在,说明在肽键的形成过程中可能是核糖体中的信使RNA起了催化作用。其实,早在1992年,诺勒(Harry Noller)等就证明了23S rRNA具有酶的活性,能够催化肽键的形成[9]。
RNA酶的发现说明RNA在遗传方面的功能更为全面,可以携带遗传信息、调节基因表达、催化自我复制,这表明RNA在某些场合可以不需要DNA和蛋白质而完成自我复制,是一种可以独立进行信息表达和遗传的大分子。《Science》杂志在2000年12月介绍当年的重大科学成就时,把人类基因组工作草图绘制工作放在了第1位,认为生命可能是源于RNA而非DNA[10]。吉尔伯特率先提出了“RNA世界”的假说,认为在生命起源的初期,RNA已经表现出了DNA和蛋白质的某些功能特性。
RNA在生物体遗传信息传递等方面还起着承上启下的纽带作用,一些常见的低等生物,如艾滋病病毒、丙型肝炎病毒、埃博拉病毒和烟草花叶病毒等均以RNA为遗传信息载体,因此,地球上的生命起源很可能是从RNA开始的,而“中心法则”中DNA、RNA和蛋白质等生物大分子的基本分工应该是生物长期进化的结果。因此RNA和DNA之间,并不是RNA只能被动接受DNA的调控,实际上它也能够主动对DNA的遗传产生影响,是一个相互调控的过程,也从另一个角度完善了“中心法则”的内容。
5 生命公式的完善对于自然界来说,所有具有遗传物质的动物和植物,都遵守着1958年克里克提出的“中心法则”,但是在该法则提出伊始,并没有得到科学界足够的重视。1970年,克里克在《Nature》杂志上重申:遗传信息可以从DNA传递到RNA,再从RNA传递到蛋白质,完成遗传信息的转录和翻译的过程;也可以从DNA传递到DNA,完成遗传信息的复制过程,但是不能由蛋白质转移到蛋白质或者核酸中。
朊病毒的发现表明了蛋白质也可以作为遗传信息的载体,进一步证明了生命遗传信息载体的多样性,它证实了蛋白质也能够调控遗传信息的传递,达到了将线形生命公式实现闭环的目的,完善了生物遗传信息的传递法则。朊病毒的发现实现了蛋白质与DNA之间的相互联动,使得原先不可能相互联系的2种物质,发生了直接的调控,让“中心法则”从直线形式变成三角形的状态,这是形状上的根本改变,也是生命科学领域的重大变革。同时,朊病毒的发现也揭示了羊瘙痒症、克-雅氏症、库鲁病和疯牛病等疾病的发病机制,具有划时代的意义。
RNA酶的发现则进一步完善了“中心法则”,实现了DNA和RNA之间的相互调节,让整个循环变得更加充实。RNA酶的发现宣告了酶的本质不是单一的,部分RNA也具有酶的功能,可以实现自我催化,强化了生命公示的闭环形式,也直接表明了RNA和蛋白质在某些生物中可以作为携带遗传信息的载体,进一步证实了生命现象的多样性和复杂性。由此,生命公式从原先的直线形式变成了现在的三角形的相互关联的形式,如图 2所示。
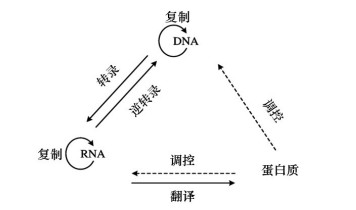 | 图 2线形的“中心法则” |
现在“中心法则”呈现闭合的三角关系,顶点之间皆存在着密切的联系。在自然界中,三角形的结构是较为稳定的,有很强的抗压能力。然而我们也不能妄言这就是定论,毕竟科学的发展没有止境,人类只能在不断地探索中完善已有学说,这才是对待科学应有的严谨态度。
| [1] | 刘锐. 生命科学简史[M]. 合肥: 中国科学技术大学出版社, 2021: 100-101. |
| [2] | John B. Principles of genetics.[M]. 7th ed. New York: The McGraw-Hill Companies, 2001: 10-12. |
| [3] | Wieland S, Weizsacker F von, Blum H E. 朊病毒Prionen [J]. 唐振亚, 译. 德国医学, 1997, 14(1): 50-53. |
| [4] | 王学, 田波. 朊病毒的研究进展[J]. 中国病毒学, 1997, 12(4): 302-308. |
| [5] | 李盛, 黄伟达. 诺贝尔奖百年鉴—构筑生命[M]. 上海: 上海科技教育出版社, 2001: 157-161. |
| [6] | 方元. 朊病毒研究进展[J]. 病毒学报, 2000, 16(4): 378- 382. |
| [7] | 刘锐, 翁屹. 从羊瘙痒症到疯牛病——朊病毒发现史[J]. 中华医史杂志, 2009, 39(3): 175-177. |
| [8] | 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 3版. 北京: 高等教育出版社, 2002: 339. |
| [9] | Nenad B, Poul N, Jeffrey H, et al. The complete atomic structure of the large ribosomal subunit at 2.4 angstrom resolution[J]. Science, 2000, 289(5481): 905-920. |
| [10] | Kennedy D. Breakthrough of the year[J]. Science, 2000, 290(5500): 2255. |
