2. 美国德州理工大学化学与生物化学系,拉伯克,79409
瑞典皇家科学院将2021年诺贝尔化学奖授予Benjamin List、David MacMillan(图 1),以表彰他们在不对称有机催化领域的贡献。
 |
图 1 2021年诺贝尔化学奖获得者Benjamin List(左)和David MacMillan(右) |
手性现象广泛存在于自然界中,地球生命中的手性现象就是一个永恒的话题[1-3]。动植物的生命起源本身与手性密切相关,它是控制生物体内生物大分子(如核酸、蛋白质、碳水化合物)和无数生物小分子等活性的基本要素之一。
“手性(chirality)”是微观小分子和宏观物质的一种基本属性,就像人们的左右手,互为镜像异构体,但是左手与右手无法相互重叠(图 2)。所有手性分子和物体中,只要它们不能与其镜像重叠,就会有手性特征。大多数情况下,手性分子和物体没有对称中心,也没有对称面。有少数例外情况,如无对称面但是有对称中心,因此没有手性(图 3)。
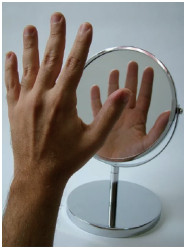 |
图 2 左右手的镜像异构现象(镜像不能重叠) |
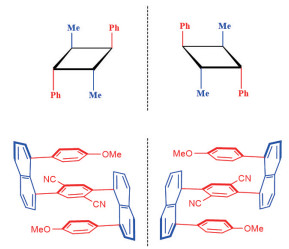 |
图 3 无对称面有对称中心/无手性(镜像可以重叠) |
迄今为止,已经发现的主要手性类型有:中心手性、轴手性、螺环手性、双平面手性、刚性多面手性(如螺烯手性)和柔性多面手性[1-3](如折叠手性)。其中,中心手性、面手性和螺环手性在自然界中存在较为广泛。
手性合成也称为不对称合成,是化学合成中手性控制的核心部分。它也是合成手性材料不可或缺的工具,可以控制选择生成各种各样的手性化合物和物质。手性药物在现有临床药物中占60% 以上,农药中手性化合物的占比也在逐年增加。手性材料[4-6],尤其是光电材料,应用性非常广阔,包括高清晰的3D显示、光学探测、光数据存储/加密、光学识别传感器等。同时,它们在生物标记、病理检测,尤其是在疾病的早期临床检测等方面具有广泛应用。
不对称合成化学控制手性主要通过4个途径:手性辅基底物、手性试剂(当量使用)、手性环境(如手性溶剂)和手性催化剂。其中,手性催化剂控制的不对称合成是最具有挑战性的。由于其具有手性放大的效果,也是合成手性化合物最高效的途径之一。
2 手性催化和催化剂与普通催化剂一样,大多数手性催化剂是通过降低化学反应过渡态的自由能(能垒)使反应加速进行。关键区别在于,手性催化剂可使反应朝有利于与催化剂手性相匹配的镜像异构体生成方向进行,从而达到控制手性的目的。
手性催化/催化剂可分为生物催化(如酶,DNA/RNA催化[7-8])和化学催化(金属和非金属催化)两大类(图 4)。2021年诺贝尔化学奖主题——手性有机催化属于化学催化中的非金属催化(图 4中红色标记部分)。
 |
图 4 不对称催化和催化剂的分类总结 |
手性有机催化剂主要分为酸性有机催化剂(如质子-Brønsted酸)和碱性有机催化剂(如氮杂环卡宾,含氮的胺类和含磷、硫的化合物),也可以称之为Lewis酸和Lewis碱2类。带正离子的质子广义上也可归纳为Lewis酸,因为它们可以接受孤对电子的化学物种。
以上催化剂均存在优缺点,但它们可以进行互补。生物催化的立体选择性强,但底物范围窄,并且通常只能生产1种对映体,有时生物体系的催化条件要求苛刻。化学催化的底物范围宽,但有时立体选择性控制难度大,并且立体选择性随着底物的改变而改变很多。另外,金属催化的产物中会掺杂金属杂质,有时难以去除。正是因为诸多原因,使科学家始终在寻找各种更好的手性催化剂。
胺类手性有机催化剂基于一级、二级胺(如脯氨酸)和三级胺(如奎宁),它们在反应之初,都是通过亲核功能来进行催化的。Benjamin List和David MacMillan早期工作(也是他们获奖的工作)主要基于二级胺,反应底物需要有缺电子原子,如羰基碳(C=O)的存在。多数胺催化的反应,其过程中产生的手性中间体(中性亚胺imine、烯胺enamine和带正电荷的亚胺iminium)是不对称催化反应成功的关键。
3 有机小分子催化“绿色化学”已经成为新世纪化学追求的主要方向之一,其核心思想是消除污染源头。顺应这一发展趋势,本次诺贝尔化学奖青睐绿色有机催化领域。酸与碱广泛存在于大自然中,对人们的生产生活有着极其重要的意义。例如,生命体中酶催化活性中心的催化基团作为质子供体或受体参与催化,酶催化几乎都存在酸碱催化机制。
尽管20世纪就有人提出并开展过有机催化(organocatalysis)和有机小分子催化的类似概念和工作[9-10],但是Benjamin List和David MacMillan在有机小分子催化方面的突破性进展、有机催化概念的明确提出、对领域研究的梳理,大大推动了该学科的发展。值得称道的是,两位获奖者的工作使诺贝尔化学奖在10年后再次回归了合成方法学领域。当然2016年诺贝尔化学奖——分子机器,也属于合成化学领域。
Benjamin List小组在美国Scripps研究所的早期研究旨在模仿天然酶催化策略,以开发高立体选择性、高原子经济性和高产率的手性酸碱绿色催化剂(图 5)。其中部分工作是与己故化学家Carlos Barbas III合作进行的。这些催化剂可以避免在化学反应中使用惰性保护气体、保护基团、有害溶剂或高温高压等。Benjamin List小组2000年在《美国化学会会志》发表了文章“脯氨酸催化的直接不对称羟醛反应”,这项研究使用脯氨酸作为天然手性催化剂实现了丙酮和各种醛之间的直接不对称醛醇反应[11],该反应模拟醛缩抗体催化和天然I类醛缩酶催化中的烯胺反应机制,通过小分子脯氨酸催化实现了上述目标。
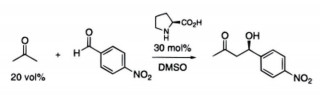 |
图 5 模仿天然酶的有机小分子催化 |
2012年和2016年,Benjamin List分别设计了具有双轴手性骨架的亚胺双磷酸类(IDP)、亚氨基-亚胺双磷酸盐类(iIDP)和亚胺双磷酰亚胺类(IDPi)等系列有机小分子手性催化剂(图 6)[12]。这类手性催化剂具有酸性强、活性高的特点,其中亚胺双磷酰亚胺类在乙腈中的pKa值达4.5。另外双轴手性骨架为催化剂构建了类似生物酶结构中的受限空间(手性口袋),而手性催化剂的活性中心被包裹在其中,为不对称反应中提供了一种特殊的手性微环境,可进一步提高催化剂对反应的立体控制能力。近年来,这种强酸性的手性有机小分子催化剂在非活化烯烃的不对称官能化方面获得了突破性进展,比较有代表性的是利用亚胺双磷酰亚胺催化剂,可以对惰性烯烃分子的碳碳双键先进行质子化,进而促进烯烃底物发生分子内氢烷氧化反应,高对映选择性地得到一系列含季碳中心的环状化合物。
 |
图 6 双轴手性骨架的亚胺双磷酸类有机催化剂 |
David MacMillan开创了亚胺(iminium)有机催化新领域[13],该工作是基于他课题组设计的手性咪唑烷酮小分子催化剂(图 7)。这些催化剂的合成简易,从而使得工业化生产更为方便。亚胺的催化模式不同于烯胺(enamine)。后者的催化基于自然界中醛缩酶(class I aldolases)利用赖氨酸的氨基催化醛酮生成烯胺进行反应转化,而亚胺离子催化是受到了Lewis酸催化活化Michael受体的启发(图 7)。2000年,David MacMillan在加州大学伯克利分校期间发表了第一篇亚胺不对称催化工作(Diels-Alder反应),并在此文中明确提出了有机催化的概念。反应是在室温及水溶液参与的情况下进行的。对于环茂二烯底物的Diels-Alder反应,手性咪唑烷酮催化剂不仅有效控制了对映选择性(enantioselectivity),还可以适当控制endo/exo非对映选择性(diastereoselectivity)。催化剂分子的单晶结构,助力解释该反应的立体化学控制过程。
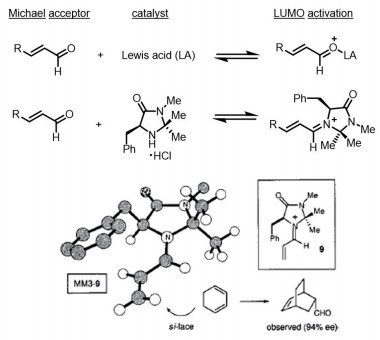 |
图 7 有机手性咪唑烷酮小分子催化 |
作为有机催化的奠基者及开拓者之一,David MacMillan又进一步提出了基于单电子转移的SOMO Catalysis策略,首次实现了自由基参与的有机胺不对称反应,该工作为他日后开创不对称光氧化还原奠定了基础,为如今可见光催化的蓬勃发展起了重要的引领作用[14]。
4 催化剂回收和重复使用在此类有机手性酸碱催化剂控制的不对称反应中,催化剂的用量偏大。这给不对称合成,尤其是不对称合成的量产阶段,带来了极大的不便,也增加了合成和生产的成本。因此开发可回收和可重复使用的有机催化剂便尤为重要。目前主要有3种方法,分别是利用高分子、有机盐和小分子GAP化学回收催化剂。利用高分子附载手性催化剂或把催化剂附载到有机盐上,为不对称催化起到很好的推动作用。尽管有时存在一定的局限性,如高分子的大分子量、有机盐催化剂的正离子或负离子对反应可能产生不良影响等。
李桂根提出的小分子GAP化学方法是将强极性官能团连接到手性催化剂上(图 8)[15],来控制均相不对称催化反应。在无溶剂的情况下,由于强极性官能团的负载,GAP催化剂以固体形式存在,而且是似盐非盐的特殊固体,回收催化剂只需要有机溶剂洗涤,操作简单。这种可回收和可重复使用的GAP催化剂,已经与David MacMillan的原始催化剂在不对称反应的行为进了对比,并取得了良好的结果。
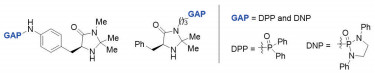 |
图 8 可回收和重复使用的GAP小分子催化剂 |
近20年来,中国化学家在手性胺催化、手性磷酸催化、手性氮杂环卡宾催化、亲核路易斯碱催化等催化领域做出了重要贡献。
在手性胺催化方面,程津培、罗三中设计了新型手性伯叔二胺催化剂[16],成功实现了不对称Aldol反应及手性季碳中心的构建[17]。冯小明实现了手性氮氧和手性氨基酸盐催化的不对称氰基化反应和其他几种不对称转化[18]。龚流柱等的手性脯氨酰胺催化剂[19]和肖文精教授的手性脯氨双酰胺有效地催化了多种不对称Aldol反应[20]。钟国富成功地将手性脯氨酸用于醛的不对称胺氧化反应产生高对映纯1,2-二醇,方法简易快速,便于应用[21]。赵刚的手性氨基酸催化剂,高效高对映选择地控制了碳—碳(氧、氟)键形成和多组分串联反应一步形成多个手性中心[22]。王锐的金鸡纳碱盐手性催化剂和马军安的糖衍生手性伯胺-硫脲类催化剂被成功应用于不对称Michael加成反应[23-24]。江智勇利用手性碱催化的不对称环化反应为手性杂环骨架构建提供了新策略[25]。王春江研发了一种酰胺衍生的手性硫脲叔胺催化剂,在多种不对称转化中表现出很好的催化效果[26]。许鹏飞开发了多种手性胺催化的不对称多组分反应、串联反应,为手性环状化合物的合成提供了新策略[27]。周剑将一类金鸡纳碱衍生的磷酰胺催化剂应用于不对称氰基化反应[28]。刘小华报道了一类新型的手性胍类催化剂[29],此类催化剂在多种不对称反应中均表现出优异的催化活性。陈应春以金鸡纳碱衍生的伯胺为催化剂,开发了多类催化不对称反应,并在双烯胺催化、三烯胺催化方面做出系列创新性的工作[30]。
在手性磷酸催化方面,涂永强设计的手性磷酸催化的半片呐醇重排反应,为手性螺醚类化合物的合成提供了高效策略[31]。周其林、朱守非将具有螺环骨架的手性磷酸应用于不对称N—H插入反应[32]。钟国富发展了手性磷酸催化的不对称Hydroxylation反应[33]。游书力提出的手性磷酸催化的不对称傅克反应,具有良好的区域及立体选择性[34]。石枫研发了手性磷酸催化的吲哚类平台分子参与的不对称转化反应,为手性吲哚骨架的高效构建提供了新策略[35]。谭斌实现了手性磷酸催化的多种轴手性骨架的催化不对称构建[36]和不对四组分Ugi反应[37],助力不对称轴手性化学入选2020化学与材料科学十大热点前沿。刘心元利用手性磷酸和金属的联合催化体系,实现了烯烃的不对称双官能团化和外消旋的联烯或二烯烃的动态动力学不对称氢胺化反应[38-39]。孙建伟实现了手性磷酸催化的氧杂环丁烷开环反应,为活性生物碱的合成提供了新策略[40]。杜大明报道了一类双联萘骨架的磷酸,并将其应用于喹啉的不对称氢转移反应[41]。龚流柱、胡文浩报道了手性磷酸与金属的联合催化策略,实现了亲电试剂对羟鎓叶立德的高对映选择性捕捉[42]。周永贵利用手性磷酸和金属的仿生接力催化策略,实现了多种杂芳环的不对称氢化反应[43]。叶龙武通过氢键导向的紧密离子对策略,从带氢键给体芳基取代的炔酰胺底物出发,以各类手性磷酸作为催化剂,实现了系列基于手性磷酸直接活化碳碳三键的催化不对称去芳构化反应(CADA)[44]。杨晓瑜利用手性磷酸催化2-氨基苄醇的高效动力学折分,合成了对映异构纯的4H-3,1- 苯并噁嗪[45]。林旭峰设计的手性螺环磷酸(SPAs)、第二代手性螺环磷酸(SPAs 2.0)和平面手性磷酸(PPAs)等新型手性磷酸催化剂被应用于一系列不对称催化合成,并实现了商业化[46]。丁奎岭开发了手性磷酸催化的不对称Baeyer-Villiger氧化反应,此反应以廉价的双氧水为氧化剂,高对映选择性获得了γ-内酯衍生物[47]。
在手性氮杂环卡宾催化方面,游书力设计了樟脑衍生的手性氮杂环卡宾催化剂,实现了醛酮不对称交叉Benzoin反应[48]。叶松开发了脯氨醇硅醚衍生的手性氮杂环卡宾催化剂,实现了烯酮的不对称环化反应[49]。孙建伟首次实现了手性氮杂环卡宾催化的不对称亲电氟化反应。在该工作中,具有双重亲核位点的共轭烯醇负离子(vinylogous enolate)在羰基α位以很高的区域选择性和对映选择性发生实现了碳—氟键的构建[50]。黄湧课题组利用质子迁移策略,有效解决了非对映选择性和催化剂循环的瓶颈,报道了第一例基于氮杂环卡宾非共价催化的不对称碳—碳合成,并将之拓展至碳—氮、碳—硫、碳—磷键的手性合成,成为一种普适的不对称催化新模式[51-52]。池永贵实现了包括饱和酯β-位活化等多种氮杂环卡宾催化的不对称反应,为手性氮杂环卡宾催化提供了很好的素材[53]。王舰的氮杂环卡宾催化剂成功地诱导了对映选择性[3+3] 环化反应和对药物化学非常重要的不对称氟化反应[54]。
在亲核路易斯碱催化方面,张万斌开发了双环咪唑类亲核路易斯碱催化剂,并将其应用于Steglich反应[55]。钟国富、罗德平利用手性氨基酸衍生的膦催化剂,通过不对称Aza-Rauhut-Currier反应实现手性氮杂六元环烯胺的合成[56]。张俊良、黄有分别开发了手性亚磺酰胺衍生的膦催化剂和含有酚羟基、酰胺基的多官能团骨架手性膦催化剂,并将其有效应用于不对Rauhut-Currier反应[57-58]。施敏发展了手性双功能膦催化剂,解决了Morita-Baylis-Hillman反应中立体选择性难以控制的难题[59]。童晓峰以金鸡纳碱作为手性亲核路易斯碱催化剂,实现了联烯参与不对称串联环化反应[60]。郭红超报道了手性膦催化的不对称环化反应,为手性杂环骨架的催化不对称构建提供了新策略[61]。
在其他有机小分子催化方面,丁奎岭开发了手性二醇类氢键催化剂,并将其应用于不对称DielsAlder反应中[62]。赵刚设计了双功能氮杂酰基氨基膦催化剂,成功应用于联烯酯和双活化烯烃的不对称[3+2]环加成反应[63]。马军安发展了一种柔性的双联萘骨架相转移催化剂,此类催化剂在不对称共轭加成反应中表现出良好的催化活性[64]。郭其祥发展联萘骨架手性醛催化剂,实现了手性醛催化氨基酸酯的不对称直接α-烷基化反应[65]。赵宝国利用轴手性N-甲基吡哆醛催化剂,应用于羰基催化的策略实现了仿生的不对称曼尼希反应[66]。闫海龙通过氢键催化,成功实现了高难度的含多种手性基元的Azepine骨架的构建[67]。
海外华人化学家在有机催化领域,早期就做出了突出贡献。1996年,史一安(现在常州大学)和杨丹(现在西湖大学)分别开发了糖衍生的手性酮和联萘骨架的手性酮类小分子催化剂,成功用于烯烃的不对称环氧化[68-69]。邓力(现在西湖大学)开发了金鸡纳碱催化的琥珀酸酐衍生物的去对称化反应[70]。王卫开发了手性四氢吡咯烷磺酰胺催化剂[71],实现了高效的不对称Michael加成反应,他还利用氧化烯胺策略,实现了醛的β-官能团化反应[72]。张绪穆(现在南方科技大学)利用刚性的手性膦催化剂,控制了联烯酸酯参与的环化反应中立体选择性[73]。陈俊丰发展了手性双胍类催化剂[74],并将其用于不对称环化反应,随后又进一步发展了手性胍盐类相转移催化剂及离子对催化剂,实现了常规手段难以实现的三级卤代烷的不对称亲核取代反应[75]。卢一新等开发了二肽类手性膦催化剂,并发展了此类催化剂在串联环化反应中的应用[76]。李桂根将小分子手性GAP催化剂应用于Diels-Alder和Friedel-Crafts反应,成功地控制了对映选择性、endo/exo非对映选择性选择性和区域选择性(regioselectivity)[15]。
6 结论有机不对称催化属于绿色环保化学领域的研究,不仅对化学科学,而且对手性药物和手性材料,尤其是光电材料领域,将发挥重要作用。2位诺奖得主的手性胺催化的工作,都必须有羰基官能团参与。手性酸催化也大多数基于羰基底物。发展更加高效、底物应用范围更加广阔的手性有机催化剂和催化体系需要进一步加强。Push-Pull多位点协同催化模式以及有效催化循环机制的研究,将有助于提高化学反应速度和立体选择性。合成化学、计算化学和人工智能(AI)的交叉融合,结合催化剂-底物组合化学和筛选的建立,将加速各种不对称反应的条件优化过程。光电条件下的有机不对称催化和底物定点选择性控制,也将是科研工作者研究的热点。仿生催化和模拟生物酶的催化,发展新的催化剂体系和高效控制模式,并以此开发新的高效不对称反应,是未来有机不对称催化的一个重要发展趋势。最后,未来还需要开发更多、更有效的、适用范围更广泛、可回收和可重复使用的手性有机催化剂。
| [1] | Wu G, Liu Y, Yang Z, et al. Multilayer 3D chirality and its synthetic assembly[J]. Research, 2019, 2019(6244): 1-11. |
| [2] | Wu G, Liu Y, Yang Z, et al. Enantioselective assembly of multi-layer 3D chirality[J]. National Science Review, 2020, 7(3): 588-599. |
| [3] | Wu G, Liu Y, Rouh H, et al. Asymmetric catalytic approach to multilayer 3D chirality[J]. Chemistry-A European Journal, 2021, 27(30): 8013-8020. |
| [4] | Hu M, Feng H T, Yuan Y X, et al. Chiral AIEgens-Chiral recognition, CPL materials and other chiral applications[J]. Coordination Chemistry Review, 2020, 416 (213329): 213329. |
| [5] | Zhao T, Han J, Duan P, et al. New perspectives to trigger and modulate circularly polarized luminescence of complex and aggregated systems: Energy transfer, photon upconversion, charge transfer, and organic radical[J]. Accounts of Chemical Research, 2020, 53(7): 1279-1292. |
| [6] | Ru Y, Sui L, Song H, et al. Rational design of MulticolorEmitting chiral carbonized polymer dots for full-color and white circularly polarized luminescence[J]. Angewandte Chemie International Edition, 2021, 60(25): 14091-14099. |
| [7] | Silverman S K. DNA as a versatile chemical component for catalysis, encoding, and stereocontrol[J]. Angewandte Chemie International Edition, 2010, 49(40): 7180-7201. |
| [8] | Lilley D M J. Mechanisms of RNA catalysis[J]. Philosophical Transactions of The Royal Society B, 2011, 366 (1580): 2910-2917. |
| [9] | Langenbeck W. Über organische katalysatoren. Ⅲ. die bildung von oxamid aus dicyan bei gegenwart von aldehyden [J]. Justus Liebigs Annalen der Chemie, 1929, 469(1): 16-25. |
| [10] | Hajos Z G, Parrish D R. Asymmetric synthesis of bicyclic intermediates of natural product chemistry[J]. The Journal of Organic Chemistry, 1974, 39(12): 1615-1621. |
| [11] | List B, Lerner R A, Barbas C F. Proline-Catalyzed direct asymmetric aldol reactions[J]. Journal of American Chemistry Society, 2000, 122(10): 2395-2396. |
| [12] | Čorić I, List B. Asymmetric spiroacetalization catalysed by confined brønsted acids[J]. Nature, 2012, 483(7389): 315-319. |
| [13] | Ahrendt K A, Borths C J, MacMillan D W C. New strategies for organic catalysis: The first highly enantioselective organocatalytic Diels-Alder reaction[J]. Journal of American Chemistry Society, 2000, 122(17): 4243-4244. |
| [14] | Nicewicz D A, MacMillan D W C. Merging photoredox catalysis with organocatalysis: The direct asymmetric alkylation of aldehydes[J]. Science, 2008, 322(5898): 77-80. |
| [15] | Qiao S, Mo J, Wilcox C B, et al. Chiral GAP catalysts of phosphonylated imidazolidinones and their applications in asymmetric Diels-Alder and Friedel-Crafts reactions [J]. Organic & Bimolecular Chemistry, 2017, 15(7): 1718-1724. |
| [16] | Luo S Z, Xu H, Li J, et al. A simple primary-tertiary diamine-brønsted acid catalyst for asymmetric direct aldol reactions of linear aliphatic ketones[J]. Journal of the American Chemical Society, 2007, 129(11): 3074-3075. |
| [17] | Zhu Y, Long Z, Luo S Z. Asymmetric α-photoalkylation of β -ketocarbonyls by primary amine catalysis: Facile access to acyclic all-carbon quaternary stereocenters[J]. Journal of the American Chemical Society, 2014, 136 (42): 14642-14645. |
| [18] | Liu X, Qin B, Zhou X, et al. Catalytic asymmetric cyanosilylation of ketones by a chiral amino acid salt[J]. Journal of the American Chemical Society, 2005, 127 (35): 12224-12225. |
| [19] | Tang Z, Jiang F, Yu L T, et al. Novel small organic molecules for highly enantioselective direct aldol reaction [J]. Journal of the American Chemical Society, 2003, 125 (18): 5262-5263. |
| [20] | Chen J R, Lu H H, Li X Y, et al. Readily tunable and bifunctional L-prolinamide derivatives: Design and application in the direct enantioselective aldol reactions[J]. Organic Letters, 2005, 7(20): 4543-4545. |
| [21] | Zhong G F. A facile and rapid route to highly enantiopure 1, 2-diols by novel catalytic asymmetric a-aminoxylation of aldehydes[J]. Angewandte Chemie International Edition, 2003, 42(35): 4247-4250. |
| [22] | Chai Z, Zhao G. Efficient organocatalysts derived from simple chiral acyclic amino acids in asymmetric catalysis [J]. Catalysis Science & Technology, 2012, 2(1): 29-41. |
| [23] | Chen F X, Shao C, Wang Q, et al. An enantioselective michael addition of malonate to nitroalkenes catalyzed by low loading demethylquinine salts in water[J]. Tetrahedron Letters, 2007, 48(48): 8456-8459. |
| [24] | Liu K, Cui H F, Nie J, et al. Highly enantioselective michael addition of aromatic ketones to nitroolefins promoted by chiral bifunctional primary amine-thiourea catalysts based on saccharides[J]. Organic Letters, 2007, 9 (5): 923-925. |
| [25] | Wang J, Liu H, Fan Y, et al. Bicyclic guanidine-catalyzed direct asymmetric allylic addition of N-aryl alkylidene-succinimides[J]. Chemistry A European Journal, 2010, 16(42): 12534-12537. |
| [26] | Zhang Z H, Dong X Q, Chen D, et al. Fine-tunable organocatalysts bearing multiple hydrogen-bonding donors for construction of adjacent quaternary and tertiary stereocenters via a michael reaction[J]. Chemistry A European Journal, 2008, 14(29): 8780-8783. |
| [27] | Han R G, Wang Y, Li Y Y, et al. Proline-mediated enantioselective construction of tetrahydropyridines via a cascade Mannich-type/intramolecular cyclization reaction[J]. Advanced Synthesis & Catalysis, 2008, 350(10): 1474-1478. |
| [28] | Liu Y L, Zhou F, Cao J J, et al. A facile method for the synthesis of oxindole based quaternary alpha-aminonitriles via the Strecker reaction[J]. Organic & Biomolecular Chemistry, 2010, 8(17): 3847-3850. |
| [29] | Chen X, Dong S, Qiao Z, et al. Guanidine prganocatalyst for the asymmetric mannich-type reaction between isothiocyanato imide and sulfonyl imines[J]. Chemistry A European Journal, 2011, 17(9): 2583-2586. |
| [30] | Xie J W, Chen W, Li R, et al. Highly asymmetric michael addition to α, β-Unsaturated ketones catalyzed by 9-amino-9-deoxyepiquinine[J]. Angewandte Chemie International Edition, 2007, 46(3): 389-392. |
| [31] | Zhang Q W, Fan C A, Zhang H J, et al. Børnsted Acid catalyzed enantioselective semipinacol rearrangement for the synthesis of chiral spiroethers[J]. Angewandte Chemie International Edition, 2009, 48(45): 8572-8574. |
| [32] | Xu B, Zhu S F, Xie X L, et al. Asymmetric N—H insertion reaction cooperatively catalyzed by rhodium and chiral spiro phosphoric acids[J]. Angewandte Chemie International Edition, 2011, 50(48): 11483-11486. |
| [33] | Lu M, Zhu D, Lu Y, et al. Chiral brønsted acid-catalyzed enantioselective alpha-hydroxylation of beta-Dicarbonyl compounds[J]. Journal of the American Chemical Society, 2009, 131(13): 4562-4563. |
| [34] | Kang Q, Zhao Z A, You S L. Highly enantioselective Friedel-Crafts reaction of indoles with imines by a chiral phosphoric acid[J]. Journal of the American Chemical Society, 2007, 129(6): 1484-1485. |
| [35] | Zhang Y C, Jiang F, Shi F. Organocatalytic asymmetric synthesis of indole-based chiral heterocycles: Strategies, reactions, and outreach[J]. Accounts of Chemical Research, 2020, 53(2): 425-446. |
| [36] | Cheng J K, Xiang S H, Li S, et al. Recent advances in catalytic asymmetric construction of atropisomers[J]. Chemical Reviews, 2021, 121(8): 4805-4902. |
| [37] | Zhang J, Yu P, Li S Y, et al. Asymmetric phosphoric acid-catalyzed four-component Ugi reaction[J]. Science, 2018, 361(6407): eaas8707. |
| [38] | Lin J S, Li T T, Jiao G Y, et al. Chiral brønsted acid catalyzed dynamic kinetic asymmetric hydroamination of racemic allenes and asymmetric hydroamination of dienes [J]. Angewandte Chemie International Edition, 2019, 58 (21): 7092-7096. |
| [39] | Yu P, Lin J S, Li L, et al. Enantioselective C—H bond functionalization triggered by radical trifluoromethylation of unactivated alkene[J]. Angewandte Chemie International Edition, 2014, 53(44): 11890-11894. |
| [40] |
Chen Z, Wang B, Wang Z, et al. Complex bioactive alkaloid-type polycycles through efficient catalytic asymmetric multicomponent |
| [41] | Guo Q, Du D, Xu J. The development of double axially chiral phosphoric acids and their catalytic transfer hydrogenation of quinolines[J]. Angewandte Chemie International Edition, 2008, 47(4): 759-762. |
| [42] | Hu W H, Xu X F, Zhou J, et al. Cooperative catalysis with chiral børnsted Acid-Rh2(OAc)4: Highly enantioselective three-component reactions of diazo compounds with alcohols and imines[J]. Journal of the American Chemical Society, 2008, 130(25): 7782-7783. |
| [43] | Chen Q A, Wang D S, Zhou Y G, et al. Convergent asymmetric disproportionation reactions: Metal/brønsted acid relay catalysis for enantioselective reduction of quinoxalines[J]. Journal of the American Chemical Society, 2011, 133(16): 6126-6129. |
| [44] | Zhang Y Q, Chen Y B, Liu J R, et al. Asymmetric dearomatization catalysed by chiral brønsted acids via activation of ynamides[EB/OL].[2021-10-16]. https://doi. org/ 10.1038/s41557-021-00778-z. |
| [45] | Rajkumar S, Tang M Y, Yang X Y. Chiral phosphoric acid catalyzed kinetic resolution of 2-amido benzyl alcohols: Asymmetric synthesis of 4H-3, 1-Benzoxazines[J]. Angewandte Chemie International Edition, 2020, 59(6): 2333-2337. |
| [46] | Rahman A, Lin X F. Development and application of chiral spirocyclic phosphoric acids in asymmetric catalysis[J]. Organic & Biomolecular Chemistry, 2018, 16(26): 4753-4777. |
| [47] | Xu S M, Wang Z, Zhang X, et al. Chiral brønsted acid catalyzed asymmetric baeyer-villiger reaction of 3-substituted cyclobutanones by using aqueous H2O2[J]. Angewandte Chemie International Edition, 2008, 47(15): 2840-2843. |
| [48] | Li Y, Zhen F, You S L. D-camphor-derived triazolium salts for catalytic intramolecular crossed aldehyde-ketone benzoin reactions[J]. Chemical Communications, 2008, 39(19): 2263-2265. |
| [49] | Zhang Y R, He L, Wu X, et al. Chiral N-heterocyclic carbene catalyzed staudinger reaction of ketenes with imines: Highly enantioselective synthesis of N-Boc-lactams [J]. Organic Letters, 2008, 10(2): 277-280. |
| [50] | Zhao Y M, Cheung M S, Lin Z, et al. Enantioselective synthesis of β, γ -unsaturated α -fluoroesters catalyzed by N-heterocyclic carbenes[J]. Angewandte Chemie International Edition, 2012, 51(41): 10359-10363. |
| [51] | Wang L, Chen J, Huang Y. Highly enantioselective AzaMichael reaction between alkyl amines and β-trifluoromethyl β-aryl nitroolefins[J]. Angewandte Chemie International Edition, 2015, 54(51): 15414. |
| [52] | Guo F, Chen J, Huang Y. A bifunctional N-heterocyclic carbene as a noncovalent organocatalyst for enantioselective Aza-Michael addition reactions[J]. ACS Catalysis, 2021, 11(10): 6316. |
| [53] | Fu Z, Xu J, Zhu T, et al. β-Carbon activation of saturated carboxylic esters through N-heterocyclic carbene organocatalysis[J]. Nature Chemistry, 2013, 5(10): 835-839. |
| [54] | Zhao C, Guo D, Munkerup K, et al. Enantioselective[3+3] atroposelective annulation catalyzed by N-heterocyclic carbenes[J]. Nature Communications, 2018, 9(1): 611. |
| [55] | Zhang Z F, Xie F, Jia J, et al. Chiral bicycle imidazole nucleophilic catalysts: Rational design, facile synthesis, and successful application in asymmetric Steglich rearrangement[J]. Journal of the American Chemical Society, 2010, 132(45): 15939-15941. |
| [56] | Shi Z, Yu P, Loh T P, et al. Catalytic asymmetric[4+2] annulation initiated by an aza-rauhut-currier reaction: Facile entry to highly functionalized tetrahydropyridines [J]. Angewandte Chemie International Edition, 2012, 51 (31): 7825-7829. |
| [57] | Su X, Zhou W, Li Y, et al. Design, synthesis, and application of a chiral sulfinamide phosphine catalyst for the enantioselective intramolecular Rauhut-Currier reaction [J]. Angewandte Chemie International Edition, 2015, 54 (23): 6874-6877. |
| [58] | Dong X, Liang L, Li E, et al. Highly enantioselective intermolecular cross Rauhut-Currier reaction catalyzed by a multifunctional Lewis base catalyst[J]. Angew Chem Int Ed Engl, 2015, 54(5): 1621-1624. |
| [59] |
Shi M, Chen L H, Li C Q. Chiral phosphine Lewis bases catalyzed asymmetric |
| [60] | Wang X J, Fang T, Tong X F. Enantioselective aminecatalyzed[4+2] annulations of allenoates and oxo-dienes: An asymmetric synthesis of dihydropyrans[J]. Angewandte Chemie International Edition, 2011, 50(23): 5361-5364. |
| [61] | Zhang L, Liu H, Qiao G, et al. Phosphine-catalyzed highly enantioselective[3+3] cycloaddition of MoritaBaylis-Hillman carbonates with C, N-cyclic azomethine imines[J]. Journal of the American Chemical Society, 2015, 137(13): 4316-4319. |
| [62] | Du H, Zhao D, Ding K. Enantioselective catalysis of the hetero-Diels-Alder reaction between Brassard's diene and aldehydes by hydrogen-bonding activation: A onestep synthesis of (S)-(+)-dihydrokawain[J]. Chemistry A European Journal, 2004, 10(23): 5964-5970. |
| [63] | Xiao H, Chai Z, Zheng C W, et al. Asymmetric[3+2] cycloadditions of allenoates and dual activated olefins catalyzed by simple bifunctional N-Acyl aminophosphines [J]. Angewandte Chemie International Edition, 2010, 249 (26): 4467-4470. |
| [64] | Hua M Q, Cui H F, Wang L, et al. Reversal of enantioselectivity by tuning the conformational flexibility of phase-transfer catalysts[J]. Angewandte Chemie International Edition, 2010, 49(15): 2772-2776. |
| [65] | Xu B, Shi L L, Zhang Y Z, et al. Catalytic asymmetric direct α-alkylation of amino esters by aldehydes via imine activation[J]. Chemical Science, 2014, 5(5): 1988-1991. |
| [66] | Chen J F, Gong X, Li J Y, et al. Carbonyl catalysis enables a biomimetic asymmetric Mannich reaction[J]. Science, 2018, 360(6396): 1438-1442. |
| [67] | Huang S, Wen H, Tian Y A, et al. Organocatalytic enantioselective construction of chiral azepine skeleton bearing multiple-stereogenic elements[J]. Angewandte Chemie International Edition, 2021, 60(39): 21486-21493. |
| [68] | Tu Y, Wang Z X, Shi Y. An efficient asymmetric epoxidation method for trans-olefins mediated by a fructosederived ketone[J]. Journal of the American Chemical Society, 1996, 118(40): 9806-9807. |
| [69] | Yang D, Yip Y C, Tang M W, et al. A C2 symmetric chiral ketone for catalytic asymmetric epoxidation of unfunctionalized olefins[J]. Journal of the American Chemical Society, 1996, 118(2): 491-492. |
| [70] | Chen Y, Tian S-K, Deng L. A highly enantioselective catalytic desymmetrization of cyclic anhydrides with modified cinchona alkaloids[J]. Journal of the American Chemical Society, 2000, 122(39): 9542-9543. |
| [71] | Wang W, Wang J, Hao L. Direct, highly enantioselective pyrrolidine sulfonamide catalyzed Michael addition of aldehydes to nitrostyrenes[J]. Angewandte Chemie International Edition, 2005, 44(9): 1369-1371. |
| [72] | Zhang S L, Xie H X, Zhu J, et al. Organocatalytic enantioselective β -functionalization of aldehydes by oxidation of enamines and their application in cascade reactions[J]. Nature Communications, 2011, 2(2): 211. |
| [73] | Zhu G, Chen Z, Jiang Q, et al. Asymmetric[3+2] cycloaddition of 2, 3-butadienoates with electron-deficient olefins catalyzed by novel chiral 2, 5-dialkyl-7-phenyl-7-phosphabicyclo[2.2.1]heptanes[J]. Journal of the American Chemical Society, 1997, 119(16): 3836-3837. |
| [74] | Ma T, Fu X, Kee C W, et al. Pentanidium-catalyzed enantioselective phase-transfer conjugate addition reactions [J]. Journal of the American Chemical Society, 2011, 133 (9): 2828-2831. |
| [75] | Zhang X, Ren J, Tan S M, et al. An enantioconvergent halogenophilic nucleophilic substitution (SN2X) reaction [J]. Science, 2019, 363(6425): 400-404. |
| [76] | Han X, Wang Y, Zhong F, et al. Enantioselective[3+2] cycloaddition of allenes to acrylates catalyzed by dipeptide-derived phosphines: Facile creation of functionalized cyclopentenes containing quaternary stereogenic centers[J]. Journal of the American Chemical Society, 2011, 133(6): 1726-1729. |
2. Department of Chemistry and Biochemistry, Texas Tech University, Lubbock 79409, USA