2020年10月7日,瑞典皇家科学院宣布2020年度诺贝尔化学奖授予马克斯·普朗克病原学研究室(Max Planck Unit for the Science of Pathogens)的埃马纽埃尔·卡彭蒂耶(Emmanuelle Marie Charpentier)教授和加州大学伯克利分校(University of California,Berkeley)的珍妮弗·杜德纳(Jennifer Anne Doudna)教授(图 1[1]), 以表彰她们“开发出一种基因编辑方法”。CRISPR/Cas9“基因剪刀”是基因编辑技术中最强大的工具之一,具有成本低、易用性强和效率高等特点,可使研究人员非常精准且快速地改变植物、动物和微生物的DNA(脱氧核糖核酸)。这一工具为植物育种带来了新机会,有助于开发新的癌症疗法,并可能使治愈遗传性疾病的梦想成真,为整个生命科学带来了无限的可能。
 |
图 1 埃马纽埃尔·卡彭蒂耶(左)和珍妮弗·杜德纳(右) |
“这个基因编辑工具拥有巨大的能量,会影响到我们每一个人。它不仅引发了基础科学的变革,也产生了很多创新性的成果,并将带来具有独创性的新治疗方法。”诺贝尔化学委员会主席古斯塔夫森(Claes Gustafsson)在诺贝尔奖得主公布后,接受采访时说[1]。
CRISPR/Cas9技术核心来源于微生物的免疫反应。1987年日本学者石野良纯(Yoshizumi Ishino)发现大肠杆菌内存在一些异常重复序列[2]。随后,莫伊察(Francisco Mojica)在古细菌基因组中也发现了这种重复序列,受到石野良纯工作的启发,他对此展开了深入研究并在20余种不同微生物中发现了此类结构的存在[3]。2002年詹森(Ruud Jansen)与莫伊察通过商议正式将这一结构命名为CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,常间回文重复序列簇集)[4]。随着相关研究不断深入,2007年微生物学家巴兰古(Rodolphe Barrangou)证实CRISPR是一种细菌体内的适应性免疫系统[5],但其作用机理仍有待深入探究,这吸引了越来越多的研究者,卡彭蒂耶与杜德纳便是“误入藕花深处”的两位“幸运儿”。
1 科研历程 1.1 杜德纳的生命科学之旅珍妮弗·杜德纳,1964年出生于美国华盛顿特区,7岁时移居夏威夷并在那里长大,父母都在当地的大学任教。在父母的鼓励下,杜德纳从小便热爱探索,痴迷于岛上奇特的动植物群体,大自然的魅力激发了她的好奇心与理解潜在生命机制的欲望。沃森(James Watson)的《双螺旋——发现DNA结构的故事》如侦探小说般引领着这个充满强烈好奇的少女走进了生命科学的微观世界[6]。
高中时,一场关于细胞癌变的讲座使杜德纳找到了自己的使命。“我当时简直目瞪口呆”,杜德纳回忆道,“我想成为像演讲者一样的科学家”[7]。受此影响,她进入加州波莫纳学院(Pomona College)学习生物化学,1985年毕业后进入哈佛医学院(Harvard Medical School),在杰克·绍斯塔克(Jack Szostak,2009年诺贝尔生理学或医学奖获得者)教授指导下于1989年获得博士学位。读博期间,她改造催化性RNA使之具有自我复制能力,为证明RNA是早期生命的基础提供了依据。1991年,杜德纳进入科罗拉多大学博尔德分校(University of Colorado Boulder)做博士后,致力于RNA微观构造研究;1994年,她进入耶鲁大学(Yale University)分子生物物理与生物化学系担任助理教授;2000年担任教授并受邀为哈佛大学(Harvard University)客座教授;2002年进入加州大学伯克利分校[8]。
在加州大学伯克利分校,杜德纳开始接触与CRISPR相关的研究。通过与微生物学家班菲尔德(Jillian Banfield)交流,她了解到CRISPR这种奇怪的结构,其中非重复的序列部分似乎与多种病毒的遗传基因相关,细菌在自身RNA中保留病毒的遗传密码作为对抗宿敌留下的记录,并成为免疫系统的一部分,来保护自身免受病毒的下一次侵害。虽然学界对于这一功能的机制尚无定论,但与杜德纳正在研究的RNA干扰具有非常奇妙的相似性。
为了解这一机制是如何运作的,杜德纳和她的团队将视线聚焦在了一种与CRISPR相关的特殊基因(CRISPR-associated genes,Cas)上,这种基因与一种专门负责解旋与切割DNA的蛋白质的编码基因十分相似。他们用了几年时间成功地揭示了数种不同Cas蛋白质的功能,发现其作用机理非常复杂,需要多种不同种类的蛋白质共同作用才能够分解侵入体内的病毒。“我记得,我当时认为这可能是我研究过的最难懂的东西。”杜德纳回忆时说[7]。
与此同时,多所大学的科研团队也在研究这种存在于细菌体内的CRISPR/Cas系统,并有了不同的发现,其中包括卡彭蒂耶教授。
1.2 卡彭蒂耶的辗转研究之路卡彭蒂耶,1968年出生在法国朱维西(Juvisysur-Orge),1986年进入巴黎第六大学(University of Pierre and Marie Curie)学习生物化学、微生物学和遗传学,这是她研究之路的开端。在2015年生命科学突破奖颁奖典礼上,她讲到:“好奇心,对于新知的渴望和理解,将永远是我生命中强大的驱动力”[9]正是这种永不停息的对于知识的渴求促使着她一路辗转,不断寻找着更为理想的科研环境。
1992年,卡彭蒂耶进入法国巴斯德研究所(Pasteur Institute)进行抗生素抗药性分子机制的研究,1995年获得了博士学位;留所1年后进入纽约洛克菲勒大学(Rockefeller University),在托马宁(Elaine Tuomanen)教授的实验室做博士后,研究病原体肺炎链球菌利用其可移动基因原件改变其基因组的原理,同时尝试阐述肺炎链球菌如何产生万古霉素耐药性[10]。1997—2002年,卡彭蒂耶先后在纽约大学朗格尼医学中心(NYU Langone Medical Center)、圣朱迪儿童研究医院(St. Jude Children's Research Hospital)和纽约斯格鲍尔生物分子医学研究院(Skirball Institute of Biomolecular Medicine)担任助理研究员。2002年,她返回欧洲,成为维也纳大学(University of Vienna)微生物和遗传研究所的实验室主任和客座教授;2004年担任微生物学和微生物免疫学实验室主任;2006年进入分子生物学中心,并担任马克斯·费迪南·佩鲁茨(Max f. Perutz)实验室主任;2008年卡彭蒂耶进入瑞典于默奥大学(Umea University);2013—2015年,移居德国不伦瑞克,任汉诺威医学院(Hanover Medical School)教授,兼任亥姆霍兹感染研究中心(Helmholtz Centre for Infection Research)的部门负责人;2015年,卡彭蒂耶接受邀请担任马克斯·普朗克感染生物学研究所(Max Planck Institute for Infection Biology)主任,并在2018年创立马克斯·普朗克病原学研究室[11]。
卡彭蒂耶在过去20余年的科研生涯中,曾在5个国家、7个城市的10余家不同机构任职,从依赖短期资助经营自己的小实验室,到建立更为理想的科研平台,她的坚持为她带来了回报。特别是2008年进入于默奥大学,成为她研究飞速进展的开端,原本的工作积累在此时派上了用场,她在化脓性链球菌的RNA测序时曾注意到这种细菌中存在某种未知小分子RNA,而进一步的研究发现,其基因序列的一部分竟然与自身基因组中的特有CRISPR序列相匹配。
尽管此前卡彭蒂耶并未接触过CRISPR的研究,但她与团队仍迅速开始工作,进行化脓性链球菌CRISPR系统图谱的绘制。与杜德纳团队所研究的复杂的CRISPR/CasI型系统不同,化脓性链球菌的CRISPR/Cas系统属于Ⅱ型,仅需要一个Cas蛋白——Cas9,即可进行病毒DNA裂解。与此同时,卡彭蒂耶认识到这种能够与CRISPR配对的小分子RNA(tracrRNA,trans-activating CRISPR RNA)的重要性:细菌基因组中的CRISPR与Cas蛋白质裂解病毒DNA的过程,必须要有这种小分子RNA才能够被激活。终于,这种困扰学界多年的神秘小分子得到了破译,上述成果于2011年3月发表在《Nature》上[12],根据多年在微生物学方面的研究经验,她知道一些更加激动人心的事情将要发生了。
1.3 波多黎各的相遇就在文章发表后的那个春天,卡彭蒂耶受邀到波多黎各参加美国微生物学会举办的学术会议。在那里她结识了杜德纳,并一拍即合,决定共同开展CRISPR/Cas9系统的研究[13]。
合作很快就取得了突破性的成果,她们发现当细菌受到“入侵”时,CRISPR序列会转录出precrRNA(crRNA的前体)和tracrRNA,两者相结合形成复合物,随后pre-crRNA被加工为带有单个病毒密码的成熟crRNA(CRISPR-derived RNA),与一同加入连接队列的剪切蛋白Cas9共同形成天然的“基因剪刀”,游走在细菌细胞中,识别病毒感染并对其进行精确切割。随后,她们尝试简化这一结构,通过设计将tracrRNA与crRNA分子合二为一,并修改其中负责记忆的部分,使之与需要被切割的DNA位点相匹配,最终达到在确定的位置精确切割DNA的目的。经过了1年对于实验的反复确认后,CRISPR/Cas9基因编辑技术的成果于2012年在《Science》发表[14]。
生命在数十亿年的演化中常常能够给出让人惊叹的解决方案,一种长期与人类免疫系统作斗争的细菌,其本身也拥有着对抗侵略的武器,卡彭蒂耶和杜德纳通过合作,破解了这一机制并从中发展出一种全新的精准基因编辑工具——CRISPR/Cas9“基因剪刀”。它是如此简单且有效,一经出世就吸引了世界的目光。
1.4 令人喝彩的大胜利基于Web of Science数据库的检索结果,截止到2021年9月6日,卡彭蒂耶和杜德纳2012年在《Science》上发表的CRISPR/Cas9基因编辑技术的论文[14]总被引次数为7332,具体年份数据见图 2。
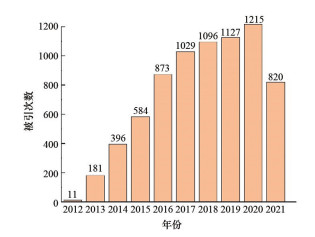 |
图 2 CRISPR/Cas9技术论文引用次数统计 |
由图 2可见,该论文自发表以来,其被引次数迅速上涨,至2017年突破千次,其后上涨趋缓但仍保持着高被引,可见CRISPR/Cas9技术的研究和应用前景之广。其实,在大量研究的基础上,该技术已在不同学科催生出很多重大成果。例如在植物研究领域,已用于开发耐干旱、严寒或者霉菌虫害的作物;在动物研究领域,尝试制造抗病猪,以及通过设计使猪具有含功能性人类细胞或组织的嵌合器官以用于人类器官移植;在微生物领域,可对酿酒酵母的基因组进行编辑;在医学领域,与“基因剪刀”技术相关的癌症新疗法临床试验正在开展,治愈遗传性疾病有望成为现实[15]。
其实CRISPR/Cas9并非唯一的基因编辑技术,如锌指核酸内切酶(zinc-finger nucleases,ZFN)和类转录激活因子效应物核酸酶(transcription activator-like effector nucleases,TALEN)技术也能够对基因进行精确编辑,且已有了较为成熟的应用,在特定条件下甚至比CRISPR/Cas9的效果更好[16]。但CRISPR/Cas9的易用性与低成本是其他技术所不可及的,打破了昂贵的成本对于科研工作的限制,极大地提高了生命科学的科研效率[17]。
麻省理工学院教授贾尼斯(Rudolf Jaenisch)评价CRISPR/Cas9“基因剪刀”技术的易用性为“任何白痴都能做得到”[18]。生物物理化学家、诺贝尔化学委员会成员斯塔夫谢德(Pernilla Wittung Stafshede)在2020年诺贝尔化学奖线上颁奖仪式上评价该技术的价值:“在任何需要的位置切割DNA的能力彻底改变了生命科学。这种在8年前发现的‘基因剪刀’,已经使人类受益匪浅。”[1]曾证明了CRISPR是细菌体内适应性免疫系统的北卡罗来纳州立大学研究员巴兰古认为杜德纳和卡彭蒂耶“开发出了一种惊人的技术,使学界能够实现基因组编辑的民主化”[18]。
卡彭蒂耶和杜德纳的CRISPR/Cas9研究工作不仅受到学界的赞誉,也为她们赢得了多个国际奖项,除2020年的诺贝尔化学奖外,她们还获得了2014年保罗·詹森博士生物医学研究奖(Dr. Paul Janssen Award)、2015年生命科学突破奖(Breakthrough Prize)、2015年格鲁伯遗传学奖(Gruber Genetics Prize)和2016年加拿大盖尔德纳国际奖(Canada Gairdner International Award);卡彭蒂耶还于2016年获得德国研究基金会的莱布尼茨奖(Leibniz Prize),并当选瑞典皇家科学院院士[18]。
2 思考与启示 2.1 掌声为了谁?当我们都在庆贺CRISPR/Cas9的获奖时,也应想到这掌声不仅仅是为了卡彭蒂耶和杜德纳两个人,更是为了她们所代表着的科研中的女性力量与其专注于基础研究的科学精神。自2020年诺贝尔奖颁布后,获得诺贝尔化学奖的女性已达7位,这不仅是对CRISPR/Cas9技术本身价值的认可,同时也是对两位科学家所代表的女性科研人员的肯定,毕竟这是有史以来诺贝尔奖第1次只发给2名女性!英国皇家化学学会主席威尔顿(Tom Welton)表示:“非常高兴看到诺贝尔委员会选择表彰两位积极研究的女性。”[18]而获奖者本人的态度也印证了这次奖项带来的积极作用,“尤其是对于年轻女性来说,看到女性的工作能够像男性一样得到认可,这太棒了”。杜德纳表示,“我认为对于许多女性来说,总是有一种感觉,她们的工作很难像男士一样得到认可,我们一直在期待着这种现状被改变,当然,我们现在就走在正确的路上”[19]。卡彭蒂耶也认为,自己得到认可,对于想要开始并长时间从事科研工作的年轻女性来说是一个非常积极的信息[20]。当女性科研工作者能够受到与男性同样的认可与期待,她们完全能够做出毫不逊色的科研成果以回馈社会。
巴兰古说,这个奖项是“该领域先驱们庆祝的一次大好机会”,在她们的工作之前,“较少人关注CRISPR”[18]。事实上,正在从事不被看好或曾经不被看好的基础研究的科学家都应为此庆祝。经世致用的应用研究固然有推动社会发展的价值所在,但探究性的基础研究亦有其不可取代的重要性,有时甚至比应用研究更为重要。古细菌中的常间回文重复序列簇集(CRISPR)看似无实用价值,而据其发现的“基因剪刀”却深刻地改变了生命科学。诺贝尔奖获得者萨拉姆(Abdus Salam)也认为,“一个国家,特别是发展中国家要想得到长足的进步与国力的发展,那就必须重视基础科学”,科学家“需要明智的科学政策,长期的保证,慷慨的资助,以及实行自治和自由的国际交往”[21]。如此,才能更加高效地工作,不断推进国家科学技术的发展,进而提升综合国力和国际影响力。
2.2 是胜利还是陷阱?CERISPR/Cas9技术的发现虽然为科研工作者带来福音,但也引发了许多人的忧虑。基因改造一直是大众十分敏感的话题,伦理学家担心基因编辑技术被用在有目的性地修改人类胚胎的研究中,当人们轻率地删除一些非病理性、不受欢迎的基因时会将整个人类带入一个优生陷阱中,CRISPR/Cas9技术的高易用性则很有可能加速这一进程[22]。而以CRISPR/Cas9技术为基础的基因驱动技术给予了改造基因在群体中快速传播的能力,这使得人为干预基因的行为变得非常危险[23]。当我们拥有了轻易改造整个种群的基因的能力,那么如何控制这种能力就成为一件至关重要的事。
在推动技术发展的同时,2位技术开发者也表现出了对于CRISPR/Cas9基因编辑技术被误用的担心,并尝试着与多国科研工作者共同推动CRISPR/Cas9技术的研究与应用朝着更加明智的方向发展。2015年1月,杜德纳作为组织者之一发起并主持了纳帕谷会议,与会者包括科学家、生物伦理学家、电影制片人以及加州大学伯克利分校的行政管理人员,会上讨论了基因工程可能对卫生保健、农业和环境等方面产生的影响,并将该项技术对人类生殖细胞系的修改所产生的影响作为讨论重点。杜德纳在当年12月为《Nature》杂志所撰的一篇评论中表示,“我对基因工程有可能对人类生活以及我们对生物系统的基本理解所产生的积极影响感到兴奋,但我也认为,当今的科学家应当进行严谨的思考,来为他们的工作对社会、伦理和生态可能造成的后果做好更加周全的准备。”[24]卡彭蒂耶认可此观点,并认为应有国际禁令对生殖细胞编辑做出限制[25]。以纳帕谷会议为起点,杜德纳已在世界各地发表了60余次演讲,以鼓励人们充分了解并积极参与CRISPR技术应用范围的讨论[26]。2015年12月,由中国科学院与美国国家科学院、美国国家医学院和英国皇家学会联合举办的人类基因编辑国际峰会在华盛顿召开,来自22个国家和地区相关领域的专家和学者200余人参加了会议并达成协议,其中包括:允许利用基因编辑技术进行修改人类胚胎或生殖细胞的研究,但严格禁止经过修改的生殖细胞继续生存、发育[27]。基因编辑技术的影响广泛且深远,面对其发展问题,国际社会必须树立人类命运共同体意识。现已达成的国际共识是非常良好的开端,后续如何加强技术交流与合作,在法律法规及伦理道德方面达成一致共识,仍需要国际范围内科学界和社会各界的共同努力与持续沟通。
2.3 快速商业化是喜是忧?商业化是推动技术发展的强大动力,CRISPR/Cas9技术迅速发展[28],其巨大的商业潜力催生了一批公司,如位于英国剑桥的地平线探索公司(Horizon Discovery Group),美国马萨诸塞州的爱迪达斯医药公司(Editas Medicine)和智能医疗公司(Intellia Therapeutics)等上市公司,以及由张峰、David Liu与J. Keith Joung共同创立的光束医疗公司(Beam Therapeutics),Paul Dabrowski和Michael Dabrowski兄弟创立的合成器公司(Synthego)等非上市公司。很多传统大型医药公司与CRISPR技术持有者进行合作研发并给予资金支持,如由卡彭蒂耶创办的CRISPR医疗公司(CRISPR Therapeutics),于2016年与拜耳公司合资成立凯斯比亚公司(Casebia),拜耳公司同意在未来5年内向CRISPR Therapeutics支付至少3亿美元的研发投资[29]。
另一方面,市场投资方对CRISPR/Cas9技术的商业价值也保持着持续关注。Thessalus生物技术投资基金的米切尔(Mitchell Ng)认为:“CRISPR推动着几乎所有的生物技术领域内的前沿发现,从基因编辑到癌症治疗,我们基金在2017年度表现最好的投资都与该技术直接或间接相关。”[30]根据亿欧咨询(Yole Développement)的报告《CRISPR Technology & Market Overview from Lab to Industry 2018》(《CRISPR技术市场概述:从实验室到产业界2018》),CRISPR/Cas9技术的市场将在生物技术和农业技术领域的应用推动下以44% 的年增长率持续,到2023年预计可增长至50亿美元。其中,基因治疗作为经济前景最广阔的领域,相关募资总额在2018年已达近39亿美元,对于该技术未来可能达到的整体市场规模来说,这是一个非常积极的信号[31]。
但与此同时,如此大量的资本涌入也让我们不得不有所忧虑。为了追求投资回报,争夺市场的主导权,资本必将不断催促科研工作者进行更快速、深入的研发。在这个过程中,如何保证既有的约定不被打破,进而保证CRISPR/Cas9技术的纯洁性,将是一个需要全球科研工作者和政府部门、国际组织等共同面对的问题。
| [1] | The Nobel Prize in Chemistry 2020[EB/OL]. [2020-11-04]. https://www.nobelprize.org/prizes/chemistry/2020/summary/. |
| [2] | Ishino Y, Shinagawa H, Makino K, et al. Nucleotide sequence of the iap gene responsible for alka-line phosphatase isozyme conversion in Escherichia coli and identification of the gene product[J]. Journal of Bacteriology, 1987, 169: 5429-5433. |
| [3] | Mojica F J, Díez-Villaseñor C, Soria E, et al. Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria[J]. Molecular Microbiology, 2000, 36(1): 244-246. |
| [4] | Jansen R, van Embden J D A, Gaastra W, et al. Identification of genes that are associated with DNA repeats in prokaryotes[J]. Molecular Microbiology, 2002, 43(6): 1565-1575. |
| [5] | Rodolphe B, Christophe F, Hélène D, et al. CRISPR provides acquired resistance against viruses in prokaryotes [J]. Science, 2007, 315(5819): 1709-1712. |
| [6] | Strength in stubbornness: A 2020 Nobel winner reflects on her career[EB/OL]. [2020-11-02]. https://www.nationalgeographic.com/science/2020/10/interview-jenniferdoudna-winner-of-nobel-prize-in-chemistry/. |
| [7] | Jennifer Doudna, a pioneer who helped simplify genome editing[EB/OL]. [2020-11-02]. https://www.nytimes.com/2015/05/12/science/jennifer-doudna-crispr-cas9-geneticengineering.html. |
| [8] | Jennifer Doudna-Wikipedia[EB/OL]. [2020-10-20]. https://en.wikipedia.org/wiki/Jennifer_Doudna. |
| [9] | Jennifer Doudna wins 2015 Breakthrough Prize in life sciences[EB/OL]. [2020-11-04]. https://innovativegenomics.org/news/jennifer-doudna-wins-2015-breakthroughprize-in-life-sciences/. |
| [10] | Novak R, Henriques B, Charpentier E, et al. Emergence of vancomycin tolerance in Streptococcus pneumoniae [J]. Nature, 1999, 399(6736): 590-593. |
| [11] | Emmanuelle Charpentier-Wikipedia[EB/OL]. [2020-10-20]. https://wikipedia.org/wiki/Emmanuelle-Charpentier. |
| [12] | Deltcheva E, Chylinski K, Sharma C M, et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase Ⅲ[J]. Nature, 2011, 471(7340): 602-607. |
| [13] | Genetic scissors: A tool for rewriting the code of life[EB/OL]. [2020-11-13]. https://www.nobelprize.org/uploads/2020/10/popular-chemistryprize2020.pdf. |
| [14] | Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J]. Science, 2012, 337(6096): 816-821. |
| [15] | 郑武, 谷峰. CRISPR/Cas9的应用及脱靶效应研究进展[J]. 遗传, 2015, 37(10): 1003-1010. |
| [16] | 周金伟, 徐绮嫔, 姚婧, 等. CRISPR/Cas9基因组编辑技术及其在动物基因组定点修饰中的应用[J]. 遗传, 2015, 37(10): 1011-1020. |
| [17] | 左其生, 李东, 张亚妮, 等. CRISPR-Cas介导的基因编辑工具[J]. 生物技术通报, 2014, (7): 37-43. |
| [18] | CRISPR, the revolutionary genetic 'scissors', honored by Chemistry Nobel[EB/OL]. [2020-10-20]. https://www.sciencemag.org/news/2020/10/crispr-revolutionary-genetic-scissors-honored-chemistry-nobel. |
| [19] | Jennifer A. Doudna interview[EB/OL]. [2020-11-02]. https://www.nobelprize.org/prizes/chemistry/2020/doudna/interview/. |
| [20] | Emmanuelle Charpentier interview[EB/OL]. [2020-11-02]. https://www.nobelprize.org/prizes/chemistry/2020/charpentier/interview/. |
| [21] | 马贤荣, 马雪峰. 为基础科学研究而劝勉——诺贝尔物理学奖获得者阿卜杜斯·萨拉姆[J]. 物理教师, 2016, 37(10): 67-70. |
| [22] | 赵钦军, 韩忠朝. 基因编辑技术的发展前景及伦理与监管问题探讨[J]. 科学与社会, 2016, 6(3): 1-11. |
| [23] | 薛杨, 俞晗之. 前沿生物技术发展的安全威胁: 应对与展望[J]. 国际安全研究, 2020, 38(4): 136-156. |
| [24] | Doudna J. Perspective: Embryo editing needs scrutiny[J]. Nature, 2015, 528(7580): S6. |
| [25] | 张薇薇. 基因编辑技术: 一场正在进行的革命——伊曼纽尔·查朋特访谈录[J]. 世界科学, 2015(9): 13-15. |
| [26] | Doudna J. Genome-editing revolution: My whirlwind year with CRISPR[J]. Nature, 2015, 528(7583): 469-471. |
| [27] | On human gene editing: International summit statement [EB/OL]. [2020-10-31]. https://www.nationalacademies.org/news/2015/12/on-human-gene-editing-international-summit-statement. |
| [28] | 李东巧, 杨艳萍. 作物基因组编辑技术国际发展态势分析[J]. 中国科学: 生命科学, 2019, 49(2): 179-190. |
| [29] | Top 10 CRISPR companies leveraging gene editing technologies[EB/OL]. [2020-10-27]. https://www.genengnews.com/a-lists/top-10-companies-leveraging-geneediting-in-2019. |
| [30] | Tech explained: CRISPR gene editing[EB/OL]. [2020-11-02]. https://www.springwise.com/tech-explained/crispr-gene-editing. |
| [31] | CRISPR technology & market overview from lab to industry 2018[EB/OL]. [2020-10-29]. https://www.slideshare.net/Yole-Developpement/crispr-technology-market-overview-from-lab-to-industry-2018-report-byyole-developpement-120311808. |