2. 中国地质科学院矿产资源研究所,北京 100037
锂是稀有元素,它具有最小的原子半径和最轻的质量,因此锂具有独特的物理、化学性质,被广泛应用于军事、机械、化工、医药和新能源等行业[1]。伴随新能源行业迅猛发展,全球锂年消耗量已从2012年22500 t到2019年47600 t,增长量达111.6%,2019年预测全球锂生产力为91000 t(图 1,资料来源于文献[2]~[13])。美国地质调查局2019年最新统计世界已查明的锂资源量6200万t,主要分布在南美洲和亚洲(约70%),重要富集地为南美洲"锂三角"(玻利维亚、阿根廷、智利),而中国金属锂资源量450万t,居世界锂资源储量第6位,其中盐湖锂资源所占比例约80%,占世界盐湖锂资源的1/3[14],主要分布在青海、西藏等西部地区。
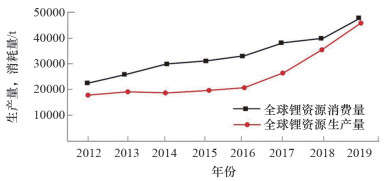 |
图 1 世界锂资源生产和消费趋势 |
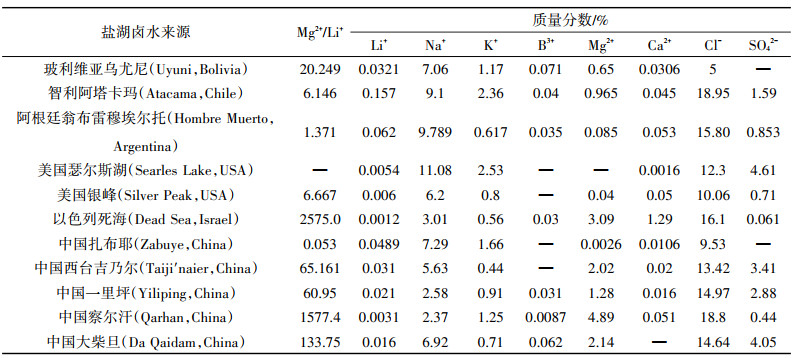
盐湖是一种综合性的宝贵的自然资源,人类已从盐湖中大量开采盐类资源,综合利用取得长足进步。表 1[15-17]列出了世界主要富锂盐湖的化学组成。盐湖卤水中主要含有Li+、Na+、K+、Ca2+、Mg2+等阳离子和SO42-、Cl-、CO32-等阴离子,按化学成分盐湖卤水分为碳酸盐型、硫酸盐型和氯化物型。盐湖提锂工艺和成本主要由盐湖类型控制,卤水中Mg2+、B3+等伴生离子通常会给Li+分离带来麻烦。目前世界上已经被工业化开发的盐湖大多数为低镁锂比盐湖,如智利阿塔卡玛盐湖(Atacama,Chile)、美国瑟尔斯湖(Searles Lake,USA)等。中国盐湖资源除西藏扎布耶盐湖(中度碳酸盐型盐湖)外都具有高镁锂比[18],由于Mg和Li具有相似的化学性质,导致高镁锂比盐湖中镁锂用沉淀法分离效果差,使盐湖锂资源开发难度更高,研制出液相锂吸附剂实现高效提锂不仅经济意义巨大,而且具有重要的战略意义。
吸附剂提锂工艺是用天然或合成的化合物,制成可对卤水中锂离子进行选择性吸附,再用水或洗脱液将吸附剂中锂离子洗脱,使锂离子与杂质和伴生离子分离的方法[19-21]。吸附法适用于高镁锂比盐湖,且提锂工艺简单,提锂过程中污染小,按照制备吸附剂材料不同分为有机吸附树脂吸附剂和无机吸附剂,无机吸附剂目前有层状吸附剂、无定型氢氧化物吸附剂、铝盐吸附剂、天然矿物吸附剂、离子筛吸附剂等。吸附剂提锂工艺在高镁锂比盐湖中应用目前存在如下问题:(1)吸附剂通用性差;(2)实际吸附容量远小于理论吸附容量;(3)吸附剂制备与成型工艺对吸附容量影响大;(4)吸附剂的复用频率低。
本文以制备针对高镁锂比盐湖卤水锂吸附剂为目标,针对以上问题对已经工业化应用的吸附剂进行分析。重点研究离子筛吸附剂,总结锰系离子筛的离子交换机理、氧化还原机理和混合机理研究进展,分析天然矿物改性做吸附剂的机理,提出各种吸附剂在工业提锂应用中面临的挑战,展望天然矿物改性作吸附剂的前景。
1 离子筛吸附剂离子筛吸附剂最早由苏联科研人员在1970年左右研制成功[22],并用在盐湖提锂工艺。其基本原理就是将目的离子导入无机化合物中生成新的复合氧化物,在保持晶体结构不变的前提下洗脱目的离子,得到缺少目的离子孔隙的化合物,因此其对目的离子可进行选择性吸附(图 2[23])。
 |
图 2 锂离子筛吸附过程示意[23] |
在锰的氧化物中尖晶石结构的λ-MnO2具有三维网络离子隧道,Li+更容易嵌入形成更合适的结晶结构,使其对Li+具有特殊的吸附效应(图 3)。
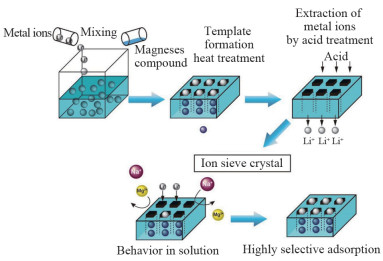 |
图 3 锰系离子筛合成及提锂示意[23] |
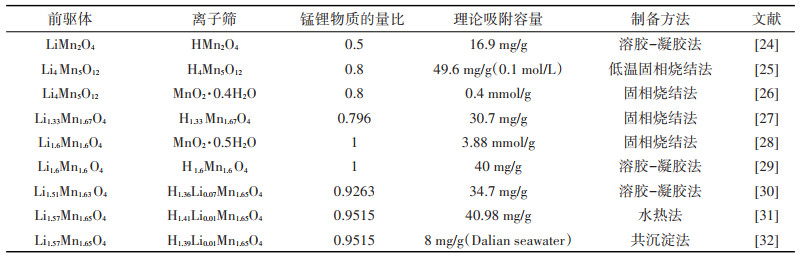
尖晶石结构主要包括LiMn2O4、Li4Mn5O12和Li4Mn5O12等(表 2),其中LiMn2O4类前驱体研究较多。
| 表 2 锰系锂离子筛吸附特征对比 |
而关于Li+在尖晶石结构中嵌入/脱出的机理主要的观点有氧化还原机理、离子交换机理和二者复合机理。
Hunter等[33]在Li+脱出尖晶石的反应中最早提出氧化还原机理:
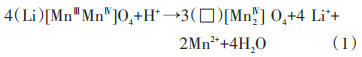
式中,()为8a四面体位;[]为16d八面体位;□为空位。
Ooi等[34]通过Li+嵌入λ-MnO2中的反应同样提出氧化还原机理,此机理中Mn2+会伴随Li+脱出进入溶液中,解释了锰的溶损和使用中锂离子筛吸附容量随时间降低的现象。
部分学者提出了离子交换机理,与氧化还原机理截然不同,Shen等[35]认为Li+从LiMn2O4脱出发生的是H+、Li+离子交换反应:
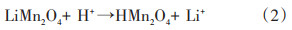
得到的离子筛锰氧化物的8a四面体位不是氧化还原机理所描述的空位,而是质子化的。Clearfield等[36]同样认为Li+的迁出和嵌入是Li+和H+的离子交换反应,晶格内锰离子并未发生变化,很好地解释锰离子筛的稳定性,但不能说明锰离子筛随着吸附循环次数的增加但性能降低,其反应方程式如下:
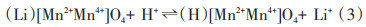
Koyanaka等[37]通过锂吸附量与λ-MnO2中H+定量化关系,指出Li+与H+发生的是离子交换反应。并用溶液pH值与离子筛吸附容量的关系证明了这一机理的存在,但该机理不能有效地解释锰溶损现象。
上述两种机理都对尖晶石结构锰系离子筛在卤水提取锂做了很好的解释,但它们都存在局限性。Feng等[38]认为Li+在锰系离子筛中的嵌入/脱出同时存在上述两种机理,Li+在迁出时同时存在氧化还原位点和离子交换位点,Li+在不同位点分别遵从氧化还原反应和离子交换反应,这两个位点存在于锰-氧的结构中,同时电子可以在锰离子间自由移动(图 4)。该机理可以很好解释Li+嵌入/脱出过程,但理论复杂仍存在争议,在未来锰系离子筛的研究中应重点关注该机理。
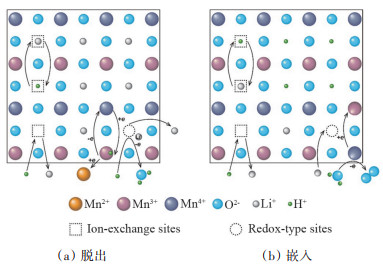 |
图 4 复合机理 Li+脱出(a)与嵌入(b)示意图 |
为了解决锰系离子筛洗脱过程锰的溶损问题,增加吸附剂的循环性能,研究人员提出掺杂改性改过程中锰的溶损问题,找到合适的阳离子或阳离子组合掺杂改性并解决改性后吸附容量下降的问题,同时解决吸附剂成型问题,将锰系吸附剂做成膜并保持吸附容量在未来有较好的发展前景。
1.2 钛系锂离子筛因为锰系离子筛锰溶损问题,研究人员尝试用更稳定氧化物制备新型离子筛,1971年Desckanvers等[39]合成了Li4Ti5O12型离子筛,其具有尖晶石结构,结构式可写为[Li]8a[Li1/3Ti5/3]16d[O4]32e,晶格常数a=0.836 nm。Onodera等[40]发现TiO2和Li2CO3经高温和酸处理后制备的钛系离子筛对Li+有很好的选择性。钛系锂离子筛通常以TiO2或者Ti(OC4H9)4为钛源,LiOH、Li2CO3或CH3COOLi为锂源,经高温固相或水热/溶剂热、溶胶-凝胶技术(图 5)反应生成前驱体,再用酸洗脱置换出Li+,即可得到钛系离子筛吸附剂。
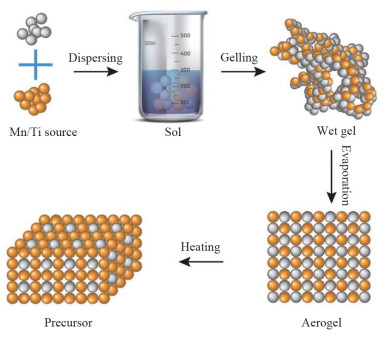 |
图 5 溶胶-凝胶技术制备钛系离子筛前驱体过程 |
董殿权等[41]采用溶胶-凝胶法Ti(OC4H9)4、CH3COOLi、柠檬酸和乙二醇等为原料合成Li4Ti5O12,HNO3改性后制得锂离子筛IE-H,利用X射线衍射分析、缩核模型描述离子筛IE-H交换Li+的动力学,证明Li4Ti5O12和锂离子筛IE-H均为尖晶石结构。发现不同浓度HNO3处理Li4Ti5O12时Li+的抽出率为19.6%~81.5%,Ti4+抽出率小于4.2%,锂的饱和交换容量为5.95 mmol/g。Zhang等[42]采用溶胶-凝胶法以Ti(OC4H9)4和CH3COOLi为原料制得的离子筛前驱体Li2TiO3,通过Langmuir和Freundlich模型分析数据,得出最佳煅烧温度为650℃,在70℃下经0.25 mol/L盐酸洗脱8h后,锂的迁出率为78.9%,钛溶损率仅有0.07%;再用高岭土,滑石粉和氧化铝为原料制作发泡剂,提高离子筛流动性和渗透率,经HCl洗脱,Li+迁出率为50.2%,锂的饱和吸附24 h提高到21.0 mg/g。陈念等[43]采用溶胶-凝胶法以Ti(OC4H9)4、CH3COOLi为原料制备出Li2TiO3,经过6次循环试验,锂的饱和交换吸附量在18.62 mg/g,钛溶损率仅有0.02%。
李少鹏等[44]采用高温固相法,以商业TiO2和LiOH为原料,分别在不同条件下制备离子筛,通过XRD表征所得离子筛为具有特殊记忆效应的锐钛相TiO2离子筛,主要物质为立方晶系的Li1.33Ti1.66O4,对锂的饱和吸附量为0.7 mmol/L;Chitrakar等[45]采用高温固相法以HCl改性Li2TiO3前驱体得到H2TiO3离子筛,在pH=6.5的卤水中经过24 h吸附,计算得饱和吸附量4.7 mmol/g,经过重复吸附离子筛吸附容量基本没变化;Sinha等[46]采用高温固液燃烧新型工艺方法,燃烧后直接获得纯单斜Li2TiO3前驱体,计算Li2TiO3出晶胞参数,此工艺方法简单易行,适合工业化生产。
钛系锂离子筛性质稳定、溶损低,耐酸性好,吸附容量大,锂洗脱率高,但该类吸附剂由于多是粉末状,渗透率差,吸附速率慢,吸附周期长,将钛系离子筛成型造粒后吸附容量会大大降低,今后研究要解决钛系吸附剂造粒成型工作后吸附容量稳定性问题。
2 铝盐吸附剂铝盐吸附剂由铝盐沉淀法发展而来,其核心是合成对LiCl具有选择性吸附LiX·2Al(OH)3·nH2O[47].其中X代表阴离子,通常为Cl。中国蓝科锂业利用此法已经在察尔汗盐湖进行工业生产(图 6),其吸附和脱附原理如下[48]:
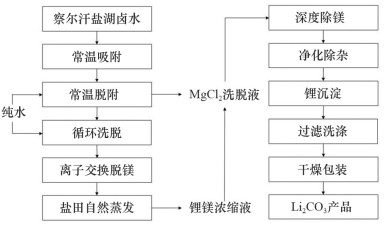 |
图 6 中国蓝科锂业使用铝盐吸附法生产Li2CO3流程[48] |
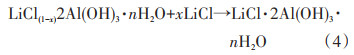

William等[49]通过对晶体结构进行研究,采用另一种简便方法制备LiCl·2Al(OH)3·nH2O吸附剂,将Al(OH)3颗粒(10~140目)放置于LiOH溶液中,使LiOH进入到Al(OH)3颗粒的空隙中,形成颗粒状的LiOH/Al(OH)3,再用HCl使LiOH/Al(OH)3转化成LiCl/Al(OH)3即可,该方法使用寿命长,但吸附容量低(实验证明2~3 mg/g)。李杰[50]先将AlCl3溶液、LiCl溶液混合,并搅拌均匀,搅拌过程中加入NaOH溶液,产生Li+与Al(OH)3共沉淀,Li+嵌入在Al(OH)3的层间结构中,形成LiCl·2Al(OH)3·nH2O,再用水洗出部分Li+,形成缺少Li+规则空隙结构的铝盐吸附剂。
目前吸附法所用吸附剂大部分是粉末状,流动性、渗透率很差,需要解决吸附剂成型问题。而铝盐吸附剂不存在成型问题,其损耗小,循环次数多,选择性优良,但吸附容量小,在未来研究中,降低成本、增大吸附容量是铝盐吸附剂工作重点。
3 天然矿物改性吸附剂天然高岭土、沸石等黏土矿物中存在空旷构架,内部分布大量孔隙,铝含量高,含有水分子和阳离子,改性后的高岭土和沸石具有很高的阳离子交换容量和比表面积,对重金属有很好的吸附效果,循环利用率高[51-52]。近来已有一些学者将高岭土等黏土矿物用于提锂的研究,Wisniewska等[53]用天然沸石和聚丙烯酸对地热水中的锂进行吸附研究,得出沸石对锂离子的吸附能力受沸石的比表面积、平均孔径、溶液pH和聚丙烯酸浓度有关。吴雅琴等[54]用蒙脱石和高岭石对Li含量1.4 mg/L的人工卤水进行吸附实验,实验结果表明蒙脱石和高岭石在2 h内均能达到吸附平衡,高岭石对锂的吸附量受溶液pH影响较大,pH=4时,高岭石吸附容量为33.2 μg/g,pH=8时高岭石吸附容量为72.4 μg/g,当pH>8时吸附容量明显下降,实验结果表明,0.5 g高岭石的吸附量将最大达到0.075 mmol/g,当pH>8时溶液中二价阳离子竞争吸附使高岭石对锂离子吸附量下降。
高岭石、沸石、蒙脱石等黏土矿物经过固相烧结、酸浸等改性,使其获得更高的阳离子交换容量和比表面积,可以直接对溶液中Li+进行吸附,用伪一级动力学和伪二级动力学公式对吸附过程进行判断,确定吸附机理;也可用这类黏土矿物和水合氢氧化锂、硝酸锂等锂的化合物进行离子筛前驱体的合成,在未来如何合成具有尖晶石结构的前驱体应重点关注。
4 结论随着新能源技术快速发展,锂资源需求量将继续增加,而盐湖中锂资源的提取将成为锂资源发展的重心,高效地提取占比更大的高镁锂比盐湖中的锂更是一项重要的能源保障技术。在未来高镁锂比盐湖中应用锂的吸附剂进行工业化提取锂应重点关注以下研究方向。
1)铝盐吸附剂吸附速率快,且脱附过程不需要消耗酸,循环稳定性较好,已成功应用于工业化生产,在今后研究中要提高吸附容量,增强离子选择性,降低卤水总盐度对铝盐吸附剂吸附容量的影响。
2)锰系离子筛在吸附量和选择性方面均具有较大的优势,但目前脱附过程的锰溶损问题制约着其工业化应用,掺杂改性解决溶损问题,和在制备过程中用镁代替锂制备离子筛前驱体是未来重点研究问题。
3)天然矿物经过改性后,矿物孔径范围可控,对锂离子可以选择性吸附和洗脱,吸附过程中能源消耗更少,吸附锂工艺简单,产生废料少利于环保,因此针对盐湖气候条件和锂资源赋存的特点,研发出切实可行的利用天然矿物对液态锂提取新工艺,对加强盐湖、海水、地热水资源的综合利用和提高资源的利用效率有重大意义,但天然矿物选取要依据盐湖附近资源量进行成本计算,天然矿物的选取和机理的探索,矿物改性后成型造粒问题都是未来天然矿物改性作吸附剂研究重点。
| [1] | 伍倩,刘喜方,郑绵平,等.我国盐湖锂资源开发现状、存在问题及对策[J].现代化工,2017,37(5):1-5. |
| [2] | Swain B.Recovery and recycling of lithium:A review[J].Separation and Purification Technology,2016,172:388-403. |
| [3] | Jewell S,Kimball S M.Mineral commodity summaries 2009[R].Reston:U.S.Geological Survey,2009. |
| [4] | Jewell S,Kimball S M.Mineral commodity summaries 2010[R].Reston:U.S.Geological Survey,2010. |
| [5] | Jewell S,Kimball S M.Mineral commodity summaries 20111[R].Reston:U.S.Geological Survey,2011. |
| [6] | Jewell S,Kimball S M.Mineral commodity summaries 2012[R].Reston:U.S.Geological Survey,2012. |
| [7] | Jewell S,Kimball S M.Mineral commodity summaries 2013[R].Reston:U.S.Geological Survey,2013. |
| [8] | Jewell S,Kimball S M.Mineral commodity summaries 2014[R].Reston:U.S.Geological Survey,2014. |
| [9] | Jewell S,Kimball S M.Mineral commodity summaries 2015[R].Reston:U.S.Geological Survey,2015. |
| [10] | Jewell S,Kimball S M.Mineral commodity summaries 2016[R].Reston:U.S.Geological Survey,2016. |
| [11] | Jewell S,Kimball S M.Mineral commodity summaries 2017[R].Reston:U.S.Geological Survey,2017. |
| [12] | Jewell S,Kimball S M.Mineral commodity summaries 2018[R].Reston:U.S.Geological Survey,2018. |
| [13] | Jewell S,Kimball S M.Mineral commodity summaries 2019[R].Reston:U.S.Geological Survey,2019. |
| [14] | 郑绵平,向军,魏新俊,等.青藏高原盐湖[M].北京:北京科学技术出版社,1989. |
| [15] | 乜贞,卜令忠,郑绵平.中国盐湖锂资源的产业化现状--以西台吉乃尔盐湖和扎布耶盐湖为例[J].地球学报,2010,31(1):95-101. |
| [16] | 高峰,郑绵平,乜贞,等.盐湖卤水锂资源及其开发进展[J].地球学报,2011,32(4):483-492. |
| [17] | 余疆江,郑绵平,伍倩.富锂盐湖提锂工艺研究进展[J].化工进展,2013,32(1):13-21. |
| [18] | 郑绵平,张永生,刘喜方,等.中国盐湖科学技术研究的若干进展与展望[J].地质学报,2016,90(9):2123-2166. |
| [19] | 赵旭,张琦,武海虹,等.盐湖卤水提锂[J].化学进展,2017,29(7):796-808. |
| [20] | 刘东帆,孙淑英,于建国.盐湖卤水提锂技术研究与发展[J].化工学报,2018,69(1):141-155. |
| [21] | 苏慧,朱兆武,王丽娜,等.从盐湖卤水中提取与回收锂的技术进展及展望[J].材料导报,2019,33(13):2119-2126. |
| [22] | 肖小玲,戴志锋,祝增虎,等.吸附法盐湖卤水提锂的研宄进展[J].盐湖研究,2005,13(2):66-69. |
| [23] | Xu X,Chen Y M,Wan P Y,et al.Extraction of lithium with functionalized lithium ion-sieves[J].Progress in Ma-terials Science,2016,84(84):276-313. |
| [24] | Zhang Q H,Sun S Y,Li S P,et al.Adsorption of lithium ions on novel nanocrystal MnO2[J].Chemical Engineer-ing Science,2018,62(18-20):4869-4874. |
| [25] | Sun S Y,Song X,Zhang Q H,et al.Lithium extraction/insertion process on cubic Li-Mn-O precursors with dif-ferent Li/Mn ratio and morphology[J].Adsorption,2011,17(5):881-887. |
| [26] | Xiao J,Nie X,Sun S,et al.Lithium ion adsorption-de-sorption properties on spinel Li4Mn5O12 and pH-depen-dent ion-exchange model[J].Advanced Powder Technol-ogy,2015,26(2):589-594. |
| [27] | Ryu T,Shin J,Lee D H,et al.Development of multistage column for lithium recovery from an aqueous solu-tion[J].Hydrometallurgy,2015,157:39-43. |
| [28] | Sun S Y,Xiao J L,Wang J,et al.Synthesis and adsorp-tion properties of Li1.6Mn1.6O4 by a combination of redox precipitation and solid-phase reaction[J].Industrial&Engineering Chemistry Research,2014,53(40):15517-15521. |
| [29] | Chitrakar R,Kanoh H,Miyai Y,et al.Recovery of lithi-um from seawater using manganese oxideadsorbent (H1.6Mn1.6O4) derived from Li1.6Mn1.6O4[J].Industrial&En-gineering Chemistry Research,2001,40(9):2054-2058. |
| [30] | Wang L,Meng C G,Ma W.Study on Li+ uptake by lithium ion-sieve via the pH technique[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2009,334(1-3):34-39. |
| [31] | Wang L,Meng C G,Han M,et al.Lithium uptake in fixed-pH solution by ion sieves[J].Journal of Colloid&Interface Science,2008,325(1):31-40. |
| [32] | Wang L,Meng C,Ma W.Preparation of lithium ionsieve and utilizing in recovery of lithium from seawater[J].Frontiers of Chemical Engineering in China,2009,3(1):65-67. |
| [33] | Hunter J C.Preparation of a new crystal form of manga-nese dioxide:λ-MnO 2[J].Journal of Solid State Chemis-try,1981,39(2):142-147. |
| [34] | Ooi K,Miyai Y,Katoh S,et al.Topotactic Li+insertion to λ-MnO2 in the aqueous phase[J].Langmuir,1989,5(1):150-157. |
| [35] | Shen X M,Clearfield A.Phase transitions and ion ex-change behavior of electrolytically prepared manganese dioxide[J].Academic Press,1986,64(3):270-282. |
| [36] | Clearfield A.Inorganic ion exchangers,past,present,and future[J].Solveent Extraction and Ion Exchange,2000,18(4):655-678 |
| [37] | Koyanaka H,Matsubaya O,Koyanaka Y,et al.Quantita-tive correlation between Li absorption and H content in manganese oxide spinel λ-MnO2[J].Journal of Electroan-alytical Chemistry,2003,559:77-81. |
| [38] | Feng Q,Miyai Y,Kanoh H,et al.Lithium (1+) extraction/insertion with spinel-type lithium manganese oxides.Characterization of redox-type and ion-exchange-type sites[J].Langmuir,1992,8(7):1861-1867. |
| [39] | Deschanvers A,Ravean B,Sekkal Z.Mise en evidence et etude cristallographique d'une nouvelle solution sol-ide type spinelle Li1+xTi2-xO4≤x≤0.333[J].Materials Re-search Bulletin,1971,6:699-704. |
| [40] | Onodera Y,Iwasaki T,Hayashi H,et al.A new inorgan-ic material with high selective adsorbability for lithium ions[J].Chemistry and Industry,1988,24:786. |
| [41] | 董殿权,张凤宝,张国亮,等.Li4Ti5O12的合成及对Li+的离子交换动力学[J].物理化学学报,2007(6):950-954. |
| [42] | Zhang L Y,Zhou D L,Yao Q Q,et al.Preparation of H 2TiO3-lithium adsorbent by the solgel process and its adsorption performance[J].Applied Surface Science,2016,368:82-87. |
| [43] | 陈念.溶胶-凝胶法合成锂离子筛及其吸附性能研究[D].成都:成都理工大学,2015. |
| [44] | 李少鹏,张钦辉,孙淑英,等.TiO2离子筛的制备及表征[J].天津大学学报(自然科学与工程技术版),2007(4):453-456. |
| [45] | Chitrakar R,Makita Y,Ooi K,et al.Lithium recovery from salt lake brine by H2TiO3[J].Dalton Transactions,2014(43):8933-8939. |
| [46] | Sinha A,Nair S R,Sinha P K.Single step synthesis of Li2TiO3 powder[J].Journal of Nuclear Materials,2010,399(2-3):162-166. |
| [47] | 李杰,熊小波.铝盐吸附剂盐湖卤水提锂的研究现状及展望[J].无机盐工业,2010,42(10):9-11. |
| [48] | 罗阿敏,程芳,李辉谷,等.盐湖卤水提锂的研究进展[J].化工矿物与加工,2018,47(5):66-72. |
| [49] | Bauman W C,Burba III J L.Composition f or the lithi-um values from brine and process of making/using said composition:6280693[P].2001-08-28. |
| [50] | 李杰.铝盐锂吸附剂制备工艺及吸附性能研究[D].成都:成都理工大学,2011. |
| [51] | 李霞,邓昭平,李晶.高岭土在盐湖卤水提锂中的应用[J].化工进展,2017,36(6):2057-2063. |
| [52] | 左思敏,荆肇乾,陶梦妮,等.天然沸石和改性沸石在废水处理中的应用研究[J].应用化工,2019,48(5):1136-1139,1145. |
| [53] | Wisniewska M,Fijałkowska G,Ostolska I,et al.Investi-gations of the possibility of lithium acquisition fromgeo-thermal water using natural and synthetic zeolites apply-ingpoly (acrylic acid)[J].Journal of Cleaner Production,2018,195:821-830. |
| [54] | 吴雅琴,赵志琦.高岭石和蒙脱石吸附Li+的实验研究[J].矿物学报,2011,31(2):291-295. |
2. Department Institute of Mineral Resources,Chinese Academy of Geological Sciences, Beijing 100037, China