2. 中国科学院生物物理研究所,北京 100101
2. Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China
酶是天然催化剂,是生命体代谢反应的承担者。近50年来,有机化学尤其是金属有机领域发展了多种小分子催化反应,通过调控金属配体结构,实现了对反应的操纵。相对于有机化学反应,酶催化反应由于底物谱窄、立体选择性无法控制、对反应条件要求高、催化反应有限等原因,制约了酶催化在精细化学品、医药中间体合成等方面的应用。
定向进化是在实验室环境中模拟达尔文进化过程,通过随机突变和重组,人为制造大量突变,按照特定的需要和目的给予选择压力,筛选出具有期望特征的蛋白质,实现分子水平的模拟进化[1]。过去25年来,定向进化在突变体文库构建和筛选方法上取得进步,包括位点饱和突变(saturation mutagenesis,SM)、易错PCR(error-prone polymerase chain reaction,epPCR)及DNA重组(DNA shuffling)等技术产生序列多样性的随机突变体文库的方法,以及高效液相色谱、质谱等高通量、自动化的筛选方法,使定向进化成为酶工程领域的有效研究方法[2]。定向进化作为一种工程化的改造方法,不需要对蛋白质的结构信息及催化机制事先了解,通过迭代有益突变,可以实现蛋白质性能的飞跃[3]。2018年,酶定向进化领域的重要贡献者——加州理工大学教授Frances H. Arnold获得诺贝尔化学奖,标志着定向进化技术在学术界得到广泛认可。
定向进化的应用不仅局限在对现有酶的选择性改变,目前还广泛应用于通过改造现有的酶,使其具有新的功能,从而构建人工酶。人工酶可以是天然酶经过突变等改造得到的新酶,也可以是非蛋白质、具有类似天然酶催化活性的物质,例如基于核酸的核酸酶和一些基于纳米材料的纳米酶等。纳米酶是一类蕴含酶学特性的纳米材料,在纳米尺度表现出只有天然酶才具有的酶学催化特性[4]。纳米酶的概念是由中国科学家提出的,它是得到学术界广泛认可并具有巨大应用前景的人工酶。
本文基于中国科协第383次青年科学家论坛的讨论和共识,回顾人工酶与定向进化领域的前沿研究,展望该领域的挑战与发展。
1 工业生物催化与定向进化由于酶具有高选择性、生物相容性和反应的温和性,在工业生物催化尤其是医药中间体的生产中有广泛的应用前景。β-氨基酸是一大类非蛋白质氨基酸,具有多样的生物活性,被应用于医药、食品、农牧业等多个产业。β-内酰胺抗生素、重磅药物紫杉醇(抗癌药物)、西格列汀(糖尿病药物)及维生素B5等多种具有巨大市场销售额的“明星分子”均需要β-氨基酸作为合成单元。β-氨基酸的合成长期以来一直依赖于过渡金属催化的化学途径,需要昂贵的催化剂、繁琐的保护与去保护步骤以及苛刻的反应条件。设计β-氨基酸的新型绿色合成途径是生物合成领域的一项重大挑战。中国科学院微生物研究所研究员吴边团队通过使用人工智能计算技术,综合选用一系列计算方法,对天冬氨酸酶进行了分子重设计,成功获得了一系列具有绝对位置选择性与立体选择性的人工β-氨基酸合成酶(图 1[5])。随后,该团队构建出能够高效合成β-氨基酸的工程菌株。通过发酵工艺优化与转化工艺优化,该生物催化体系可一步实现相应β-氨基酸的合成。该人工设计的反应体系体现了高效率、高原子经济性等巨大优势,底物浓度达300 g/L,实现了99%转化率、99%区域选择性以及99%立体选择性,相关指标达到了工业化生产的标准[6]。该项技术已经通过转化,建设了千吨级的生产线并成功投产,相关产品潜在市场超过30亿,有望在紫杉醇、度鲁特韦与马拉维若等抗癌与艾滋病治疗药物的生产过程中大幅降低生产成本。
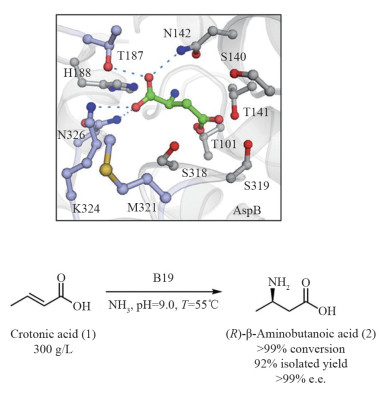 |
图 1 计算设计人工β-氨基酸合成酶 |
纳米酶是一类蕴含酶学特性的纳米材料,在纳米尺度表现出只有天然酶才具有的酶学催化特性。纳米酶的研究属于中国科学家的原创研究。2007年,中国科学院生物物理研究所研究员、中国科学院院士阎锡蕴团队首次报道了四氧化三铁纳米颗粒具有类似过氧化物酶的活性[7]。随后,中国科学院长春应用化学所研究员、中国科学院院士汪尔康团队首次提出了纳米酶的概念[8]。迄今,全球已有26个国家的220多个实验室从事纳米酶的研究,超过50种不同纳米酶相继被发现,应用研究也拓展到了生物、医学、农业、环境治理与国防安全等多个领域。
2018年,阎锡蕴团队报道了纳米酶活性标准化,首次定义了纳米酶催化活性单位(nanozyme unit,U),即在最适反应条件下,1 min催化1 μmol底物转化为产物所需的纳米酶量为1 U;纳米酶的比活性(specific activity,U/mg)定义为每单位质量的纳米酶单位数,并严格规定了纳米酶的比活检测条件及计算公式(ananozyme=V/(ε×l)×(△A/△t)/Fe[m])[6]。该工作使得纳米酶产品在疾病诊疗方面变得可量化,有利于纳米酶相关产品的评价以及开发,同时提高了纳米酶分析方法的重复性及准确性,极大推进了纳米酶相关产品的开发。
对于蛋白质酶构效关系的研究已经有很多成熟的方法,但是纳米酶构效关系还缺乏深入研究。为了获得指导纳米酶设计的描述符(理解化学反应快慢的标度),南京大学教授魏辉团队和合作者以钙钛矿氧化物纳米材料作为模型氧化物,系统研究了金属氧化物纳米材料的电子结构对其催化活性的影响。通过理论计算和实验研究,发现过渡金属离子的eg电子个数与其催化活性之间具有很明显的火山型关系,当eg电子个数在1左右时,催化活性最高;eg电子个数为0或2时,催化活性最低(图 2[9])。eg电子占据主要通过改变材料对底物的吸附强度以及反应的速率决定步骤直接影响材料的催化活性[9-10]。
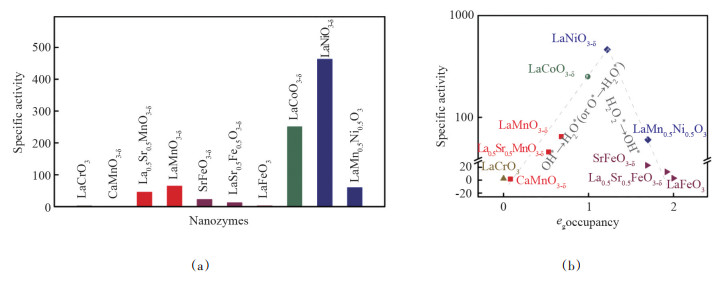 |
图 2 钙钛矿氧化物纳米酶构效关系研究 |
许多经典的化学生物学方法已经成为人工酶构建的重要方法。近年来,如何将太阳能转换为化学能已经成为化学及生物学研究领域的重点问题。中国科学院院长、中国科学院院士白春礼等2018年在《焦耳》杂志发文提出,在化石燃料枯竭的未来,“液态阳光”可能是解决问题的关键[11]。实现液态阳光的关键在于利用丰富的太阳能,将能源利用过程中过量排放的CO2重新循环转化为稳定、可存储、高能量的化学物质。植物的光合作用系统作为一种天然的解决方案,因其清洁、自组装、可持续和高效的光致电荷分离效率等优势受到广泛关注。目前,如何利用和模拟光合作用的高光合效率来驱动具有挑战性的化学转化是目前的研究热点。然而,影响该领域发展的技术挑战及研究难点在于:1)天然光合作用系统由复杂的膜蛋白亚基和多种辅酶组成,这给研究和实际应用带来了不便;2)光合系统中产生的还原分子NAD(P)H由于还原力较低不能直接用于还原CO2;3)相比化学小分子催化剂,天然光合作用系统的CO2还原效率相对低下。为解决这些问题,中国科学院生物物理研究所研究员王江云团队多年来一直致力于应用合成生物学方法,开发基因编码的人工光合作用系统,使其兼具天然光系统和化学小分子催化剂的优势。这种人工设计的光合蛋白质不仅可以为研究挑战性的化学转化提供新思路,也为进化具有非天然光催化活性的人工生命体提供研究基础。
该研究组的前期研究发现,仅有约27 kD的荧光蛋白具有改造为类似天然光系统的光合蛋白质的潜能。首先,研究发现荧光蛋白受光激发后,其发色团可以生成具有高还原活性的物种,这种中间体可以高效率地向位于蛋白质beta折叠桶外的电子受体传递电子。另一方面,应用基因密码子扩展技术,可以特异性地插入非天然氨基酸取代原组成发色团的酪氨酸。这使得研究人员可以理性设计荧光蛋白的荧光发色团化学结构,优化其吸收光谱、激发态寿命、自由基还原电势等一系列光化学性质[12-15]。设计基于荧光蛋白突变体的高效CO2光还原蛋白质的核心问题在于如何延长其发色团受激发后所生成的还原性中间态的寿命,降低它的还原电势。王江云团队选择了一种带有二苯甲酮取代基的酪氨酸类似物(BpA)来改造发色团。二苯甲酮是一种有机光催化中常用的光敏剂。当它受到一定波长的光照射时,其激发态以近100%的效率系间穿越为寿命较长的三重态。这种三重态进而和牺牲还原剂反应生成高活性的自由基态,催化下游氧化还原反应。基于密码子扩展方法插入BpA改造荧光蛋白的发色团后,其新生成的光敏蛋白(PSP)保留了这种特性。瞬态吸收光谱的研究表明,受光激发后,BpA组成的新发色团几乎可以全部转化为三重态;在有和生物相关牺牲还原剂的存在下,三重态中间体快速氧化牺牲还原剂从而生成自由基态。该自由基被蛋白质骨架保护,因此在没有氧气存在的条件下可以稳定存在10 min以上。晶体结构衍射显示,PSP处于自由基状态时,其发色团呈现出更加扩展的共平面构象,这与紫外-可见吸收光谱检测得到的红移吸收结果一致。另一方面,合成的含有BpA发色团小分子的电化学分析表明,所生成的自由基态具有接近-1.5 V的还原电势。这不仅满足了还原CO2的需求,也低于已知的天然生物还原剂(图 3[12-16])。在获得了该光敏蛋白后,研究人员进一步应用化学生物学方法在PSP蛋白表面特定位点引入了一种小分子CO2电化学还原催化剂三联吡啶镍配合物。这种杂合蛋白质具有在光照条件下还原CO2生成CO的活性,光量子产率为2.6%,高于大部分已报道的CO2光还原催化剂[16]。
 |
图 3 通过引入非天然氨基酸构建的人工金属酶可以催化CO2的还原 |
在人工酶与定向进化领域,仍存在以下挑战与前沿问题。
1)传统上有机化学反应和酶催化的生物合成在反应条件、反应类型等方面相差较大。金属有机催化的发展以及在蛋白质中引入金属配合物构建人工酶的方法淡化了这种界限;同时合成化学和酶催化可实现的反应大大拓展,反应类型已经有所重叠。合成化学与生物合成哪种方法更高效普适,二者之间的碰撞必将引发催化科学的发展。
2)许多经典的化学生物学方法,如探针的构建、非天然氨基酸的引入已经成为人工酶构建的重要方法。例如通过非天然氨基酸的引入,中国学者成功构建了利用光能固定CO2的酶,实现了人工的光合作用;通过手性相反的结构单元,构建了镜像生物大分子。化学生物学方法的发展必将促进人工酶构建的进步,而人工酶的研究也会促进我们对化学生物学的理解。
3)计算方法已成为实验科学的有力补充,随着算法的进化,包括量子化学与分子力学的结合,人工智能在酶设计领域的应用等,人工酶领域将实现“干湿结合”,设计更加强大的酶将成为可能。
4)自动化大大降低了定向进化的工作量,多个实验室正在开发标准化、智能化的实验室自动化系统,未来将提高通量、降低人力投入。
5)人工酶与定向进化作为工程化改造蛋白质的手段与工具,与合成生物学的理念非常契合,在“design-build-test-learn”循环中如何更好总结知识,加深对酶的理解,还需要进一步的研究。
| [1] | Arnold F H. Innovation by evolution: Bringing new chemistry to life (Nobel Lecture)[J]. Angewandte Chemie (International Edition), 2019, 58(41): 14420-14426. |
| [2] | Zeymer C, Hilvert D. Directed evolution of protein catalysts[J]. Annual Review of Biochemistry, 2018, 87(1): 131-157. |
| [3] | Reetz M T. Directed evolution of artificial metalloenzymes: A universal means to tune the selectivity of transition metal catalysts?[J]. Accounts of Chemical Research, 2019, 52(2): 336-344. |
| [4] | 曲戈, 朱彤, 蒋迎迎, 等.蛋白质工程:从定向进化到计算设计[J].生物工程学报, 2019, 35(10): 1843-1856. |
| [5] | Li R, Wijma H J, Song L, et al. Computational redesign of enzymes for regio-and enantioselective hydroamination[J]. Nature Chemical Biology, 2018, 14(7): 664-670. |
| [6] | Jiang B, Duan D, Gao L, et al. Standardized assays for determining the catalytic activity and kinetics of peroxidase-like nanozymes[J]. Nature Protocols, 2018, 13(7): 1506-1520. |
| [7] | Gao L, Zhuang J, Nie L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nature Nanotechnology, 2007, 2(9): 577-583. |
| [8] | Wei H, Wang E. Nanomaterials with enzyme-like characteristics (nanozymes): Next-generation artificial enzymes[J]. Chemical Society Reviews, 2013, 42(14): 6060-6093. |
| [9] | Wang X, Gao X J, Qin L, et al. eg occupancy as an effective descriptor for the catalytic activity of perovskite oxide-based peroxidase mimics[J]. Nature Communications, 2019, 10(1): 704. |
| [10] | Wu J, Wang X, Wang Q, et al. Nanomaterials with enzyme-like characteristics (nanozymes): Next-generation artificial enzymes (Ⅱ)[J]. Chemical Society Reviews, 2019, 48(4): 1004-1076. |
| [11] | Shih C F, Zhang T, Li J, et al. Powering the future with liquid sunshine[J]. Joule, 2018, 2(10): 1925-1949. |
| [12] | Liu X, Jiang L, Li J, et al. Significant expansion of fluorescent protein sensing ability through the genetic incorporation of superior photo- induced electron- transfer quenchers[J]. Journal of the American Chemical Society, 2014, 136(38): 13094-13097. |
| [13] | Liu X, Li J, Dong J, et al. Genetic incorporation of a metal-chelating amino acid as a probe for protein electron transfer[J]. Angewandte Chemie (International edition), 2012, 51(41): 10261-10265. |
| [14] | Liu X, Li J, Dong J, et al. Genetic incorporation of a metal-chelating amino acid as a probe for protein electron transfer[J]. Angewandte Chemie (International edition), 2012, 51(41): 10261-10265. |
| [15] | Lv X, Yu Y, Zhou M, et al. Ultrafast photoinduced electron transfer in green fluorescent protein bearing a genetically encoded electron acceptor[J]. Journal of the American Chemical Society, 2015, 137: 7270-7273. |
| [16] | Liu X, Kang F, Hu C, et al. A genetically encoded photosensitizer protein facilitates the rational design of a miniature photocatalytic CO2- reducing enzyme[J]. Nature Chemistry, 2018, 10: 1201-1206. |