运动医学的发展,一方面离不开体育运动,特别是高水平职业竞技运动水平的提高和业余全民体育运动的广泛开展;另一方面离不开基于新技术、新材料、新理念的医疗科技水平提高。近年来,全世界运动医学水平随着科技和经济的发展逐步提高,在运动创伤的诊断与治疗、伤病术后康复、新材料和新方法应用以及新的疾病认知等各领域发展迅速。
随着2020年奥运会备战进入最后冲刺阶段和2022年北京冬季奥运会准备工作的全面铺开,以冰雪运动为引领的全民体育运动事业和高水平竞技体育运动事业蓬勃发展。以此为契机,回顾盘点了2019年运动医学领域的5项研究热点,并对未来前景进行了展望。
1 前交叉韧带重建术后重返运动前交叉韧带损伤是体育运动中的常见伤病(图 1),在所有膝关节运动损伤中占比达50%[1]。据不完全统计,全球每年发生前交叉韧带损伤约20万例[2](其中1/6的病例、约3万例发生于美国),其中超过10万例接受手术治疗[3],中国确切的发病数据和手术病例数仍缺乏准确统计。
 |
(图片来源:jnjmedicaldevices.com) 图 1 完好的前交叉韧带 |
前交叉韧带断裂的发生几率在业余运动爱好者和高水平运动员中并不尽相同:前者发病率约为3%,后者高达15%[1];女性发病率较男性高2~8倍;15~20岁的女性运动员是最常见的受伤群体[1, 3]。前交叉韧带断裂的发生率一方面随着参与运动人群数量的增加而增加,另一方面有赖于专业运动医学医师的专业技术以及核磁共振等先进医疗仪器辅助进行准确及时地诊断,因而在国民经济水平发展较高的国家会有更高的发病率和确诊率。
目前,经过数十年探索,对前交叉韧带断裂的治疗和康复已经形成了较为科学统一的体系化流程。准确诊断后的及时重建手术仍然是治疗前交叉韧带断裂的金标准,经过科学的手术时机选择,精准的手术操作和细致的康复训练后,绝大多数患者可在术后恢复良好的关节稳定性并逐步恢复日常生活和体育运动(图 2)。
 |
(图片来源:clinicaladvisor.com) 图 2 重建的前交叉韧带 |
前交叉韧带重建术后重返体育运动的比例,文献报道的差异极大,范围在56%~100%。其中13% ~69%患者可以恢复到伤前水平[2],恢复体育运动的时间从术后6.7~12个月不等[2];33%~92%患者在术后1年内恢复体育运动,65%能恢复到伤前体育运动水平,55%可恢复到重返竞技运动水平[4]。
据Nwachukwu等报道,19项研究纳入的2175名前交叉韧带断裂病例中,术后69.4%重返体育运动,术后平均重返体育运动的时间为17.2个月[4]。Della等通过超过29个月的随访发现,术后约86%的病例可以恢复体育运动,62%能够从事伤前体育运动,59%能够恢复到伤前运动水平[5]。
虽然从关节功能改善和运动水平恢复等不同角度看,重建手术治疗前交叉韧带断裂均取得了良好的临床效果,但各类研究结果均显示,仍有接近30%的患者术后无法获得预期的改善效果[6],其中超过6.2%的病例为创伤因素、非创伤因素或感染因素等多种原因导致的手术失败[5]。除此之外,影响手术预期效果的原因可能包含受伤与手术间隔时间、术前及术后膝关节症状、术前膝关节功能状态、术后膝关节力量及双侧对称性恢复、术后预期恢复的体育项目以及社会—心理因素。当前,前交叉韧带重建术后的功能恢复是研究热点之一,有针对性地制定对生理和心理不良因素的个体化康复方案,有助于受伤人群在术后获得更好的远期效果[7]。
多项研究得出了较为一致的结论:伤前较高的运动水平和较长的训练年限、较轻的膝关节疼痛症状、相对较短的受伤手术间隔时间(injury-to-surgery time,ITST)、较小的致伤年龄和性别男性、较好的术后康复依从性和较低的焦虑恐惧级别均有利于伤后运动水平恢复[1, 3, 5, 8-9]。
此前,对于前交叉韧带重建术后恢复体育运动时机的评估标准大多针对于膝关节基础的力量稳定性、运动机能方面。Glogovac等发现,患者重返运动时,不同研究报道的膝关节评分差异度较大,其中IKDC评分(International Knee Documentation Committee score)43% ~86%,Tgner评分4.3~9,Lysholm评分84%~91%[2],因此难以单纯使用各类膝关节评分作为判断重返运动时机的标准。目前临床实践中,跳跃试验(hop test)多用于前交叉韧带重建术后患者运动机能的评估,只有患肢在试验中的得分达到对侧90%以上,才被判定为“通过”,从而被认为具备了重返体育运动的条件[10]。
近年来,心理因素在前交叉韧带重建术后运动水平恢复过程中起到的作用,日益得到重视。术后个体对于动作的恐惧、对于关节功能的信心、对于重返体育运动准备的充分程度会在很大程度上影响膝关节功能[11]。对于再次受伤的恐惧是最常见的心理不良因素(76.7%),其次是对术后膝关节缺乏信心(14.8%),抑郁和缺乏运动动力分别占5.6%和2.5%[4, 7]。目前,临床实践中应用了多款量表以衡量前交叉韧带重建术后人群在重返体育运动前的心理准备程度,例如ACL-RSI[11],RIAI[11]以及RSSIQ[11]等。其中,对于伤后运动员自信程度评估可靠性和体育运动专项性最强的是I-PRRS量表[11]。通过对术后不同康复时间节点运动员自信程度的评估来明确其重返体育运动前的心理准备程度[12]。在Webster等进行的包含635名运动员病例的研究中,男性、较小的受伤年龄、较短的受伤—手术间隔时间、伤前较好的运动基础、较好的肢体对称性和较高的客观膝关节功能评分,均有利于术后心理准备程度的恢复[13]。需要注意的是,虽然较好的膝关节力量和功能状态能够提高重返运动前的心理准备程度,较高的心理准备程度并不说明受评估个体具备了足够的膝关节功能基础,在恢复体育运动前,务必综合对二者进行详细评估,以降低再次伤病发生的可能性[14]。
既往的研究和临床经验中,前交叉韧带重建术后8~12个月即可重返体育运动。但需注意的是,术后1年内再次受伤的几率远高于第二年[15],而在康复过程中,相当一部分人群在康复的最初6个月内肌肉力量恢复缓慢,术后9个月内仍可能存在较为明显的肌肉力量丧失,需要接受额外的康复训练并且延迟评估时间和恢复体育运动的时间[8]。
虽然目前全世界对于前交叉韧带断裂的诊断及治疗已经形成了良好的规范并取得令人满意的效果,针对不同人群的基础状况和术后功能需求,仍有很多问题有待解决。在可见的将来,在康复过程中,对于不同个体制定进行更细致的追踪观察,结合不同情况制定个体化的生理康复和心理辅导计划以及重返体育运动的方案,将持续成为研究和实践的热点。
2 髌股关节疼痛的循证干预髌股关节疼痛(patellofemoral pain,PFP),也被称为髌骨周围疼痛或膝前痛,是运动医学门诊最常见的症状主诉之一。长久以来,运动医学和康复学业界对于此疾病定义、诊断、治疗干预缺乏具有循证医学理论支持的规范指南。2019年,美国骨科物理治疗学院(Academy of Orthopaedic Physical Therapy)和美国物理治疗协会(American Physical Therapy Association,APTA)梳理、制定并发布了针对髌股关节疼痛的循证诊疗指南,对临床行为提供了良好的借鉴和规范[16]。
髌股关节疼痛患者常描述症状为缓慢起病,但在某次剧烈运动如跑步、跳跃、重复深蹲等后突然加重。在症状出现后,即便做一些简单的运动,如久坐、下台阶都可能变得困难。诊断多以通过深蹲等动作引发髌股后方和髌骨周围疼痛症状而做出。其他髌股关节加压动作,诸如上下台阶等,若引发症状,也有助于做出诊断[16-17]。
诊断的做出应包含以下3个要点:1)髌骨后方疼痛或周围疼痛;2)重复髌股关节加压动作可引出典型症状;3)除外膝关节周围其他可能的疼痛原因如髂胫束股骨外髁摩擦综合征和髌腱腱病等疾患[16-17]。
典型的髌股关节疼痛,其原因可能包含以下4方面因素:1)过度使用或超负荷;2)肌肉力量相对不足;3)运动模式不良;4)活动度欠缺[16-17]。
专科医师应采用AKPS(Anterior Knee Pain Scale)、KOOS-PF(the patellofemoral pain and osteoarthritis sub-scale of the Knee injury and Osteoarthritis Outcome Score)等量表和问卷评估衡量髌股关节疼痛患者的症状严重程度和功能状态[16-17]。
在诊疗过程中,专科医师可采用适当的手段引发症状和评估下肢动作模式,如深蹲、下台阶和单腿深蹲等。这些检查可以衡量患者与疼痛和功能相关的基线情况[16-17]。下肢力线评估、肌肉力量评估也可在诊疗过程中被采用[16-17]。
专科医师应采用膝—髋动作统合训练达到以减轻疼痛、改善自主症状和功能状态为代表的短期、中期和长期目标。髋关节训练主要针对大腿后群肌肉结构,膝关节训练主要针对膝关节周围肌肉结构。初期训练应以髋关节训练为主,在治疗整个过程中,应该将膝—髋统合训练放在比单纯膝关节训练更高的地位上[16-17]。
对于髌股关节疼痛的治疗,应在统合训练基础上,联合应用物理治疗、足部力线改善、髌骨周围扎贴、髌骨松动术和下肢拉伸练习。任意手段的单独应用均无法获得满意的效果[16-17]。
值得注意的是,虽然谨慎的针刺疗法可以作为治疗的补充手段,但干针松解不应该被纳入治疗体系当中。髌骨周围扎贴无法起到改善膝关节周围肌肉力量的作用,膝关节护具、膝套等器材也不作为常规推荐使用[16-17]。
长久以来,我们一直认为针对不同患者进行的个体化评估和方案制定能够有效提高髌股关节疼痛的治疗和缓解效率,但从临床实践的结果看,这一疾患某种程度上不单纯是膝关节本身的功能失调或病变,而具有更深层次因素,在循证医学的基础上以最新的生物—社会—心理医学模式的理念指导临床诊疗行为,可能在一定程度上能够更有效地解决更多的问题[17]。
3 血小板富集血浆在肌肉及肌腱疾病中的治疗应用血小板富集血浆(platelet-rich plasma, PRP),是将动物或人的全血经过离心后得到的富含高浓度血小板的血浆(图 3)。近年来作为一种新型的再生医学技术被越来越广泛地应用于众多临床领域,用以在传统认为修复能力较低的组织结构内起到促进修复恢复结构及功能的作用。在运动医学领域,越来越多的应用于关节内纤维软骨结构和关节表面透明软骨的修复、退行性关节病的治疗和肌肉肌腱急性损伤和慢性炎症以及末端病的治疗中。
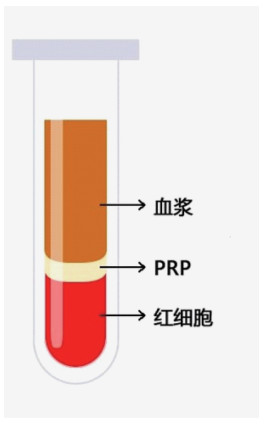 |
图 3 全血离心后成分示意 |
以往研究表明,PRP对于肱骨外上髁炎治疗疗效较为肯定,对比激素封闭治疗,1年和2年内疼痛缓解和功能评分改善明显[18-19],近期研究表明,与生理盐水、糖皮质激素、自体全血和布比卡因局部封闭治疗相比,有效度有所差异[20-22]。表现为:PRP相比全血局部注射,6周内缓解症状明显,但6个月后功能改善无优势;相比糖皮质激素1个月内疼痛缓解无明显优势,3个月后二者效果大体相同;对比布比卡因6个月时治疗效果更好[20-22]。
PRP治疗跟腱腱病的结果报告较为混杂,有报道开放跟腱缝合术中应用PRP可在术后8周较早地恢复体育运动,但1年后术中使用PRP的病例并未获得更好的动力性评分[23]。
对于慢性跟腱腱病,多项个案报道、前导性研究和回顾性研究均报道了良好的PRP应用效果[23-31],有效期达4年。但近期研究表明,相比生理盐水对照注射,PRP应用在6个月和1年的时间节点,并未表现出在临床功能和体育运动水平方面的明显优势,也未在6个月后的超声评估中表现出更好的新生血管化和跟腱结构的改善[32]。
病例研究和回顾性研究显示,PRP应用对于髌腱腱病的疗效肯定[25-26, 31, 33]。虽然在一些较小的对照研究中,PRP注射未在6个月内造成明显的疼痛缓解,但在1年后表现出了相对超声波治疗更好的效果[34]。
现有的病例研究和单盲研究表明,对于急性肌肉损伤(大腿、肩关节、足、踝),超声引导下PRP注射相比保守治疗,能够更好地缓解早期疼痛、改善活动范围、加快恢复运动速度[35]。但对于大腿后群肌肉损伤,大规模双盲队列试验并未发现在康复训练同时应用PRP对于加速恢复、改善肌肉力量和降低再受伤概率有益。
虽然当前再生医学发展如火如荼,PRP为代表的新兴技术被越来越广泛地应用于诸多方面,但在运动医学领域,我们可以看到仍有许多基础性研究和临床实践工作需要开展。PRP治疗应用需要更严格的指征把握、更精准的剂量掌握、更完善的患者教育、更大规模设计、更完善随访时间和更长的临床研究设计来充分证明其在医疗行为中的安全性和有效性。
4 间充质干细胞在骨关节病治疗中的应用现状及前景骨关节病是一种慢性、普遍的老年性关节疾患,全世界65岁以上人群中有50%以上的人患病。世界卫生组织(WHO)估计全世界有近1.5亿人患病[36]。
传统上的骨关节病治疗以对症为主,主要目的为疼痛管理和功能保存,对于提高退变组织的再生能力以打断疾病退变进程并无作用。由于关节内软骨、韧带和半月板结构自愈能力极为有限,促进这些组织结构的再生成为骨关节病新兴治疗手段的首要目标[37]。
干细胞在骨关节病治疗中的作用是目前研究的热点[38]。在各类干细胞中,由于其能够分化为软骨细胞的能力和免疫调制特性,间充质干细胞(mesenchymal stem cell,MSC)吸引了众多研究者的关注[39-40](图 4)
 |
(图片来源:creative-daignostics.com) 图 4 间充质干细胞 |
间充质干细胞应用于骨关节病的治疗,具有干细胞易于获取、增殖快速、分化潜力强、免疫排斥反应小、移植简易并且能够长期共存的特点,由于其软骨分化潜力和免疫调制特性,自体间充质干细胞关节内注射可以有效促进软骨结构增生,改善关节炎性环境,达到缓解症状和保存改善功能的作用。这一疗法使间充质干细胞在骨关节病治疗中的应用具有极大的研究价值和光明的应用前景[41]。
截至2019年,共有50多项临床研究用以评估和确认间充质细胞对于骨关节病治疗的有效性。接受这一治疗的骨关节病患者反馈了明显并具有临床意义的疼痛症状减轻和生理功能改善,并在WOMAC评分(Western Ontario and McMaster Universities Arthritis Index)中得到了验证[42]。更重要的是,数项研究结果表明,骨髓间充质干细胞治疗对于其他传统治疗无效的骨关节病患者效果良好[43-44]。
在2019年,间充质干细胞治疗骨关节病的作用机制有了更进一步的深入研究成果。除了以往认为的在损伤局部起到分化为软骨细胞进行缺损填充的作用外,间充质干细胞可在生理及病理条件下生成包含mRNA、脂类、siRNA、蛋白质、miRNA、酶类等物质的外泌体进行细胞间物质传递。此类外泌体被发现可以通过免疫调节机制改善骨关节病患者的关节内炎症状态,进一步起到阻止骨关节病疾病进展、促进病变组织修复、加快正常结构再生的作用[45]。
未来研究的热点方向之一是在进一步验证自体及异体间充质干细胞疗法的有效性和适用的剂量以及治疗进程的同时,进行间充质干细胞在骨关节病治疗过程中的免疫躲避、长期存活和治疗效果的相关研究。在此基础上,间充质干细胞生成的外泌体因其独特的免疫调节作用机制,预期不仅在骨关节病的治疗中,更将在其他全身性系统疾病的治疗中扮演越来越重要的角色,并因其便于批量生产的特性,有望在不远的将来快速投入临床应用和实践当中。
5 肌少症的认知及对策进展肌少症(Sarcopenia),是近年来逐渐被医学界认知的一种与衰老相关的病理性功能状态,英文名称Sarcopenia来源于希腊语词根sarx+penia,最早由Irwin Rosenberg于1989年提出,用以描述与衰老相关的肌肉减少[46]。据欧洲老龄人群肌少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)统计,肌少症社区发病率为1%~ 29%,在长期看护机构可高达14%~33%[46]。
近年来,随着全球范围老龄化趋势的逐步显现,与年龄相关的疾患及功能障碍越发引起关注,其中肌少症也逐步成为了研究热点。
2019年,EWGSOP提出了对肌少症的最新规范化定义,以进行性的广泛骨骼肌容量与力量下降为特征,伴有生理功能障碍、生活质量低下并可导致死亡的一类症候群。依据这一最新的全面定义,肌少症的含义至少包含了肌肉容量的进行性减少和同时出现的肌肉功能持续性减退(力量及运动能力)两方面含义,并与多种负面结局如跌倒、衰竭和死亡相关[47]。自2016年,肌少症已经被纳入了国际疾病分类编码(International Classification of Diseases-10 code),成为一类疾病的正式诊断:ICD- 10-CM (M62.84)[48]。
提出疾病定义的同时,EWGSOP也给出了相应的诊断流程:1)对于高危人群或疑似病例,采用SARC-F问卷用以评估症状;2)利用握力试验(男性 < 27 kg,女性 < 16 kg)、坐姿站立试验以及其余肌力测试手段评估病情状况;3)用双向X线能量吸收法(dual- energy X-ray absorptiometry,DXA)等检测手段确认肌肉容量和质量的减少(男性 < 20 kg,女性 < 15 kg),进行疾病确诊。其中计算机体层摄影(computed tomography,CT)和核磁共振成像(magnetic resonance imaging,MRI)检查,由于能够精准评估全身肌肉总量和组分质量,是确诊肌少症的金标准(图 5);4)通过步态试验、SPPB试验(short physical performance battery,包含行走速度、平衡检测和坐姿站立试验)、TUG试验(timed up and go test,计时起立行走试验)400 m行走试验评估疾病进展状况[49]。
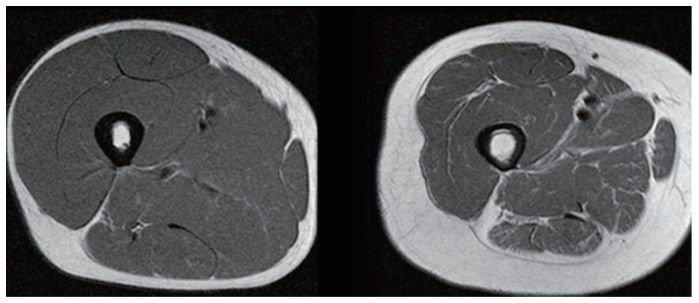 |
(图片来源:hearlth-innovations.org) 图 5 25岁(左侧)及63岁(右侧)个体大腿MRI扫描成像肌肉含量对比 (图片来源:hearlth-innovations.org) |
研究认为,肌少症的起因主要是机体衰老干扰了骨骼肌的合成与代谢,导致萎缩速度大于新生速度,但具体的分子生物学机制目前尚不明确[46]。
对于肌少症,目前尚无特效药物治疗。但普遍共识为,在进行营养保障的同时,进行必要的身体机能训练和功能康复对于疾病的进展有显著益处。从远期角度看,提倡青少年时期积极参与体能训练和体育运动,人生各阶段避免吸烟、酗酒等不良嗜好,对于推迟肌少症的发病时间和延缓肌少症的进展速度,具有积极的作用[46]。
目前,中国肌少症发病率尚缺乏确切数字,较早前的针对4000名65岁以上社区居住老人的研究显示为3.1%[47]。随着中国老龄化趋势的逐步发展,发病率及发病人口总数在未来预计会有急速增加。国内对于此疾病状态的认知尚有相当程度的不足,未来对于广大易感人群的生活方式干预、疾病征兆预警和发病人群治疗康复,将是工作的重点。尤其是中国广大地区,经济社会发展水平差异度较大,对于不良生活方式的认知和老龄化慢性疾病的预防存在着较大落差,如何从基层工作做起,避免肌少症等老龄化慢性疾病造成广大人民群众生活水平和质量下降,将成为医务工作者和社会工作者需要关注的热点。当前,2020年奥运会和北京2022年冬季奥运会已经进入了最后的备战和准备阶段,如何利用高水平赛事作为契机,从全社会角度倡导健康的生活方式,提高全民身体素质和健康意识,将成为国家医药卫生和体育工作结合方向的工作热点。
在运动医学学科快速发展的今天,越来越多新技术、新材料、新方法的出现和应用,极大地改变了以往人们对于运动创伤预防、诊断、治疗、康复的一些固有观念。更科学的临床队列研究设计和更有针对性的个体化方案的制定,将在今后的学科发展中更好地以准确的研究结论指导精准的诊断治疗和康复过程,推动运动医学这个体育运动科学与现代医学的交叉热点学科更好更快地向前发展。
| [1] | Flagg K Y, Karavatas S G, Thompson S Jr, et al. Current criteria for return to play after anterior cruciate ligament reconstruction:An evidence-based literature review[J]. Annals of Translational Medicine, 2019(7):S252. |
| [2] | Glogovac G, Schumaier A P, Grawe B M. Return to sport following revision anterior cruciate ligament reconstruction in athletes:A systematic review[J]. Arthroscopy 2019, 35(7):2222-2230. |
| [3] | Kostyun R O, Burland J P, Kostyun K J, et al. Male and female adolescent athletes' readiness to return to sport after anterior cruciate ligament injury and reconstruction[J]. Clinical Journal of Sport Medicine, 2019, doi:10.1097/jsm.0000000000000751. |
| [4] | Nwachukwu B U, Adjei J, Rauck R C, et al. How much do psychological factors affect lack of return to play after anterior cruciate ligament reconstruction? A systematic review[J]. Orthopaedic Journal of Sports Medicine, 2019, 7(5):2325967119845313. |
| [5] | Della Villa F, Andriolo L, Ricci M, et al. Compliance in post-operative rehabilitation is a key factor for return to sport after revision anterior cruciate ligament reconstruction[J]. Knee Surgery, Sports Traumatology, Arthroscopy, 2019, doi:https://doi.org/10.1007/s00167-019-05649-2. |
| [6] | Kosy J D, Phillips J R P, Edordu A, et al. Failure to return to preinjury activity level after hamstring anterior cruciate ligament reconstruction:Factors involved and considerations in goal setting[J]. Indian Journal of Orthopaedics 2019, 53(6):714-720. |
| [7] | Patel N K, Sabharwal S, Hadley C, et al. Factors affecting return to sport following hamstrings anterior cruciate ligament reconstruction in non-elite athletes[J]. European Journal of Orthopaedic Surgery & Traumatology, 2019(29):1771-1779. |
| [8] | Bodkin S G, Rutherford M H, Diduch D R, et al. How much time is needed between serial "return to play" assessments to achieve clinically important strength gains in patients recovering from anterior cruciate ligament reconstruction[J]. The American Journal of Sports Medicine, 2020, 48(1):70-77. |
| [9] | Hamrin Senorski E, Svantesson E, Beischer S, et al. Low 1-Year return-to-sport rate after anterior cruciate ligament reconstruction regardless of patient and surgical factors:A prospective cohort study of 272 patients[J]. The American Journal of Sports Medicine, 2018, 46(7):1551-1558. |
| [10] | Davies W T, Myer G D, Read P J. Is it time we better understood the tests we are using for return to sport decision making following ACL reconstruction? a critical review of the hop tests[J]. Sports Medicine, 2020, 50:485-495. |
| [11] | Hart H F, Culvenor A G, Guermazi A, et al. The InjuryPsychological Readiness to return to sport (I-PRRS) scale and the Sport Confidence Inventory (SCI):A crosscultural validation[J]. Physical Therapy in Sport, 2019(40):218-224. |
| [12] | Dunlop G, Ardern C L, Andersen T E, et al. Return-to-play practices following hamstring injury:A worldwide survey of 131 premier league football teams[J]. Sports Medicine, 2019, doi:10.1007/s40279-019-01199-2. |
| [13] | Webster K E, Nagelli C V, Hewett T E, et al. Factors associated with psychological readiness to return to sport after anterior cruciate ligament reconstruction surgery[J]. The American Journal of Sports Medicine, 2018, 46(7):1545-1550. |
| [14] | O'Connor R F, King E, Richter C, et al. No relationship between strength and power scores and anterior cruciate ligament return to sport after injury scale 9 months after anterior cruciate ligament reconstruction[J]. The American Journal of Sports Medicine, 2020, 48(1):78-84. |
| [15] | Nagelli C V, Hewett T E. Should return to sport be delayed until 2 years after anterior cruciate ligament reconstruction? Biological and functional considerations[J]. Sports Medicine, 2017, 47(2):221-232. |
| [16] | Willy R W, Hoglund L T, Barton C J, et al. Patellofemoral Pain[J]. Journal of Orthopaedic & Sports Physical Therapy, 2019, 49(9):CPG1-CPG95. |
| [17] | Willy R W, Hoglund L T, Barton C J, et al. Patellofemoral pain:Using the evidence to guide physical therapist practice[J]. Journal of Orthopaedic & Sports Physical Therapy, 2019, 49(9):631-632. |
| [18] | Edwards S G, Calandruccio J H. Autologous blood injections for refractory lateral epicondylitis[J]. Journal of Hand Surgery, 2003, 28(2):272-278. |
| [19] | Mishra A, Pavelko T. Treatment of chronic elbow tendinosis with buffered platelet-rich plasma[J]. American Journal of Sports Medicine, 2006, 34(11):1774-1778. |
| [20] | Mishra A K, Skrepnik N V, Edwards S G, et al. Efficacy of platelet-rich plasma for chronic tennis elbow:A double-blind, prospective, multicenter, randomized controlled trial of 230 patients[J]. The American Journal of Sports Medicine, 2014, 42(2):463-471. |
| [21] | Creaney L, Wallace A, Curtis M, et al. Growth factorbased therapies provide additional benefit beyond physical therapy in resistant elbow tendinopathy:A prospective, single-blind, randomised trial of autologous blood injections versus platelet-rich plasma injections[J]. British Journal of Sports Medicine, 2011, 45(12):966-971. |
| [22] | Thanasas C, Papadimitriou G, Charalambidis C, et al. Platelet-rich plasma versus autologous whole blood for the treatment of chronic lateral elbow epicondylitis:A randomized controlled clinical trial[J]. The American Journal of Sports Medicine, 2011, 39(10):2130-2134. |
| [23] | Pinar H, Koch M A, Hawkins H, et al. Treatment of achilles tendinopathy with platelet-rich plasma[J]. International Journal of Sports Medicine, 2010, 31(8):577-583. |
| [24] | Owens R F, Jr Ginnetti J, Conti S F, et al. Clinical and magnetic resonance imaging outcomes following platelet rich plasma injection for chronic midsubstance Achilles tendinopathy[J]. Foot & Ankle International, 2011, 32(11):1032-1039. |
| [25] | Volpi P, Quaglia A, Schoenhuber H, et al. Growth factors in the management of sport-inducedtendinopathies:Results after 24 months from treatment. A pilot study[J]. The Journal of Sports Medicine and Physical Fitness, 2010, 50(4):494-500. |
| [26] | Mautner K, Colberg R E, Malanga G, et al. Outcomes after ultrasound-guided platelet-rich plasma injections for chronic tendinopathy:A multicenter, retrospective review[J]. PM&R, 2013, 5(3):169-175. |
| [27] | Creaney L. Platelet-rich plasma for treatment of Achilles tendinopathy[J]. The Journal of the American Medical Association, 2010, 303(17):1696. |
| [28] | Deans V M, Miller A, Ramos J. A prospective series of patients with chronic achilles tendinopathy treated with autologous-conditioned plasma injections combined with exercise and therapeutic ultrasonography[J]. The Journal of Foot and Ankle Surgery, 2012, 51(6):706-710. |
| [29] | Oloff L, Elmi E, Nelson J, et al. Retrospective analysis of the effectiveness of platelet-rich plasma in the treatment of Achilles tendinopathy:Pretreatment and posttreatment correlation of magnetic resonance imaging and clinical assessment[J]. Foot & Ankle Specialist, 2015, 8(6):490-497. |
| [30] | Murawski C D, Smyth N A, Newman H, et al. A single platelet-rich plasma injection for chronic midsubstance achilles tendinopathy:A retrospective preliminary analysis[J]. Foot & Ankle Specialist, 2014, 7(5):372-376. |
| [31] | Ferrero G, Fabbro E, Orlandi D, et al. Ultrasound-guided injection of platelet-rich plasma in chronic Achilles and patellar tendinopathy[J]. Journal of Ultrasound, 2012, 15(4):260-266. |
| [32] | de Vos R J, Weir A, van Schie H T, et al. Platelet-rich plasma injection for chronic Achilles tendinopathy:A randomized controlled trial[J]. The Journal of the American Medical Association, 2010, 303(2):144-149. |
| [33] | Charousset C, Zaoui A, Bellaiche L, et al. Are multiple platelet-rich plasma injections useful for treatment of chronic patellar tendinopathy in athletes? A prospective study[J]. The American Journal of Sports Medicine, 2014, 42(4):906-911. |
| [34] | Kaux J F, Bruyere O, Croisier J L, et al. One-year follow-up of platelet-rich plasma infiltration to treat chronic proximal patellar tendinopathies[J]. Acta Orthopaedica Belgica, 2015(81):251-256. |
| [35] | Bubnov R, Yevseenko V, Semeniv I. Ultrasound guided injections of platelets rich plasma for muscle injury in professional athletes. Comparative study[J]. Medical Ultrasonography, 2013, 15(2):101-105. |
| [36] | Liu B, Cheng H, Ma W, et al. Common variants in the GNL3 contribute to the increasing risk of knee osteoarthritis in Han Chinese population[J]. Scientific Reports, 2018, 8(1):9610. |
| [37] | Evans C H. Advances in regenerative orthopedics[J]. Mayo Clinic Proceedings, 2013, 88(11):1323-1339. |
| [38] | de Bari C, Roelofs A J. Stem cell-based therapeutic strategies for cartilage defects and osteoarthritis[J]. Current Opinion in Pharmacology, 2018, 40:74-80. |
| [39] | Kong L, Zheng L Z, Qin L, et al. Role of mesenchymal stem cells in osteoarthritis treatment[J]. Journal of Orthopaedic Translation, 2017(9):89-103. |
| [40] | Im G I. Tissue engineering in osteoarthritis:Current status and prospect of mesenchymal stem cell therapy[J]. BioDrugs 2018(4), 32:183-192. |
| [41] | Volarevic V, Arsenijevic N, Lukic M L, et al. Concise review:Mesenchymal stem cell treatment of the complications of diabetes mellitus[J]. Stem Cells, 2011, 29(1):5-10. |
| [42] | Emadedin M, Labibzadeh N, Liastani M G, et al. Intraarticular implantation of autologous bone marrow-derived mesenchymal stromal cells to treat knee osteoarthritis:A randomized, triple-blind, placebo-controlled phase 1/2 clinical trial[J]. Cytotherapy, 2018, 20(10):1238-1246. |
| [43] | Davatchi F, Sadeghi Abdollahi B, Mohyeddin M, et al. Mesenchymal stem cell therapy for knee osteoarthritis:5 years follow-up of three patients[J]. International Journal of Rheumatic Diseases, 2016, 19(3):219-225. |
| [44] | Orozco L, Munar A, Soler R, et al. Treatment of knee osteoarthritis with autologous mesenchymal stem cells:A pilot study[J]. Transplantation, 2013, 95(12):1535-1541. |
| [45] | Elaheh M, Hamid R M, Maryam M T, et al. Mesenchymal stem cell-derived exosomes:A new therapeutic approach to osteoarthritis[J]. Stem Cell Research & Therapy 2019(10):340. |
| [46] | Marzetti E, Calvani R, Tosato M, et al. Sarcopenia:An overview[J]. Aging Clinical and Experimental Research, 2017(29):11-17. |
| [47] | Yu R, Wong M, Leung J, et al. Incidence, reversibility, risk factors and the protective effect of high body mass index against sarcopenia in community-dwelling older Chinese adults[J]. Geriatrics & Gerontology International, 2014, 14(suppl 1):15-28. |
| [48] | Anker S D, Morley J E, von Haehling S. Welcome to the ICD-10 code for sarcopenia[J]. Journal of Cachexia, Sarcopenia and Muscle, 2016, 7(5):512-514. |
| [49] | Cruz-Jentoft A J, Bahat G, Bauer J, et al. Sarcopenia:Revised European consensus on definition and diagnosis[J]. Age and Ageing, 2019, 48(4):16-31. |