2. 包头医学院基础医学与法医学院,包头 014060
3. 包头医学院第一附属医院神经外科,包头 014010
氧气(O2)是线粒体产生ATP和许多细胞内生化反应的关键底物,因此,维持氧气稳态对于大多数原核和真核生物的生存至关重要。2019年诺贝尔生理学或医学奖授予美国哈佛医学院教授威廉·凯林(William G. Kaelin Jr.)、英国牛津大学教授彼得·拉特克利夫(Peter J. Ratcliffe)和美国约翰斯霍普金斯大学医学院教授格雷格·塞门扎(Gregg L. Semenza)3位科学家,以表彰他们在“细胞如何感知和适应供氧环境变化”中的决定性研究成果和巨大贡献。3位科学家发现了机体通过调节基因的活性以应对不同水平的氧气环境,为了解氧水平如何影响细胞代谢和生理功能奠定了基础。
1 氧气的特性18世纪,约瑟夫·普里斯特利和卡尔·威廉·舍勒发现氧气,约占地球大气的20.8%。在呼吸过程中,动物和一些细菌从大气中吸收氧气,并释放二氧化碳,而绿色植物会通过光合作用,吸收二氧化碳并释放出游离的氧气。大气中几乎所有的游离氧都是由于光合作用产生的。
1.1 生理条件下的氧感应氧气在人类的肺泡中交换。通过肺泡-毛细血管交换系统输送到毛细血管中的氧气有95%以上与红细胞(red blood cell,RBC)中的血红蛋白结合。心脏将氧合血红蛋白(oxyhemoglobin,HbO2)的血液泵送到外周,这对于器官和细胞发挥功能并执行氧化磷酸化至关重要。血红蛋白对氧的亲和力根据氧分压(oxygen partial pressure,pO2)的水平而变化。pO2低时,血红蛋白对氧的亲和性低,血红蛋白释放氧到组织中,同时血红蛋白氧饱和度也保持低水平;当pO2升高时,血红蛋白对氧的亲和力增加,从而使更多的氧分子与血红蛋白结合,直至完全被氧饱和。氧从血红蛋白离解受到温度、pH值、2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-DPG)和一氧化碳水平的影响(图 1)[1]。
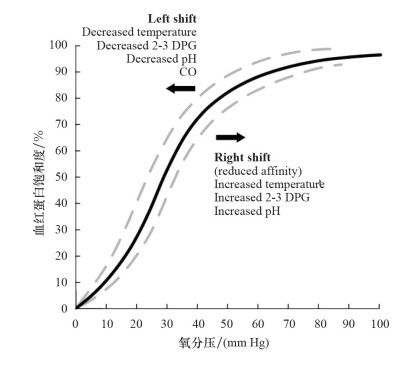 |
The oxygen-hemoglobin dissociation curve. From Anaesthesia UK.15 2, 3 DPG indicates 2, 3-diphosphoglycerate; CO, carbon monoxide
图 1 影响氧饱和度的因素 (图片来源:http://www.ncbi.nlm.nih.gov/pubmed/28953054) |
当获得氧气的方式发生变化时,细胞必须对此做出反应,因为过低或过高的氧气压力都会给生物体带来重大挑战。过量的氧气会形成活性氧而具有毒性,但是生理条件下,细胞更多时候遇到的是低氧状态,通过氧气感应使细胞的新陈代谢适应低氧水平。例如,剧烈运动时,肌肉中由氧感测控制的适应性过程包括新血管的产生和红细胞的生成。同时,免疫系统和其他生理功能也可以通过氧气感应机制进行微调。甚至氧气传感已被证明由于控制正常的血管形成和胎盘发育,在胎儿发育过程中是必不可少的。RBC通过氧依赖性代谢调节来响应体外低氧。在空气中氧气较少的高海拔地区,肾脏会刺激促红细胞生成素的分泌,致使产生更多的红细胞,从而减轻氧气的短缺。高原低氧刺激2 h内促红细胞生成素(erythropoietin,EPO)水平即可增加[2],EPO刺激的骨髓成熟RBC的产生可能需要几天的时间。
1.2 低氧在病理条件下的适应低氧血症的定义为动脉血氧张力低于正常值的情况,该症可能导致组织缺氧。当细胞由于通气不足、弥散障碍、心肺分流和通气-灌注不均或者组织毒性缺氧等因素导致氧气需求超过氧气供应时,就会低氧。低氧激活了低氧信号通路,包括HIF(hypoxia-inducible factor)通路、核因子-κB(nuclear factor-κB,NF-κB)途径和钙/钙调蛋白依赖性激酶2等。
1)低氧与肿瘤。
实体瘤通常发生在遭受急性或慢性低氧的区域,患有不同肿瘤类型的患者之间严重程度各异。尽管严重或长期的缺氧是有害的,但适应低氧的微环境已使癌细胞能够在这种敌对的环境中存活和增殖。肿瘤缺氧是由于肿瘤脉管系统的结构和功能异常所致,因为癌症的生长通常会超过癌症脉管系统适应不断增长的氧气需求的能力。传统上,低氧被认为是通过降低细胞分裂能力来限制癌症生长的因素。然而,最近多个报道表明,降低的氧气张力会产生更多的恶性细胞,并诱导多种细胞适应,从而再次维持并促进癌症的发展,诱导癌症的生长。缺氧可导致细胞反应,通过诱导血管生成改善氧合和活力,增加糖酵解和上调参与细胞存活/凋亡的基因来改变代谢。缺氧也已显示出增加的遗传不稳定性,活化浸润性生长和保存未分化细胞状态。研究表明,缺氧与常规疗法的耐药性有关。鉴于低氧作为不良预后和预测因素的重要作用,被认为是癌症治疗的最佳靶标之一[3]。
2)低氧与慢性阻塞性肺病。
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种进展性阻塞性肺疾病,表现为气喘和生产性咳嗽。肺气肿和肺结构重塑引起的气流限制导致通气/灌注不匹配,产生低氧。患有肺气肿性表型的COPD患者表现为肺部单位通气增加(即高V/Q比),因此增加了生理死腔。相反,患有严重气道疾病的受试者更可能具有较低的V/Q比,且肺泡通气量发生改变,通气不足区域的血液大量灌注以及随之而来的生理分流。与COPD相关的低氧血症会导致生活质量下降、运动耐力下降、骨骼肌功能下降,并最终增加死亡风险。COPD的恶化通常与气体交换的恶化和相关的低氧血症有关,V/Q比例的不匹配是决定性因素;组织耗氧增加,导致混合静脉血氧张力降低,这也加剧了COPD患者在病情加重期间并发低氧血症。此外,越来越多的证据表明,低氧血症不仅仅是晚期疾病的征兆,也是肺外合并症的关键因素。例如,肺动脉高压、继发性红细胞增多症、全身性炎症和骨骼肌功能障碍等[4]。
3)低氧与心脏疾病。
循环系统将血液分配到每个组织,并输送氧气和营养,通过外周循环来维持组织的生理功能。因此,血液循环紊乱会减少氧气的输送,从而导致组织缺氧。这种缺氧发生在多种心血管疾病中,例如,动脉粥样硬化、肺动脉高压和心力衰竭等。由于心血管疾病能够诱发组织缺氧,但缺氧信号本身具有调节组织重塑过程或心血管疾病严重性的潜力。有研究表明,心肌梗塞后的组织受到再灌注损伤的严重限制,增加了发生心律不齐、心肌震颤和梗死面积的机会。矛盾的是,低氧调节心脏成纤维细胞的生长、增殖能力和1型胶原的产生,因此可以在心肌胶原基质的梗塞后重塑中发挥作用。此外,低氧还可以诱导心肌细胞凋亡。在低氧条件下可以用内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的基因疗法治疗肺动脉高压及其所致的右心衰竭[5]。
4)低氧与其他疾病。
在病理情况下,氧感测是许多疾病的核心。组织缺氧已被认为是慢性肾脏疾病(chronic kidney disease,CKD)和急性肾损伤(acute kidney injury,AKI)的病理生理学中的重要指标。患有慢性肾功能衰竭的患者通常由于EPO表达降低而患有严重的贫血[6]。此外,低氧可以诱导多种炎性因子,例如白介素-2(interleukin-2,IL-2)、IL-4和干扰素γ(interferon-γ,IFNγ)的产生,降低人单核细胞产生IL-10的能力。缺氧也可诱导巨噬细胞和内皮细胞在mRNA和蛋白质水平上产生趋化剂IL-8和活性IL-1a[7]。因此,炎症程度部分取决于特定白介素的低氧刺激作用的平衡。此外,动脉粥样硬化、类风湿性关节炎以及与年龄有关的黄斑变性、子宫内膜异位症和子宫腺肌病等疾病也与之有关。
5)低氧作为治疗靶点的应用。
低氧已经成为多种疾病治疗的靶点,并且已经有部分药物上市。2018年12月,全球首个利用低氧诱导因子原理开发的肾性贫血治疗创新药罗沙司他胶囊(商品名:爱瑞卓)在北京上市,用于治疗慢性肾脏疾病患者由于接受透析治疗引起的贫血。此外,2019年9月,药物罗沙司他在日本获批上市,在美国和欧洲等国家或地区完成临床试验,即将向药监部门提交上市申请。最新临床试验表明,低氧诱导因子HIF-2α抑制剂对癌症治疗有良好效果。
2 低氧的积极效应——低氧预适应在低氧领域研究之初,人们更多注重低氧损伤效应,后期才逐步重视低氧环境的积极因素。自1986年Murry研究狗的心脏缺血时,提出缺血预适应概念以来,低氧反应及其低氧适应已成为20世纪90年代以来的热点研究领域。“低氧/缺血预适应”(hypoxic/ischemic preconditioning,H/IPC)是指通过预先暴露短时间的、亚致死性的低氧/缺血刺激,或短时间的低温以及其他中度压力效应,可以增加机体对随后严重缺血/低氧的抵抗。它是一种内源性细胞保护机制[8],这种现象可发生于心脏、大脑、肾和肝脏等器官。
2.1 低氧预适应的历史及其神经保护作用1927年,霍尔丹认为“组织细胞对缺氧的获得性耐受性”是在进化过程中形成的[9]。1963年中国低氧预适应创始人吕国蔚提出其为“组织细胞对缺氧的适应”[10]。由于大脑本身的高耗氧率,对氧气浓度的变化最为敏感。因此,在低氧期间,大脑利用关键的适应性机制得以生存并保持体内平衡。
HPC的神经保护作用研究始于1986年,自发现以来便备受重视[11]。有报道称,缺氧预处理可抑制新生儿脑损伤中的神经胶质活化和神经炎症。研究者使用新生儿的缺氧缺血性脑损伤模型,在7日龄大鼠和体外缺氧模型评估低氧和低氧预处理对胶质细胞激活的影响,发现缺氧预处理可显著减弱神经胶质的激活,并产生强大的神经保护作用。同样,体外实验表明,暴露于0.5%的氧气4 h会引起神经胶质炎性反应。在低氧损伤之前24 h暴露于短暂的(0.5 h)缺氧可明显缓解这种反应[12]。另有研究表明,缺氧预处理可显著减轻低氧缺血(hypoxia-ischemic injury,H/I)脑损伤,并显著改善H/I后35 d的感觉运动和认知功能。HPC长期神经学预后的改善至少部分归因于少突胶质细胞祖细胞的分化和成熟能力的恢复,小胶质细胞/巨噬细胞激活和神经炎症的改善以及H/I后脑发育的持续[13]。
在吕国蔚建立的一种全身性HPC模型基础上,现有实验进一步评估动物对缺氧的耐受性[14]。研究者将小鼠放在一个密封的低氧瓶中,创造缺氧的环境。这导致了机体的“自动缺氧”,动物因为自身的耗氧量在密闭的环境中耗尽了氧气,根据其张口喘气的频率来判断动物的耐受性。一旦动物开始喘息,它将被移入另一个密封的低氧瓶中,这个过程被重复2,3,4或5次。缺氧4或5次的动物被认为是低氧预适应的动物。在此过程中,每增加一次缺氧,动物的耐受性就会随之增加。重复2、3、4和5次动物的耐受性时间,分别是第一次运行时的2、4、6和8倍[8]。这表明了低氧预适应产生的保护作用。致力于低氧预适应机制的研究,将为低氧预适应成为临床治疗手段和高原、航天、航海等极端条件下作业的细胞保护提供新思路和新策略。
2.2 低氧预适应的可能机制吕国蔚等认为高等动物应对低氧应激有两种选择。一是通过调节机制,调动器官系统反应,维持有氧代谢,保护内环境相对恒定,不随外环境变化而变化;另一选择是改变内环境,降低氧耗和减少能量生成,以顺应外环境的变化[8]。
HPC的基本机制是大脑代谢的抑制和产生冬眠状态的活性。早期研究表明,在低氧条件下,新生和成年哺乳动物中也经常发生无脊椎动物和低等脊椎动物常见的代谢率下降,这似乎在很大程度上取决于温度调节。因此,调节体温并因此调节代谢速率的能力是代谢抑制的中心过程。在细胞水平上,低氧时细胞利用厌氧糖酵解活性来提高能量产生的效率以及减少能量消耗过程,为了产生相当于氧化磷酸化的能量,细胞需要大量的葡萄糖,因此,与葡萄糖转运和糖酵解有关的酶可能在HPC诱导的低氧耐受性中起关键作用。HPC的神经保护作用的发挥与许多基因有关,例如,p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,p38-MAPK)、细胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)、蛋白激酶C(protein kinase C,PKC)及其几种同工酶、N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)及其受体基因等。此外,HPC抑制脯氨酰羟化酶-2,它通过控制HIF-1α的降解来调节HIF-1α的功能,进而影响其靶标蛋白表皮生长因子(epidermal growth factor,EGF)、EPO、一氧化氮(NO)等的表达,由于NO对血管舒张作用以及对线粒体的作用而在预处理中起重要作用,成为神经保护的作用因子。HPC还可以通过影响线粒体功能以及与之相关的凋亡基因,例如Bcl-2、Bcl-x、BAD和Bax等成员及caspase-3或caspase-9而影响凋亡。siRNA在预处理中起着重要作用,可能是赋予神经保护和潜在治疗干预的重要途径[15](图 2)。了解低氧耐受的细胞机制需要更多生理条件下的分析,并且可能会产生独特的治疗靶标。
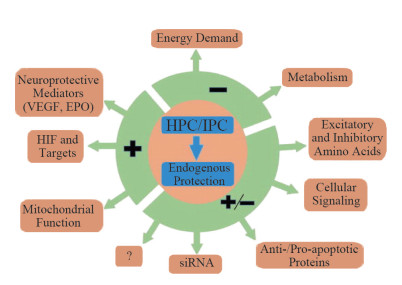 |
图 2 缺氧和缺血预处理(HPC/IPC)的分子机制 (图片来源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5515698/#R55) |
通过刺激和低氧适应之间的时间效应,可以进一步了解HPC。快速HPC或成为HPC早期相是一种持续时间较短的保护性表型,快速HPC在亚致死性低氧暴露后数分钟至数小时被早期诱导。普遍认为这种早期适应是离子通道通透性、蛋白磷酸化和其他翻译后修饰改变的结果。相反,延迟HPC或HPC晚期相为需要基因激活和从头合成蛋白质的“经典预处理”,在HPC之后数小时到数天才显现出来。在延迟性HPC中,激活了多种多样的促生存基因家族,这些家族编码的蛋白质可提高大脑对缺血性损伤的耐受性。这既涉及抑制性损伤机制,也涉及生存和修复基础的机制的增加[8, 16]。
3 低氧预适应的应用和局限性 3.1 临床应用当前,正如实验室动物模型结果提示预适应治疗的益处,研究者正在探索包括HPC和IPC在内的多种新颖的预适应的应用。但是,临床实验结果仍然不能很好投入应用。首先,HPC或IPC的人体试验研究人群较少,并且不能反映临床疾病的异质性。其次,预适应的刺激的最佳持续时间、频率和幅度可能因不同疾病而有所不同,因此有必要进行广泛的人体试验。研究表明,HPC具有抗高血压特性。在20个疗程中对37名1期高血压男性进行4~10次缺氧治疗(吸入气中的氧浓度分数=10%),每次持续3分钟,而对照组接受了室内空气[17]。结果表明,治疗组的血压降低,并且在某些患者中,这种降低持续了长达3个月,证实HPC可以增强心脏对缺血的耐受性。另外,可以通过与其他疗法组合来优化药理学和低氧预处理的功效。
3.2 HPC的局限性HPC的一个主要局限性在于其益处是短暂的,通常仅持续几天,而许多目标疾病的病程是无法预测的。例如,卒中或心脏疾病出现发病迹象明显时,再开始进行预适应为时已晚。因此HPC或IPC可能更适合于术前的干预。例如,Zarbock等探索了远端缺血预处理(remote ischemic preconditioning,RIP)对接受心脏手术的患者的肾功能的治疗益处,并发现术后急性肾损伤的发生率有所降低[18]。
4 结论越来越多的研究结果表明,低氧预适应对多种组织器官的损伤存在保护作用。在未来的医学发展中,低氧预适应也可以作为一个靶标,尤其是预处理刺激的最佳持续时间,频率和幅度可能因不同疾病而异,因此有必要进行广泛的人体试验。低氧预适应在临床的广泛利用及极端低氧环境作业应用还需要进一步的研究,提供更多的有力证据。
| [1] | Kayton A, Timoney P, Vargo L, et al. A Review of oxygen physiology and appropriate management of oxygen levels in premature neonates[J]. Advances in Neonatal Care, 2018, 18(2): 98-104. |
| [2] | Eckardt K U, Boutellier U, Kurtz A, et al. Rate of erythropoietin formation in humans in response to acute hypobaric hypoxia[J]. Journal of Applied Physiology, 1989, 66(4): 1785-1788. |
| [3] | Moen I, Stuhr L E B. Hyperbaric oxygen therapy and cancer-a review[J]. Targeted Oncology, 2012, 7(4): 233-242. |
| [4] | Kent B D, Mitchell P D, McNicholas W T. Hypoxemia in patients with COPD: Cause, effects, and disease progression[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2011, 6: 199. |
| [5] | Abe H, Semba H, Takeda N. The roles of hypoxia signaling in the pathogenesis of cardiovascular diseases[J]. Journal of Atherosclerosis and Thrombosis, 2017, 24(9): 884. |
| [6] | Ow C P C, Ngo J P, Ullah M M, et al. Renal hypoxia in kidney disease: Cause or consequence[J]. Acta Physiologica, 2018, 222(4): e12999. |
| [7] | Naldini A, Carraro F, Silvestri S, et al. Hypoxia affects cytokine production and proliferative responses by human peripheral mononuclear cells[J]. Journal of Cellular Physiology, 1997, 173(3): 335-342. |
| [8] | Lu G W, Yu S, Li R H, et al. Hypoxic preconditioning: A novel intrinsic cytoprotective strategy[J]. Mol Neurobiol, 2005, 31(1-3): 255-271. |
| [9] | Haldane J B. Carbon monoxide as a tissue poison[J]. Biochemical Journal, 1927, 21(5): 68-75. |
| [10] | 吕国蔚. 缺氧适应的组织机制[M]. 北京: 人民卫生出版社, 1963, 169-273. |
| [11] | Schurr A, Reid K H, Tseng M T, et al. Adaptation of adult brain tissue to anoxia and hypoxia in vitro[J]. Brain Research, 1986, 374(2): 244-248. |
| [12] | Chen C Y, Sun W Z, Kang K H, et al. Hypoxic preconditioning suppresses glial activation and neuroinflammation in neonatal brain insults[J]. Mediators Inflamm. 2015(2015): 632592. |
| [13] | Xu M Y, Wang Y F, Wei P J, et al. Hypoxic preconditioning improves long-term functional outcomes after neonatal hypoxia-ischemic injury by restoring white matter integrity and brain development[J]. CNS Neurosci Therapeutics, 2019, 25(6): 734-747. |
| [14] | Lu G W, Cui X Y, Zhao B M. Alteration of oxygen consumption and energy metabolism during repetitive exposure of mice to hypoxia[J]. Neurochemical Research, 1999, 24(5): 625-628. |
| [15] | Li S, Hafeez A, Noorulla F, et al. Preconditioning in neuroprotection: From hypoxia to ischemia[J]. Program Neurobiology, 2017(157): 79-91. |
| [16] | Gidday J M. Cerebral preconditioning and ischaemic tolerance[J]. Nature Reviews Neuroscience, 2006, 6(7): 437-448. |
| [17] | Lyamina N P, Lyamina S V, Senchiknin V N, et al. Normobaric hypoxia conditioning reduces blood pressure and normalizes nitric oxide synthesis in patients with arterial hypertension[J]. Journal of Hypertension, 2011, 29 (11): 2265-2272. |
| [18] | Zarbock A, Schmidt C, Van Aken H, et al. Effect of remote ischemic preconditioning on kidney injury among high-risk patients undergoing cardiac surgery: A randomized clinical trial[J]. Journal of the American Medical Association, 2015, 313(21): 2133-2141. |
2. Preclinical and Forensic Medicine, Baotao Medical College, Baotou 014060, China
3. Department of Neurosurgery, the First Affiliated Hospital of Baotou Medical College, Baotou 014010, China