2019年1月15日,美国食品和药物管理局(U.S. Food and Drug Administration,FDA)将“突破性疗法”通行证,授予了百济神州公司的一款在研抗癌新药。这对中国的制药界来讲是一个大新闻。中国自己研制的药物,有不少在美国进行临床研究,但是这个叫泽布替尼(Zanubrutinib)的在研新药,是第一个获得美国FDA“突破性疗法”通行证的中国药物。对于中国现代制药业来说,这可谓是一个从0到1的突破。这次被授予突破性疗法认证的药物泽布替尼是一种布鲁顿氏酪氨酸激酶(BTK)抑制剂,用于治疗先前接受至少一次疗法的成年套细胞淋巴瘤(MCL)患者,作为这一症状的二线治疗方式。FDA的“突破性疗法”是什么,泽布替尼又因何获得这个殊荣?
1 “突破性疗法”是什么?FDA是美国的药物评审机构,同时也是世界上最顶尖最严格的药物评审机构。因为新药研发的周期太长,为了能够帮助最具有创新、突破意义的药物尽快上市,通过缩短审批周期,达成尽快帮助患者的目的,FDA在2012年开始发放“突破性疗法”的通行证。
一个新的治疗方式,如果能在早期临床研发阶段就表现出相对于目前疗法的创新性和突破性,就有机会获得FDA的“突破性疗法”认证。有了这张通行证,就能获得FDA多种形式的支持,例如:FDA会对药物临床研究进行指导,FDA高级管理人员会参与到对药物审批的过程中来,获得进入药物审批快速通道的资格。
这张“突破性疗法”通行证有什么效果呢?从目前的统计数据看,有了这张通行证,药物从临床研究到获得批准的时间,平均缩短了2年!不要小看这2年的时间,对药企来说,这2年不仅可以提前完成新药研发的周期,把更多资源投入到其他的新药研究上,最重要的是,患者可以提前2年使用上新的药物,克服疾病的困扰。特别是对于一些晚期癌症患者来说,其预期生存期通常不足6个月,没有2年的时间等待新药。所以,这个“突破性疗法”的通行证,从某种意义上来说是很多患者的救命符。这张“突破性疗法”的通行证,具有满满的含金量,谁都想得到,那泽布替尼为什么成为了中国第一个拿到这个通行证的新药呢?
2 泽布替尼:新型布鲁顿氏酪氨酸激酶抑制剂泽布替尼是百济神州公司在研的新型布鲁顿氏酪氨酸激酶(BTK)靶向抑制剂。在它之前,已经有第一代BTK靶向药伊布替尼(Ibrutinib),于2013被FDA正式批准用于套细胞淋巴瘤的治疗,之后又获得批准,用于慢性淋巴细胞白血病(CLL)、华氏巨球蛋白血症(WM)等适应症。套细胞淋巴瘤占全部非霍奇金淋巴瘤(Non-Hodgkin lymphoma,NHL)的6%。非霍奇金淋巴瘤(NHL)是具有很强异质性的一组独立疾病的总称,是中国常见的。在前10位以内。NHL病变是主要发生在淋巴结、脾脏、胸腺等淋巴器官,也可发生在淋巴结外的淋巴组织和器官的淋巴造血系统的恶性肿瘤。依据细胞来源将其分为3种基本类型:B细胞、T细胞和NK/T细胞。NHL在病理学分型、临床表现与治疗个体化分层上都比较复杂,但这是一种有可能高度治愈的肿瘤,目前发病率在不同年龄阶段呈明显上升的趋势。
因此,套细胞淋巴瘤药物的研发也受到了广泛的关注,对于治疗这一疾病的全球首个靶向药物伊布替尼来说,在当年也拿到了“突破性疗法”通行证,并于2013年在FDA正式获批,在2017年得到中国食品药品监督管理总局(CFDA)批准,适用于既往至少接受过一种治疗的慢性淋巴性白血病(CLL)/小淋巴细胞淋巴瘤、套细胞淋巴瘤(MCL)患者的的治疗。然而,其副作用对治疗的影响极大。据估计,第一年治疗中,就会有40%的患者因副作用停药,因此开发新药显得更加迫切。对于在研药物泽布替尼来说,对比第一代抑制剂伊布替尼,虽然同属不可逆BTK抑制剂,但是泽布替尼在铰链区与伊布替尼有分子构型差异,可能因此导致了对靶点更佳的选择性(图 1)。总结来说,泽布替尼的靶点占有率更高、选择性更强、抑制更持久。
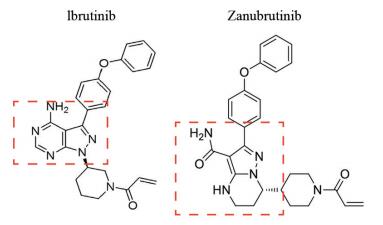 | 图 1 Ibrutinib(伊布替尼)和Zanubrutinib结构式 Fig. 1 Structure of Ibrutinib and Zanubrutinib |
作为靶向药,考核的一个重点就是靶点占有率。一代BTK抑制剂给患者服用后,外周血的靶点占有率达到80%,也就是能把80%BTK靶点都封闭住,从而获得很好的治疗效果。如果同样的考核,泽布替尼是个什么成绩呢?不管是外周血中的BTK靶点,还是淋巴结中的BTK靶点,泽布替尼的中位数占有率都可以达到100%!也就是说,泽布替尼能把靶点分子接近完全封闭。因为封闭得完全,泽布替尼才在淋巴瘤的治疗中显示出了非常好的效果。在套细胞淋巴瘤的临床试验中,对于难治、复发性患者,在接受泽布替尼治疗后,84%的患者达到客观缓解,高达59%的患者更是达到完全缓解:肿瘤完全消失[1]。而在之前类似的临床中,一代BTK靶向药只能让68%的患者达到客观缓解,而达到完全缓解的只有21%[2]。
2.2 选择性更强记得当年军训实弹射击的时候,有人靶上一颗子弹没有,而有人靶上却飞来了不少别人的子弹。在现实中,小分子靶向药除了对靶向分子有抑制活性,对其他一些结构比较类似的蛋白,也可能会有一些活性,这就是脱靶效应,专业上的表达就是选择性有问题。如果比较泽布替尼和一代靶向药,会发现泽布替尼对于EGFR、HER2、ITK等靶点的抑制活性都比较低,说明脱靶现象比较少[3]。治疗患者时的脱靶可能是副作用和不良反应。而脱靶少,选择性强,意味着一个药物所带来的副作用会更少。比较临床试验的数据,泽布替尼也确实显现出更好的安全性,不良反应事件发生率更低了[2]。
一代BTK抑制剂最常见的不良反应是腹泻,50%的服用者都会有,而且6%的患者是严重腹泻;相比之下,泽布替尼的腹泻发生率只有10.5%,没有患者出现严重腹泻。房颤是一代BTK抑制剂比较严重的不良反应,一旦出现,患者需要减少剂量或者停药,否则将有可能导致心脏功能下降,甚至心力衰竭;同时房颤还有可能导致心房不能正常泵血,容易形成血栓,而血栓如果随血流进入大脑,就会造成脑卒中。一代BTK抑制剂在当年的临床试验中,房颤发生率是4.5%[2]。相比之下,在泽布替尼治疗套细胞淋巴瘤的临床试验中,患者都没有出现房颤的现象,再次预示着这新一代的BTK抑制剂有着更好的安全性[1]。
当然,历史数据的比较,严格来说并不能作为优劣性的证据。不同的临床试验,由于患者平均年龄、随访时间的差别,会对药物的有效性和不良反应的数据造成影响。目前,有一项头对头的Ⅲ期临床试验(BGB-3111-302)[4],正在华氏巨球蛋白血症患者中进行,到底这两个药在疗效、安全性方面的差别有多少,需要等这个临床试验的结果来揭晓。
2.3 抑制更持久虽然这些BTK抑制剂都是不可逆抑制剂,但在临床前的动物实验中,一代BTK抑制剂虽然一开始可以对外周血、淋巴结里的靶点形成很好的封闭,但是检测发现,在24 h之内,有27%~62%的封闭就失效了。但是对于泽布替尼来说,这新型的靶向药不但可以很容易获得更高的血液浓度,很精准地射到BTK上,而且还能很持久地封闭住靶点分子。这个持久性在临床治疗中就转化成了持久的缓解率。在套细胞淋巴瘤的临床试验中,接受泽布替尼治疗后,患者在12周时无进展生存率为90%,在24周时仍有82%。而在同样的临床试验中,一代BTK抑制剂治疗24周时,患者的无进展生存率只有60%左右[5]。
3 展望一代BTK抑制剂也是一个很好的药物,只是不完美,在靶点占有率、选择性、抑制持久性这3个方面具有局限性,但这些局限都被泽布替尼突破,而且泽布替尼已经在目前的临床试验中显示出更好的疗效和安全性,才获得了美国FDA的“突破性疗法”通行证。此外,对于华氏巨球蛋白血症(WM)的治疗,泽布替尼之前也获得了美国FDA“快速通道”通行证。
对中国患者来说,更好的消息是泽布替尼已经在中国递交了新药上市申请,针对的适应症是复发或难治性套细胞淋巴瘤(MCL)、慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL),而且目前均已被中国药品审评中心纳入优先审评,有望在2019年获得批准,成为第一个本土制造的BTK新药。虽然最终获得批准还需要一点时间,但是泽布替尼如今获得美国FDA“突破性疗法”通行证,说明了一件事——中国的现代制药已经真正走入新的阶段,从仿制迈向创新,新药从中国崛起并走向海外,已经成为可能。这是一个从0到1的突破!希望这突破,是一个新时代的开始。
| [1] | Song Y, Zhou K, Zou D, et al. Safety and activity of the investigational bruton tyrosine kinase inhibitor zanubrutinib (BGB-3111) in patients with mantle cell lymphoma from a phase 2 Trial[J]. Blood, 2018, 132(Suppl 1): 148. |
| [2] | Wang M L, Rule S, Martin P, et al. Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma[J]. New England Journal of Medicine, 2013, 369(6): 507-516. |
| [3] | Kaptein A, Bruin G, van Hoek M, et al. Potency and selectivity of BTK inhibitors in clinical development for B-Cell malignancies[J]. Blood, 2018, 132(Suppl 1): 1871. |
| [4] | Tam C S, Leblond V, Novotny W, et al. A head-to-head Phase Ⅲ study comparing zanubrutinib versus ibrutinib in patients with Waldenström macroglobulinemia.[J]. Hematological Oncology, 2018, 35(S2): 422-423. |
| [5] | Wang M L, Blum K A, Martin P, et al. Long-term follow-up of MCL patients treated with single-agent ibrutinib: Updated safety and efficacy results[J]. Blood, 2015, 126(6): 739-745. |
(责任编辑 田恬)