据全球信息技术研究与顾问公司(Gartner)发布数据显示,2016年全球3D打印市场规模为70亿美元,未来5年复合增速达32%。中国增材制造产业联盟统计数据显示,2016年中国3D打印产业规模已达80亿元,产业规模实现较快增长。然而,全球3D打印产业目前仍处于发展初期,在全球制造业市场的占比较小,市场潜力还没有完全开发,随着在材料、装备、工艺、应用、标准等方面加大培育力度,完善产业政策体系,中国3D打印产业将迎来高速发展的契机。
3D打印是一种以数字模型为基础,将材料逐层堆积制造出实体物品的新兴制造技术[1-2],该技术将对传统的工艺流程、生产线、工厂模式、产业链组合产生深刻影响,是制造业有代表性的颠覆性技术。
3D打印技术发展至今已有30多年历史,面临最大的发展问题是标准缺乏[3]。国际标准化组织(ISO)成立了专门的增材制造技术委员会,开展3D打印技术的国际标准制定,美国材料与试验协会(ASTM)也成立了增材制造技术委员会,研究并发布了3D打印在材料领域的标准,但是中国在这一领域尚处于刚刚起步阶段。随着欧盟3D打印标准化路线图的发布,国际组织关于3D打印一系列标准的制定,以及美国FDA关于3D打印技术文件等一系列规范的出台,3D打印逐渐拥有了自己的通用语言和方向。
1 3D打印在中国医疗领域的发展现状航空工业与医疗产业是最先开始应用3D打印的领域,目前,3D打印已经在这两个方面实现了相当规模的应用。刚刚试飞成功的C919首次成功应用了中国自主研制的3D打印钛合金中央翼肋缘条零件。医疗器械行业是3D打印的重要市场,3D打印能够实现个性化[4]、精准化[5]的医疗服务,需求量正在迅速增长[6-7],例如医疗模型[8]、手术导板、牙科及骨科植入物、组织器官生物打印等[9-10]逐渐进入临床,部分已实现规模化生产。
2015年9月,中国首个3D打印人体植入物-髋臼部件获得国家食品药品监督管理总局(CFDA)注册批准,标志着3D打印技术在中国正式进入临床应用。3D打印医疗器械的使用一直受到法规政策的限制,各个国家都没有相关的审批注册标准,许多创新产品无法完成注册检验,进入不了市场,大部分3D打印技术仅用于打印肿瘤、器官模型及手术导板等临床边缘产品,作为风险等级相对较小的医疗器械进行管理,临床应用价值大打折扣。然而,3D打印技术的核心价值在于打印临床使用的关节、骨骼、脊柱等定制式手术植入物,替代传统的外科手术植入物,达到更好的治疗效果,而这些高风险产品受到严格监管,属于风险等级最高的三类医疗器械,需要注册审批才能准入临床[11]。医疗领域的3D打印在中国处于刚刚起步阶段,截止目前,仅有5款产品通过了CFDA认证,分别是:爱康宜诚与北医三院合作的3D打印髋臼部件、3D打印椎体假体和3D打印脊柱椎间融合器这3款产品,西安科谷的3D打印个体化下颌骨重建假体,以及迈普医学的3D打印硬脑(脊)膜补片。
目前,3D打印在医疗领域的发展面临巨大困境与挑战,其中之一是标准的缺乏,各国对3D打印医疗器械的管理依据基本处于空白状态,缺乏相关的审批认证制度。一方面,管理部门对于这种非传统制造工艺生产的3D打印产品缺乏管理经验[12],如何分类、如何管理没有相关的法规可以参考;另一方面,严重缺乏相关技术标准[13-14],对于研发设计、检验检测、生产经营、质量管理等缺乏针对性的国家标准和行业标准,国际上也没有相关的标准做参考,对产品的安全性、有效性等技术评审带来很大障碍。
2 国际标准化路线推动3D打印发展国际标准化组织增材制造技术委员会(ISO/TC 261)和美国材料与试验协会增材制造技术委员会(ASTM F42)是国际上最主要的两个3D打印标准制定组织。2009年,由美国材料与试验协会发起成立ASTM F42委员会,旨在通过标准化手段实现3D打印技术的推广、研究和应用,汇集了来自美国、欧洲等3D打印领域400多名成员单位[15]。ASTM F42委员会下设术语(F42.91)、设计(F42.04)、材料与工艺(F42.05)、测试方法(F42.01)、环境/健康/安全(F42.06)等6个分技术委员会,其中材料与工艺分技术委员会(F42.05)又细分为金属材料、聚合物材料、医疗应用和航空应用这4个专业领域。
2011年,国际标准化组织成立了ISO/TC 261技术委员会,由20个参与国和5个观察员国组成,旨在制定3D打印领域国际标准。ISO/TC 261委员会下设术语、工艺流程和材料、测试方法和性能标准、数据处理与设计4个工作组,同时与ASTM F42委员会达成合作协议,共同研究并制定3D打印联名标准[16]。
为通过标准化手段推动3D打印技术的产业发展和应用,欧盟启动了一项“3D打印标准支持行动(SASAM)计划”,整合和协调ISO/TC 261与ASTM F42等组织的3D打印标准活动,聚焦3D打印的设计、方法与工艺、材料、测试方法这4个方面的标准研制,建立统一的3D打印标准化路线图[17]。
在ISO/TC 261与ASTM F42达成标准工作合作框架协定后,初步形成了基础标准、分类标准和专用标准的三级标准体系框架,如图 1所示。最高级为基础标准,包括术语、工艺和材料、测试方法、设计与数据格式;第二级为分类标准,包括原材料、工艺和设备、零件技术指标和成品测试等;第三级为专用标准,包括专用材料检测标准、工艺专用标准、应用标准等。
 | 图 1 3D打印国际通用标准体系框架 Figure 1 Framework of international general standard system for 3D printing |
现行的3D打印国际标准约20项,均按照3D打印通用标准体系框架进行分类,如表 1所示。目前,这些标准作为3D打印通用标准,已被国际社会广泛认可,3D打印有了国际通用的语言,推动了3D打印技术在全球的发展与应用。然而,除了这些术语、材料、工艺等方面的通用标准外,医疗等领域的专用标准尚属空白。2017年12月,美国食品和药品管理局(FDA)发布了《3D打印医疗器械技术指导意见》,为医疗器械制造商提供有关3D打印技术方面的规范建议,以及制造商在提交3D打印医疗器械审批时的文件资料要求,包括3D打印方法、设计与制造过程、功能、耐久性测试以及质量管理要求等,以技术规范文件助推3D打印技术在医疗领域的应用[18]。
| 表 1 3D打印现行国际标准 Table 1 Current international standards for 3D printing |
随着欧盟支持的SASAM项目标准化路线图发布,ISO/TC 261与ASTM F42关于增材制造的一系列国际标准制定,FDA增材制造医疗器械技术文件等一系列规范出台,3D打印在医疗领域的应用开始得到推广。截止目前,FDA已经审查批准了100多种3D打印产品,包括特定植入物和第一个3D打印药物,对于创新3D打印医疗器械的审批更是加快了步伐。例如,2017年6月,FDA批准了SI-BONE公司生产的首款骶髂关节3D打印植入物,该产品用于骶髂关节微创手术的钛金属植入物;2017年7月,FDA批准了Osseus公司生产的3D打印颈椎融合器,用于治疗退行性椎间盘疾病;2017年10月,FDA分别批准了ChoiceSpine LP公司和NexxtSpine公司生产的两款3D打印脊柱植入物;2017年11月北美放射学会年会(RSNA)上,国际医疗器械制造商西门子、通用电气公司和飞利浦分别发布了嵌入其图像处理软件平台的3D打印技术应用软件,实现将影像数据直接转化为3D打印解剖模型,实现高效的医疗3D打印,提升医疗机构的诊疗效率和患者的临床效果;3D打印的抗癫痫药物SPRITAM速溶片也于2015年获得FDA批准,标志着3D打印药物实现应用[19]。这些产品的上市,将进一步推动医疗3D打印技术在临床的广泛应用和发展。
3 中国3D打印产业迎来历史机遇期 3.1 国家出台一系列政策推动3D打印技术与实体经济融合2015年2月,工业和信息化部、发改委、财政部联合发布《国家增材制造业发展推进计划(2015—2016年)》,提出到2016年中国要初步建立较为完善的增材制造产业体系,整体技术水平保持与国际同步[20]。
2015年5月,国务院印发《中国制造2025》规划,明确将增材制造产业作为发展重点,推动中国3D打印技术和装备的研发和应用[21]。作为智能制造的重要内容,3D打印技术在中国制造2025“1+X”多个规划中被提及。相关3D打印领域企业也将获得国家特别上市制度支持。
2016年12月,工业和信息化部批复国家增材制造创新中心[22],由西安交通大学、北京航空航天大学、西北工业大学、清华大学和华中科技大学这5所高校及装备、材料、软件及研发等13家重点企业共同组建,开展3D打印共性技术研究、标准制定及产业化。同时,国家质量监督检验检疫总局批准了无锡市产品质量监督检验中心筹建国家增材制造产品质量监督检验中心,开展相关产品检测、认证等服务。
2017年11月,工业和信息化部等12部门印发《增材制造发展行动计划(2017—2020年)》,明确提出到2020年,中国增材制造产业年销售收入超过200亿元,年均增速在30%以上[23]。3D打印技术的发展需要材料、工艺装备、核心部件等关键技术研发及产业化能力的提升,以及推进在重点行业的创新应用。行动计划对医疗3D打印技术的发展明确了方向,提升医疗增材制造专用材料的质量和工艺性能,完善个性化医疗器械的材料设计和微结构设计技术,提高增材制造装备及核心部件质量性能及可靠性,同时,要积极探索“3D打印+医疗”示范应用新模式,针对医疗领域个性化医疗器械、康复器械、植入物、软组织修复等需求,推动完善个性化医用增材制造产品在分类、临床检验、注册、市场准入等方面的政策法规,研究确定医用3D打印产品及服务的医疗服务项目收费标准和医保支付标准。同时,建立完善增材制造标准体系、检测和认证体系,以及人才培养体系。
3.2 标准化工作推动中国3D打印产业发展3D打印的产业化及应用面临最大的发展瓶颈问题是标准制定没有跟上,国家通过相关政策支持,进一步推动3D打印标准化工作。在国家标准化管理委员会推动下,联合相关政府部门、3D打印领域科研机构、高校、企业等成立了全国增材制造标准化技术委员会(SAC/TC 562),启动了术语和定义、文件格式、工艺和材料分类、测试方法等方面6项国家标准的制定,实现了中国3D打印领域重要基础标准的突破。下一步,结合国际增材制造标准化体系、发挥标准化技术委员会作用的基础上,进一步完善通用基础、专用材料、工艺及装备、软件、部件、成形件、检测评估、技术服务等方面的增材制造综合标准化体系。2016年9月,国家发改委批复湖南华曙高科技有限责任公司为增材制造国家工程实验室,强化3D打印技术研究、标准研制、成果转化,为3D打印产业化发展提供支撑。工业和信息化部等部门在《增材制造发展行动计划(2017—2020年)》中明确提出健全增材制造标准作为重要的支撑体系,加快国家标准、行业标准的制定,研制一批团体标准,完善企业成套技术标准,助推企业研发能力和创新能力提升,并积极参与国际标准制定。3D打印技术涉及多学科、多领域、技术交叉融合,标准制定存在一定困难,在制定和完善中国增材制造标准时,应围绕3D打印技术的特点,特别是医疗应用领域的特点,制定适合中国产业结构的3D打印标准和体系。同时,对适合中国增材制造产业特点的国际标准进行跟踪与及时转化,并积极参与国际相关标准的制修订活动,推动3D打印技术的快速发展和应用。
3.3 3D打印医疗器械注册技术规范为市场准入开辟通道3D打印医疗器械的临床使用一直受到法规政策的限制,各个国家都没有相关的标准进行审批注册,大部分3D打印产品主要包括肿瘤、器官模型及手术导板等临床辅助产品,只需要备案,不在审批注册严格监管范围内。2017年,美国食品和药品管理局(FDA)发布了《3D打印医疗器械技术指导意见》,以规范相关产品的生产制造活动,明确了医疗产品的增材制造流程和相关检测的操作规范[18],如图 2所示,对3D打印的方法、设计、工作流程,制造工艺、材料控制、后处理、测试以及质量管理等基本流程提出了具体技术要求,为3D打印医疗器械审批注册提供了依据,为产品市场准入开辟了通道。
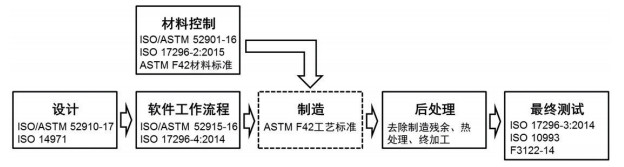 | 图 2 3D打印医疗器械的基本流程 Figure 2 Basic flow of 3D printing medical devices |
2018年2月,国家食品药品监督管理总局(CFDA)发布了《定制式增材制造医疗器械注册技术审查指导原则》的征求意见稿,明确了注册审批相关操作和资料要求,对3D打印产品的用途、产品性能、临床试验、质量管理等提出了具体要求,特别强调了医工交互的条件与能力确认,对3D打印医疗器械的生产和验证过程,包括对打印设备、工艺、后处理、原材料和最终产品的测试要进行严格控制,对于设计开发、产品交付、产品使用的人员资质与能力进行确认,保障3D打印产品在临床的安全、有效使用,此外,强调在产品全生命周期中要对患者的健康状况建立数据库,评价器械的耐久性以及医疗事故的追溯性[24]。该审批注册规范的出台意味着中国医疗领域3D打印行业即将拥有正式的技术审查指导原则,为3D打印医疗器械注册、审批、上市扫除障碍。
3.4 培训体系提供3D打印人才保障美国国家增材制造创新研究所负责3D打印的技术研究、人才培训和产业应用,已成功培训了7000多名3D打印领域的专业技术人员,形成了完善的3D打印人才培训体系[4]。2018年,中国人力资源和社会保障部正式出台3D打印造型师全国计算机信息高新技术考试制度,建立了中国首个国家级面向3D打印人才培训的考试体系,为3D打印产业发展奠定了人才培训基础,尤其是对于3D打印医疗器械在设计、制造、使用过程中技术人员与其岗位相适应的能力培训与鉴定提供了保障。3D打印人才培训体系的完善,将为行业提供高素质的3D打印技术和产业发展人才。
4 展望 4.1 3D打印医疗器械遵守3D打印通用标准3D打印技术在医疗领域的快速发展离不开3D打印技术本身的进步,更离不开整个行业相关标准的统一。自ASTM和ISO就ASTM F42和ISO/TC261共同制定增材制造标准签订正式协议后,标志着两大国际标准组织将共同制定统一的3D打印通用标准。在中国,大部分的医疗器械企业自身没有资源制定相关的3D打印标准,国家层面也尚未出台医疗器械相关的3D打印标准,全国增材制造标准化技术委员会的标准化工作也才刚起步,3D打印通用标准将为整个行业提供一种通用语言,来指导这些企业完成相关产品的研发、制造与审批注册,进而进入市场,国家在制定行业或者国家标准时也应借鉴先进的国际通用标准。在两大国际组织的协同下,3D打印通用标准已基本形成体系,是3D打印行业发展的基础标准,中国3D打印医疗器械产业的发展也将遵循该通用标准。
4.2 3D打印医疗器械应用标准制定充分考虑行业特点医疗行业属于特殊的应用领域,对于3D打印材料的物理化学特性、工艺流程、软件等提出了不同的需求,尤其对材料与产品的生物兼容性提出了更为严格的要求,因此,仅完善材料和工艺流程的通用标准是不够的,必须结合医疗行业的特点制定专门的应用标准,尤其对于亟待解决的临床实际问题进行有针对性的标准制定。同时,建立3D打印医疗器械材料与产品性能的检测体系,系统化评价其机械、化学、物理性能以及生物相容性,确保产品的安全性和有效性,更好地推动3D打印技术在医疗领域的广泛应用。
4.3 审批注册指导原则等规范为市场准入提供依据国家食品药品监督管理总局(CFDA)将3D打印骨科植入物列入《需进行临床试验审批的第三类医疗器械目录》[25],进一步发布了《定制式增材制造医疗器械注册技术审查指导原则》,加强3D打印医疗器械应用于临床的过程验证,包括材料的性能检测,临床数据采集处理,加工过程控制,质量管理等环节,通过规范化的审批注册流程确保3D打印产品安全、有效的进入临床使用,将是中国3D打印医疗器械制造企业在产品准入市场过程中遵循的重要法规规范。
5 结论当前,全球范围内正在迎来新一轮科技革命和产业革命,制造模式、消费模式等开始重塑,世界各国纷纷将3D打印技术作为未来制造业发展新的增长点,通过3D打印技术实现个性化商品与服务的产生,利用先进信息与通信技术的制造系统的开发与实施,将会激发社会创新并提升其劳动竞争力,同时,推动3D打印技术与互联网、新材料、人工智能等新技术加速融合,3D打印将迎来巨大的发展机遇。
党的十九大提出,现在已经进入中国特色社会主义的新时代,社会主要矛盾和奋斗目标已经改变,发展路径要从跟随型追赶战略转变为领先型创新战略,加快发展先进制造业,推动3D打印等先进技术与制造业深度融合,尤其是在医疗领域的产业化和推广应用,是突破制造业重点领域关键技术实现产业化的重要途径。
| [1] |
朱艳青, 史继富, 王雷雷, 等. 3D打印技术发展现状[J]. 制造技术与机床, 2015(12):50-57. Zhu Yanqing, Shi Jifu, Wang Leilei, et al. Current status of the three-dimensional printing technology[J]. Manufacturing Technology & Machine Tool, 2015(12):50-57. |
| [2] | Wong K V, Hernandez A. A review of additive manufacturing[J]. ISRN Mechanical Engineering, 2012, 2012:1-10. |
| [3] |
王灿友, 苏秦, 李涤尘. 3D打印标准化探究[J]. 信息技术与标准化, 2015(12):18-21. Wang Chanyou, Su Qin, Li Dichen. Discussion on standardization establishment of 3D printing[J]. Information Technology & Standardization, 2015(12):18-21. |
| [4] |
余冬梅, 张建斌. 3D打印:定制化医疗修复[J]. 金属世界, 2016(1):21-28. Yu Dongmei, Zhang Jianbin. 3D printing:customized medical repair[J]. Metal World, 2016(1):21-28. |
| [5] |
邓滨, 欧阳汉斌, 黄文华. 3D打印在医学领域的应用进展[J]. 中国医学物理学杂志, 2016, 33(4):389-392. Deng Bin, Ouyang Hanbin, Huang Wenhua. Application progress of three-dimensional printing in medical field[J]. Chinese Journal of Medical Physics, 2016, 33(4):389-392. |
| [6] |
罗丽娟, 余森, 于振涛, 等. 3D打印钛及钛合金医疗器械的优势及临床应用现状[J]. 生物骨科材料与临床研究, 2015, 12(6):72-75. Luo Lijuan, Yu Sen, Yu Zhentao, et al. The advantage and clinical application of titanium medical devices prepared by 3D printing[J]. Orthopaedic Biomechanics Materials and Clinical Study, 2015, 12(6):72-75. |
| [7] |
王微. 3D打印生命阶梯, 我们走到哪一步了[J]. 科技导报, 2016, 34(13):9-9. Wang Wei. 3D printing life ladder, Which step do we have arrived[J]. Science & Technology Review, 2016, 34(13):9-9. |
| [8] |
孙小磊, 汪缨, 张晖, 等. 3D打印技术在临床中的应用现状及展望[J]. 中国医疗设备, 2017, 32(1):99-102. Sun Xiaolei, Wang Ying, Zhang Hui, et al. Clinical application status and prospect of 3D printing technology[J]. China Medical Devices, 2017, 32(1):99-102. |
| [9] |
管吉, 杨树欣, 管叶, 等. 3D打印技术在医疗领域的研究进展[J]. 中国医疗设备, 2014, 29(4):71-72, 135. Guan Ji, Yang Shuxin, Guan Ye, et al. Research progress of 3D printing technology in medical domain[J]. China Medical Devices, 2014, 29(4):71-72, 135. |
| [10] | Conese M. Bioprinting:A further step to effective regenerative medicine and tissue engineering[J]. Advancements in Genetic Engineering, 2014, doi:10.4172/2169-0111.1000e112. |
| [11] |
韩倩宜, 李淑萍, 肖雄夫, 等. 3D打印技术在植入式医疗器械中的应用[J]. 科技导报, 2017, 35(2):72:79. Han Qianyi, Li Shuping, Xiao Xiongfu, et al. 3D printing:The application in medicine devices[J]. Science & Technology Review, 2017, 35(2):72-79. |
| [12] |
赖炎鑫, 朱鹏志."3D打印"在医疗器械领域中的现状及前景展望[J]. 中国医疗器械信息, 2017(10):112-114. Lai Yanxin, Zhu Pengzhi. Clinical application status and prospect of 3D printing in medical device[J]. China Medical Device Information, 2017(10):112-114. |
| [13] |
蒋海洪, 李晓. 对3D打印医疗器械管理的政策建议[J]. 科技导报, 2017, 35(14):11-12. Jiang Haihong, Li Xiao. Policy suggestions on the management of 3D printing in medical devices[J]. Science & Technology Review, 2017, 35(14):11-12. |
| [14] |
钟新周, 聂婷, 陈玲, 等. 发展3D打印医学产品的问题与对策[J]. 经济研究导刊, 2016(8):57-58. Zhong Xinzhou, Nie Ting, Chen Ling, et al. Problems and countermeasures of developing 3D printing medical products[J]. Economic Research Guide, 2016(8):57-58. |
| [15] | ASTM. Committee F42 on additive manufacturing technologies[EB/OL].[2018-03-16]. https://www.astm.org/COMMITTEE/F42.htm. |
| [16] | ISO. Standards catalogue:ISO/TC261 Additive manufacturing[EB/OL].[2018-03-16]. https://www.iso.org/committee/629086/x/catalogue/. |
| [17] | SASAM. Additive Manufacturing:SASAM standardisation roadmap[R]. AM Platform, 2015. |
| [18] | FDA. Technical considerations for Additive Manufactured medical devices[S]. Food and Drug Administration, 2017. |
| [19] | Fitzgerald S. FDA approves first 3D-printed epilepsy drug experts assess the benefits and caveats[J]. Neurology Today, 2015, 15(18):26-27. |
| [20] | 工业和信息化部. 关于印发《国家增材制造产业发展推进计划(2015-2016年)》的通知(工信部联装[2015] 53号)[EB/OL]. (2015-02-11)[2018-03-16]. http://www.miit.gov.cn/n1146295/n1652858/n1652930/n3757018/c3763342/content.html. |
| [21] | 国务院. 国务院关于印发《中国制造2025》的通知(国发[2015] 28号)[A/OL]. (2015-05-08)[2018-03-16]. http://www.gov.cn/zhengce/content/2015-05/19/content_9784.htm. |
| [22] | 陕西省工业和信息化厅. 国家增材制造创新中心(筹)落户陕西[EB/OL]. (2017-01-04)[2018-03-16]. http://www.sxgxt.gov.cn/zwhd/36501.jhtml. |
| [23] | 工业和信息化部. 十二部门关于印发《增材制造产业发展行动计划(2017-2020年)》的通知(工信部联装[2017] 311号)[A/OL]. (2017-11-30)[2018-03-16]. http://www.miit.gov.cn/n1146290/n4388791/c5956898/content.html. |
| [24] | 国家食品药品监督管理总局医疗器械技术审评中心. 关于对《定制式增材制造医疗器械注册技术审查指导原则》(征求意见稿)公开征求意见的通知[EB/OL]. (2018-02-26)[2018-03-16]. http://www.cmde.org.cn/CL0004/6954.html. |
| [25] | 国家食品药品监督管理总局. 国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号)[A/OL]. (2014-08-25)[2018-03-16]. http://www.sda.gov.cn/WS01/CL0087/105374.html. |
