1 全球首个自体细胞“CAR-T”疗法获批上市
2017年8月30日,诺华公司CAR-T(嵌合抗原受体T细胞)疗法Tisagenlecleucel(CTL019,商品名:Kymriah,研发历程见图 1)获美国FDA批准上市,用于治疗25岁以下急性淋巴细胞白血病(ALL)的复发或难治性患者,成为全球首个上市的自体细胞CAR-T疗法。Kymriah的上市具有里程碑式的意义,标志着CAR-T细胞疗法的疗效、安全性和整个商业化流程获得了FDA的正式认可,部分肿瘤患者迎来了全新的“活细胞治疗药物”,同时对其他细胞疗法(如工程化自体TCR-T〔嵌合型T细胞〕、工程化自体干细胞等)也将产生积极的推动作用,将加速更多细胞治疗药品的上市,以造福更多肿瘤及其他棘手疾病的患者。
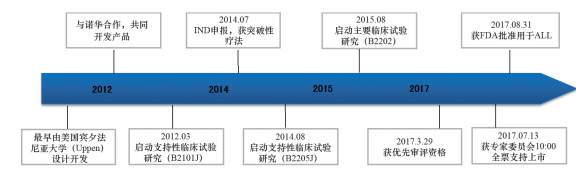 | 图 1 诺华Kymriah的研发历程(2012—2017) |
肿瘤免疫治疗是指直接或间接利用人体免疫系统对肿瘤患者进行有效治疗的方法,主要包括肿瘤疫苗、免疫检查点抑制剂、细胞免疫治疗以及细胞因子类等。备受关注的细胞免疫治疗已从早期的LAK(淋巴因子激活的杀伤细胞)、TIL(肿瘤浸润淋巴细胞)、CIK(多种细胞因子诱导的杀伤细胞)及CTL(细胞毒性T淋巴细胞)等传统或非特异性细胞疗法,发展到特异性的CAR-T和TCR-T等细胞疗法[1]。
肿瘤免疫治疗最早可追溯到1891年外科医生William Coley用细菌治疗肿瘤的试验。之后随着人们对肿瘤和人体免疫系统的深入认识和探索,在1984年,Steven Rosenberg等首次应用IL-2成功治疗黑色素瘤患者[2],给肿瘤免疫治疗带来新希望(肿瘤免疫治疗和CAR-T研发历程见图 2)。2011年,首款免疫检查点抑制剂抗人CTLA4抗体Ipilimumab(商品名:Yervoy)在美国获批上市,用于治疗晚期黑色素瘤。2014年,FDA相继批准两款PD-1抗体(商品名:Opdivo和Keytruda)用于黑色素瘤等实体瘤的治疗,正式揭开肿瘤免疫治疗大幕。2017年,伴随着全球首个CAR-T疗法——Kymriah的上市,活细胞作为一种全新的药物形式用于肿瘤治疗,预示着肿瘤免疫治疗经历百年发展终成“主角”。
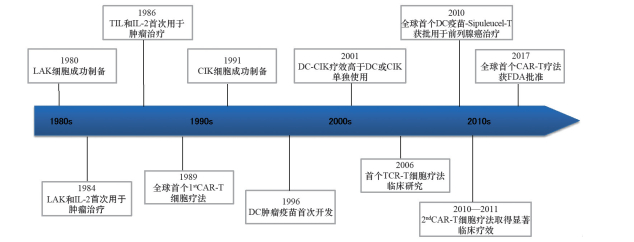 | 图 2 肿瘤免疫治疗和CAR-T研发历程 |
CAR-T疗法是将患者T淋巴细胞通过基因工程改造,使其表达肿瘤特异性的嵌合抗原受体(CAR)基因,被“重编码”的T淋巴细胞在体外大量培养、扩增后回输患者,以主要组织相容性分子(MHC)非依赖地方式识别和杀伤肿瘤。自1989年以色列科学家Zelig Eshhar设计开发的第一个CAR-T至今,CAR-T已经历近30年的发展历程,而围绕肿瘤靶点、单链抗体选择以及CAR结构优化等相关问题也已取得初步确定性进展[3]。Kymriah作为全球首个靶向CD19上市的CAR-T产品,用于B细胞相关血液肿瘤已呈现确切疗效,同时靶向CD20、CD22和CD30等抗原的CAR-T疗法的研究将逐渐把CAR-T应用于更广泛的血液肿瘤上。实体肿瘤由于肿瘤特异性抗原的缺乏和免疫抑制肿瘤微环境的存在,使得CAR-T在实体瘤中的研究略显缓慢,然而,目前靶向实体肿瘤抗原GPC3、EGFRvIII和PMSA等CAR-T疗法也已取得一定的临床进展,但广泛临床应用仍需不断的探索和研究[4]。
值得注意的是,在Kymriah的上市说明书中,FDA将细胞因子释放综合症(CRS)列为黑框警告,并注有风险评估、减轻策略以及解决方案(罗氏IL-6R单抗)。作为一种全新的活细胞治疗药物,细胞因子风暴(CRS)和脱靶效应是CAR-T疗法的主要安全问题,而“双抗原”(dual-antigen)和“开关”(switch on/off)CAR-T可能成为解决CAR-T安全性问题的主要备选方案。“双抗原”CAR结构的基本原理是第2个CAR可抑制或增强激活信号,使得T淋巴细胞对肿瘤细胞的识别具有“双保险”,增强特异性,降低脱靶效应[5],而“开关”结构是通过添加自杀基因或调节体内抗体或小分子浓度来控制CAR-T工作与否或强度,提高安全性[6],目前相关临床研究已广泛开展,但临床应用尚在探索过程中。
此外,Kymriah是采用自体细胞1对1的回输进行治疗,因此如何确保细胞制备成功,保证患者得到必要治疗是重中之重的问题。相比之下,异体CAR-T(T细胞来源于捐赠者)疗法看似更具优势,目前已有异体CAR-T产品获FDA批准开展临床研究(NCT03203369),用于急性骨髓性白血病(AML)和母细胞性浆细胞样树状突细胞肿瘤(BPDCN)的治疗。
4 中国跻身全球CAR-T研发第一梯队全球范围来看,CAR-T的火热进展不仅吸引了业内研究者,也引来包括Juno、Kite、Cellectis等Start up公司以及诺华、辉瑞、GSK和近期以119亿美元高价买入Kite的吉利德等大型制药公司的驻足。宾夕法尼亚大学、费城儿童医院、美国癌症研究院、福瑞德·哈金森(Fred Hutchinson)癌症研究中心、斯隆凯特琳癌症中心、安德森癌症中心和西雅图儿童医院等是最早开展CAR-T细胞治疗的研究机构,适应症主要以血液肿瘤为主,CD19是研究最火热的靶点,诺华、Juno和Kite公司均有靶向CD19-CAR-T疗法的主打产品。
国内范围看,CAR-T是为数不多的中国不落后于西方国家的医药研发领域。在ClinicalTrials.gov网站上以“CAR-T”为关键词进行检索(CAR-T全球临床试验备案情况见图 3),截至2017年10月7日,国内已备案的临床研究为139例,仅次于美国的144例,适应症以实体瘤居多,其中代表性研究机构为解放军301医院、重庆西南医院、上海交通大学附属仁济医院和复旦大学附属肿瘤医院等,代表企业为西比曼、科济生物、博生吉和南京传奇等初创公司。
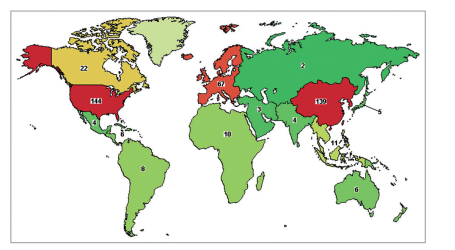 | 图 3 CAR-T全球临床试验备案情况(clinical trials. gov) |
在实体瘤CAR-T研究中,GPC3(磷脂酰肌醇蛋白聚糖3)和MUC1(粘蛋白1)是国内热点研究的靶标,适应症主要为肝癌、肺癌等实体肿瘤。科济生物于2015年开展全球首个靶向GPC3-CAR-T疗法[7],用于复发或难治性肝癌的治疗,目前已取得初步临床结果(来自2017年AACR会议信息)。MUC1虽表达于多种正常上皮细胞,但在肿瘤细胞中呈异常糖基化(Tn-MUC1)和结构改变。2007年,John Maher等首次证明MUC1可作为CAR-T疗法的研究靶点[8]。2016年Carl June等发现靶向Tn-MUC1的CAR-T细胞呈现“靶点特异性”的肿瘤杀伤作用,异常糖基化抗原可能是CAR-T疗法的理想靶标[9]。目前MUC1-CAR-T疗法已有6项临床试验备案,注册机构均来自国内,博生吉公司是最早(2015年临床备案)开展相关研究的企业。
在血液肿瘤研究中,BCMA(B细胞成熟抗原)可能是除CD19和CD20之外较具前景的靶点之一,且BCMA-CAR-T已在多发性骨髓瘤(MM)中呈现优异临床疗效。在2017年6月的AS-CO会议上,国内企业南京传奇披露了其研发的一款BC-MA-CAR-T在MM中的临床进展:客观缓解率达100%(35例),近一半患者取得完全缓解。目前已备案BCMA-CAR-T临床试验美国11项,中国8项,国外领先企业蓝鸟已于今年10月启动其第2款BCMA-CAR-T疗法临床试验。
此外,专利保护将成为CAR-T上市和产业化必将面临的一个问题,据粗略计算,CD28-CD3、4-1BB-CD3载体专利到期时间最早为2023和2032年。中国企业虽在抗体选择、靶点和实体瘤的CAR-T研发中呈一定领先优势,但CAR结构大多为沿用国外已有结构,创新性尚存在不足。因此,如何规避和突破专利可能是未来中国CAR-T企业推进产业化进程的努力方向。
5 结语在过去10年时间里,以CAR-T细胞疗法和免疫检查点抑制剂为代表的免疫疗法发展迅速,其确切疗效不仅吸引业内人士的目光和驻足,各国政府也相继为肿瘤免疫治疗开启绿灯。2015年美国总统奥巴马在国情咨文中宣布政府将投资2.15亿美元重点支持精准医疗发展(包括肿瘤免疫治疗和基因测序)。2017年,FDA给予Kymriah(2014年曾获突破性疗法)优先审评通道,上市之路可谓顺风顺水。2016年,中国在“十三五”规划纲要中,将精准医疗提升到国家战略,先后出台《“十三五”健康产业科技创新专项规划》等一系列重大政策,大力支持基因测序、肿瘤免疫治疗、细胞治疗等关键技术的发展及应用。目前,中国虽未见CAR-T产品的上市申报,但相关药品注册审评审批部门正在积极准备,迎接国内首个CAR-T疗法的申报。
作为一种新兴的精准、再生医学治疗手段,CAR-T疗法的应用空间和市场前景是非常值得我们想象的,但是作为一种自体工程化活细胞药物,其安全性相关的诸多问题仍亟待解决和优化:肿瘤特异性抗原的筛选和鉴定,CAR-T疗法靶向性和安全性的问题,临床不良反应的预防、监测和治疗,细胞生产、储存和运输环境及标准的建立等。这些方向无疑将成为我们未来努力的方向。
| [1] | Wang Z, Wu Z, Liu Y, et al. New development in CAR-T cell therapy[J]. Journal of Hematology & Oncology, 2017, 10(1): 53. |
| [2] | Rosenberg S A, Lotze M T, Muul L M, et al. Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer[J]. New England Journal of Medicine, 1985, 313(1): 1485-1492. |
| [3] | Srivastava S, Riddell S R. Engineering CAR-T cells: Design concepts[J]. Trends in Immunology, 2015, 36(8): 494-502. |
| [4] | Kakarla S, Gottschalk S. CAR T cells for solid tumors: Armed and ready to go[J]. Cancer Journal, 2014, 20(2): 151-155. |
| [5] | Jones B S, Lamb L S, Goldman F, et al. Improving the safety of cell therapy products by suicide gene transfer[J]. Frontiers in Pharmacology, 2014, 5(524): 254. |
| [6] | Seton-Rogers S. Immunotherapy: Two antigens are better than one[J]. Nature Reviews Cancer, 2016, 16(3): 128-129. |
| [7] | Gao H, Li K, Tu H, et al. Development of T cells redirected to glypican-3 for the treatment of hepatocellular carcinoma[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2014, 20(24): 6418-6428. |
| [8] | Wilkie S, Picco G, Foster J, et al. Retargeting of human T cells to tumor-associated MUC1: The evolution of a chimeric antigen receptor[J]. The Journal of Immunology, 2008, 180(7): 4901-4909. |
| [9] | Posey A D, Schwab R D, Boesteanu A C, et al. Engineered CAR T cells targeting the cancer-associated Tn-glycoform of the membrane mucin MUC1 control adenocarcinoma[J]. Immunity, 2016, 44(6): 1444-1454. |
文/郑洪丽,林欣
作者简介:郑洪丽,清华大学医学院,博士后;林欣,清华大学医学院,教授。
(责任编辑 王丽娜)