2. 南京卡迪奥密生物技术有限公司,南京211106
3. 江苏省人民医院肿瘤科,南京210029
4. 山东大学医学院,济南250100
5. 江苏省南京高新生物医药公共服务平台有限公司,南京210032
2. Nanjing Cardiomicx Inc, Ltd., Nanjing 211106, China
3. Department of Oncology, Jiangsu Province Hospital, Nanjing 210029, China
4. Medical College, Shandong University, Jinan 250100, China
5. Nanjing Biopharmaceutical Innovation Platform Co., Ltd., Nanjing 210032, China
2011年,美国国家科学院在“迈向精准医疗:构建生物医学研究知识网络和新的疾病分类体系”报告中,对“精准医疗(precision medicine)”的概念和措施做了系统的论述[1]。报告探讨了一种新的疾病命名的可能性和方法,该方法基于导致疾病的潜在的分子诱因和其他因素,而不是依靠传统的病人症状和体征。报告建议通过评估患者标本中的组学(omics)信息,建立新的数据网络,以促进生物医学研究及其与临床研究相整合。美国总统奥巴马在2015年1月20日的国情咨文中正式将“精准医疗计划”作为美国新的国家研究项目发布,致力于治愈癌症和糖尿病等疾病,让每个人获得个性化的信息和医疗,从而“引领一个医学新时代”。此举措很快得到了美国政府研究机构和医学界的热烈响应[2, 3],当然也包括来自医学界和社会的争议。
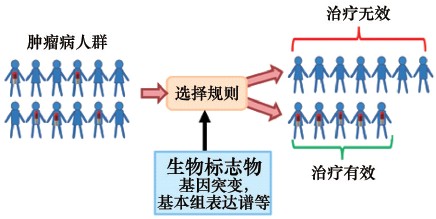
1 精准医疗与个体化医疗1.1 定义什么是精准医疗(又称精确医学),其与通常所讲的个体化医疗(personalized medicine)又是什么关系?精准医疗就是与患者分子生物病理学特征,如基因组信息,相匹配的个体化诊断和治疗策略。个体化医疗利用诊断性工具去检测特定的生物标志物,尤其是遗传性标志物,然后结合患者的病史和其他情况,协助决定哪一种预防或治疗干预措施最适用于特定的患者。通俗地讲,个体化医疗就是考虑患者本身的个体差异,药物治疗因人而异,为理想化的治疗。而精准医疗着眼于一组病患或人群(图 1),相对于个性化医疗针对个体病患的情况更为宽泛,更可行。两者有共同的内涵。也有医疗和研究机构将这两个概念放在一起,如杜克大学的“精准和个体化医疗中心”。
 | 图 1 精准医疗的核心 Fig. 1 Heart of precision medicine |
无论是个体化或精准医疗,都涉及到个性化和标准化两个理念的平衡,这是现代医学发展的必由之路。精准医疗的理念是把个体化预见性治疗建立在以分子生物学特征或指标为基础的标准化方法上的。虽然目前个性化或精准医疗的实践远落后于理论,但在医学界已创造了一种文化氛围或理念转变,即一种类型的药物适合于所有的病患(one sizefits all)的时代已经过去,没有什么治疗是常规的(there is nothing routine)。
“精准医疗”这个概念事实上已经存在多年,而且很早就在中国的中医实践中体现。中医对同一个病症可以有多个不同的药方,因为要考虑到每一个病人的不同体质类型、心理特征和环境情况等。另外,中医将人区分为柴胡人、半夏人等,也是基于病人的基本体质。而如何应用现代科学技术来解释中医这些个体化对症治疗的机制和基础,尤其在肿瘤精准医疗中的应用,则是一个非常有意义,也是极具挑战性的现代课题。
1.2 精准医疗的发展现代个体化医疗的时代始于21世纪初,紧随当时人类基因组计划(human genome project,HGP)的完成以及在Nature和Science 杂志上人类基因组信息的发表[4, 5]。此计划于1990年由美国能源部(DOE)和国家卫生研究院(NIH)启动。本文部分笔者所在的美国劳伦斯伯克利国家实验室(LBNL)是当时能源部进行人类基因组研究的主要基地之一。其中金健博士更是直接参与者,开发了第一代DNA测序技术。英国、日本、法国、德国和中国等相继加入此计划,于2003年成功完成了测定人类23对染色体的遗传图谱、物理图谱和约30亿个碱基对的DNA序列的目标,被称之为生命科学的“登月计划”。当时号召来自各行各业的科学家和科技特长者参与此计划,包括遗传学家和分子生物学家,和来自化学、物理、工程、生物信息和伦理学的科学家通力合作。人类基因组计划无疑是走向精准医疗的关键第一步。而今天的精准医疗的实现,也同样需要各类科学家和临床医生通力合作,应用和开发新的理念方法和技术。
精准医疗适合医学各个学科,但基于种种原因,目前肿瘤学科是实施和加强精准医疗的最佳选择领域之一。本文主要围绕肿瘤的精准医疗,对其概念、技术和未来进行综述。
2 肿瘤精准医疗的分子病理基础癌症是当今危害人类健康的主要疾病。在中国,癌症发生率正处于快速上升期,癌症已成为第一死因。人类癌症与环境因素息息相关,其通过基因组(genome)的异常改变而发生和演变,使细胞发生病理改变,导致肿瘤的无限生长和转移。
越来越多的证据显示,癌症是一种复杂和多样性疾病,患者可能表现出类似的症状,并具有相同的病理改变,却可能由完全不同的基因变化而造成。正因为这样的异质性(heterogeneity)(图 2),病理同类型癌症患者对目前可用药物的反应率差别很大。比如对传统的放疗和化疗,患者可能有数种截然不同的反应(图 3)。总而言之,某一特定治疗往往只有一部分肿瘤患者有反应,而问题的关键是我们无法预知哪些患者会受益。因为无法在治疗前判断不同肿瘤个体对药物的敏感性和耐药性,许多患者往往遭受不必要的和(或)损害性大(副作用)的治疗。由此肿瘤精准治疗的概念应运而生。
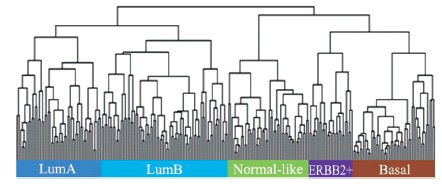 | 图 2 乳腺癌的异质性 Fig. 2 Heterogeneity of breast cancer 应用PAM50 将258 个乳腺癌人分为5 个分子类型 |
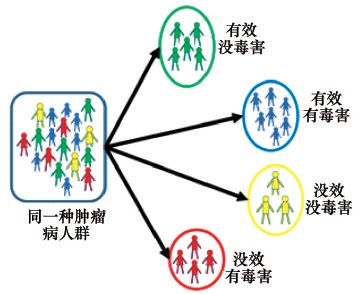 | 图 3 放疗和化疗的多样性反应 Fig. 3 Diverse responses to radiotherapyand chemotherapy |
可以说,目前肿瘤精准治疗的主要基础无疑是与肿瘤遗传相关的易感癌基因的发现和在分子水平对这些基因变化的检测,由此提供生物指标和信息,从而达到个体化和预见性的治疗。这些基因包括癌基因(oncogenes)和抑癌基因(tumor suppressor genes),而癌基因的激活和抑癌基因的失活是肿瘤发生的关键因素。目前发现的癌相关基因已超过400个。毛建华等也发现了数个癌相关基因和其功能,如AURORA-A[6]、FBXW7[7]、HIPK2[8]和PTEN[9]等,其中有的已经被应用于临床实践,如FBXW7。在肿瘤发生和发展的不同阶段,这些癌相关基因的突变(mutation)、扩增(amplification)和过度表达(overexpression)以及抑癌基因的缺失(loss)和低表达(low expression)等形式特征变化与肿瘤的发生、演进和转移密切相关。每个肿瘤都与特定癌基因的突变和相关信号通路的异常相关联(图 4),而这些信息是用来确定药物治疗靶点和干扰通路的基础,如同时应用IGF-1R和ALK抑制剂的联合靶向治疗,有效提高了对含有ALK融合基因的肺癌治疗效果[10]。近年来靶向治疗(targeted therapy)已经在很多医院开展,多个靶向治疗癌症药物已经在美国和欧洲上市,还有很多正处于临床试验阶段。而很多这种靶向治疗或药物都伴随有相应的分子生物学标志,即伴随生物标志物(companion biomarker),或相关配套诊断试验,以确定病人对药物反应或发生副作用的可能性[11]。
 | 图 4 EGFR/RAS 通路及其相应的靶向抗癌药物 Fig. 4 EGFR/RAS pathway and corresponding targetedanticancer drugs |
目前支持个体化或精准医疗的理论和实践基础就是个体间在分子遗传上的差异,后者被认为是人类疾病易感性和药物反应的决定性因素。早期的例子充分证明了遗传与肿瘤精准医疗的关系:靶向抗癌药物吉非替尼(Iressa)和厄洛替尼(Tarceva)最初上市时,在肺癌患者中应用的药品副作用虽较化疗有很大提高,但药效并不是非常显著,仅仅作为肺癌治疗的二线药物。但其后发现在携带EGFR 特定基因突变的肺癌患者中,吉非替尼和厄洛替尼治疗效果优异,现在已成为临床治疗这类患者的一线标准治疗药物。这证明了肿瘤基因突变与药物和治疗反应的相关性,而根据基因突变的信息和组合来决定患者的靶向治疗方案是精准医疗的大方向。
近年来,毛建华等[7]研究结果也显示了肿瘤基因突变状态以及在靶向治疗上的成功应用。他们首先发现了FBXU7为P53依赖性肿瘤抑制基因,而其功能意义在于与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)结合并使之降解。现有研究表明,mTOR在细胞的增殖、生长、分化和凋亡过程中起着中心调控点的作用。毛建华等[12]发现FBXW7在多种人类肿瘤中发生突变和/或缺失,并使肿瘤细胞系对雷帕霉素治疗特别敏感。正是利用此特性,匹兹堡大学肿瘤所的医生们应用雷帕霉素成功治疗了一位具FBXW7突变的肺癌患者[13]。此患者为EGFR和ALK野生型,应用雷帕霉素前多种特异性疗法均无法阻止其肿瘤的进展。
3 精准医疗相关技术正如它的名称所示,精准医疗需要精准的诊断工具和相应的标准,例如遗传测试、鉴定与疾病相关的药物靶点(图 4),影像分析和选择合适的患者做临床试验。笔者认为所有能够满足临床上进行个体化治疗且提高疗效,减少副作用的方法和技术都可以划为精准医疗的范畴,因而适用于精准医疗的方法和技术并没有什么限定。从方法学上来讲可分为间接的和直接的两大类(图 5)。间接方法是指由基因(生物标记)检测及诊断并通过统计/数学信息模型选择治疗方案,生物大数据和知识背景是此方法的奠基。目前处于大数据年代,此方法也讨论的最多;直接方法是指将患者肿瘤细胞或组织通过2D 细胞培养或3D 组织或类器官培养(3D organoid culture)或病人源性异种移植(patient- derivedxenograft,PDX)模型来进行抗癌药物的直接筛选从而选择最佳治疗方案。
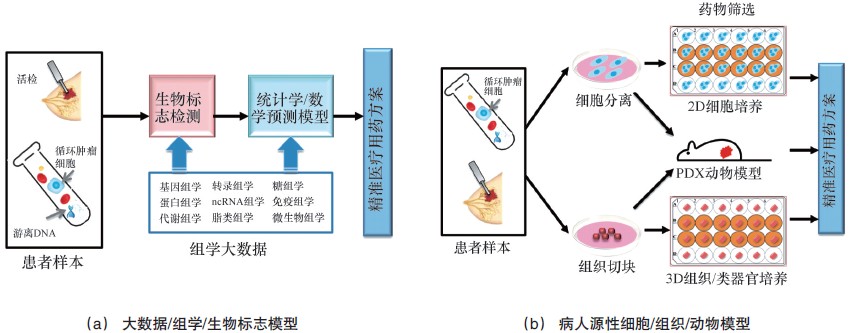 | 图 5 间接的和直接的适用于精准医疗的方法和技术 Fig. 5 Direct and indirect methodologies and technologies for precision medicine |
近几年来循环肿瘤细胞(circulating tumor cell,CTCs)和游移DNA(cell-free DNA)的发现和应用为肿瘤无创诊断、精准治疗和实时疗效监控等方面提供了更便捷的途迳。目前仍然迫切需要研发可以被用来更好地预测癌症患者对药物反应(敏感性或抗药性)的新方法和新技术。
3.1 生物大数据和信息库近年来肿瘤分子病理、基因检测等现代分子生物学领域的进展颇丰,临床数据的采集和积累也突飞猛进,但对这些数据的挖掘、评估、整合和应用还亟待加强。可喜的是生物信息技术方面突飞猛进的发展,特别是在各种组学方面,为我们提供了前所未有的机会去进行大数据处理来认识肿瘤的遗传特征和发病分子机理,并对癌症的个体性预防或治疗带来准确且强大的指导。下面介绍两个具有重要意义的癌症基因组研究计划:
1)癌症基因组图谱(the cancer genome atlas,TCGA)项目。该项目于2006年启动,任务是创制33种不同癌症基因和分子变化的综合全景图,以对癌症生物学、发病分子机理和治疗获得更好地了解。此“10000个癌症基因组计划”已宣告完成。在数据生成方面,该项目已经取得无可争议的成功。
2) 国际癌症基因组联盟(international cancer genomeconsortium,ICGC)计划。该计划正联合各国科学家对癌症基因组开展研究,绘制较为完整的人类癌症基因图谱,包括50种不同类型的癌症,每种癌症500个标本,总共25000个癌症患者的基因图谱。从基因组学、表观遗传学、转录等方面分析癌症的发生发展,并希望得到所有与癌症相关的基因突变的图谱。在此计划中,中国负责胃癌的基因组测序,而美国负责脑癌、卵巢癌和胰腺癌等。
价值和意义:1)创立一个免费使用的基因组大数据。这将有助于加速癌症研究,比如笔者利用TCGA数据总结了12个癌基因在中国8大常见肿瘤中的突变率(图 6),可以清楚看出这些基因在不同癌症的突变情况以及不同基因在同一癌症的突变组合图谱。每种癌症都是不同的。就RAS 基因来说,在约30%的非小细胞肺癌、50%的结肠癌、10%的胃癌发现其突变激活;2)用于精准医疗。数据被用来将癌症基因组学和临床更好的整合,直接鉴定基因型—临床表型的相关性,开发更好的计算模型,从而选择最佳治疗方案;3)基因大数据用来寻找新的基因突变并开发相应的新药,即新的靶向治疗药。比如,治疗慢性髓样白血病的一线药物格列维克(Gleevec)为人类历史上第一个成功研制的小分子靶向药物并首个被批准应用于临床。此病的发生是由于两个不同的染色体断裂且重新配对形成所谓的“ 费城染色体”(Philadelphia chromosome),其结果是形成了BCR/ABL 融合基因及相应的具有高激酶活性的融合蛋白,构成疾病的重要发生机制。格列维克能够靶向抑制BCR-ABL,从而有效治疗此型白血病。另1例是几年前发现IDH1和IDH2基因在许多癌症发生突变,生物医药公司(包括诺华Novartis)开发了针对IDH1和IDH2突变的靶向治疗药物,现在已经处于临床试验阶段。
 | 图 6 12 个癌基因在中国8 大常见肿瘤中的突变率 Fig. 6 Mutation rates of 12 cancer genes in 8 common types of cancers in China |
主要包括基因组学(genomics)、蛋白组学(proteinomics)、代谢组学(metabolomics)、转录组学(transcriptomics)、RNA组学(RNomics)、脂类组学(lipidomics)、免疫组学(immunomics)和糖组学(glycomics)等。
毋庸置疑,基因组学或基因突变及其检测方法研究已成为生物学研究和临床精准医疗的热点和基础。癌相关基因变化的形式主要有点突变、小缺失、插入、染色体易位或逆转、杂合性丧失、扩增、甲基化及染色体非组蛋白改变等。精准医疗并不单纯是DNA测序,如针对人类表皮生长因子受体2(HER-2)状态的检测方法包括传统免疫组化和荧光原位杂交(FISH)。癌基因和抑癌基因的激活和失活有多种表现形式,其中基因产物过度表达为重要形式之一,可表现为mRNA和蛋白质量的增加,此外,基因扩增可表现为基因拷贝数的增加,这些基因表达的异常,均可加以检测并作为靶向药物的生物标志物(表 1)。
| 表 1 常用肿瘤靶向药物和相应的伴随生物标志物 Table 1 Common tumor-targeted drugs and theircorresponding companion biomarkers |
1)生物芯片技术(microarray)。把生物信息片段或成分打印在支持介质表面的微阵列杂交技术,可以说是产生大数据的首个高通量生物技术。现有的芯片包括DNA、RNA、蛋白质、糖分子、甲基化、细胞和组织等类型。随着第二代测序技术的问世,某些类型芯片如DNA芯片已逐渐被冷落,但因其技术和分析工具的成熟性,仍有临床精准医疗应用的价值。而且,此技术在生物感测器(biosensor)等方面的开发和应用前途无量。另外改造的液相芯片(见Panomics 和NanoString技术)为此技术增加了新的活力并可广泛应用于精准医疗。
2)第二代测序技术(next-generation sequencing,NGS)。一个能生成高达500千兆碱基数据(gigabases)的大规模平行测序技术。该技术是TCGA和ICGC绘制完整的人类癌症基因图谱的主要工具,可以检测单核苷酸变异、插入或缺失、拷贝数异常、结构变异、基因融合、甲基化及表达。第二代测序在科学和技术领域迅速获得认可,已成为一个重要研究平台。
图 7显示的是目前市场上的几个主要测序平台或仪器的代表。因为第二代测序的样品制备过程非常复杂并且生成的序列数据难处理,对将其应用于临床基因诊断带来许多障碍。
 | 图 7 市场上主要高通量第二代测序平台或仪器及其生产厂家 Fig. 7 Several major high-throughput nextgenerationsequencing platforms or instruments andtheir manufacturers currently on the market |
3)Panomics 技术。该技术是Luminex 公司研制出的后基因组时代技术平台,是在流式细胞技术、ELISA技术和芯片技术基础上开发出的液相芯片技术平台。它运用branchDNA信号放大技术捕获目标RNA信号,可进行3~80个基因的同时定量分析的大样本验证检测,效果特异、灵敏,可应用于肿瘤诊断、精准治疗和预后评估,尤其为复杂的多因性疾病诊断、制定个性化治疗方案提供了极大便利。如在乳腺癌个体化治疗靶标检测上的使用,通过检测乳癌组织中14种基因mRNA表达水平和CYP2D6基因的多态性,筛选最适合的化疗药物,确定适用的靶向药物。
4)NanoString技术。该技术是继生物芯片和二代测序技术后在基因表达谱分析上展示出强大应用前景的新液相芯片技术[14]。其核心技术是nCounter分析系统,是直接对基因表达进行多重计数的全新数字式技术,利用分子条形码和单分子成像来检测及统计每一个反应体系中特定转录本的数量,表现出极高的灵敏度、精确度和重复性。该技术无需使用酶,无需反转录,也不需要做PCR扩增,即可进一步减少误差的产生,因此nCounter在表达谱定量分析领域具有无可比拟的优势。应用领域包括基因表达谱研究(800个基因分析通量)、小RNA分析、拷贝数多样性分析和帮助二代测序进行后期验证。
3.3 病人源性直观抗癌药物筛选随着生物技术的发展和成熟,以及可靠的组学数据和临床数据的大量积累,上述的精准医疗间接方法得以在临床实施。但是由于此方法是基于生物标志物的发现及其在肿瘤发生中的功能及机理的认知,加上大数据基础上的关联模型的建立,因此在可靠性和重复性方面具有很大的挑战性,从而目前应用上有其局限性。鉴于上述原因,笔者提出了利用病人源性细胞和组织来直接筛选抗肿瘤药物的精准医疗方法理念,作为对组学方法的验证和扩展。尤其是通过病人源性3D组织或类器官培养和异种移植PDX模型进行抗癌药物的直接筛选已开始受到重视。
1)二维(2D)细胞培养。作为最早的药物筛选模型仍然被广泛使用于医药行业[15]。2D细胞培养技术可适用于各种类型的细胞,人类肿瘤细胞很适合于在人为控制的实验室条件生长和维护。然而,在含高水平血清的二维培养平皿中即便是原代细胞的培养,代表着一种过度简单化和脱离机体的生物学系统。这些细胞在保存其来源组织的基因型和表型等方面,具有其局限性。
2)体外组织培养(histoculture)。基本原理包括癌组织的活检、将活组织块在特定培养介质中三维生长、抗癌药物的加入和疗效评估[16]。后者可通过不同的肿瘤化疗药敏试验进行,如常见的四甲基偶氮唑盐比色法(MTT法)。此培养法能够保持肿瘤的组织病理和细胞微环境(microenvironment)等特性,更接近体内的环境生长条件,不失为一种快速、简易筛选抗癌药物的体外方法。
3)病人源性异种移植。它是直接将患者的临床癌症组织转移到裸鼠中建立的动物模型。肿瘤组织能保留患者完全相同的遗传和形态学的特征,为药物筛选和新药开发提供了很具预测力的个性化抗癌药物疗效检测平台。但此法周期长,成本昂贵,缺少关键的免疫因素影响,而且很难高通量[17]。
4)三维类器官培养(3D organoid culture)。肿瘤患者对抗癌疗法,如化疗的临床反应有很大的个体差异,其原因被认为除遗传差异和肿瘤异质性外,机体和肿瘤之间形成的微环境也很关键。越来越多的证据表明,肿瘤的发展和对治疗的反应是由肿瘤微环境进行调控的。在此领域中有不少研究显示细胞外基质(ECM)可作为人类癌症临床结果的预测。三维类器官培养模型近年来得到了生物医药界的关注[18]。部分笔者所在的劳伦斯伯克利国家实验室为乳腺癌类器官培养的发源地之一(图 8)[19]。与二维细胞培养的方法相比,三维类器官的组织结构与它们起源的组织样本高度相似。该模型具有基质结构和功能,后者能影响肿瘤组织和结构、治疗反应、多细胞耐药(MCR)和药物渗透等。尤其是该模型能提供肿瘤微环境,因此可以用来更加准确地筛选抗肿瘤等药物。
 | 图 8 小鼠乳腺3D 类器官培养 Fig. 8 3D organoid culture of mouse mammary glands |
另外,最近有报道,利用循环肿瘤细胞进行类器官培养以及药物反应试验[20]。虽然目前有一些类器官培养的报道问世,但其在临床上的应用受限于对培养类器官的精确定量和高通量的样本和数据处理[21]。有的研究已在进行这方面的尝试。总之,3D类器官肿瘤模型为临床提供了一条令人兴奋的新途径来制定精准医疗的方案。4 肿瘤精准医疗的展望
人类基因组图谱,包括癌症基因组图谱,对于癌症的精准医疗具有决定性意义。基因组学作为临床学科的时代已经来临。但也看到,虽然近几年来在肿瘤分子病理、基因检测等现代分子生物学领域的进展颇丰,临床数据的采集和积累也突飞猛进,但是将这些数据和成果以及它们的系统整合应用于医疗实践才刚刚开始,例如肿瘤靶向治疗伴随基因诊断的临床开展在中国还是远远不够的。基于目前的知识和已有的靶向治疗药物,笔者用国内发病率很高的非小细胞肺癌(NSCLC)为例,推荐一种在临床上可行的精准医疗实施方案(图 9)。
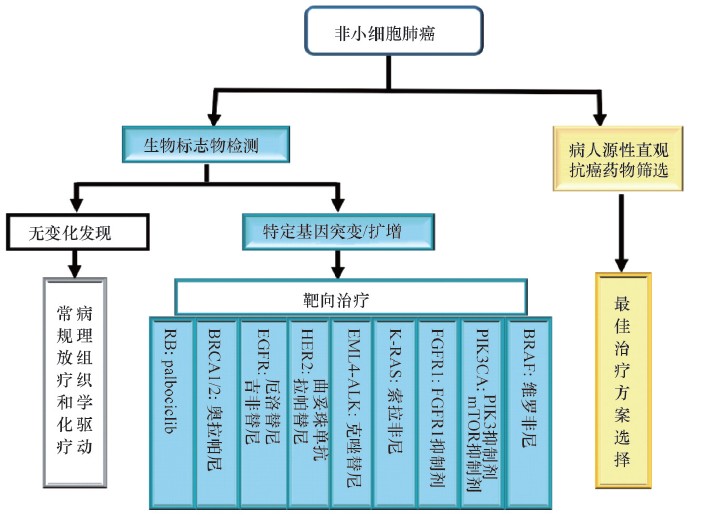 | 图 9 非小细胞肺癌精准医疗的可行性建议方案 Fig. 9 A suggested proposal on the feasibility of precision medicine of non-small cell lung cancer 已上市药物直接列出靶向药物名;对还没有获得批准的靶向药物,使用基因抑制剂 |
基因组测序新技术的发展会使测序更快、更高通量、成本更低,如第三代测序技术。另外,新技术的开发和最新进展将影响此领域的研究和应用,例如,基因组编辑工具(如CRISPR-Cas9)提供了前所未有的能力,以快速的、可扩展的和更具成本效益的方式,来研究遗传变异,而且有应用于临床治疗的潜能。
精准医疗的组学方法(即间接方法)紧密依赖于临床相关测试的标准化、数据管理和分析、相关模型的建立。因此从标本采集、实验操作程序、分析中质控、分析结果报告规范化,到诊断指标标准化,都需要建立完整的一系列的质量保证,这样才能对肿瘤的诊断和临床治疗方案的选择提供有意义的指导。否则,任何环节的差错都可能影响精准医疗的精确性。最近中国国家卫生和计划生育委员会发布的《肿瘤个体化治疗检测技术指南(试行)》就是为了实现以上所述规范化的目的。在某种程度上,直接方法程序简单直观,可以避免操作上误差,但也需要规范化。
精准医疗应该与精准预防、精准诊断、精准预后,甚至精准毒理等共同实施,因为它们是通过遗传特性有机结合在一起的。另外,肿瘤的治疗涵盖多学科多技术,如肿瘤免疫治疗,包括肿瘤疫苗、抗体导向治疗、CAR-T细胞疗法、免疫检验点疗法和小分子抑制剂等近年来备受关注,是继靶向治疗后肿瘤治疗领域的又一革新,对于未来的精准医学一定会有重要影响。由于受篇幅限制,本文不再详述。
在此认为有以下几点在精准和个体化医疗的有效实施中起关键性作用。
1)了解癌症发生的分子机制,决定哪种疗法或综合疗法可以应用,包括药物的联合,如前述的IGF-1R和ALK抑制剂的联合靶向治疗。
2)确定与癌症演变和对药物反应/复发相关的分子改变和相应的生物标志物。
3)寻找与药物安全和耐受相关的生物标志物,以便选择最安全的治疗方法和正确剂量。
4)鉴于癌症的复杂性(遗传突变的多样性和组合的多重性),寻找临床验证的合适人数是关键。药物效能可能仅仅在一类患者亚群中明显,而不是在所有人群中。
5)通过更好地了解有反应和无反应患者的分子生物学特性来拯救“失败”的药物。
6)组学数据的管理、临床资料的精确性以及检测程序的规范化。
随着生物高科技的突飞猛进,从精准医疗的技术层面来看,其在临床上的应用正日趋成熟。无可非议,精准医疗能提高临床治疗质量,降低医疗费用,如美国基因健康公司(Genomic Health Inc)的Oncotype DX多基因检测可确定乳腺癌患者是否需要接受化疗。因该技术能够大大降低医疗费用,而被美国保险公司接受为常规的临床检测。尽管精准医疗旨在为每位患者量身定制治疗方案,从而建立一个健康世界,医学界以及社会上对精准医疗仍存有争议,比如其对伦理,法律,财政以及社会问题的潜在影响。推广精准医疗的最大的挑战可能来自临床和保险业的接受性、个人信息保护和经济层面。美国医院和保险业对OncotypeDX检测的接受就花费了5年左右的时间。而一些低成本,对大众广泛有效的治疗措施仍然会是主要途经。
精准医疗的实施如何与中国的医疗体制改革体系相结合,例如在提升全民医疗福利、疾病早期诊断、合理配置医疗资源、有效控制医保费用等方面依然任重道远。精准医疗的光明前景需要患者、医疗服务人员、保险业者,甚至政府和投资人等利益相关者一起提高认识,共同努力。
| [1] | Pascal, Chris B. The history and future of the office of research integrity Scientific misconduct and beyond[J]. Science and Engineering Ethics, 1999, 5: 183-198. |
| [2] | Division of Public Health Service, Department of Health and Human Services. Responsibility of PHS awardee and applicant institutions for dealing with and reporting possible misconduct in science[Z]. 42 C. F. R. Part 50, 1989. |
| [3] | National Science Foundation. Misconduct in science and engineering: final rule[J]. Federal Register, 1991, 56: 22286- 22290. |
| [4] | Panel on Scientific Responsibility and the Conduct of Research, National Academy of Sciences, National Academy of Engineering, and Institute of Medicine. Responsible science: ensuring the integrity of the research process[M]. Washington, DC: National Academy Press, 1992. |
| [5] | Commission on Research Integrity. Integrity and misconduct in research[R]. Washington DC: US Government Printing Office, 1995. |
| [6] | Fransis, Sybil. Developing a federal policy on research misconduct[J]. Science and Engineering Ethics, 1999, 5: 261- 272. |
| [7] | The Office of Science and Technology Policy (OSTP). Federal policy on research misconduct[J]. Federal Register, 2000, 65 (235). |
