2. 中国科学院微生物研究所网络信息中心,北京100101
3. 中国科学院北京生命科学研究院,北京100101
4. 中国科学院微生物研究所病原微生物与免疫学重点实验室,北京100101
5. 中国疾病预防控制中心,北京102206
2. Information Center, Institute of Microbiology, Chinese Academy of Sciences,Beijing100101, China
3. Beijing Institutes of Life Science, Chinese Academy of Sciences, Beijing 100101, China
4. CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing100101, China
5. Chinese Center for Disease Control and Prevention, Beijing 102206, China
埃博拉病毒病(Ebola Virus Disease)以往称埃博拉出血 热(Ebola Hemorrhagic Fever)。目前国内统称为埃博拉出血 热,世界卫生组织(World Health Organization,WHO)和美国 疾病预防控制中心(Centers for Disease Control andPrevention, US CDC)已将埃博拉出血热更名为埃博拉病毒病。埃博拉病 毒病是由埃博拉病毒(Ebolavirus)引起的一种急性传染病,病 死率可高达90%,是病死率最高的传染病之一。埃博拉病毒 是单股负链、不分节段的RNA囊膜病毒,与马尔堡病毒同属 丝状病毒科[ 1 ]。2013年12月开始,西非几内亚出现埃博拉 病毒病疫情,随后扩散至利比里亚、塞拉利昂和尼日尼亚等 西非国家。2014年8月8日,WHO宣布,西非埃博拉病毒病 疫情构成国际紧急公共卫生事件[ 2 ]。截至2014年8月20 日,上述西非4国已报告2615例埃博拉病毒病病例,死亡 1427人[ 3 ]。中国与西非国家在劳务、商务、留学教育等领域 合作紧密,相关人员往来密切,还有援外医疗队常驻西非国 家,虽然目前尚无确认的埃博拉病毒病疫情,但随时面临输 入风险。为加深对该病的科学认识和应对准备,现对其发 现、流行历史、疫情现状、生态学、传播途径、感染风险、临床 表现、诊断、治疗和预防控制进行综述。同时,本课题组对 该病的病原学、致病机制、药物和疫苗研发进展等也进行了 综述,另文发表[ 4 ]。
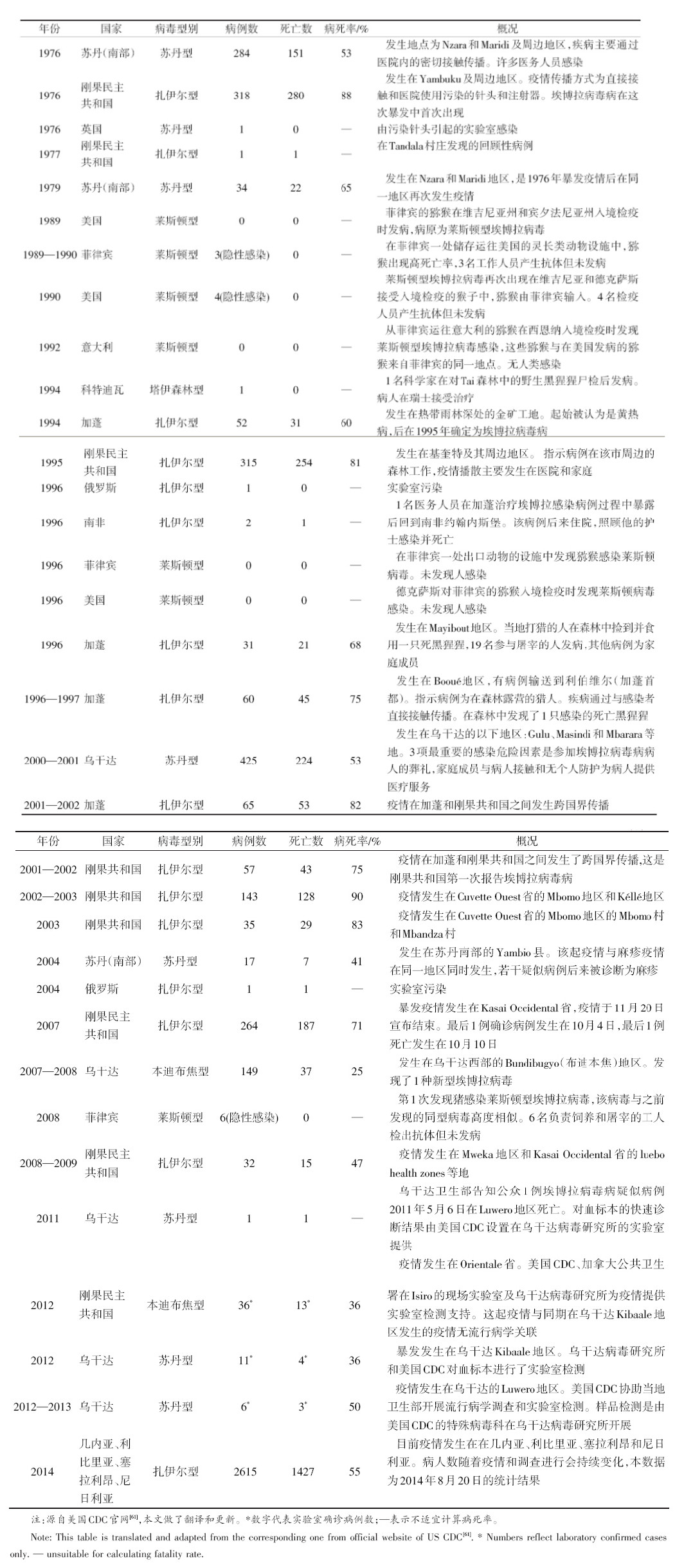
埃博拉病毒于1976年在中非地区的2起暴发疫情中首 次发现[ 5, 6 ]。1976年6—7月,苏丹南部毗邻热带雨林的镇上出 现了第1例埃博拉病毒病病例,来自当地一家棉花工厂,随后 播散至相邻地区,并在一家医院发生严重传播。该疫情一直 持续至1976年11月,约产生15代人传人病例,共报告284例 病例,死亡151人。另1起疫情于1976年8月底从扎伊尔(现 在的刚果民主共和国)临近热带雨林的地区开始,指示病例 在治疗疟疾时被发现,疫情播散主要发生在医院,超过25% 的续发病例中,唯一的已知暴露是院内注射。在临近地区也 有亲属因照顾病例、接生及其他接触而感染。这起疫情发病 318例,死亡280人,病死率高于苏丹疫情。两起疫情均分离 到一种新病毒,当时根据扎伊尔疫情发生地一条名为埃博拉 的小河统一命名为“埃博拉病毒”,但几年后发现疫情是由2 种埃博拉病毒引起,即苏丹型(Sudan ebolavirus,EBOV)和扎 伊尔型(Zaire ebolavirus,EBOV)[ 7 ]。
目前,确认埃博拉病毒属包括5个种,除扎伊尔型和苏丹 型外,还有塔伊森林型(Taï Forest ebolavirus,TAFV)、本迪布 焦 型(Bundibugyo ebolavirus,BDBV)和 莱 斯 顿 型(Reston ebolavirus,RESTV)。莱斯顿型于1989年在美国维吉尼亚州 和宾夕法尼亚州发现,当时从菲律宾进口的猕猴在入境检疫 时出现大量死亡,之后从病死猕猴中检出该型病毒[ 8 ]。塔伊 森林型于1994年在科特迪瓦发现(所以又叫科特迪瓦型或者 象牙海岸型),一名人类学专家在解剖塔伊森林中的病死黑 猩猩后感染发病,但未死亡[ 9 ]。本迪布焦型于2007年在乌干 达本迪布焦地区的暴发疫情中发现(所以又叫乌干达型),指 示病例没有明确的动物暴露史[ 10 ]。5种埃博拉病毒引起的疫 情流行历史及暴发现状见图1。
除莱斯顿型外,其余4种埃博拉病毒都有人感染发病的 报告(表1)。此次西非疫情前,全球已报告27起疫情。自然 状态发生的疫情均在非洲,大规模暴发疫情主要集中在中非 10°N—10°S的地区(图1(a));另外还有俄罗斯和英国报道实 验室工作人员感染发病(图1(b)) [ 11, 12, 13 ]。报告疫情的非洲国家 有刚果民主共和国、刚果共和国、乌干达、苏丹、加蓬、科特迪 瓦和南非7国,共报告病例2300余例,其中死亡约1500人,病 死率25%~90%,疫情主要发生在相对封闭的偏远农村地区。 其中,扎伊尔型引发的疫情起数和病例数最多,其病死率 (47%~90%)整体高于苏丹型(36%~65%)和本迪布焦型(25% ~36%)。塔伊森林型至今仅报告前述1例人感染发病。莱斯 顿型病毒与美国、意大利和菲律宾的多起猕猴暴发疫情相 关,其中美国和意大利的感染猕猴均来自菲律宾[ 14, 15, 16, 17, 18, 19 ]。2008 年首次在菲律宾的猪中分离到该型病毒[ 14 ]。美国和菲律宾曾 接触过猕猴和猪的人的血清中也检出过莱斯顿型病毒抗体, 但均未出现临床症状[ 14, 20, 21 ]。
2014年西非埃博拉病毒病疫情始于几内亚。3月22日, 几内亚向WHO报告发生埃博拉病毒病暴发,当时发病49人, 其中死亡29人[ 22 ]。回顾性调查显示,指示病例可能是1名来 自林区的2岁儿童,于2013年12月初发病死亡。实验室检测 结果表明病原体为扎伊尔型埃博拉病毒,但基因序列分析显 示,与既往疫情的扎伊尔型埃博拉病毒同源性97%,存在一 定的变异[ 23 ]。初始阶段,疫情主要集中在几内亚首都和另外 3个地区。3月底邻国利比里亚开始报告病例,5月疫情扩散 至相邻的塞拉利昂,7月底尼日利亚也报告了首例病例,该病 例是从利比里亚乘飞机来到尼日利亚。截至2014年8月20 日,上述西非4国已报告2615例埃博拉病毒病病例,死亡 1427人[ 3 ]。其中,几内亚发病607例,死亡406人;利比里亚发 病1082例,死亡624人;塞拉利昂发病910例,死亡392人;尼 日利亚发病16例,死亡5人。
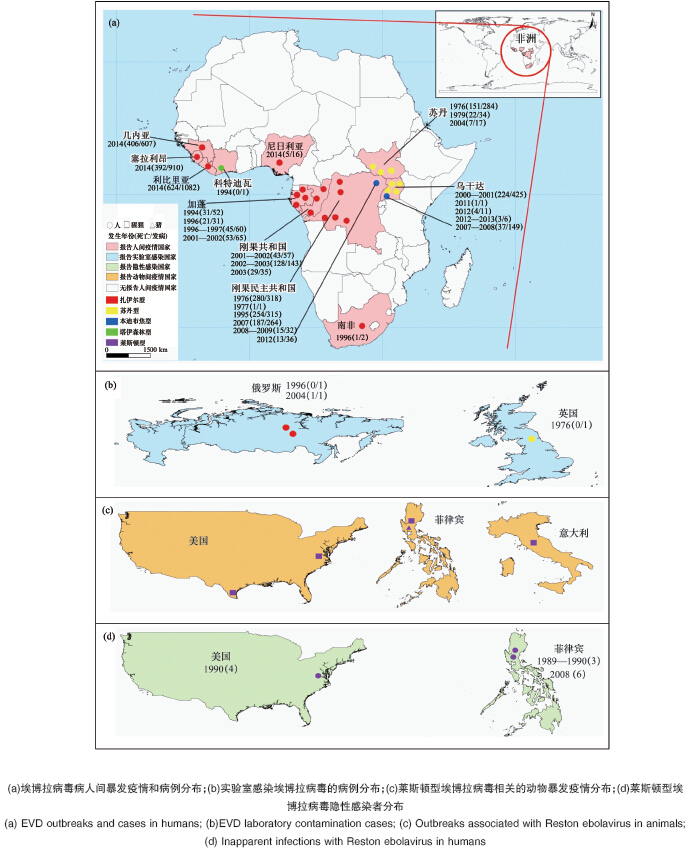 | 图1 埃博拉病毒病流行历史及暴发现状(截至2014年8月20日) (图片来源:Nature) (a)埃博拉病毒病人间暴发疫情和病例分布;(b)实验室感染埃博拉病毒的病例分布;(c)莱斯顿型埃博拉病毒相关的动物暴发疫情分布;(d)莱斯顿型埃 博拉病毒隐性感染者分布 (a) EVD outbreaks and cases in humans; (b)EVD laboratory contamination cases; (c) Outbreaks associated with Reston ebolavirus in animals; (d) Inapparent infections with Reston ebolavirus in humans |
| 表1 埃博拉病毒病疫情一览 |
本次疫情是埃博拉病毒发现以来,规模最大的一次暴发 流行,除了偏远农村地区,在人口密集的大城市也出现疫情, 是第一次在非洲国家的首都(科纳克里、蒙罗维亚、弗里敦、 拉各斯)发生暴发流行,也是第一次在西非地区出现埃博拉 病毒病暴发疫情[ 24 ]。
埃博拉病毒病一直被认为是动物源性传染病,其自然储 存宿主以及病毒在自然界的循环、传播方式尚不明确。目前 研究显示,非洲的果蝠很可能是病毒的自然储存宿主,在3种 非洲果蝠(锤头果蝠、富氏前肩头果蝠和孤领果蝠)体内曾检 出扎伊尔型埃博拉病毒的RNA和抗体[ 25, 26 ]。此外,还在埃及 果蝠体内分离出同属丝状病毒科的马尔堡病毒[ 26 ]。流行病学 证据也支持果蝠是病毒的自然储存宿主。2007年刚果民主 共和国的暴发疫情调查结果提示,指示病例因暴露于果蝠而 发病[ 27 ];马尔堡出血热疫情与蝙蝠洞穴存在关联[ 28, 29 ]。另外,实验室和现场调查结果显示,感染埃博拉病毒的果蝠不发 病,这符合经典动物宿主的特征[ 30, 31 ]。还有研究支持啮齿类 动物是病毒的可能储存宿主,在中非的仓鼠和尖鼠体内检测 到埃博拉病毒RNA [ 32 ],但该研究缺乏其他证据支持(如抗体、 病毒分离),也未被其他独立开展的研究再次证实。
除人类暴发疫情外,还有非洲的大猩猩、黑猩猩等非人 类灵长类动物感染埃博拉病毒发病、死亡[ 33, 34, 35 ],在非洲的森林 羚羊和豪猪中也曾有疫情报告[ 36, 37 ]。这提示人类和上述动物 可能是埃博拉病毒的终末宿主,而非自然储存宿主。多起人 类暴发疫情中的指示病例的可能感染来源指向非人类灵长 类动物,也有将感染源头指向果蝠[ 38 ],但仍有部分疫情指示病 例的感染来源缺乏明确线索。因此,非人类灵长类动物(如 大猩猩、黑猩猩)、森林羚羊和豪猪,以及果蝠等可能将埃博拉病毒传播给人类,但具体跨种传播的机制和过程尚不明 确,也不能排除存在其他中间宿主的可能。
现有证据支持埃博拉病毒生态学假说可能是(图2):病 毒主要在果蝠间自然循环、传播,偶尔可传播给黑猩猩、大猩 猩等非人类灵长类动物,以及森林羚羊和豪猪等哺乳动物, 人类通过接触这些动物而感染发病;此外,果蝠还可直接将 病毒传播给人;人与人之间的传播最终导致人类疫情暴发流 行[ 39 ]。上述假说仍有待进一步研究证实,尤其是其中跨种传 播的机制及其决定因素。有专家提出应考虑其他动物宿主 (例如猪)的作用[ 39, 40 ]。有研究发现菲律宾本地猪可感染莱斯 顿型病毒,并造成人类隐性感染[ 14 ];中国2011年曾在猪中检 出莱斯顿型病毒RNA,但缺乏病毒分离的结果[ 41 ],这些都提 示其他潜在宿主的可能。
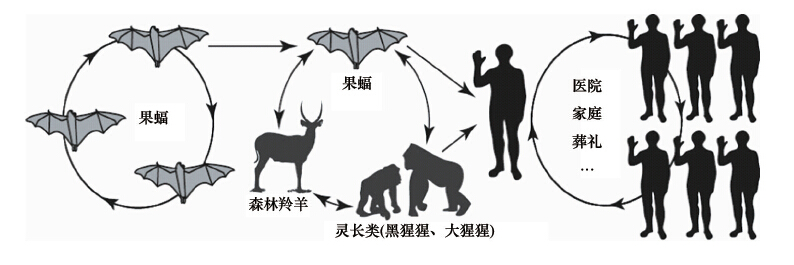 | 图2 埃博拉病毒生态学假说 |
既往暴发疫情提示埃博拉病毒可从猩猩、果蝠等动物直 接传播给人类[ 17 ]。关于跨种传播的确切方式尚缺乏科学证 据,但目前一些研究提示了可能的传播途径。直接接触患病 猩猩等动物或其尸体可导致人感染发病。1994年感染塔伊 森林型病毒的病例是在解剖病死黑猩猩后发病[ 9 ],1996年加 蓬疫情的早期病例都与屠宰病死猩猩有关[ 42 ]。但这些行为与 感染发病的关联尚不能量化,关联的地域差异也不得而知。 另外,虽然正确烹饪可灭活埃博拉病毒,但食用未煮熟的感 染动物仍可能导致感染。感染埃博拉病毒的非人类灵长类 动物器官中的病毒滴度可高达107~108 pfu/g,60℃加热需60 min方能灭活。如果未彻底煮熟而食用,存在导致感染的可 能[ 43 ]。2007年刚果暴发疫情中,指示病例很可能是食用果蝠 而感染[ 27 ]。喀麦隆的血清学研究也显示,食用蝙蝠会增加感 染的风险[ 44 ]。
当埃博拉病毒病在人群中暴发时,续发病例主要通过接 触病人或其尸体而感染[ 5, 6, 45, 46 ],也有因共用未消毒的注射器而 感染的报告[ 5, 6 ]。在人类及非人类灵长类动物的皮肤和体液中 均可发现病毒颗粒和RNA [ 43, 47, 48, 49, 50 ]。因此,接触病人的血液、体 液(如唾液、精液)、排泄物、呕吐物及尸体都可造成感染。此 外,埃博拉病毒在室温下,可在液体和干燥物料中存活至少 若干天,且保持感染活性[ 51 ],所以接触被病人血液、体液等污染的物品也可能被感染。
发生接触后,埃博拉病毒经黏膜、破损皮肤侵入人体[ 39 ]。 虽然有动物实验研究报告埃博拉病毒可通过气溶胶传播[ 52 ], 但目前尚无人与人经近距离飞沫或空气传播的报告[ 24 ]。在这 一点上,埃博拉病毒与SARS冠状病毒和流感病毒不同,后者 可以通过近距离飞沫在人与人之间传播。
同的传播途径可能对潜伏期和病死率有影响。1976 年的扎伊尔型埃博拉暴发疫情中,因注射针头污染而致感染 的病例的平均潜伏期6.3天,病死率100%;而直接接触病人 或其尸体的病例的平均潜伏期9.5天,病死率约80% [ 39 ]。不同 传播途径还可能影响病程进展。动物实验显示,非人类灵长 类动物经注射感染后的病程进展,较气溶胶暴露的快[ 52 ]。
埃博拉病毒以何种方式从宿主动物传播给人目前尚不 明确,但现有证据提示经常在埃博拉疫情流行地区的森林、 洞穴和矿井等地活动的人感染风险高,几次暴发疫情的溯源 调查都指向了这些场所[ 33, 38, 44, 53 ]。蝙蝠、猩猩等可能的动物宿 主在这些场所较多,无防护地接触和屠宰食用动物宿主等行 为容易导致感染。
当埃博拉病毒病在人群中暴发流行后,感染的风险主要 取决于接触行为和接触对象。现有证据不支持处于潜伏期的病例有传染性,随访研究提示康复病例也无传染性[ 46, 54 ],有 症状的病例才具有传染性,且随病程进展其传染性会增 强[ 55 ]。另外,病人尸体也是传染来源。如不采取恰当防护措 施,接触病例的体液及其污染物和病人尸体等,则感染的风 险高,这种风险在病程后期尤其高。因此,医护人员和家庭 护理人员是高风险人群[ 1, 39 ]。但若采取正确个人防护措施,即 使存在暴露,也属低感染风险[ 56 ]。另外,在无防护情况下,若 只是与病例共处一室、握手等偶然接触,也属低感染风险[ 56 ], 特别是病例处于病程早期,感染的风险就更低。
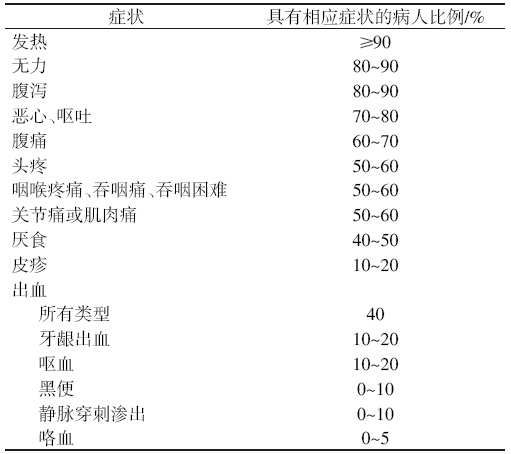
埃博拉病毒病潜伏期为2~21天,常见潜伏期8~10天[ 57 ]。 起病急,早期常见症状有非特异性发热、厌食、虚弱无力,可 能还有寒颤、肌肉疼痛、精神萎靡等[ 46 ],病后5~7天可在面、 颈、躯干和手臂等部位出现弥漫性红斑样斑丘疹,这是区别于 其他类似疾病的症状。病例存活后,斑丘疹一般会脱落[ 39, 45, 46 ]。
随病程进展,病后5天开始可出现胃肠道症状,如严重水 样腹泻、恶心、呕吐、腹痛等,部分病例可出现胸痛、气短、头 痛、意识模糊、打嗝和结膜充血等,还有病例可出现癫痫和脑 水肿等[ 46, 58 ]。部分患者还可出现内出血和外出血,出血包括但 不限于:皮肤出血点、瘀斑、紫癜、血疱,牙龈出血,鼻出血,月 经血量过多,尿血,便血,呕血,颅内出血,肝脾等器官血肿等 [ 46, 58 ],一般在病程后期出现[ 39, 46 ]。本病最初命名为埃博拉出血 热也是因为有出血症状,但并非所有病例都有出血[ 59 ],有些疫 情中具有出血症状的病人的比例甚至低于50%(表2),严重 出血的也相对少见,故WHO将其更名为埃博拉病毒病。
| 表2 1995年刚果民主共和国103例埃博拉病毒病病例临床症状[ 60 ] |
死亡病例一般在病程早期即出现严重症状,常在6~16天 因多器官衰竭和感染性休克等并发症而死亡[ 39 ]。存活病例一 般发热数天后,在6~11天开始好转,但可能经历较长康复期, 并出现脊髓炎、复发性肝炎、精神病及葡萄膜炎等后遗症,孕 妇还有流产风险[ 39 ]。造成病例死亡或存活结局差异的因素尚 未完全阐明,但有研究发现死亡病例一般不出现强烈的免疫 反应,而存活病例病情好转的时间与体液免疫出现时间相吻 合[ 47 ],且往往与早期出现白介素β(interleukin β)、白介素6 (interleukin 6)和肿瘤坏死因子α(TNFα)相关[ 39 ],未来可考虑 进一步研究上述生物标记物预示临床结局的价值。
埃博拉病毒病患者临床血常规和生化检测可出现白细 胞、淋巴细胞和血小板计数降低,随病程进展,中性粒细胞数 增加并出现核左移。在胰腺感染的情况下,淀粉酶可升高。 在肝脏转氨酶浓度上升过程中,天冬氨酸转氨酶一般高于丙 氨酸转氨酶。还可能出现蛋白尿。发生弥漫性血管内凝血 时,凝血酶原时间和部分凝血活酶时间延长,血液中纤维蛋 白降解产物增加。若病程后期发生继发感染,可致白细胞计 数上升[ 39, 45 ]。
早期识别和诊断埃博拉病毒病对于控制疫情扩散至关 重要。但其早期症状及血常规和血生化等临床实验室检测 指标缺乏特异性,仅以临床表现和一般实验室检查难以确 诊。而且在非洲地区,容易与其他常见传染病混淆,如疟疾、 伤寒、脑膜炎球菌血症、肺炎、黄热病等[ 39 ]。病例发病前21 天,若有埃博拉病毒病暴发流行地区的居住或旅行史,且具 备相应临床表现,则应怀疑埃博拉病毒感染,应尽快开展特 异性实验室诊断。
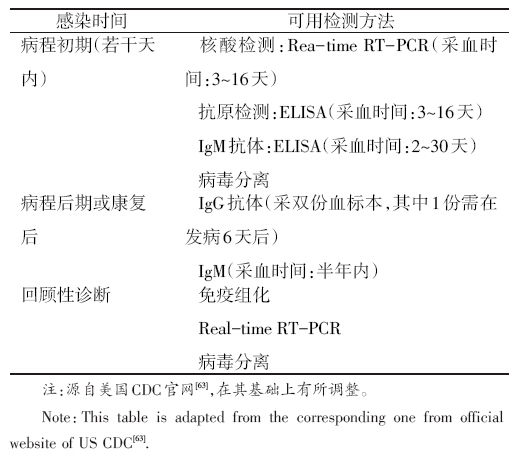
目前,针对埃博拉病毒的实验室诊断方法主要有两类, 即检测病毒颗粒或抗原、检测特异性抗体。抗原和抗体检测 主要用ELISA法(酶联免疫法),检测IgM抗体还可用捕获 ELISA法[ 61 ]。检测病毒核酸主要采用RT-PCR法[ 61 ],但传统 RT-PCR法会因易污染而出现假阳性结果,所以推荐实时荧 光定量PCR法(Real-time RT-PCR)。2014年8月5日,美国 食品药品监督管理局(FDA)紧急批准美国国防部开发的 Real-time RT-PCR试验(EZ1rRT-PCR Assay)用于检测疑似 患者的临床标本[ 62 ]。
病毒核酸、抗原及抗体在临床标本中的出现和持续时间 各不相同。埃博拉病毒病病例血液中的病毒抗原和核酸出 现时间较早,一般在发病后3天可检出,7~16天降到检出水 平以下[ 43 ]。IgM抗体在发病后2天出现,1个月至半年后消 失[ 54 ]。IgG抗体可维持数年,但出现时间较晚,一般在病后6~ 18天出现[ 54 ]。
基于埃博拉病毒生物标记物出现的时间,在病程不同阶 段可采用不同的实验室诊断方法(表3)。发病初期数天内, 可采集血标本检测病毒核酸、抗原或IgM抗体,也可进行病毒 分离。病程后期或患者康复后,可优先考虑检测IgG抗体;若发病在半年内,也可尝试检测IgM抗体。IgM抗体阳性、IgG 抗体阳转,或恢复期较急性期抗体滴度4倍升高,则提示新发 感染,单份血清IgG抗体阳性则提示既往感染[ 43 ]。免疫组化、 Real-time RT-PCR、病毒分离等方法均可对死亡个体做回顾 性诊断[ 63 ]。需特别注意的是,若病后3天内采集的血标本检 测阴性,则不能完全排除感染,需后续采样继续检测。
| 表3 埃博拉病毒实验室诊断方法 |
目前国际上没有已批准上市的治疗埃博拉病毒病的特 效药物。一些药物,包括ZMapp和TKMEbola等正在研发和 临床试验阶段,其安全性和有效性尚待科学研究证实。其中 ZMapp是由美国与加拿大联合研制的药物,包含3种人源化 的单克隆抗体,通过植物细胞表达系统(烟草属)表达生产。 该药物是优化的鸡尾酒疗法[ 64 ],包含针对埃博拉病毒感染有 保护效果的单克隆抗体组合MB003和ZMAB中最有效的成 分。该药物通过与病毒多个关键致病位点结合,从而使人体 获得保护。迄今为止,该药物仅在2名美国患者和1名西班 牙患者中使用,其中2名美国患者病情有所改善[ 65 ]。生产该 药的公司网站显示,该药处于新药临床研究申请阶段(国际 GMP规范),尚未进入I期临床的安全性试验。恢复期血浆疗 法也对少量患者有效[ 66 ]。然而,这些药物和疗法尚处于早期 研究阶段,其安全性和有效性缺乏足够科学证据,短期内大 规模推广的可能性不大。埃博拉病毒病病情重、进展快,任 何单一疗法可能都不是最优治疗方案,合适的治疗策略应是 通过抑制病毒复制和延缓病程进展,为通过天然和获得性免 疫消除感染赢得时间[ 69, 70 ]。
目前,对病人主要以对症和支持治疗为主,包括保持水 和电解质平衡,维持血氧浓度和血压稳定及治疗继发感染[ 71 ]。 某些现象提示恰当的支持治疗能提高生存率,例如,马尔堡 病毒也无特效治疗药物,但马尔堡出血热在欧洲的病死率 (22%)远却低于非洲(70%~85%)[ 39 ]。体外和体内试验均显示 利巴韦林对丝状病毒没有效果[ 70, 71 ],且可能导致严重不良反 应,故不建议针对埃博拉病毒使用。
目前尚无批准上市的针对埃博拉病毒病的疫苗,有应用 前景的疫苗也在漫长的临床试验阶段。现阶段埃博拉病毒 病疫情预防控制的主要策略是早期发现病例、及时调查处 置、追踪和密切观察接触者,以及有效的医院内和社区的感 染控制[ 1 ]。多次大规模暴发的埃博拉病毒病疫情,包括本次 西非疫情,都存在首发病例发现严重滞后而导致疫情播散的 问题。从首发病例发病到发现暴发疫情往往间隔数月[ 72 ],在 此期间埃博拉病毒已在人群中传播、扩散。若能早期诊断病 例并及时调查处置,发生大规模暴发疫情的可能性将大大降 低。在这方面,2011年乌干达的埃博拉病毒病疫情的监测和 应对堪称范例。这起疫情仅确诊1名病例,从其死亡到实验 室诊断仅6天,确诊后第2天,乌干达卫生部门即启动病例追 踪和隔离观察等措施。病例的及时发现及迅速处置,对控制 疫情起到了重要作用[ 73 ]。
当埃博拉病毒病在人群中暴发流行时,医院不仅是发现 病例的前沿阵地,也是感染控制的重点场所。历史上已有过 多次在医院内发生暴发流行的惨痛教训[ 3, 4, 73 ]。医院尽管存在 感染的高风险,但这种风险可防可控。1995年刚果民主共和 国暴发疫情前期出现了大量医护人员感染,但后期采取病例 隔离和个人防护等措施后,就没有医院内的感染病例,这说 明通过恰当防护措施和感染控制,可有效降低和控制医院内 的感染风险[ 73 ]。感染控制应贯穿每一个医疗环节,包括确诊 前对疑似病例隔离、疑似病例和确诊病例分类管理、临床标 本采集、运输、实验室检测及标本灭活处理等,每个环节都要 根据暴露风险穿戴相应个人防护设备,并定期对器械和环境 消毒。感染控制并不一定要求有最先进的设备,在物资有限 条件下也可有效开展。WHO和美国CDC开发了指导非洲医 疗机构实施感染控制的手册[ 74 ],该手册充分利用了常见的低 成本物品,如家用漂白剂、水、棉布及塑料布等,其有效性已 在实际疫情控制中得到验证[ 75, 76 ]。
尽管埃博拉病毒病目前仍在西非4国流行,也有经航空 工具远距离传播疫情的报道,但1976年以来,埃博拉病毒病 的实验室诊断、调查处置、感染控制等技术已取得巨大进 步。该病在具备良好监测系统和卫生应急体系完善的国家 发生大规模传播的可能性极小。2003年SARS流行之后,中 国的公共卫生体系得到极大加强,传染病监测、发现、检测、 救治、应急反应和处置能力大幅度提升,中国政府的相关部 门已为预防埃博拉疫情输入制定了相应技术方案,并储备了 相应物资。对于包括中国在内的尚未发生疫情的国家而言,在加强监测和积极准备应对的基础上,无需过度恐慌。目 前,该病尚有包括治疗在内的诸多科学问题有待解决,在符 合伦理原则的前提下,开展深入的流行病学、病毒学、临床、 免疫、病理、治疗药物等研究,可加深对该病的科学认识,提 供更为有效的防治手段。
| [1] | World Health Organization. Ebola and Marburg virus disease epidemics: preparedness, alert, control, and evaluation (Interim version 1.1) [M/OL].[2014-08-10]. http://www.who.int/csr/disease/ebola/manual_EVD/en. |
| [2] | WorldHealthOrganization.WHOstatementonthemeetingoftheInternational Health Regulations Emergency Committee regarding the 2014 Ebola outbreak in West Africa [EB/OL]. (2014-08-08) [2014-08-10]. http://www.who.int/mediacentre/news/statements/2014/polio-20140505/en. |
| [3] | Centres for Disease Prevention and Control. Ebola hemorrhagic fever-2014 Ebola outbreak in West Africa [EB/OL]. [2014-08-24]. http://www. cdc.gov/vhf/ebola/outbreaks/guinea/index.html. |
| [4] | Cheng Y, Liu J, Li Y, et al. Ebloa viral disease: Update research of etiology, pathogenic mechanism, treatment and vaccine[J]. Chinese Science Bulletin, (under review). |
| [5] | World Health Organization. Ebola haemorrhagic fever in Sudan, 1976 [J]. Bull World Health Organ, 1978, 56: 247-270. |
| [6] | World Health Organization. Ebola haemorrhagic fever in Zaire, 1976 [J]. Bull World Health Organ, 1978, 56: 271-293. |
| [7] | Cox N J, McCormick J B, Johnson K M, et al. Evidence for two subtypes of Ebola virus based on oligonucleotide mapping of RNA [J]. J Infect Dis, 1983, 147: 272-275. |
| [8] | Jahrling P B, Geisbert T W, Johnson E D, et al. Preliminary report: Isolation of Ebola virus from monkeys imported to USA[J]. The Lancet, 1990, 335: 502-505. |
| [9] | Le Guenno B, Formenty P, Wyers M, et al. Isolation and partial characterisation of a new strain of Ebola virus [J]. The Lancet, 1995, 345: 1271-1274. |
| [10] | Wamala J F, Lukwago L, Malimbo M, et al. Ebola hemorrhagic fever associated with novel virus strain, Uganda, 2007—2008 [J]. Emerg Infect Dis, 2010, 16(7): 1087-1092. |
| [11] | Emond R T, Evans B, Bowen E T, et al. A case of Ebola virus infection[J]. British Medical Journal. 1977, 2(6086): 541-544. |
| [12] | Borisevich I V, Markin V A, Firsova I V, et al. Hemorrhagic (Marburg, Ebola, Lassa, and Bolivian) fevers: Epidemiology, clinical pictures, and treatment [J]. Voprosy Virusologii-Problems of Virology, 2006, 51(5): 8-16. |
| [13] | Akinfeyeva L A, Aksyonova O I, Vasilyevich I V, et al. A case of Ebola hemorrhagic fever[J]. Infektsionnye Bolezni, 2005, 3(1): 85-88. |
| [14] | Barrette R W, Metwally S A, Rowland J M, et al. Discovery of swine as a host for the Reston ebolavirus [J]. Science, 2009, 325: 204-206. |
| [15] | Jahrling P B, Geisbert T W, Johnson E D, et al. Preliminary report: Isolation of Ebola virus from monkeys imported to USA[J]. The Lancet, 1990, 335: 502-505. |
| [16] | Hayes C G, Burans J P, Ksiazek T G. Outbreak of fatal illness among captive macaques in the Philippines caused by an Ebola-related filovirus[J]. The American Journal Tropical Medicine and Hygiene, 1992, 46: 664-671. |
| [17] | World Health Organization. Viral haemorrhagic fever in imported monkeys[R]. Weekly Epidemiological Record, Ceneva: WHO, 1992, 67 (24): 183. |
| [18] | Rollin P E, Williams J, Bressler D, et al. Isolated cases of Ebola (subtype Reston) virus among quarantined non-hman primates recently imported from the Philippines to the United States[J]. Journal of Infectious Diseases, 1999, 179 (Suppl 1): 108-114. |
| [19] | Miranda M E, Ksiazek T G, Retuya T J, et al. Epidemiology of Ebola (subtype Reston) virus in the Philippines, 1996[J]. Journal of Infectious Diseases, 1999, 179 (Suppl 1): 115-119. |
| [20] | Miranda M E, White M E, Dayrit M M, et al. Seroepidemiological study of filovirus related to Ebola in the Philippines [J]. The Lancet, 1991, 337: 425-426. |
| [21] | Centers for Disease Control and Prevention. Update: Filovirus infection in animal handlers [J]. Morbidity Mortality Weekly Report, 1990, 39 (13): 221. |
| [22] | World Health Organization. Ebola virus disease in Guinea—23 March 2014 [EB/OL]. [2014-03-25]. http://www.who.int/csr/don/2014_03_ 23_ebola/en. |
| [23] | Baize S, Pannetier D, Oestereich L, et al. Emergence of Zaire Ebola virus disease in Guinea-Preliminary Report[J]. N Engl J Med, [2014-08-14] http://www.nejm.org/doi/full/10.1056/NEJMoa1404505. |
| [24] | European Centre for Disease Prevention and Control. Outbreak of Ebola virus disease in West Africa [R/OL]. (2014-08-01)[2014-08-14]. http://www.ecdc.europa.eu/en/publications/_layouts/forms/Publication_DispForm. aspx?List=4f55ad51-4aed-4d32-b960-af70113dbb90&ID=1141. |
| [25] | Pourrut X, Délicat A, Rollin P E, et al. Spatial and temporal patterns of Zaire ebolavirus antibody prevalence in the possible reservoir bat species [J]. J Infect Dis, 2007, 196 Suppl 2): 176-183. |
| [26] | Towner J S, Amman B R, Sealy T K, et al. Isolation of genetically diverse Marburg viruses from Egyptian fruit bats [J]. PLoS Pathogens, 2009, 5.[2014-08-14] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2713404. |
| [27] | Leroy E M, Epelboin A, Mondonge V, et al. Human Ebola outbreak resulting from direct exposure to fruit bats in Luebo, Democratic Republic of Congo, 2007[J]. Vector-Borne and Zoonotic Diseases, 2009, 9: 723-728. |
| [28] | Bausch D G, Nichol S T, Muyembe-Tamfum J J, et al. Marburg haemorrhagic fever associated with multiple genetic lineages of virus [J]. N Engl J Med, 2006, 355: 909-919. |
| [29] | Bausch D G, Borchert M, Grein T, et al. Risk factors for Marburg hemorrhagic fever, Democratic Republic of the Congo[J]. Emerg Infect Dis, 2003, 9: 1531-1537. |
| [30] | Leroy E M, Kumulungui B, Pourrut X, et al. Fruit bats as reservoirs of Ebola virus[J]. Nature,2005, 438 (7068): 575-576. |
| [31] | Swanepoel R, Leman P A, Burt F J, et al. Experimental inoculation of plants and animals with Ebola virus[J]. Emerg Infect Dis, 1996, 2(4): 321-325. |
| [32] | Morvan J M, Deubel V, Gounon P, et al. Identification of Ebola virus sequences present as RNA or DNA in organs of terrestrial small mammals of the Central African Republic [J]. Microbes and Infection, 1999, 1: 1193-1201. |
| [33] | Leroy E M, Rouquet P, Formenty P, et al. Multiple Ebola virus transmission events and rapid decline of central African wildlife [J]. Science, 2004, 303(5656): 387-390. |
| [34] | Formenty P, Boesch C, Wyers M, et al. Ebola virus outbreak among wild chimpanzees living in a rain forest of Cote d'Ivoire [J]. J Infect Dis, 1999, 179(Suppl 1): 120-126. |
| [35] | Bermejo M, Rodríguez-Teijeiro J D, Illera G, et al. Ebola outbreak killed 5000 gorillas[J]. Science, 2006, 314 (5805): 1564. |
| [36] | Nkoghe D, Formenty P, Leroy E M, et al. Multiple Ebola virus haemorrhagic fever outbreaks in Gabon, from October 2001 to April 2002[J]. Bull Soc Pathol Exot. 2005, 98 (3): 224-229. |
| [37] | Formenty P, Libama F, Epelboin A, et al. Outbreak of Ebola hemorrhagic fever in the Republic of the Congo, 2003: a new strategy[J]. Med Trop (Mars). 2003, 63(3): 291-295. |
| [38] | Feldmann H, Jones S, Klenk H D, et al. Ebola virus: From discovery to vaccine [J]. Nature Reviews Immunology, 2003, 3(8): 677-685. |
| [39] | Heinz F, Thomas W G. Ebola haemorrhagic fever [J]. The Lancet, 2011, 377: 849-862. |
| [40] | Groseth A, Feldmann H, Strong J E. The ecology of Ebola virus [J]. Trends in Microbiology, 2007, 15(9): 408-416. |
| [41] | Pan Y, Zhang W, Cui L, et al. Reston virus in domestic pigs in China [J]. Arch Virol, 2014, 159(5): 1129-1132. |
| [42] | Georges A J, Leroy E M, Renaud A A, et al. Ebola hemorrhagic fever outbreaks in Gabon, 1994—1997: Epidemiologic and health control issues[J]. J Infect Dis, 1999, 179(Suppl 1): 65-75. |
| [43] | Geisbert T W, Hensley L E, Larsen T, et al. Pathogenesis of Ebola haemorrhagic fever in cynomolgus macaques: evidence that dendritic cells are early and sustained targets of infection [J]. Am J Pathol, 2003, 163(6): 2347-2370. |
| [44] | Kuniholm M H. Bat exposure is a risk factor for Ebola virus infection[C] //Filoviruses: Recent advance and future challenges: An ICID Global Symposium, Winnipeg, Manitoba, Canada, 2006. |
| [45] | Peters C J, LeDuc L W. Ebola: The virus and the disease [J]. J Infect Dis, 1999, 179 (Suppl 1): 1-288. |
| [46] | Khan A S, Tshioko F K, Heymann D L, et al. The reemergence of Ebola haemorrhagic fever, Democratic Republic of the Congo, 1995 [J]. J Infect Dis, 1999, 179 (Suppl 1): 76-86. |
| [47] | Ksiazek T G, West C P, Rollin P E, et al. ELISA for the detection of antibodies to Ebola virus [J]. J Infect Dis, 1999, 179 (Suppl 1): 192-198. |
| [48] | Rodriguez L L, De Roo A, Guimard Y, et al. Persistence and genetic stability of Ebola virus during the outbreak in Kikwit, Democratic Republic of the Congo, 1995 [J]. J Infect Dis, 1999, 179 (Suppl 1): 170-176. |
| [49] | Zaki S R, Shieh W J, Greer P W, et al. A novel immunohistochemical assay for the detection of Ebola virus in skin: Implications for diagnosis, spread, and surveillance of Ebola haemorrhagic fever [J]. J Infect Dis, 1999, 179(Suppl 1): 36-47. |
| [50] | Jahrling P B, Geisbert T W, Jaax N K, et al. Experimental infection of cynomolgus macaques with Ebola-Reston filoviruses from the 1989— 1990 U.S. epizootic [J]. Arch Virol, 1996, 11 (Suppl 1): 115-134. |
| [51] | Piercy T J, Smither S J, Steward J A, et al. The survival of filoviruses in liquids, on solid substrates and in a dynamic aerosol [J]. J Appl Microbiol. 2010, 109 (5): 1531-1539. |
| [52] | Geisbert T W, Daddario-Dicaprio K M, Geisbert J B, et al. Vesicular stomatitis virus-based vaccines protect nonhuman primates against aerosol challenge with Ebola and Marburg viruses [J]. Vaccine, 2008, 26 (52): 6894-6900. |
| [53] | Bertherat E, Renaut A, Nabias R, et al. Leptospirosis and ebola virus infection in five gold-panning villages in northeastern Gabon[J]. Am J Trop Med Hyg, 1999, 60(4): 610-615. |
| [54] | Rowe A K, Bertolli J, Khan A S, et al. Clinical, virologic, and immunologic follow-up of convalescent Ebola haemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo [J]. J Infect Dis, 1999, 179 (Suppl 1): 28-35. |
| [55] | Colebunders R, Borchert M. Ebola haemorrhagic fever—A review [J]. J Infect, 2000, 40(1): 16-20. |
| [56] | Centres for Disease Control and Prevention. Interim guidance for monitoring and movement of persons with Ebola virus disease exposure[R/OL]. [2014-08-15]. http://www.cdc.gov/vhf/ebola/hcp/monitoringand-movement-of-persons-with-exposure.html. |
| [57] | Centres for Disease Control and Prevention. Ebola hemorrhagic feversigns and symptoms [EB/OL]. [2014-08-15]. http://www.cdc.gov/vhf/ebola/symptoms/index.html. |
| [58] | Okware S I, Omaswa F G, Zaramba S, et al. An outbreak of Ebola in Uganda[J]. Tropical Medicine and International Health. 2002, 7(12): 1068-1075. |
| [59] | Kortepeter M G, Bausch D G, Bray M. Basic clinical and laboratory features of filoviral hemorrhagic fever [J]. J Infect Dis, 2011, 204 (Suppl 3): 810-816. |
| [60] | Bwaka M A, Bonnet M J, Calain P. Ebola hemorrhagic fever in Kikwit, Democratic Republic of Congo: Clinical observations in 103 patients [J]. J Infect Dis, 1999, 179(Suppl 1): 1-7. |
| [61] | Strong J E, Grolla A, Jahrling P B, et al. Filoviruses and arenaviruses[C] //Detrick B, Hamilton R G, Folds J D. Manual of molecular and clinical laboratory immunology. 7th ed. Herndo, Virginia: ASM Press, 2006: 774-790. |
| [62] | US Food and Drug Administration. Emergency use authorizations-2014 Ebola virus emergency use authorization [EB/OL]. [2014-08-17]. http://www.fda.gov/medicaldevices/safety/emergencysituations/ucm161496.htm. |
| [63] | Centres for Disease Control and Prevention. Ebola hemorrhagic feverdiagnosis[ EB/OL].[2014-08-15].http://www.cdc.gov/vhf/ebola/diagnosis/index.html. |
| [64] | Fauci A S. Ebola—Underscoring the global disparities in health care resources[EB/OL]. [2014-08-17]. http://www.nejm.org/doi/full/10.1056/NEJMp1409494. |
| [65] | Centre for Infectious Disease Research and Ppolicy. Experimental Ebola drug may have helped 2 US patients [EB/OL]. [2014-08-11]. http://www.cidrap.umn.edu/news-perspective/2014/08/experimental-ebola-drug-may-have-helped-2-us-patients. |
| [66] | Mupapa K, Massamba M, Kibadi K, et al. Treatment of Ebola haemorrhagic fever with blood transfusions from convalescent patients. International Scientific and Technical Committee [J]. J Infect Dis, 1999, 179 (Suppl 1): 18-23. |
| [67] | Feldmann H, Jones S M, Schnittler H J, et al. Therapy and prophylaxis of Ebola virus infections [J]. Curr Opin Investig Drugs, 2005, 6(8): 823-830 |
| [68] | Bray M, Paragas J. Experimental therapy of filovirus infections [J]. Antiviral Res, 2002, 54 (1): 1-17. |
| [69] | Centres for Disease Prevention and Control. Ebola hemorrhagic fever-treatment [EB/OL]. [2014-08-16]. http://www.cdc.gov/vhf/ebola/treatment/index.html. |
| [70] | Huggins J W. Prospects for treatment of viral haemorrhagic fevers with ribavirin, a broad-spectrum antiviral drug [J]. Rev Infect Dis, 1989, 11 (Suppl 4): 750-761. |
| [71] | Ignatyev G, Steinkasserer A, Streltsova M, et al. Experimental study on the possibility of treatment of some haemorrhagic fevers [J]. J Biotechnol, 2000, 83(1/2): 67-76. |
| [72] | MacNeil A, Farnon E C, Morgan O W, et al. Filovirus outbreak detection and surveillance: Lessons from Bundibugyo[J]. J Infect Dis, 2011, 204 (Suppl 3): 761-767. |
| [73] | Borchert M, Mutyaba I, van Kerkhove M D, et al. Ebola haemorrhagic fever outbreak in Masindi District, Uganda: Outbreak description and lessons learned [J]. BMC Infect Dis, 2011, 11: 357. |
| [74] | World Health Organization, Centres for Disease Control and Prevention. Infection Control for Viral Haemorrhagic Fevers [R/OL]. [2014-08-15]. http://www.cdc.gov/vhf/abroad/pdf/african-healthcare-setting-vhf.pdf. |
| [75] | Dowell S F, Mukunu R, Ksiazek T G, et al. Transmission of Ebola haemorrhagic fever: A study of risk factors in family members, Kikwit, Democratic Republic of the Congo, 1995 [J]. J Infect Dis, 1999, 179 (Suppl 1): 87-91. |
| [76] | Lloyd E S, Zaki S R, Rollin P E, et al. Long-term disease surveillance in Bandundu region, Democratic Republic of the Congo: A model for early detection and prevention of Ebola haemorrhagic fever [J]. J Infect Dis, 1999, 179 (Suppl 1): 274-280. |