2. 中国科学院机器人与智能制造创新研究院, 辽宁 沈阳 110169;
3. 中国科学院大学, 北京 100049;
4. 沈阳理工大学自动化与电气工程学院, 辽宁 沈阳 110159
2. Institutes for Robotics and Intelligent Manufacturing, Chinese Academy of Sciences, Shenyang 110169, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. School of Automation and Electrical Engineering, University of Shenyang Ligong, Shenyang 110159, China
20世纪中叶,世界上第一台机器人问世,旨在代替人高效地完成重复性工作,因而引起了人们极大的兴趣。在过去几十年间,随着科学技术的蓬勃发展,机器人已成为现代社会发展中的重要一环,被广泛应用于工业、制造、医疗、服务、军事等领域。
然而,仍存在一些挑战限制了传统的基于机电系统的机器人进一步地发展。例如,对于传统的基于电动机的驱动系统,从电源到执行机构之间的多个能量转换与传递环节会产生大量的能量损失,因此导致能量利用率较低(
智能材料的引入促进了新型机器人的产生,例如形状记忆合金(SMA)、介电弹性体(DEA)等驱动材料可用于创造软体机器人驱动系统,提高系统的灵活性与适应性。这些材料通常具有较高的能量与功率密度,但仍存在一些不可忽略的缺点[2-3]。例如,SMA需要不断加热,其响应速度慢、工作频率低、可控性较差;DEA需要较高的驱动电压;并且大多数基于软体驱动材料的机器人尺度集中于厘米级,难以在微观尺度发挥作用。
相比于传统的机电系统,大自然赋予了生命体多方面的优异性能:1) 生命体具有较高的能量转换效率(
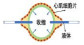
由于生命体具有传统机电系统难以复制的多方面优势,研究人员开始探索直接将生命系统应用于机器人研究,尝试将生命系统与机电系统在分子、细胞、组织尺度进行深度有机融合,以生命材料为机器人系统的功能核心,构建出集生命材料的优势(能量转换效率高、负重比大、尺寸可扩展性好、续航时间长、适应性强、本质安全等)与机电系统的优点(精度高、强度高、可批量制造、可控性好等)于一身的类生命机器人(图 1)。典型的类生命机器人由生命材料和非生命材料融合而成。其中,生命材料是实现类生命系统驱动、感知、智能等功能的核心部件,是类生命机器人区别于其他类型机器人的主要组分;非生命材料则为生命材料的生长、保持、功能实现提供必要支撑,同样是类生命机器人的重要组分;此外,为了调控类生命机器人的行为,需要通过外源刺激对其进行控制,以实现预期的功能。近年来,以生命材料为核心的类生命机器人备受关注,已成为机器人领域的研究热点,并取得了多方面显著突破。2018年,发表在《Science Robotics》上的综述性文章将类生命机器人相关研究列为未来机器人领域发展的十大挑战之一[6]。本文围绕类生命机器人常用的生命材料、非生命材料、控制方法3个方面,系统性地总结了其发展现状,详细探讨了其对应的应用场景、所面临的潜在挑战以及可能的发展方向。

|
图 1 类生命机器人示意图 Fig.1 Schematic diagram of bio-syncretic robots |
生命材料是类生命机器人的功能核心,早期曾有学者将DNA[7-9]、肌球蛋白-肌动蛋白[10-11]、驱动蛋白-微管[12-13]、F
|
|
表 1 具有不同生命材料的类生命机器人 Tab. 1 Bio-syncretic robots with different living materials |
心肌细胞又称心肌纤维,具有兴奋收缩能力,其相互连接后形成的心肌组织具有同步自发收缩的特性。原代心肌细胞可以从新生大鼠心脏中获得,具有良好的发育可塑性,经培养后可与非生命材料集成。此外,心肌细胞还具有较高的设计灵活性和尺寸可扩展性,现已被广泛应用于类生命机器人研究[2]。
在类生命机器人研究初期,研究人员致力于心肌细胞机械与动力学性能的研究,开发出了多种可用于细胞驱动力测量的方法[32-36]。例如,Park等[37]提出了一种基于聚合物微悬臂梁的测量方法,该方法利用夹层成型工艺制造了微悬臂梁阵列,然后将心肌细胞接种到微悬臂梁上,并用纤连蛋白-明胶混合物对微悬臂梁表面进行修饰,以促进心肌细胞粘附。心肌细胞自发收缩使得微悬臂梁发生偏转,经过数值分析,测得心肌细胞的收缩力为2~5 mN/mm
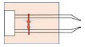
在基于心肌细胞的类生命机器人驱动方面,Xi等[41]开创性地构建出了一种自组装微型行走机器人。采用单晶反应蚀刻和金属化工艺制造了微型硅骨架,并采用Cr/Au进行心肌细胞的图案化粘附。最后,利用聚异丙基丙烯酰胺(PNIPAAm)在冷却至室温时发生液化的现象,实现了机器人的释放,在心肌细胞的自发收缩驱动下,该微型机器人能够以平均频率1.8 Hz、最大步长25
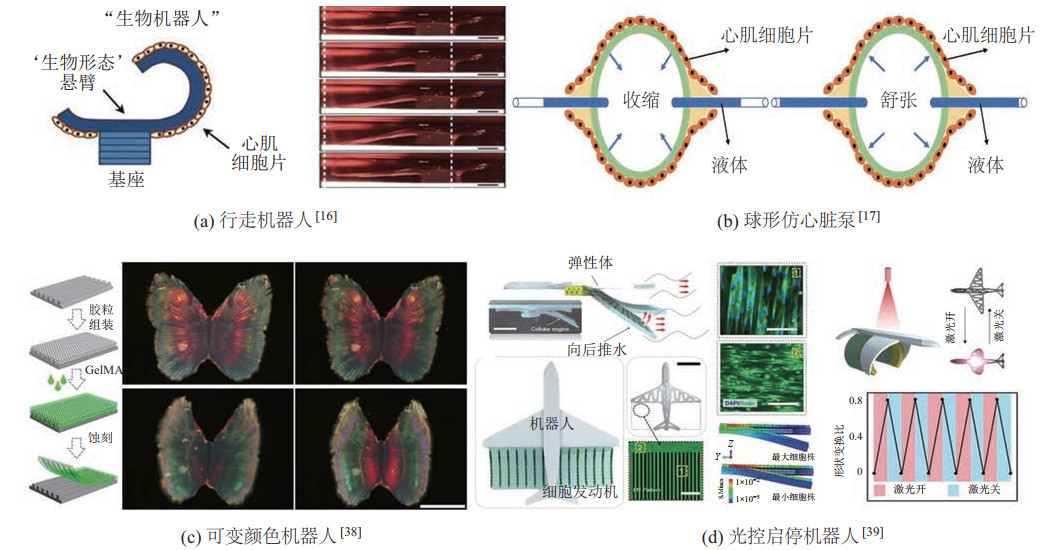
|
图 2 基于心肌细胞的类生命机器人 Fig.2 Cardiomyocytes based bio-syncretic robots |
此外,研究人员还将心肌细胞与智能材料相集成,实现了除驱动以外的功能性应用。例如,Fu等[38]受变色龙结构颜色调节机制的启发,将心肌细胞接种到了一种颜色可变的智能水凝胶薄膜上,随着心肌细胞的自发收缩-舒张,该水凝胶薄膜的结构颜色同步变化(图 2(c))。该团队将所构建的类生命机器人作为“可视化心脏芯片”,开展了心肌细胞对药物作用的响应研究,展示了类生命机器人在生物医学领域的潜在应用。基于心肌细胞的类生命机器人通常由心肌细胞的自发收缩来驱动,存在可控性较差等问题。为了提高类生命机器人的可控性,Xu等[39]将光敏水凝胶引入到心肌细胞驱动的类生命机器人研究中,利用近红外光刺激对水凝胶的形状进行控制,实现了类生命机器人的启停转换(图 2(d))。
心肌细胞具有较好的尺寸可扩展性以及有效的收缩力,而且心肌组织的制造方法简单,只需要将心肌细胞接种到软体结构中,就可以自组装形成具有驱动能力的心肌组织。但是心肌细胞仍然存在一些局限性,限制了它在类生命机器人研究中的应用。例如,心肌细胞时刻处于自发收缩-舒张状态,导致它的可控性较差,难以实现精确的受控驱动;常用的自组织制造方法难以制造出高性能的3D心肌组织,影响了类生命机器人性能的进一步提高等。
2.2 骨骼肌细胞骨骼肌是哺乳动物运动系统的重要组成部分,其受神经系统控制,可实现精准的可控收缩[45]。基于此,Herr等[46]开发了一种由青蛙半腱肌驱动的类生命机器人,在电刺激仪的刺激作用下,该机器人可以实现启停、前进、转向运动,其最大速度可达4 cm/s。尽管这种外植体肌肉可以实现有效的可控驱动,但仍存在一些限制其进一步发展的缺点,如续航时间短、尺寸可扩展性差、需要不断牺牲实验动物等[2]。相比于外植体肌肉,骨骼肌成肌细胞能够无限增殖,并且可以融合分化成为收缩运动可控的肌管。此外,骨骼肌细胞还可以与多种细胞(如神经细胞等)共培养,进行交互协同,因此,骨骼肌细胞是类生命机器人研究中较为理想的生命材料,引起研究人员的广泛关注[47]。由于肌组织的培养与制造也是类生命机器人研究的主要挑战之一,因此,该领域早期大部分的研究工作聚焦于肌组织的培养与制造。
据报道,细胞种类(小鼠的成肌细胞C2C12、鸟类胚胎的肌肉细胞、新生和成年哺乳动物的肌肉细胞[48])、培养基底(基底材料、基底硬度、基底形状)、刺激方式(电、磁、化学刺激)、制造工艺(2D制造方法、3D制造方法)等都会对骨骼肌组织的体外培养与制造产生影响。例如,培养基底材料应具有良好的生物相容性、无毒性[49]、较低的杨氏模量[50]等,以更好地促进细胞生长分化。常见的基底材料有聚二甲基硅氧烷(PDMS)、水凝胶等。此外,基底形状也会影响肌组织生物物理特性,研究表明,与平面相比,微图案化表面更有利于细胞排列和肌管形成[50-56]。例如,Lam等[57]开发了一种骨骼肌组织的微图案化制造方法。该方法首先使用刚性微拓扑图案化表面引导成肌细胞预排列,然后再将其转移到水凝胶中进行培养。结果表明,与未进行预对齐的对照组相比,使用该方法制造出的肌组织的峰值力增加了2倍,有效比力(峰值等长力/横截面积)增加了23%。Hosseini等[58]在具有微槽结构的甲基丙烯酸酐化明胶(GelMA)水凝胶基底上培养成肌细胞,获得了排列更整齐、收缩性能更强的肌管。此外,细胞外基质(ECM)蛋白质,如纤连蛋白、胶原蛋白、层粘连蛋白等,可以促进成肌细胞粘附以及肌管形成[59-62],也已被用于骨骼肌组织的体外培养与制造研究。并且研究表明,长时间的刺激训练对于肌纤维的成熟具有显著的促进作用[49],例如在细胞培养过程中进行机械拉伸[19, 63-64],电[20, 65-66]、光[21, 67]、化学刺激[68]等,可以有效提高肌管的分化效率、排列性、收缩力、成熟度等[69]。其中电刺激是骨骼肌细胞培养中最为常用的刺激方法,电脉冲刺激可以导致肌管中的钙离子瞬变,进而加速功能性肌节的组装并刺激细胞的收缩活动[65-66]。
在基于骨骼肌细胞驱动的类生命机器人研究方面,Cvetkovic等[70]将成肌细胞和ECM蛋白的混合物与通过立体光刻技术打印的非对称水凝胶结构相结合,构建了一种行走式类生命机器人(图 3(a)),在骨骼肌组织的驱动下,该机器人可以进行最大速度为156

|
图 3 基于骨骼肌细胞的类生命机器人 Fig.3 Skeletal muscle cells based bio-syncretic robots |
由于哺乳动物细胞需要严格的生存环境,上述提到的类生命机器人大多被限制于含有培养液的细胞培养皿中。为了克服这一弊端,Morimoto等[73]将骨骼肌组织与培养液等封装到胶原结构中,制造出了可以在空气中运动的类生命机器人(图 3(e))。此外,该团队指出,在胶原结构中设置灌注装置,可以实现机器人的长时间运动。
基于骨骼肌细胞的类生命机器人具有较好的尺寸可扩展性,且骨骼肌细胞在外源人工刺激下可以产生可控收缩,从而执行简单的驱动操作。但目前的外源人工刺激手段仍难以有效调控骨骼肌细胞的驱动行为,因此难以实现类生命机器人灵活复杂的运动,并且使用现有的技术难以实现骨骼肌组织的高效培养与制造,这些难点制约着类生命机器人的实用化发展。
2.3 神经-肌肉尽管已提出了多种基于不同肌细胞的类生命机器人,但现阶段的多数研究仅聚焦于采用外源人工刺激控制肌细胞进行驱动,而忽略了生命体中神经系统在肌组织生长、调控等方面的重要性。神经系统能够选择性刺激肌组织,从而控制其实现复杂而又协调的驱动模式,并且神经对于肌组织还具有营养性作用,能够促进肌肉生长并保持其正常生理功能[74]。例如,Lu等[75]通过实验证明了与电刺激肌肉相比,通过神经系统刺激可以使肌肉产生更大的驱动力。此外,神经系统还能够感知外界刺激并与外界环境交互,从而实时调控生命体的运动行为。
近年来,研究人员开展了多项基于神经-肌肉驱动的类生命机器人研究探索。例如,Webster等[76]将从海兔中分离得到的神经-肌肉组织组装到3D打印的树脂骨架上,构建了一种类生命机器人,并且通过实验对比了外部电场刺激与神经刺激肌肉的效果。结果表明,由神经刺激的肌肉能够产生更大的平均峰值张力(0.1 N)和更高的驱动速度(0.54 cm/min)。Kaufman等[23]提出了一种基于脊髓-肌肉的类生命机器人(图 4(a))。该团队将完整的大鼠脊髓节段接种到骨骼肌组织上,并将两者共培养。结果表明,脊髓外植体与肌肉组织之间形成了功能性神经-肌肉接头,并且外植体自发产生的电活动会引起肌肉组织收缩。
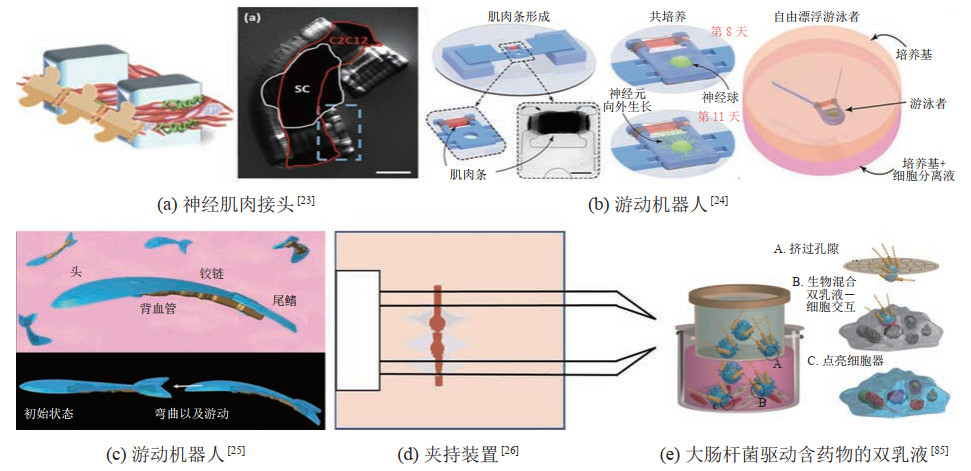
|
图 4 基于神经-肌肉/昆虫肌肉组织/微生物的类生命机器人 Fig.4 Neuro-muscle or insect muscle tissue or microorganisms based bio-syncretic robots |
除了可以通过活体分离获得用于控制肌细胞的神经组织以外,还可以通过诱导干细胞定向分化获得所需的神经细胞。例如,Cvetkovic等[77]通过诱导小鼠胚胎干细胞分化获得了含有运动神经元的胚状体,然后将胚状体与骨骼肌组织共培养,获得了神经-肌肉组织。实验表明,添加谷氨酸可以诱导神经放电,从而刺激肌组织收缩,但其收缩位移仅有不到10
相比于单一生命体材料,神经-肌肉组织的应用有望推动类生命机器人研究突破当前面临的驱动性能差、功能性不足等瓶颈。但是目前仍存在一些限制基于神经-肌肉的类生命机器人应用发展的问题。例如,难以实现神经-肌肉组织的体外高效培养;缺乏对神经-肌肉驱动控制中复杂的信号传递与转换机制的了解,难以实现基于神经-肌肉组织的类生命机器人精准控制等。此外,哺乳动物细胞需要严苛的生存条件,例如为了维持肌细胞的收缩性能,需要保证37
不同于哺乳动物,昆虫是变温动物,可以通过调节代谢水平适应不同的环境,具有较强的生存能力。例如,果蝇在55 mTorr真空度下保持60 min后,其存活率仍高达50%[79];蟑螂胚胎的一段背血管组织(DVT)在盐水溶液中可持续收缩超过260天[80]。
昆虫DVT类似于哺乳动物的心脏,是昆虫血液循环系统的功能核心,具有自发收缩的特性。以昆虫DVT为驱动单元,Akiyama等开展了相关的类生命机器人研究,并取得了一系列成果。例如,该团队构建了一种由DVT驱动的微柱阵列[81-82]。结果表明,昆虫的DVT可以在5~35
上述研究中采用的大多数DVT均从昆虫背侧分离而得,其尺寸可扩展性较差,且需要不断地牺牲实验材料,而且每个DVT的长度、性能均不一致,难以实现实验的定量分析。此外,较长的DVT容易产生不同步的自发收缩,难以实现类生命机器人的精准控制[86]。Akiyama团队尝试将DVT分离、重构,以获得形状较为规则的细胞片,但制造过程较为复杂,且驱动性能较差[87]。为此,Baryshyan等[88]采用组织工程的方法,从烟草天蛾胚胎中分离出肌细胞,并使用20-羟基蜕皮激素诱导其分化,获得了肌球蛋白染色阳性的细胞,该细胞在培养期间可自发收缩。此外,使用保幼激素可以抑制成肌细胞分化,促进其增殖,在冻存后该细胞仍能保持增殖活性以及分化能力。这一研究使得利用组织工程方法获得可收缩的昆虫肌肉组织成为可能。而后,该团队利用其开发的组织工程方法成功培养出了图案化昆虫肌肉组织。实验表明,该肌肉组织具有与其他生物驱动器相当的动力学特性,且具有良好的自修复能力与环境耐受能力,展现出了在不同环境下长期运行的应用潜力[89]。然而目前建立稳定的昆虫成肌细胞系仍存在较大的挑战,这限制了昆虫肌肉组织在类生命机器人研究中的应用发展。随着组织工程技术的进步,未来有望建立昆虫肌肉细胞系,推动类生命机器人环境适应性及应用广泛性的进一步提升。
2.5 微生物上述大多数基于肌肉细胞或组织的类生命机器人的尺度仍集中于厘米级,难以应用于微观环境,而微生物具有极小的尺寸,在驱动微观尺度类生命机器人方面展现出了巨大的应用潜力,引起了研究人员的广泛兴趣。自然界中大多数微生物均具有较强的自驱动能力,例如大肠杆菌、黏质沙雷氏菌、鼠伤寒沙门氏菌等细菌生物,以及莱茵衣藻、微藻物种等藻类生物均能够通过鞭毛实现有效的运动[69]。并且它们具有较强的环境适应性,有些微生物可耐受超过110
利用微生物的运动学性能,研究人员探索将其与微结构相集成的研究,进而构建出了多种基于微生物驱动的类生命机器人。例如,Darnton等[92]将黏质沙雷氏菌粘附到微珠上,在细菌的驱动下,微珠能够以4.7
体内靶向药物递送是微生物重要的应用方向之一,引起了研究人员的广泛关注。通过静电吸附、化学键等方法[1, 99]将微生物与含有药物的微结构结合[100],利用微生物的趋向性或其他辅助控制方法可以实现微生物的定向运动,从而进行体内靶向药物递送。例如,Singh等[85]利用生物素-链霉亲和素将大肠杆菌与含有“货物”的合成双乳液相结合,构建了一种用于靶向运输的类生命机器人(图 4(e))。实验表明,该机器人可以穿过微孔膜屏障,将“货物”输送到活体细胞。该机器人有望用于癌症等疾病的靶向治疗,以及高分辨率医学成像等方面。此外,Felfoul等[101]将趋磁细菌与载有药物的脂质体结合,构建了一种用于靶向药物递送的类生命机器人。趋磁细菌含有磁小体(纳米磁性颗粒)结构,可以通过磁场进行控制。该团队首先通过磁场控制机器人到达病灶区域,而后利用细菌自身趋向性控制其到达病灶深处的缺氧部位。实验证明,经过磁场定向引导后的细菌在病灶部位聚集的数量明显高于未经磁场引导的细菌。此外,趋磁细菌具有较好的生物兼容性,将其作为类生命驱动器进行药物递送,有望提升靶向性、速度、安全性。
微生物具有极小的尺寸以及独特的运动模式,其在人体血管等低雷诺数流体环境中展现出了较强的运动性能。此外,多数微生物还具有病变组织靶向性,因此基于微生物的类生命机器人在人体医学治疗领域具有巨大的应用潜力。但是微生物也存在一些缺点,限制了其在该领域中的应用发展,例如常用于类生命机器人研究的细菌具有致病性,并且利用微生物的趋向性控制机器人运动的方法存在时空分辨率低、速度慢等缺点。尽管趋磁细菌特定的磁小体结构使得其可以实现磁场辅助控制,从而提高驱动效率,但磁小体的磁力微弱,需要大量个体才能实现较好的驱动效果,并且基于单一类型生命材料的类生命机器人难以应用于多种工作环境。因此,需要开展面向微生物的生物兼容与精准控制研究,推动以微生物为驱动核心的类生命机器人的应用发展。
2.6 经过修饰的生命材料上述常用的生命材料,如心肌细胞、骨骼肌细胞、昆虫DVT和微生物均存在一些限制其在类生命机器人研究中应用发展的缺点。例如,心肌细胞和昆虫DVT受其自发收缩的影响,可控性较差;利用微生物趋向性的控制方法的时空分辨率低、速度慢;许多微生物存在致病性,限制了其在人体医学治疗中的应用。而通过光遗传学、铁磁粒子、基因改造等技术修饰上述常用的生命体材料,有望克服其存在的缺点,提高类生命机器人的可控性、本质安全性。
2.6.1 经过修饰的肌肉细胞组织心肌细胞、昆虫DVT受其自发收缩机制的影响,可控性较差,为此研究人员探索改善其可控性的方法。近年来,光遗传学已被用于修饰生命体材料,以改善其可控性,即使用微生物制剂或病毒在细胞膜表面表达光敏感离子通道,使细胞具有响应特定波长光脉冲刺激的特性[2]。
例如,Park等[102]以光遗传学修饰的心肌细胞为驱动单元,构建了一种仿鳐鱼类生命机器人(图 5(a))。通过光遗传学修饰心肌细胞,使其表达蓝光敏感离子通道,因此可以通过蓝光刺激控制其收缩,驱动机器人运动。在光脉冲刺激控制下,该机器人运动速度可达1.5 mm/s,并能够进行一些简单的避障运动。近期,该团队同样以光遗传学修饰的心肌细胞为驱动单元,构建了一种具有拮抗性双层心肌组织以及电自主起搏节点的类生命机器人(图 5(b))。通过慢病毒转导的方法在每个肌肉层中表达红光和蓝光敏感离子通道,通过交替的红蓝光刺激独立激活每个肌肉层。并且拮抗性双层肌肉能够互相作用,显著提高了其收缩频率。电自主起搏节点也可以辅助提高肌肉收缩频率,这2个特殊的设计显著提高了机器人的游动性能,其游动速度可达1.5 cm/s,存活寿命长达108天[18]。为了提高基于DVT驱动的类生命机器人的可控性,Suzumura等[103]使用光遗传学修饰黑腹果蝇的DVT,然后将其组装到PDMS微结构上,在蓝光照射下,DVT收缩,驱动微结构产生形变,并且通过改变光脉冲频率可以在不影响驱动力的情况下控制DVT的收缩频率。

|
图 5 基于经过修饰的生命材料/其他生命材料的类生命机器人 Fig.5 Modified living materials or other living materials based bio-syncretic robots |
此外,由于骨骼肌细胞不能自主节律性收缩,因此基于骨骼肌细胞的类生命机器人常采用电刺激方法控制,然而该方法存在一些缺点,例如空间分辨率低、容易对肌细胞造成损伤等[104]。相比之下,光刺激方法具有较高的时空分辨率,并且具有非侵入性、对肌细胞损伤小等优势。但是,骨骼肌细胞并不具有光响应特性,因此需要采取一些方法对其进行修饰。
Asano等[105]率先验证了利用光脉冲刺激控制骨骼肌细胞收缩的可行性。该团队通过光遗传学修饰成肌细胞,并将其培养为可收缩的肌管。实验表明,在光脉冲刺激下肌管可进行收缩,且与电脉冲刺激下产生的收缩相似。同年,Sakar等[106]在2D骨骼肌组织中证明了光遗传学修饰可实现肌组织的局部可控收缩。此外,该团队还制造了3D肌组织,并将其组装到PDMS微结构上,通过不同的光脉冲刺激策略进行控制,该肌组织可驱动微结构进行多自由度运动。上述基于光遗传学修饰的骨骼肌细胞收缩力仅有约2
许多细菌的致病性限制了其在体内介入诊疗等临床医学领域的应用,随着免疫学和基因工程的快速发展,越来越多的细菌被改造成为对人体具有本质安全性的菌种[85]。例如,Park等[107]利用经过基因工程改造后减毒的鼠伤寒沙门氏菌构建出了一种用于体内肿瘤治疗的类生命机器人。减毒后的鼠伤寒沙门氏菌对宿主的致病性减弱,但仍保留了其高度的免疫原性,从而为人体医学治疗应用提供了安全性保证。
此外,使用磁性粒子修饰方法可以实现对微生物运动的辅助控制,促进其在靶向药物运输等方面的应用发展。例如,Liu等[28]通过静电相互作用将Fe
采用光遗传学、基因工程、磁性粒子等技术对常用的生命材料进行修饰能够有效提高类生命机器人的可控性、适用性等,但是目前仍存在一些限制上述技术在类生命机器人研究中应用发展的瓶颈。例如,光遗传学、基因工程技术需要复杂的遗传工程操作、成本高、周期长,并且难以保证高效、均匀的光敏蛋白或基因表达;磁性粒子修饰技术同样会使得类生命机器人的制造过程更复杂,并且磁性粒子对于生命材料长期活性和寿命等的影响还有待进一步研究。
2.7 其他生命材料除了上述几种常见的生命材料以外,还有一些生命材料也被用于类生命机器人研究,如血细胞(巨噬细胞[109-111]、中性粒细胞[31, 112]、T细胞[113]、红细胞[114-115]、血小板[116-117])、精子[30, 118-119]、线虫[108, 120]等。
血细胞是人体防御系统的重要组成部分,能抵御和消灭入侵的病原微生物,修复体内创伤部位等,其在用于体内医学治疗的类生命机器人领域具有明显优势。例如,血细胞取自生命体,与人工材料相比具有更好的生物相容性、可降解性和本质安全性;血细胞具有吞噬或运输能力,可承载“货物”;血细胞还具有天然的趋向性,对人体病变部位具有靶向性,且具备穿透生物屏障的能力。近年来,研究人员开发出了多种基于血细胞的类生命机器人。例如,Zhang等[31]使用中性粒细胞吞噬载有药物和磁性颗粒,且由大肠杆菌细胞膜包覆的纳米凝胶,构建了一种用于靶向药物递送的双响应类生命机器人(图 5(e))。该机器人的运动由磁性颗粒的趋磁性以及中性粒细胞沿炎症因子梯度的趋化性共同驱动。在中性粒细胞的作用下,该机器人可以轻松穿过血脑屏障,到达病灶组织进行药物释放。
精子的鞭毛运动模式使其在低雷诺数流体环境中表现出了较强的运动能力,引起了研究人员的广泛关注。例如,Magdanz等[118]使用磁性微管捕获单个精子,构建出了基于精子的类生命机器人,在磁场辅助控制下,该机器人可以实现定向运动。随后,该团队使用3D打印的磁性微管捕获载有治疗药物的精子,构建出了用于靶向药物递送的类生命机器人(图 5(f)),通过磁场辅助控制,可以使该机器人撞击“肿瘤壁”,从而释放载有药物的精子。该机器人有望用于女性生殖道癌症及其他疾病的治疗[30]。此外,Dong等[108]提出了一种基于秀丽隐杆线虫的类生命机器人(图 5(g))。通过光遗传学方法对线虫背、腹侧的肌肉细胞进行修饰,使其具有光敏感特性,并使用伊维菌素麻痹线虫神经,使得其肌肉收缩只受光刺激控制。该团队利用所搭建的光控制系统实现了对线虫运动的实时反馈控制,并展示了线虫穿越“迷宫”,到达指定位置的灵活可控运动能力。
血细胞、精子等具有更好的生物相容性、可降解性以及本质安全性,在用于体内医学治疗的类生命机器人研究中具有较大的潜在优势;线虫简单的本体结构、自然有序的肌组织及其驱动模式使得基于线虫的类生命机器人更易于被系统性地控制,实现可控运动。但这些生命材料仍存在一些限制其在类生命机器人研究中应用发展的问题。例如,由血细胞、精子驱动的类生命机器人缺乏高通量制造技术,难以实现大规模批量化生产;基于线虫的类生命机器人尺寸可扩展性差,并且线虫单体之间具有差异性,难以实现具有同质性、高重现性的类生命机器人制造。随着科学技术的发展,更多适用于类生命机器人研究的生命材料有望得到进一步探索。
3 类生命机器人的非生命材料(Non-living materials for bio-syncretic robots)非生命材料是类生命机器人的重要组成部分[69],常被用作生命材料的支架、培养基底以及机器人本体结构等,为生命材料的生长、粘附、保持,以及机器人的运动,提供必要支撑。类生命机器人的性能与非生命材料的形状、物理化学性质(如柔韧性、生物相容性)等息息相关。常用的非生命材料有基底/支架材料(如PDMS、水凝胶)、图案化生长/粘附材料(如胶原蛋白、纤连蛋白、层粘连蛋白)等。接下来对类生命机器人研究中常用的非生命材料进行系统性介绍。
3.1 PDMSPDMS是类生命机器人研究中常用的软体材料,具有硬度可调节、制造方法简单、成本低等优点。PDMS的硬度可由弹性体与固化剂的比例、加热温度、固化时间等来调节,以满足生命材料所需的融合条件。通过多种制造方法可以获得具有特定结构的PDMS材料,如铸造、旋涂、薄膜切割、3D打印等。未经处理的PDMS具有疏水特性,不利于细胞粘附,因此为了改善PDMS表面特性,需要使用图案化粘附材料对其进行处理。例如,Feinberg等[121]使用纤连蛋白对PDMS薄膜进行图案化处理,然后在其表面接种心肌细胞,构建了一种肌肉薄膜(MTF),并使用PNIPAAm实现了MTF的释放。通过调节纤连蛋白图案化位置、PDMS固化温度或薄膜厚度,可以控制MTF在心肌细胞驱动下的运动模式(图 6(a))。据报道,该MTF可以实现泵液、抓取、行走、游动等功能。
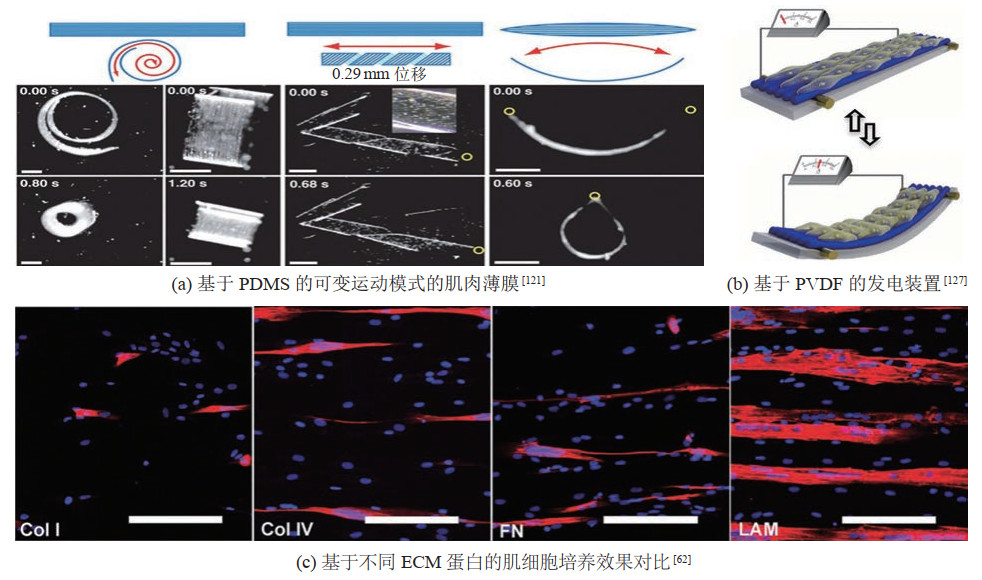
|
图 6 基于不同非生命材料的研究 Fig.6 Different non-living materials based research |
尽管在类生命机器人研究中PDMS被广泛使用,但是其仍存在一些缺点。例如,PDMS容易在固化过程中产生残余应力,使其稳定性变差,有可能对生命材料的驱动造成影响[122];并且其疏水表面可以自发恢复,不利于细胞的长时间粘附生长[123]。
3.2 水凝胶水凝胶是类生命机器人研究中常用的另一种非生命材料,具有亲水性、多孔性、生物可降解性、生物相容性、无毒性、特性可调节等特点。水凝胶的原材料来源广泛,很多水溶性或亲水性的高分子都可以通过化学或物理交联形成水凝胶。常用的水凝胶结构由基于光敏交联剂和紫外线辐射固化的3D立体光刻技术打印制造[124]。
水凝胶的多孔性有助于氧气和营养物质的扩散,并且其良好的顺应性有利于肌纤维的自发收缩,因此以水凝胶为支架/基底材料,可以制造出高性能的3D肌组织[124]。此外,水凝胶特性可调节的特点使得其能被改造以符合更多特定要求。例如,GelMA可通过调节甲基丙烯酸酐的取代率来控制其特性,取代率低时,GelMA表现出优异的生物相容性,而取代率高时,则表现出较高的力学性能。并且水凝胶还可以被改造为可变颜色水凝胶[38, 125-126]、光敏水凝胶[39]等智能材料。例如,Liu等[127]将心肌细胞单轴排列在由纤连蛋白涂覆的具有压电效应的水凝胶材料——聚偏氟乙烯(PVDF)纳米纤维上,构建出了一种可发电的器件(图 6(b))。PVDF纳米纤维能够将心肌细胞的收缩机械能转换为电能输出,并且具有良好的生物相容性,因此相比于其他常用的压电材料,其更有利于心肌细胞的活性保持。在心肌细胞以1.1 Hz的收缩频率进行驱动时,该发电装置可以产生200 mV的电压输出以及45 nA的电流输出。
此外,还有多种水凝胶已被用于类生命机器人研究,如PEG[128-129]、PEGDA[130-131]等。尽管上述水凝胶材料具有多种优点,且种类较多,应用较为广泛,但其仍存在一些缺点,例如传统的水凝胶柔性较大,虽然可以通过特性改造方法提高水凝胶的力学性能,但其物理特性在多种介质环境(如水性介质、空气介质)中的长期保持仍是当前有待解决的关键问题[132]。
3.3 其他非生命材料图案化生长/粘附材料,如胶原蛋白、纤连蛋白、层粘连蛋白等也是类生命机器人制造过程中常用的非生命材料。该类非生命材料能够模拟细胞外基质环境,促进细胞生长、粘附、迁移、分化,并且能够作为细胞结构性支架的组成部分,促进组织、器官形成。该类材料还常被用于其他材料的表面改性,例如可以对硅、PDMS等材料的表面进行修饰,以改善其疏水特性,从而促进细胞粘附、生长,或有选择性地接种细胞,提高其排列性等。例如,Duffy等[62]将成肌细胞分别接种到由纤连蛋白、胶原蛋白、层粘连蛋白修饰的微槽表面,并探究了这几种ECM蛋白质对于肌细胞培养的影响。结果表明,ECM蛋白质可以促进成肌细胞粘附、分化,并且相比于其他ECM蛋白,由层粘连蛋白图案化的表面形成的肌管面积增加了2倍以上(图 6(c))。
此外,磁性材料也广泛应用于类生命机器人的研究中。一方面,磁性材料可以用于修饰基于微生物、血细胞、精子等的类生命机器人,以提高其可控性;另一方面,磁性材料还可以用于辅助肌细胞培养。例如,Yamamoto等[133]使用磁性阳离子脂质体(MCL)修饰成肌细胞,并且在细胞培养过程中使用磁铁在培养皿底部吸引MCL,从而使细胞向培养皿中的圆柱体堆积压紧,形成了环状组织。这种培养方法有利于提高细胞的密度,促进组织的形成。
除了上述常用的非生命材料以外,还有一些非生命材料被用于类生命机器人研究。例如,Ricotti等[134]提出使用聚乳酸(PLA)超薄膜培养成肌细胞,并通过实验探究了肌细胞在PLA薄膜上的生长状况。实验表明,与聚苯乙烯(PS)薄膜相比,PLA薄膜更有利于肌细胞粘附、扩散、增殖、分化,且具有更好的生物相容性。Hasebe等[50]提出使用苯乙烯丁二烯苯乙烯嵌段共聚物作为肌细胞培养基底。与PDMS相比,该材料不需要热固化或光交联,且经图案化处理后其疏水性不容易恢复,稳定性高。
尽管目前已经提出了多种适用于类生命机器人研究的非生命材料,但现阶段其对于类生命机器人整体性能的贡献较小,一般仅被用作支架或本体结构。随着新材料、新制造工艺的出现,未来有望构建出更智能的非生命材料,除了可以更好地为生命材料提供合适的生长、生存环境,同时还可以与生命材料形成功能互补,实现类生命机器人驱动、感知、智能等系统性功能,提高类生命机器人的整体作业性能。
4 类生命机器人控制方法(Control methods for bio-syncretic robots)可控性是决定机器人整体性能的重要因素,根据不同的环境、任务采用合适的控制方法对于类生命机器人的实用化发展至关重要。生物具有丰富的感觉通路,能够对多种外界刺激迅速产生反应,因此可以通过刺激生命体驱动单元实现类生命机器人的运动控制。此外,还可以对生命材料、非生命材料进行修饰,以提高类生命机器人的可控性。如表 2所示,本文对常见的类生命机器人控制方法的优缺点进行了系统性的总结,接下来对各种控制方法进行详细介绍。
|
|
表 2 常见的类生命机器人控制方法的主要优缺点 Tab. 2 Main advantages and disadvantages of common control methods for bio-syncretic robots |
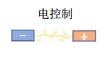
电控制方法主要用于控制基于肌肉细胞驱动的类生命机器人,电脉冲可以模拟神经信号,通过诱导钙离子瞬变,刺激肌肉收缩[1]。该方法具有快速响应、可远程控制等优点,但也存在一些限制其在类生命机器人研究中应用发展的因素,例如传统的平行板电极产生的电场均一性较差,可能会形成局部高电流,对细胞造成损伤[135];并且电极之间的高电压会造成培养液电解,从而产生有害的化学物质、气体,改变电极附近的pH值,这些都不利于细胞的活性保持[136]。为了克服这些缺点,Liu等[20]设计了一种环形分布电极阵列,通过仿真分析和实验验证,发现该电极阵列产生的电场更均匀,且相比于传统的平行板电极所需的引起肌细胞收缩的阈值电压更小,因此对肌组织造成的损伤更小。通过环形分布电极差分刺激可以实现对类生命机器人运动速度的有效控制,其最大速度可达40.9
此外,现有的电控制方法的空间分辨率较低,难以实现对类生命机器人多驱动单元的选择性控制。虽然通过侵入式电极可以提高电控制方法的空间分辨率,但其容易对肌组织造成损伤,并且电极连接线也可能会影响类生命机器人的正常运动。微电极阵列(MEA)技术有望克服这一缺点,通过在基底嵌入MEA,可以对肌细胞进行非侵入、选择性刺激,并且MEA技术已被证明可以控制肌组织中的单个肌管[137]。但是基于MEA的电控制方法也存在一些限制,例如需要复杂的外部设备,并且MEA一般是固定的,因此难以应用于移动类生命机器人的灵活运动控制。
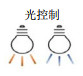
4.2 光控制光控制是实现类生命机器人可控运动的另一种较为常见的控制方法,通过光遗传学修饰可以使心肌细胞、骨骼肌细胞、昆虫DVT等生命体驱动单元具备光敏感特性,从而实现其对外部光脉冲信号的响应。该方法具有时空分辨率高、非侵入性、可远程控制等优点,并可以实现对不同肌细胞/组织的选择性、局部刺激。一种方法是使用同一波长的会聚光照射不同的肌细胞[106];另一种方法是利用光遗传学技术在肌细胞中表达对不同波长光敏感的光响应蛋白,然后通过不同波长的光实现选择性控制。例如,Lee等[18]设计了一个双层拮抗肌肉结构,并通过光遗传学修饰在每个肌肉层表达了蓝光和红光敏感离子通道,因此可以实现不同肌肉层的独立激活,从而实现选择性控制。
但是光控制方法也存在一些缺点,例如,光的穿透能力有限[138],难以对肌组织内部细胞进行激活、控制[23];会聚光产生的局部高热可能造成组织损伤[139],某些特殊波长的光还会造成DNA损伤,有可能导致细胞基因突变或死亡;并且光学控制系统需跟随类生命机器人运动而实时调控,限制了机器人的运动灵活性和应用场景。
4.3 化学控制化学控制方法的适用性较强,可用于大多数以活体细胞为驱动核心的类生命机器人。研究表明,某些化学物质可以控制肌细胞组织的收缩频率和幅度,例如,异丙肾上腺素可以提高心肌细胞收缩力和收缩频率,而高浓度钾离子溶液则会抑制心肌细胞收缩,甚至对其造成不可逆的伤害[126];胰岛素样生长因子、肌酸、糖皮质激素等药物可增强骨骼肌细胞的强直收缩力[140];甲壳动物心脏活性肽可以显著提高昆虫DVT的收缩频率[84]。在神经-肌肉组织中,化学药物(如卡巴胆碱[76]、谷氨酸[77])还可以诱导神经放电,从而控制肌组织收缩,并且通过改变化学药物的浓度可以控制其收缩频率。
此外,一些微生物的趋化性使得它们可以被化学药物控制。例如,Kim等[141]通过实验证明了黏质沙雷氏菌会向化学引诱剂(如苏氨酸)浓度高的区域运动,并且化学引诱剂还可以提高其运动速度。Park等[142]通过实验证明了鼠伤寒沙雷氏菌会聚集在化学引诱剂(如天冬氨酸)浓度高的区域,而远离化学趋避剂(如NiSO
化学控制方法目前主要应用于基于微生物或血液细胞的类生命机器人控制研究,其优点在于无需外部系统,仅靠环境固有物质即可实现机器人运动控制[107]。此外,该方法还可以与其他控制方法相结合,以提高类生命机器人的受控运动性能。但是化学控制方法也存在较多的局限性,例如,化学药物扩散需要一定时间,因此导致该方法响应时间较长[99];化学控制下的运动具有一定的随机性,无法实现精确的运动控制,并且随着化学物质浓度的降低,控制作用也会明显减弱。
4.4 磁控制相比于电控制、光控制与化学控制方法,磁控制方法具有一个明显的优点,即磁场穿透性强,适用于人体内等大多数环境[99]。磁控制方法已被证明可用于基于趋磁细菌[101, 143]以及基于磁性材料修饰的微生物[28-29]、血细胞[31]、精子[30, 119]等驱动的类生命机器人运动控制。此外,该方法还有望用于基于肌肉细胞或组织驱动的类生命机器人运动控制,例如,Zhang等[144]构建了一种具有磁性颗粒的由心肌细胞驱动的仿海豚类生命机器人,通过磁场的辅助控制可以实现机器人运动的人为调控以及增强等。
磁场强大的穿透力使得磁控制方法具有较强的环境适应性。此外,磁控制方法还具有响应速度快、可远程控制、可建立相对精确的控制模型等优点。然而,磁控制方法也存在一定的局限性,例如难以实现选择性控制,需要复杂的外部控制设备,并且较强的电磁体所产生的热量容易造成组织损伤等。
4.5 其他控制方法除了上述电控制、光控制、化学控制、磁控制方法,还有一些其他的控制方法也被用于类生命机器人运动控制研究。例如利用微生物趋气性、趋热性等的控制方法。许多细菌是厌氧菌,而肿瘤组织区域处于缺氧状态,因此可以利用细菌的趋气性进行肿瘤靶向药物递送[101]。此外,还可以通过物理结构实现类生命机器人的运动控制。例如设计结构非对称的支架[16, 19, 22],在生命材料的驱动下类生命机器人会向特定方向运动;将类生命机器人限制在定向物理结构中,以控制其运动[118, 126, 142];还可以通过物理结构进行类生命机器人的启停控制[39]。
如表 2所示,尽管已经提出了多种可用于类生命机器人运动控制的方法,但是大多数方法仍存在一定的局限性,因此难以实现类生命机器人的有效灵活运动控制。为了提高类生命机器人的受控特性,使其在多种工作环境中开展复杂的作业任务,可以采用多种控制方法进行协同控制。例如,将磁控制与趋向性控制方法相结合,首先使用磁场控制药物递送机器人以较快的速度靠近肿瘤区域,再利用趋向性控制使其到达肿瘤组织深处,进行药物释放,进而实现高效、精准的运动控制。此外,随着科学技术的进步,新的可用于类生命机器人研究的控制策略有待进一步发展,进而推动类生命机器人的实用化进程。
5 应用场景(Application scenarios)类生命机器人的研究领域正在迅猛发展,这种多学科深度交叉的新概念机器人有望集成生命系统与机电系统的优势,为突破传统机器人所面临的负重比小、能量转换效率低、续航时间短、缺乏本质安全性等瓶颈提供潜在的思路,并在微型机器人、芯片实验室、生物医学等领域展现出了巨大的潜在应用价值,如图 7所示。
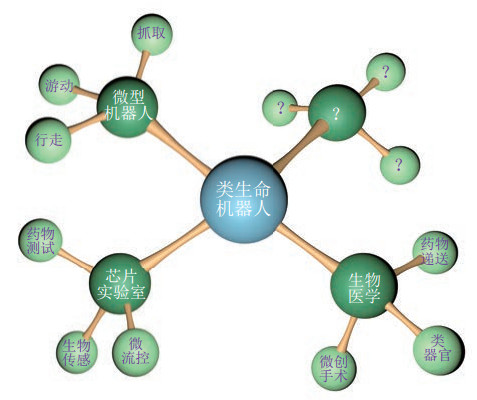
|
图 7 类生命机器人的应用场景 Fig.7 Application scenarios of bio-syncretic robots |
难以小型化是以机电系统为核心组件的传统机器人面临的发展瓶颈之一,尽管研究人员已经设计出了一些毫米级的微型机器人,但其仍存在一些缺点,如制造难度大、电源能量密度低、能量转换效率低、续航时间短等。而生命体能够在微观尺度集成驱动、感知、智能等功能,且具有较高的驱动效率和能量利用率,因此有望推动微纳机器人研究的进一步发展。例如,Ricotti等[2]通过统计对比发现,肌细胞的尺寸比最小的压电马达还要小几个数量级,但其产生的驱动力却远远大于压电马达。
目前已经提出了多种具有移动、游动、夹取、泵液、传感等功能的微型类生命机器人,这些机器人能够在狭窄环境中运动,能够对微结构进行夹持、取放等操作。例如,Akiyama等[26]提出一种由昆虫DVT驱动的微镊子,其可以夹持宽度为250
芯片实验室(lab on a chip),又称微全分析系统,是指在一块仅有几平方厘米的芯片上,对生物或化学反应过程进行分析的一种技术。然而传统的芯片上往往集成了大规模的微器件,这大大增加了其制造难度,并且使用目前的技术所制造出的器件难以比拟生命体复杂精妙的结构。将生命材料与非生命材料基底相结合,可以构建出一种新型的生物芯片,有望推动药物测试、环境监测、微流控系统等研究领域的进一步发展。
目前研究人员已经开展了基于生物芯片的药物测试、环境监测等探索。例如,Sun等[126]以心肌细胞为生命材料开发出了“心脏芯片系统”,并使用该系统验证了异丙肾上腺素对心肌细胞的影响。这种心脏芯片技术不仅有望实现不同种类心脏药物的开发与测试,还有可能为探究生物学本质提供潜在平台。Borghol等[145]将大肠杆菌组装到金电极上,设计出了一种生物传感器,利用该传感器可以对环境中的葡萄糖浓度进行监测。此外,基于大肠杆菌的生物传感器还被用于苯酚[146]、重金属(如镉、汞等)[147]的毒性检测,相比于人工传感器,生物传感器具有较高的灵敏度、较低的响应阈值,有望实现更精确的环境感知。此外,研究人员还利用生命材料开发出了微流控系统。例如,Li等[22]模仿管状心脏胚胎结构,开发出了由骨骼肌细胞驱动的微型无阀泵,其有望用于微流体泵送、循环系统研究、片上器官制造等方面。
5.3 生物医学生物医学领域关系到人类身体健康,是研究人员高度关注的重点应用领域之一,类生命机器人有望为解决现有医学领域所面临的关键难题提供潜在的有效途径。
传统的基于非生命材料的微纳米机器人已在生物医学领域得到了多方面的探索,旨在提高药物递送、局部热疗、显微手术等任务的执行效率。然而这种微型机器人需要克服材料设计、大规模制造、运动控制、生物相容性、生物可降解性等方面所带来的挑战[148]。相比于传统的微型机器人,基于微生物或血细胞的类生命机器人具有易于小型化、生物相容性好等特点,有望在人体循环系统中进行自由运动,轻松穿透生物屏障,而不会引发免疫排斥反应。并且通过趋向性控制与外部控制结合,可以提高其靶向性,有效提升体内医学治疗效率。此外,在完成任务后,类生命机器人还可以自我降解,或者通过一定的手段辅助其降解,进而有效避免安全隐患[149]。
另一方面,通过将生命体细胞与生物相容性支架、蛋白质材料等结合,还有望构建出类生命器官或组织[150-152]。这种类生命器官或组织有助于人们进一步了解生命机理、病理,甚至还有望植入人体,帮助具有生理障碍、疾病的患者康复。
6 挑战与展望(Challenges and outlook)由于类生命机器人具有较大的发展潜力,近些年吸引了国内外众多研究人员的广泛关注,并取得了一系列显著成果,已经在许多领域展现出了巨大的应用前景。然而类生命机器人研究仍处于起步阶段,目前还存在一些亟待解决的挑战,具体如下。
6.1 生命材料的获取、培养与制造目前类生命机器人研究中常用的生命材料获取方法主要有:1) 采用完整的生命体(如微生物);2) 分离活体细胞或组织(如心肌细胞、昆虫DVT、神经组织);3) 诱导细胞系(如骨骼肌细胞)或胚胎干细胞分化(如神经组织)。这些生命材料的获取方法存在一定的限制,例如,完整的生命体尺寸可扩展性差,适用性有限;而活体分离的方法需要不断牺牲生命体;尽管诱导干细胞定向分化有望避免牺牲生命体,但是干细胞分化过程较为复杂、难度大、成本高,且难以保证分化效率。通过诱导成肌细胞分化可以得到骨骼肌细胞,这种细胞系成本相对较低,且获取方便,但同样存在体外分化效率低、收缩力弱等挑战,因此限制了其在类生命机器人研究中的进一步应用。随着生命科学等相关领域的发展,这些问题有望得到进一步解决。
除了在获取方面存在挑战以外,生命材料的培养也面临着诸多瓶颈。以肌细胞为例,尽管研究人员已经提出了多种培养方法,但培养出的肌组织仍无法达到天然肌组织的性能。例如,Nomura等[63]近期提出了一种具有肌腱结构的模块化肌组织培养方法。相比于其他方法,使用该方法培养出的肌组织在驱动力方面有所提升,但是与天然的肌组织相比仍存在很大差距。其主要原因在于现有的培养技术难以将氧气和营养物质运送到肌组织内部,因此无法培养出高性能的3D肌组织。此外,培养肌细胞需要严苛的条件以尽可能模拟人体生理环境,这导致很多类生命机器人无法脱离液体培养基。尽管研究人员已经开发出了可以在气体环境中操作的类生命机器人,但复杂的保护装置以及营养物质更换程序限制了该机器人的进一步应用发展。
由于血液循环系统遍布全身,人体的肌组织能够得到充分的氧气与营养物质,且其代谢产物可以及时排放到循环系统中,因此天然肌组织具有较大的尺寸、较强的性能以及较长的存活时间。受人体血液循环系统的启发,人工血管网络的引入将有望改善现有的培养条件,实现体外肌肉驱动组织从微型向宏观的拓展,有效提高生命材料的驱动性能。此外,利用人工血管网络进行氧气和营养物质输送,还有望促进可在气体环境中操作的类生命机器人的发展,突破目前难以脱离液体环境的瓶颈。
良好的可重现性、大规模批量化生产制造是以机电系统为核心的传统机器人的特点之一,而这也是类生命机器人研究目前所面临的关键挑战。其主要原因在于生命材料难以在批量化生产制造的同时保证一致的尺寸与性能。以骨骼肌细胞为例,尽管已经提出了一些模块化制造方法,但由于成肌细胞与ECM蛋白质等材料的混合比例、空间相对位置等难以精准控制,因而所制造出的肌组织彼此之间不可避免地会存在尺寸、肌管数量、收缩性能等差异。3D生物打印技术有望成为突破上述挑战的有效途径[45]。通过将支架材料、细胞、细胞生长必备的蛋白质等组合在一起形成“生物墨水”进行定制化的逐层打印,可以有效减少人为因素的干扰,有望实现复杂而又精确的生命体结构批量化制造。并且,利用生物打印技术还可以实现多种细胞的混合打印,从而丰富生命材料的功能,为构建多功能型类生命机器人提供支撑。
6.2 类生命机器人的可控性尽管已经提出了一些用于类生命机器人运动控制的方法,但现阶段的控制方法大多仅局限于进行类生命机器人简单的运动展示,难以实现机器人运动速度、方向或输出力的精准控制。相比之下,传统的机器人则具有较为成熟的控制系统,能够实现精准且复杂的可控运动。因此亟待开发出新的控制方法以提高类生命机器人的行为可控性。通过将多种控制方法组合进行协同控制,有望改善类生命机器人的受控性能。此外,哺乳动物具有复杂的神经系统,其运动神经元可以选择性刺激骨骼肌组织,从而实现机体的灵活复杂运动。近年来,研究人员提出了基于神经-肌肉的类生命机器人研究,尽管相关工作仅处于起步阶段,但是随着对于神经-肌肉驱动控制机理的进一步挖掘,未来有望构建基于神经-肌肉驱动理论模型的控制方法,推动类生命机器人由简单驱动向复杂可控行为迈进。
6.3 类生命机器人的多功能性现有类生命机器人研究大多以运动功能演示为主,并没有发挥出集驱动、感知、智能等多功能于一身的优势。智能材料,如可变颜色水凝胶的引入,使得类生命机器人在运动的同时,具备了一定的感知能力,根据水凝胶颜色的变化可以直观地判断机器人的速度、活性,从而制定不同的控制策略。此外,多种生命材料的交互共融有望进一步推动多功能型类生命机器人的发展。例如,神经系统可以感知外界刺激,与外界环境进行交互,是机体内对生理功能活动调节起主导作用的系统。神经-肌肉组织的引入有望丰富类生命机器人的功能,提高类生命机器人的性能,推动类生命机器人在多环境、多场景下的实用化发展进程。
此外,组织工程、3D生物打印、多材料打印等先进技术的进步有望促进类生命机器人领域的发展,创造出更智能的类生命机器人。
7 结论(Conclusion)依据类生命机器人中常用的生命材料、非生命材料、控制方法对其发展现状进行了系统性的总结,并讨论了类生命机器人潜在的应用场景、目前面临的挑战与未来的发展方向。类生命机器人研究涉及生物学、医学、机械、物理、化学、材料学、控制学等多学科领域的深度交叉共融,是一个具有巨大应用潜力同时又极具挑战性的新兴领域。尽管目前类生命机器人相关研究仅处于起步阶段,但随着多学科领域的融合与发展,限制类生命机器人发展的瓶颈有望得到进一步突破。未来,具有高驱动性能、高能量转换效率、高本质安全性,且集成类生命感知与智能的多功能型类生命机器人有望在多个领域发挥重要作用,以一种新的机器人范式为人类社会发展做出贡献。
| [1] |
Chan V, Asada H H, Bashir R. Utilization and control of bioactuators across multiple length scales[J]. Lab on a Chip, 2014, 14(4): 653-670. DOI:10.1039/C3LC50989C |
| [2] |
Ricotti L, Trimmer B, Feinberg A W, et al. Biohybrid actuators for robotics: A review of devices actuated by living cells[J]. Science Robotics, 2017, 2(12). DOI:10.1126/scirobotics.aaq049 |
| [3] |
Gupta U, Qin L, Wang Y, et al. Soft robots based on dielectric elastomer actuators: A review[J]. Smart Materials and Structures, 2019, 28(10). DOI:10.1088/1361-665X/ab3a77 |
| [4] |
Burrows M. Froghopper insects leap to new heights[J]. Nature, 2003, 424(6948): 509-509. DOI:10.1038/424509a |
| [5] |
Queen Mary, University of London. Pulling power points the way to world's strongest insect—A dung beetle[EB/OL]. (2010-03-24)[2022-06-27]. https://www.sciencedaily.com/releases/2010/03/100323212158.htm.
|
| [6] |
Yang G-Z, Bellingham J, Dupont P E, et al. The grand challenges of Science Robotics[J]. Science Robotics, 2018, 3(14). DOI:10.1126/scirobotics.aar7650 |
| [7] |
Simmel F C, Yurke B. Using DNA to construct and power a nanoactuator[J]. Physical Review E, 2001, 63(4). DOI:10.1103/PhysRevE.63.041913 |
| [8] |
Shin J-S, Pierce N A. A synthetic DNA walker for molecular transport[J]. Journal of the American Chemical Society, 2004, 126(35): 10834-10835. DOI:10.1021/ja047543j |
| [9] |
Tian Y, He Y, Chen Y, et al. A DNAzyme that walks processively and autonomously along a one-dimensional track[J]. Angewandte Chemie, 2005, 117(28): 4429-4432. DOI:10.1002/ange.200500703 |
| [10] |
Huxley A. Mechanics and models of the myosin motor[J]. Philosophical Transactions of the Royal Society of London, Series B: Biological Sciences, 2000, 355(1396): 433-440. DOI:10.1098/rstb.2000.0584 |
| [11] |
Spudich J A. The myosin swinging cross-bridge model[J]. Nature Reviews: Molecular Cell Biology, 2001, 2(5): 387-392. DOI:10.1038/35073086 |
| [12] |
Limberis L, Magda J J, Stewart R J. Polarized alignment and surface immobilization of microtubules for kinesin-powered nanodevices[J]. Nano Letters, 2001, 1(5): 277-280. DOI:10.1021/nl0155375 |
| [13] |
Muthukrishnan G, Hutchins B M, Williams M E, et al. Transport of semiconductor nanocrystals by kinesin molecular motors[J]. Small, 2006, 2(5): 626-630. DOI:10.1002/smll.200500223 |
| [14] |
Noji H, Yasuda R, Yoshida M, et al. Direct observation of the rotation of F1-ATPase[J]. Nature, 1997, 386(6622): 299-302. DOI:10.1038/386299a0 |
| [15] |
Soong R K, Bachand G D, Neves H P, et al. Powering an inorganic nanodevice with a biomolecular motor[J]. Science, 2000, 290(5496): 1555-1558. DOI:10.1126/science.290.5496.1555 |
| [16] |
Chan V, Park K, Collens M B, et al. Development of miniaturized walking biological machines[J]. Scientific Reports, 2012, 2(1): 1-8. |
| [17] |
Tanaka Y, Sato K, Shimizu T, et al. A micro-spherical heart pump powered by cultured cardiomyocytes[J]. Lab on a Chip, 2007, 7(2): 207-212. DOI:10.1039/B612082B |
| [18] |
Lee K Y, Park S-J, Matthews D G, et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics[J]. Science, 2022, 375(6581): 639-647. DOI:10.1126/science.abh0474 |
| [19] |
Guix M, Mestre R, Patiño T, et al. Biohybrid soft robots with self-stimulating skeletons[J]. Science Robotics, 2021, 6(53). DOI:10.1126/scirobotics.abe7577 |
| [20] |
Liu L Q, Zhang C, Wang W X, et al. Regulation of C2C12 differentiation and control of the beating dynamics of contractile cells for a muscle-driven biosyncretic crawler by electrical stimulation[J]. Soft Robotics, 2018, 5(6): 748-760. DOI:10.1089/soro.2018.0017 |
| [21] |
Raman R, Cvetkovic C, Uzel S G, et al. Optogenetic skeletal muscle-powered adaptive biological machines[J]. Proceedings of the National Academy of Sciences, 2016, 113(13): 3497-3502. DOI:10.1073/pnas.1516139113 |
| [22] |
Li Z, Seo Y, Aydin O, et al. Biohybrid valveless pump-bot powered by engineered skeletal muscle[J]. Proceedings of the National Academy of Sciences, 2019, 116(5): 1543-1548. DOI:10.1073/pnas.1817682116 |
| [23] |
Kaufman C D, Liu S, Cvetkovic C, et al. Emergence of functional neuromuscular junctions in an engineered, multicellular spinal cord-muscle bioactuator[J]. APL Bioengineering, 2020, 4(2). DOI:10.1063/1.5121440 |
| [24] |
Aydin O, Zhang X, Nuethong S, et al. Neuromuscular actuation of biohybrid motile bots[J]. Proceedings of the National Academy of Sciences, 2019, 116(40): 19841-19847. DOI:10.1073/pnas.1907051116 |
| [25] |
Yalikun Y, Uesugi K, Hiroki M, et al. Insect muscular tissue-powered swimming robot[J]. Actuators, 2019, 8(2). DOI:10.3390/act8020030 |
| [26] |
Akiyama Y, Sakuma T, Funakoshi K, et al. Atmospheric-operable bioactuator powered by insect muscle packaged with medium[J]. Lab on a Chip, 2013, 13(24): 4870-4880. DOI:10.1039/c3lc50490e |
| [27] |
Alapan Y, Yasa O, Schauer O, et al. Soft erythrocyte-based bacterial microswimmers for cargo delivery[J]. Science Robotics, 2018, 3(17). DOI:10.1126/scirobotics.aar4423 |
| [28] |
Liu L, Wu J Y, Chen B, et al. Magnetically actuated biohybrid microswimmers for precise photothermal muscle contraction[J]. ACS Nano, 2022, 16(4): 6515-6526. DOI:10.1021/acsnano.2c00833 |
| [29] |
Kim D H, Cheang U K, Kőhidai L, et al. Artificial magnetotactic motion control of Tetrahymena pyriformis using ferromagnetic nanoparticles: A tool for fabrication of microbiorobots[J]. Applied Physics Letters, 2010, 97(17). DOI:10.1063/1.3497275 |
| [30] |
Xu H, Medina-Sánchez M, Magdanz V, et al. Sperm-hybrid micromotor for targeted drug delivery[J]. ACS Nano, 2018, 12(1): 327-337. DOI:10.1021/acsnano.7b06398 |
| [31] |
Zhang H Y, Li Z S, Gao C Y, et al. Dual-responsive biohybrid neutrobots for active target delivery[J]. Science Robotics, 2021, 6(52). DOI:10.1126/scirobotics.aaz9519 |
| [32] |
Lin G, Pister K S, Roos K P. Surface micromachined polysilicon heart cell force transducer[J]. Journal of Microelectromechanical Systems, 2000, 9(1): 9-17. DOI:10.1109/84.825771 |
| [33] |
Tan J L, Tien J, Pirone D M, et al. Cells lying on a bed of microneedles: An approach to isolate mechanical force[J]. Proceedings of the National Academy of Sciences, 2003, 100(4): 1484-1489. DOI:10.1073/pnas.0235407100 |
| [34] |
Zhao Y, Zhang X. Contraction force measurements in cardiac myocytes using PDMS pillar arrays[C]//IEEE 18th International Conference on Micro Electro Mechanical Systems. Piscataway, USA: IEEE, 2005: 834-837.
|
| [35] |
Balaban N Q, Schwarz U S, Riveline D, et al. Force and focal adhesion assembly: A close relationship studied using elastic micropatterned substrates[J]. Nature Cell Biology, 2001, 3(5): 466-472. DOI:10.1038/35074532 |
| [36] |
Zhang C, Wang W X, He W H, et al. Dynamic model for characterizing contractile behaviors and mechanical properties of a cardiomyocyte[J]. Biophysical Journal, 2018, 114(1): 188-200. DOI:10.1016/j.bpj.2017.11.002 |
| [37] |
Park J, Ryu J, Choi S K, et al. Real-time measurement of the contractile forces of self-organized cardiomyocytes on hybrid biopolymer microcantilevers[J]. Analytical Chemistry, 2005, 77(20): 6571-6580. DOI:10.1021/ac0507800 |
| [38] |
Fu F F, Shang L R, Chen Z Y, et al. Bioinspired living structural color hydrogels[J]. Science Robotics, 2018, 3(16). DOI:10.1126/scirobotics.aar8580 |
| [39] |
Xu B Z, Han X M, Hu Y W, et al. A remotely controlled transformable soft robot based on engineered cardiac tissue construct[J]. Small, 2019, 15(18). DOI:10.1002/smll.201900006 |
| [40] |
Kim D-H, Park J, Suh K Y, et al. Fabrication of patterned micromuscles with high activity for powering biohybrid microdevices[J]. Sensors and Actuators B: Chemical, 2006, 117(2): 391-400. DOI:10.1016/j.snb.2005.11.051 |
| [41] |
Xi J, Schmidt J J, Montemagno C D. Self-assembled microdevices driven by muscle[J]. Nature Materials, 2005, 4(2): 180-184. DOI:10.1038/nmat1308 |
| [42] |
Kim J, Park J, Yang S, et al. Establishment of a fabrication method for a long-term actuated hybrid cell robot[J]. Lab on a Chip, 2007, 7(11): 1504-1508. DOI:10.1039/b705367c |
| [43] |
Nawroth J C, Lee H, Feinberg A W, et al. A tissue-engineered jellyfish with biomimetic propulsion[J]. Nature Biotechnology, 2012, 30(8): 792-797. DOI:10.1038/nbt.2269 |
| [44] |
Williams B J, Anand S V, Rajagopalan J, et al. A self-propelled biohybrid swimmer at low Reynolds number[J]. Nature Communications, 2014, 5(1): 1-8. |
| [45] |
Jiang Y, Torun T, Maffioletti S M, et al. Bioengineering human skeletal muscle models: Recent advances, current challenges and future perspectives[J]. Experimental Cell Research, 2022, 416(2). DOI:10.1016/j.yexcr.2022.113133 |
| [46] |
Herr H, Dennis R G. A swimming robot actuated by living muscle tissue[J]. Journal of Neuroengineering and Rehabilitation, 2004, 1(1): 1-9. DOI:10.1186/1743-0003-1-1 |
| [47] |
Shimizu K, Sasaki H, Hida H, et al. Assembly of skeletal muscle cells on a Si-MEMS device and their generative force measurement[J]. Biomedical Microdevices, 2010, 12(2): 247-252. DOI:10.1007/s10544-009-9379-4 |
| [48] |
Dennis R G, Kosnik P E, Gilbert M E, et al. Excitability and contractility of skeletal muscle engineered from primary cultures and cell lines[J]. American Journal of Physiology: Cell Physiology, 2001, 280(2): C288-C295. DOI:10.1152/ajpcell.2001.280.2.C288 |
| [49] |
Strohman R C, Bayne E, Spector D, et al. Myogenesis and histogenesis of skeletal muscle on flexible membranes in vitro[J]. In Vitro Cellular & Developmental Biology, 1990, 26(2): 201-208. |
| [50] |
Hasebe A, Suematsu Y, Takeoka S, et al. Biohybrid actuators based on skeletal muscle-powered microgrooved ultrathin films consisting of poly (styrene-block-butadiene-block-styrene)[J]. ACS Biomaterials Science & Engineering, 2019, 5(11): 5734-5743. |
| [51] |
Riboldi S A, Sadr N, Pigini L, et al. Skeletal myogenesis on highly orientated microfibrous polyesterurethane scaffolds[J]. Journal of Biomedical Materials Research, Part A, 2008, 84(4): 1094-1101. |
| [52] |
Rockwood D N, Woodhouse K A, Fromstein J D, et al. Characterization of biodegradable polyurethane microfibers for tissue engineering[J]. Journal of Biomaterials Science, Polymer Edition, 2007, 18(6): 743-758. DOI:10.1163/156856207781034115 |
| [53] |
Evans D J, Britland S, Wigmore P M. Differential response of fetal and neonatal myoblasts to topographical guidance cues in vitro[J]. Development Genes and Evolution, 1999, 209(7): 438-442. DOI:10.1007/s004270050275 |
| [54] |
Patz T, Doraiswamy A, Narayan R, et al. Two-dimensional differential adherence and alignment of C2C12 myoblasts[J]. Materials Science and Engineering: B, 2005, 123(3): 242-247. DOI:10.1016/j.mseb.2005.08.088 |
| [55] |
Clark P, Dunn G, Knibbs A, et al. Alignment of myoblasts on ultrafine gratings inhibits fusion in vitro[J]. The International Journal of Biochemistry & Cell Biology, 2002, 34(7): 816-825. |
| [56] |
Jiang X Y, Takayama S, Qian X P, et al. Controlling mammalian cell spreading and cytoskeletal arrangement with conveniently fabricated continuous wavy features on poly (dimethylsiloxane)[J]. Langmuir, 2002, 18(8): 3273-3280. DOI:10.1021/la011668+ |
| [57] |
Lam M T, Huang Y-C, Birla R K, et al. Microfeature guided skeletal muscle tissue engineering for highly organized 3-dimensional free-standing constructs[J]. Biomaterials, 2009, 30(6): 1150-1155. DOI:10.1016/j.biomaterials.2008.11.014 |
| [58] |
Hosseini V, Ahadian S, Ostrovidov S, et al. Engineered contractile skeletal muscle tissue on a microgrooved methacrylated gelatin substrate[J]. Tissue Engineering, Part A, 2012, 18(23-24): 2453-2465. DOI:10.1089/ten.tea.2012.0181 |
| [59] |
Altomare L, Riehle M, Gadegaard N, et al. Microcontact printing of fibronectin on a biodegradable polymeric surface for skeletal muscle cell orientation[J]. The International Journal of Artificial Organs, 2010, 33(8): 535-543. DOI:10.1177/039139881003300804 |
| [60] |
Flaibani M, Boldrin L, Cimetta E, et al. Muscle differentiation and myotubes alignment is influenced by micropatterned surfaces and exogenous electrical stimulation[J]. Tissue Engineering, Part A, 2009, 15(9): 2447-2457. DOI:10.1089/ten.tea.2008.0301 |
| [61] |
Sun Y, Duffy R, Lee A, et al. Optimizing the structure and contractility of engineered skeletal muscle thin films[J]. Acta Biomaterialia, 2013, 9(8): 7885-7894. DOI:10.1016/j.actbio.2013.04.036 |
| [62] |
Duffy R M, Sun Y, Feinberg A W. Understanding the role of ECM protein composition and geometric micropatterning for engineering human skeletal muscle[J]. Annals of Biomedical Engineering, 2016, 44(6): 2076-2089. DOI:10.1007/s10439-016-1592-8 |
| [63] |
Nomura T, Takeuchi M, Kim E, et al. Development of cultured muscles with tendon structures for modular bio-actuators[J]. Micromachines, 2021, 12(4). DOI:10.3390/mi12040379 |
| [64] |
Baar K, Esser K. Phosphorylation of p70S6kcorrelates with increased skeletal muscle mass following resistance exercise[J]. American Journal of Physiology: Cell Physiology, 1999, 276(1): C120-C127. DOI:10.1152/ajpcell.1999.276.1.C120 |
| [65] |
Fujita H, Nedachi T, Kanzaki M. Accelerated de novo sarcomere assembly by electric pulse stimulation in C2C12 myotubes[J]. Experimental Cell Research, 2007, 313(9): 1853-1865. DOI:10.1016/j.yexcr.2007.03.002 |
| [66] |
Nedachi T, Fujita H, Kanzaki M. Contractile C2C12 myotube model for studying exercise-inducible responses in skeletal muscle[J]. American Journal of Physiology: Endocrinology and Metabolism, 2008, 295(5): E1191-E1204. DOI:10.1152/ajpendo.90280.2008 |
| [67] |
Raman R, Grant L, Seo Y, et al. Damage, healing, and remodeling in optogenetic skeletal muscle bioactuators[J]. Advanced Healthcare Materials, 2017, 6(12). DOI:10.1002/adhm.201700030 |
| [68] |
Romanazzo S, Forte G, Morishima K, et al. IL-12 involvement in myogenic differentiation of C2C12 in vitro[J]. Biomaterials Science, 2015, 3(3): 469-479. DOI:10.1039/C4BM00315B |
| [69] |
Zhang C, Wang W X, Xi N, et al. Development and future challenges of bio-syncretic robots[J]. Engineering, 2018, 4(4): 452-463. DOI:10.1016/j.eng.2018.07.005 |
| [70] |
Cvetkovic C, Raman R, Chan V, et al. Three-dimensionally printed biological machines powered by skeletal muscle[J]. Proceedings of the National Academy of Sciences, 2014, 111(28): 10125-10130. DOI:10.1073/pnas.1401577111 |
| [71] |
Kim T H, Kwon C H, Lee C, et al. Bio-inspired hybrid carbon nanotube muscles[J]. Scientific Reports, 2016, 6(1): 1-8. DOI:10.1038/s41598-016-0001-8 |
| [72] |
Morimoto Y, Onoe H, Takeuchi S. Biohybrid robot powered by an antagonistic pair of skeletal muscle tissues[J]. Science Robotics, 2018, 3(18). DOI:10.1126/scirobotics.aat4440 |
| [73] |
Morimoto Y, Onoe H, Takeuchi S. Biohybrid robot with skeletal muscle tissue covered with a collagen structure for moving in air[J]. APL Bioengineering, 2020, 4(2). DOI:10.1063/1.5127204 |
| [74] |
Hofmann W. Neurotrophism—Another approach[M]. Berlin, Germany: Springer, 1987: 119-134.
|
| [75] |
Lu H, McManus J M, Cullins M J, et al. Preparing the periphery for a subsequent behavior: Motor neuronal activity during biting generates little force but prepares a retractor muscle to generate larger forces during swallowing in Aplysia[J]. Journal of Neuroscience, 2015, 35(12): 5051-5066. DOI:10.1523/JNEUROSCI.0614-14.2015 |
| [76] |
Webster V A, Young F R, Patel J M, et al. 3D-printed biohybrid robots powered by neuromuscular tissue circuits from Aplysia californica[C]//Conference on Biomimetic and Biohybrid Systems. Cham, Switzerland: Springer, 2017: 475-486.
|
| [77] |
Cvetkovic C, Rich M H, Raman R, et al. A 3D-printed platform for modular neuromuscular motor units[J]. Microsystems & Nanoengineering, 2017, 3(1): 1-9. |
| [78] |
Aydin O, Passaro A P, Elhebeary M, et al. Development of 3D neuromuscular bioactuators[J]. APL Bioengineering, 2020, 4(1). DOI:10.1063/1.5134477 |
| [79] |
Shum A J, Parviz B A. Vacuum microfabrication on live fruit fly[C]//IEEE 20th International Conference on Micro Electro Mechanical Systems. Piscataway, USA: IEEE, 2007: 179-182.
|
| [80] |
Larsen W. The maintenance of embryonic cockroach heart fragments in vitro[J]. Life Sciences, 1963, 2(8): 606-610. DOI:10.1016/0024-3205(63)90114-0 |
| [81] |
Akiyama Y, Iwabuchi K, Furukawa Y, et al. Fabrication and evaluation of temperature-tolerant bioactuator driven by insect heart cells[C]//12th International Conference on Miniaturized Systems for Chemistry and Life Sciences. San Diego, USA: CBMS, 2008: 1669-1671.
|
| [82] |
Akiyama Y, Iwabuchi K, Furukawa Y, et al. Long-term and room temperature operable bioactuator powered by insect dorsal vessel tissue[J]. Lab on a Chip, 2009, 9(1): 140-144. DOI:10.1039/B809299K |
| [83] |
Uesugi K, Shimizu K, Akiyama Y, et al. Contractile performance and controllability of insect muscle-powered bioactuator with different stimulation strategies for soft robotics[J]. Soft Robotics, 2016, 3(1): 13-22. DOI:10.1089/soro.2015.0014 |
| [84] |
Akiyama Y, Odaira K, Sakiyama K, et al. Rapidly-moving insect muscle-powered microrobot and its chemical acceleration[J]. Biomedical Microdevices, 2012, 14(6): 979-986. DOI:10.1007/s10544-012-9700-5 |
| [85] |
Singh A V, Hosseinidoust Z, Park B-W, et al. Microemulsion-based soft bacteria-driven microswimmers for active cargo delivery[J]. ACS Nano, 2017, 11(10): 9759-9769. DOI:10.1021/acsnano.7b02082 |
| [86] |
Akiyama Y, Hoshino T, Iwabuchi K, et al. Room temperature operable autonomously moving bio-microrobot powered by insect dorsal vessel tissue[J]. PLoS One, 2012, 7(7). DOI:10.1371/journal.pone.0038274 |
| [87] |
Shimizu K, Takayuki H, Akiyama Y, et al. Multi-scale reconstruction and performance of insect muscle powered bioactuator from tissue to cell sheet[C]//IEEE 3rd RAS & EMBS International Conference on Biomedical Robotics and Biomechatronics. Piscataway, USA: IEEE, 2010: 425-430.
|
| [88] |
Baryshyan A L, Woods W, Trimmer B A, et al. Isolation and maintenance-free culture of contractile myotubes from Manduca sexta embryos[J]. PLoS One, 2012, 7(2). DOI:10.1371/journal.pone.0031598 |
| [89] |
Baryshyan A, Domigan L, Hunt B, et al. Self-assembled insect muscle bioactuators with long term function under a range of environmental conditions[J]. RSC Advances, 2014, 4(75): 39962-39968. DOI:10.1039/C4RA08438A |
| [90] |
Kristjansson J, Hreggvidsson G. Ecology and habitats of extremophiles[J]. World Journal of Microbiology and Biotechnology, 1995, 11(1): 17-25. DOI:10.1007/BF00339134 |
| [91] |
Martel S. Bacterial microsystems and microrobots[J]. Biomedical Microdevices, 2012, 14(6): 1033-1045. DOI:10.1007/s10544-012-9696-x |
| [92] |
Darnton N, Turner L, Breuer K, et al. Moving fluid with bacterial carpets[J]. Biophysical Journal, 2004, 86(3): 1863-1870. DOI:10.1016/S0006-3495(04)74253-8 |
| [93] |
Liu B, Breuer K S, Powers T R. Helical swimming in Stokes flow using a novel boundary-element method[J]. Physics of Fluids, 2013, 25(6). DOI:10.1063/1.4812246 |
| [94] |
Rostami M W, Liu W, Buchmann A, et al. Optimal design of bacterial carpets for fluid pumping[J]. Fluids, 2022, 7(1). DOI:10.3390/fluids7010025 |
| [95] |
Guzmán-Lastra F, Löwen H, Mathijssen A J. Active carpets drive non-equilibrium diffusion and enhanced molecular fluxes[J]. Nature Communications, 2021, 12(1): 1-15. DOI:10.1038/s41467-020-20314-w |
| [96] |
Kim M J, Breuer K S. Use of bacterial carpets to enhance mixing in microfluidic systems[J]. Journal of Fluids Engineering, 2007, 129(3): 319-324. DOI:10.1115/1.2427083 |
| [97] |
Mathijssen A J, Guzmán-Lastra F, Kaiser A, et al. Nutrient transport driven by microbial active carpets[J]. Physical Review Letters, 2018, 121(24). DOI:10.1103/PhysRevLett.121.248101 |
| [98] |
Short M B, Solari C A, Ganguly S, et al. Flows driven by flagella of multicellular organisms enhance long-range molecular transport[J]. Proceedings of the National Academy of Sciences, 2006, 103(22): 8315-8319. DOI:10.1073/pnas.0600566103 |
| [99] |
Carlsen R W, Sitti M. Bio-hybrid cell-based actuators for microsystems[J]. Small, 2014, 10(19): 3831-3851. DOI:10.1002/smll.201400384 |
| [100] |
Bastos-Arrieta J, Revilla-Guarinos A, Uspal W E, et al. Bacterial biohybrid microswimmers[J]. Frontiers in Robotics and AI, 2018, 5. DOI:10.3389/frobt.2018.00097 |
| [101] |
Felfoul O, Mohammadi M, Taherkhani S, et al. Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions[J]. Nature Nanotechnology, 2016, 11(11): 941-947. DOI:10.1038/nnano.2016.137 |
| [102] |
Park S-J, Gazzola M, Park K S, et al. Phototactic guidance of a tissue-engineered soft-robotic ray[J]. Science, 2016, 353(6295): 158-162. DOI:10.1126/science.aaf4292 |
| [103] |
Suzumura K, Funakoshi K, Hoshino T, et al. A light-regulated bio-micro-actuator powered by transgenic Drosophila melanogaster muscle tissue[C]//IEEE 24th International Conference on Micro Electro Mechanical Systems. Piscataway, USA: IEEE, 2011: 149-152.
|
| [104] |
Nagamine K, Kawashima T, Sekine S, et al. Spatiotemporally controlled contraction of micropatterned skeletal muscle cells on a hydrogel sheet[J]. Lab on a Chip, 2011, 11(3): 513-517. DOI:10.1039/C0LC00364F |
| [105] |
Asano T, Ishizua T, Yawo H. Optically controlled contraction of photosensitive skeletal muscle cells[J]. Biotechnology and Bioengineering, 2012, 109(1): 199-204. DOI:10.1002/bit.23285 |
| [106] |
Sakar M S, Neal D, Boudou T, et al. Formation and optogenetic control of engineered 3D skeletal muscle bioactuators[J]. Lab on a Chip, 2012, 12(23): 4976-4985. DOI:10.1039/c2lc40338b |
| [107] |
Park S J, Park S-H, Cho S, et al. New paradigm for tumor theranostic methodology using bacteria-based microrobot[J]. Scientific Reports, 2013, 3(1): 1-8. |
| [108] |
Dong X, Kheiri S, Lu Y, et al. Toward a living soft microrobot through optogenetic locomotion control of Caenorhabditis elegans[J]. Science Robotics, 2021, 6(55). DOI:10.1126/scirobotics.abe3950 |
| [109] |
Yasa I C, Ceylan H, Bozuyuk U, et al. Elucidating the interaction dynamics between microswimmer body and immune system for medical microrobots[J]. Science Robotics, 2020, 5(43). DOI:10.1126/scirobotics.aaz3867 |
| [110] |
Han J, Zhen J, Nguyen V D, et al. Hybrid-actuating macrophage-based microrobots for active cancer therapy[J]. Scientific Reports, 2016, 6(1): 1-10. DOI:10.1038/s41598-016-0001-8 |
| [111] |
Nguyen V D, Min H-K, Kim H Y, et al. Primary macrophage-based microrobots: An effective tumor therapy in vivo by dual-targeting function and near-infrared-triggered drug release[J]. ACS Nano, 2021, 15(5): 8492-8506. DOI:10.1021/acsnano.1c00114 |
| [112] |
Shao J X, Xuan M J, Zhang H Y, et al. Chemotaxis-guided hybrid neutrophil micromotors for targeted drug transport[J]. Angewandte Chemie, 2017, 129(42): 13115-13119. DOI:10.1002/ange.201706570 |
| [113] |
Kennedy L C, Bear A S, Young J K, et al. T cells enhance gold nanoparticle delivery to tumors in vivo[J]. Nanoscale Research Letters, 2011, 6(1): 1-11. |
| [114] |
Yan J J, Yu J C, Wang C, et al. Red blood cells for drug delivery[J]. Small Methods, 2017, 1(12). DOI:10.1002/smtd.201700270 |
| [115] |
Wu Z G, Li T L, Li J X, et al. Turning erythrocytes into functional micromotors[J]. ACS Nano, 2014, 8(12): 12041-12048. DOI:10.1021/nn506200x |
| [116] |
Lu Y F, Hu Q Y, Jiang C, et al. Platelet for drug delivery[J]. Current Opinion in Biotechnology, 2019, 58: 81-91. DOI:10.1016/j.copbio.2018.11.010 |
| [117] |
Tang S S, Zhang F Y, Gong H, et al. Enzyme-powered Janus platelet cell robots for active and targeted drug delivery[J]. Science Robotics, 2020, 5(43). DOI:10.1126/scirobotics.aba6137 |
| [118] |
Magdanz V, Sanchez S, Schmidt O G. Development of a sperm-flagella driven micro-bio-robot[J]. Advanced Materials, 2013, 25(45): 6581-6588. DOI:10.1002/adma.201302544 |
| [119] |
Xu H, Medina-Sánchez M, Maitz M F, et al. Sperm micromotors for cargo delivery through flowing blood[J]. ACS Nano, 2020, 14(3): 2982-2993. DOI:10.1021/acsnano.9b07851 |
| [120] |
Long X Y, Ye J, Zhao D, et al. Magnetogenetics: Remote non-invasive magnetic activation of neuronal activity with a magnetoreceptor[J]. Science Bulletin, 2015, 60(24): 2107-2119. DOI:10.1007/s11434-015-0902-0 |
| [121] |
Feinberg A W, Feigel A, Shevkoplyas S S, et al. Muscular thin films for building actuators and powering devices[J]. Science, 2007, 317(5843): 1366-1370. DOI:10.1126/science.1146885 |
| [122] |
Kang E, Ryoo J, Jeong G S, et al. Large-scale, ultrapliable, and free-standing nanomembranes[J]. Advanced Materials, 2013, 25(15): 2167-2173. DOI:10.1002/adma.201204619 |
| [123] |
Bodas D, Khan-Malek C. Hydrophilization and hydrophobic recovery of PDMS by oxygen plasma and chemical treatment—An SEM investigation[J]. Sensors and Actuators B: Chemical, 2007, 123(1): 368-373. DOI:10.1016/j.snb.2006.08.037 |
| [124] |
Bian W, Liau B, Badie N, et al. Mesoscopic hydrogel molding to control the 3D geometry of bioartificial muscle tissues[J]. Nature Protocols, 2009, 4(10): 1522-1534. DOI:10.1038/nprot.2009.155 |
| [125] |
Shang Y, Chen Z, Fu F, et al. Cardiomyocyte-driven structural color actuation in anisotropic inverse opals[J]. ACS Nano, 2018, 13(1): 796-802. |
| [126] |
Sun L Y, Chen Z Y, Bian F K, et al. Bioinspired soft robotic caterpillar with cardiomyocyte drivers[J]. Advanced Functional Materials, 2020, 30(6). DOI:10.1002/adfm.201907820 |
| [127] |
Liu X, Zhao H, Lu Y X, et al. In vitro cardiomyocyte-driven biogenerator based on aligned piezoelectric nanofibers[J]. Nanoscale, 2016, 8(13): 7278-7286. DOI:10.1039/C5NR08430J |
| [128] |
Yoon J, Eyster T W, Misra A C, et al. Cardiomyocyte-driven actuation in biohybrid microcylinders[J]. Advanced Materials, 2015, 27(30): 4509-4515. DOI:10.1002/adma.201501284 |
| [129] |
Cho S, Park S J, Ko S Y, et al. Development of bacteria-based microrobot using biocompatible poly (ethylene glycol)[J]. Biomedical Microdevices, 2012, 14(6): 1019-1025. DOI:10.1007/s10544-012-9704-1 |
| [130] |
Pagan-Diaz G J, Zhang X, Grant L, et al. Simulation and fabrication of stronger, larger, and faster walking biohybrid machines[J]. Advanced Functional Materials, 2018, 28(23). DOI:10.1002/adfm.201801145 |
| [131] |
Raman R, Cvetkovic C, Bashir R. A modular approach to the design, fabrication, and characterization of muscle-powered biological machines[J]. Nature Protocols, 2017, 12(3): 519-533. DOI:10.1038/nprot.2016.185 |
| [132] |
Zhang Y S, Khademhosseini A. Advances in engineering hydrogels[J]. Science, 2017, 356(6337). DOI:10.1126/science.aaf3627 |
| [133] |
Yamamoto Y, Ito A, Fujita H, et al. Functional evaluation of artificial skeletal muscle tissue constructs fabricated by a magnetic force-based tissue engineering technique[J]. Tissue Engineering, Part A, 2011, 17(1-2): 107-114. DOI:10.1089/ten.tea.2010.0312 |
| [134] |
Ricotti L, Taccola S, Pensabene V, et al. Adhesion and proliferation of skeletal muscle cells on single layer poly (lactic acid) ultra-thin films[J]. Biomedical Microdevices, 2010, 12(5): 809-819. DOI:10.1007/s10544-010-9435-0 |
| [135] |
Khodabukus A, Baar K. Defined electrical stimulation emphasizing excitability for the development and testing of engineered skeletal muscle[J]. Tissue Engineering, Part C: Methods, 2012, 18(5): 349-357. DOI:10.1089/ten.tec.2011.0364 |
| [136] |
Radisic M, Park H, Shing H, et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds[J]. Proceedings of the National Academy of Sciences, 2004, 101(52): 18129-18134. DOI:10.1073/pnas.0407817101 |
| [137] |
Langhammer C G, Kutzing M K, Luo V, et al. Skeletal myotube integration with planar microelectrode arrays in vitro for spatially selective recording and stimulation: A comparison of neuronal and myotube extracellular action potentials[J]. Biotechnology Progress, 2011, 27(3): 891-895. DOI:10.1002/btpr.609 |
| [138] |
Barolet D. Light-emitting diodes (LEDs) in dermatology[J]. Seminars in Cutaneous Medicine and Surgery, 2008, 27(4): 227-238. DOI:10.1016/j.sder.2008.08.003 |
| [139] |
Frigault M M, Lacoste J, Swift J L, et al. Live-cell microscopy—Tips and tools[J]. Journal of Cell Science, 2009, 122(6): 753-767. DOI:10.1242/jcs.033837 |
| [140] |
Vandenburgh H, Shansky J, Benesch-Lee F, et al. Automated drug screening with contractile muscle tissue engineered from dystrophic myoblasts[J]. The FASEB Journal, 2009, 23(10): 3325-3334. DOI:10.1096/fj.09-134411 |
| [141] |
Kim D, Liu A, Stitti M. Chemotactic behavior and dynamics of bacteria propelled microbeads[C]//IEEE/RSJ International Conference on Intelligent Robots and Systems. Piscataway, USA: IEEE, 2011: 1674-1679.
|
| [142] |
Park D, Park S J, Cho S, et al. Motility analysis of bacteria-based microrobot (bacteriobot) using chemical gradient microchamber[J]. Biotechnology and Bioengineering, 2014, 111(1): 134-143. DOI:10.1002/bit.25007 |
| [143] |
Martel S, Mohammadi M, Felfoul O, et al. Flagellated magnetotactic bacteria as controlled MRI-trackable propulsion and steering systems for medical nanorobots operating in the human microvasculature[J]. International Journal of Robotics Research, 2009, 28(4): 571-582. DOI:10.1177/0278364908100924 |
| [144] |
Zhang C, Wang J Y, Wang W X, et al. Modeling and analysis of bio-syncretic micro-swimmers for cardiomyocyte-based actuation[J]. Bioinspiration & Biomimetics, 2016, 11(5). DOI:10.1088/1748-3190/11/5/056006 |
| [145] |
Borghol N, Mora L, Jouenne T, et al. Monitoring of E. coli immobilization on modified gold electrode: A new bacteria-based glucose sensor[J]. Biotechnology and Bioprocess Engineering, 2010, 15(2): 220-228. DOI:10.1007/s12257-009-0146-4 |
| [146] |
Choi J-W, Park K-W, Lee D-B, et al. Cell immobilization using self-assembled synthetic oligopeptide and its application to biological toxicity detection using surface plasmon resonance[J]. Biosensors and Bioelectronics, 2005, 20(11): 2300-2305. DOI:10.1016/j.bios.2004.11.019 |
| [147] |
Souiri M, Gammoudi I, Ouada H B, et al. Escherichia coli-functionalized magnetic nanobeads as an ultrasensitive biosensor for heavy metals[J]. Procedia Chemistry, 2009, 1(1): 1027-1030. DOI:10.1016/j.proche.2009.07.256 |
| [148] |
Li J, Dekanovsky L, Khezri B, et al. Biohybrid micro- and nanorobots for intelligent drug delivery[J]. Cyborg and Bionic Systems, 2022. DOI:10.34133/2022/9824057 |
| [149] |
Lin Z, Jiang T, Shang J. The emerging technology of biohybrid micro-robots: a review[J]. Bio-Design and Manufacturing, 2022, 5(1): 107-132. DOI:10.1007/s42242-021-00135-6 |
| [150] |
Martins J-M F, Fischer C, Urzi A, et al. Self-organizing 3D human trunk neuromuscular organoids[J]. Cell Stem Cell, 2020, 26(2): 172-186. DOI:10.1016/j.stem.2019.12.007 |
| [151] |
Brassard J A, Lutolf M P. Engineering stem cell self-organization to build better organoids[J]. Cell Stem Cell, 2019, 24(6): 860-876. DOI:10.1016/j.stem.2019.05.005 |
| [152] |
Lancaster M A, Renner M, Martin C-A, et al. Cerebral organoids model human brain development and microcephaly[J]. Nature, 2013, 501(7467): 373-379. DOI:10.1038/nature12517 |
 2023, Vol. 45
2023, Vol. 45