2. 中国科学院机器人与智能制造创新研究院, 辽宁 沈阳 110169;
3. 中国科学院大学, 北京 100049
2. Institutes for Robotics and Intelligent Manufacturing, Chinese Academy of Sciences, Shenyang 110169, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
随着机器人技术的不断发展,功能各异的机器人在人类日常生活和工业生产中发挥着越来越重要的作用,已成为人类的得力助手。机器人的应用领域十分广阔,从深海[1-2], 到陆地[3-4]再到太空[5],它能够帮助人类探索更加广阔的世界。然而,当机器人操作需要从宏观尺度进入微观尺度时,如血管内药物运输、细胞内执行微操作等,现有宏观机器人则会受到尺寸限制,无法到达目标位置完成既定任务,因而亟需研发可以在微纳米尺度作业的微米和纳米机器人,即微纳米机器人。目前国际上对微纳米机器人的尺寸还没有统一的严格定义,不过科研人员通常将机器人本体尺寸介于1 mm~1 cm间的称为毫米机器人,机器人尺寸介于1 µm~1 mm间的称为微米机器人,机器人尺寸介于1 nm~1 µm之间的称为纳米机器人。微米机器人和纳米机器人统称为微纳米机器人。
在过去的几十年里,微纳米机器人迅速发展,并逐渐衍生成为一个新兴的研究领域,吸引了越来越多的科研人员投身其中进行深入的探索和研究,取得了一大批令人瞩目的科研成果,例如,微纳米机器人可以无创进入及运行在危险或难以到达的狭小空间中,可以被用来进行体内和体外检测[6]、药物递送[7-8]、组织修复和再生[9]、微操作和微装配[10]、环境修复[11-12]等。此外,2009年瑞士联邦理工学院Nelson等[13]制备了一种磁驱动螺旋微米机器人,被《吉尼斯世界记录大全》认定为“最先进的医用微型机器人”,这项认定充分印证了微纳米机器人在医疗领域的重要地位,同时也说明该领域的研究具有重要的价值和广泛的前景。
通过自上而下和自下而上等制备方法,微纳米机器人实现了从微米级到纳米级的突破。除了缩小机器人尺寸外,科研人员还制备出各种不同材质和结构的微纳米机器人,例如螺旋形[13]、管状[14]、棒状[15]、针状[16]、Janus结构[17]、花生状[18]等。科研人员的不断创新和探索推动了微纳米机器人的发展,对于微纳米机器人的控制手段也越来越多,使其运动形式逐渐多样化,如从2维运动到3维运动、从轨迹运动到避障前行、从个体运动到集群构形变化等。同时微纳米机器人可实现的功能也越来越复杂,如2维和3维的操作、体外和体内药物递送、货物运输和细胞操作等。本文对近5年来微纳米机器人的最新研究进展进行调研,根据微纳米机器人的控制手段不同,将从物理驱动、化学驱动、生物驱动和混合驱动4个方面对微纳米机器人进行分类并对其最新研究进展进行综述。
2 微纳米机器人的发展现状(The development status of micro-nano robots)驱动技术是科研人员研究微纳米机器人的重要组成部分之一。不同驱动方式不仅对微纳米机器人的运动速度和运动形式造成很大影响,同时对微纳米机器人的应用场景也加以限制。因此,本文将根据微纳米机器人不同的驱动方式来分类介绍微纳米机器人的发展现状。微纳米机器人的驱动方式可分为外部物理场驱动、化学燃料驱动、微生物驱动、以及这些驱动方式的混合驱动。
2.1 物理场驱动的微纳米机器人微纳米机器人中某些特定的材料或结构可对外界物理场作出响应,如磁性材料、光活性材料、具有凹凸端的不对称结构等。通过外界主动施加的物理场(通常有磁场、光场、声场、电场等)可使微纳米机器人具有更强的自主控制能力。
2.1.1 磁驱动微纳米机器人磁场可被精确控制,适用于远程操作,不仅可以渗透到人体内部,而且对组织无损,因此磁场被广泛用于微纳米机器人的操纵[19],在生物医疗领域具有巨大的应用前景。在微纳米机器人的制备过程中加入磁性纳米颗粒是获得磁驱动力的一种简便且有效的方式。通常通过梯度磁场[20]、旋转磁场[21-23]、振荡磁场[24-25]等方式驱动微纳米机器人的运动。通过设计制造不同的微纳米机器人结构,如螺旋状结构[26-27]、Janus微球[28]等,磁控微纳米机器人可以获得更快的运动速度、更高的控制精度,实现灵活的操纵以及集群构形变化等。
运动性能的研究是磁驱动微纳米机器人研究的重要组成部分,比如可以通过将微纳米机器人与人工智能结合,实现复杂环境中的精确自主导航和避障[29]。而磁驱动微纳米机器人最具有发展潜力的应用领域之一是生物医学领域[30-32]。科研人员主要从生物相容性、靶向运动特性、在生理溶液中的运动特性、体内可视化、逃避免疫细胞的识别等方面进行突破。
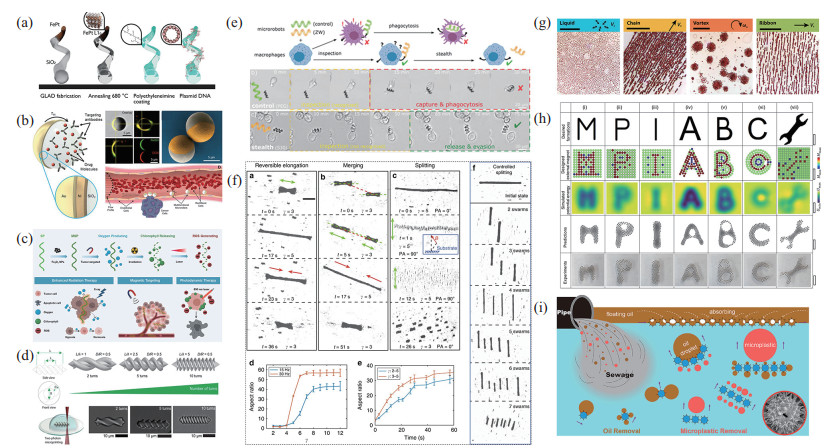
生物相容性方面。一些常用的磁性材料(如镍等)不具有生物相容性,但可通过在其表面镀上一层生物相容性材料(如氧化钛[33])等,使其不暴露于生物环境中。除此之外还通过不同磁性材料的设计开发,解决生物相容性问题,图 1(a)为Kadiri等[34]通过共沉积铁和铂(Pt)制备的铁磁FePt纳米机器人,该机器人具有非细胞毒性和生物相容性,且具有与永久钕铁硼微磁相媲美的磁化能力。
|
图 1 磁驱动微纳米机器人 Fig.1 Magnetically propelled micro-nano robots (a) 生物相容性铁磁 FePt纳米机器人[34];(b) 能够克服模拟血液流动的磁驱动微米机器人[35];(c) 可以实现成像引导诊断和协同治疗的磁性微米机器人[42];(d) 用来验证与免疫细胞相互作用的磁螺旋机器人[44];(e) 避免被免疫细胞识别的两性离子磁微米机器人[45];(f) 顺磁纳米颗粒集群不同模式的重构[24];(g) 赤铁矿胶体粒子的 4种不同集群构形[54];(h) 通过编程外部铁磁体阵列实现的静态图案[57];(i) 可汇集成链状的基于向日葵花粉粒(SPG)的磁性微型潜艇[61] |
药物递送和血液检测方面。靶向药物递送,一部分仅利用磁引导微纳米机器人到达目标位置[14],另一部分则在此基础上通过在微纳米机器人表面修饰可以和目标细胞特异性结合的抗原或抗体等[35],提高癌症治疗效率。除靶向治疗外,微纳米机器人还可用来检测和去除血液中的重金属和毒素,比如Liu等[36]设计了一种磁性介孔二氧化硅/聚赖氨酸的纳米机器人来去除血液中的Pb
生理溶液中的运动方面。在体内应用中,微纳米机器人将面临复杂的生物环境[39-40],如血液的脉动流动以及非牛顿流体等。而在复杂流体环境中的高效运动对于体内应用十分重要。Sitti课题组[35]受白细胞启发,设计了可以在3维通道中克服模拟血液流动(0.25 N/m
体内可视化方面。微纳米机器人成像是面向临床应用必须解决的主要挑战之一。Zhong等[42]在螺旋藻表面覆盖一层超顺磁颗粒(Fe
免疫逃逸方面。微纳米机器人在进入体内后,如何躲避免疫细胞防止被其识别破坏,十分关键。Sitti课题组[44]通过系统地改变螺旋微机器人的螺旋形态,包括它们的表面形态、表面化学成分和尺寸,如图 1(d)所示,研究了磁场驱动的螺旋微米机器人与免疫细胞的相互作用。他们还设计了一种非免疫原性隐形的两性离子微米机器人,可避免被免疫细胞识别[45],如图 1(e)所示,该微米机器人具有超过90 h不被巨噬细胞发现的能力。
微纳米机器人集群能够紧密合作,针对既定任务进行不同构形的变化,极大地增强了它们的能力,比如操纵物体等。对于微纳米机器人集群的研究也日渐丰富,为了使磁性微纳米机器人集群具有更好的可控性和可操纵能力,很多科研团队都在不断探索并取得了开拓性进展,例如香港中文大学张立课题组[24, 46-52]、哈尔滨工业大学谢晖课题组[32, 53-56]、德国马克斯·普朗克智能系统研究所Sitti课题组[57-59]等。张立课题组[24]利用程序振荡磁场实现了超顺磁纳米颗粒的可重构集群行为,研究了微群的产生机理,见图 1(f)。随后,又将磁活性群分为3种类型,研究了磁场诱导和介质诱导的群在生物液体中产生和导航的行为,提出了一种在不同流体环境下根据流体物理特性选择最优群体的策略[50]。谢晖课题组[54]利用交变磁场实现了赤铁矿胶体粒子的分散状、链状、漩涡状和带状的不同构形,通过切换不同的磁场(振荡磁场,锥形、竖直面内圆形、水平面内圆形旋转磁场),实现了它们之间快速可逆的转换,见图 1(g)。Sitti课题组[57]通过编程外部铁磁体阵列控制直径为100 ~350 µm的自排斥铁磁微米机器人,见图 1(h),创造了多种复杂的静态结构,包括字母M、P、I、A、B、C和扳手形状的图案,还实现了磁性微米机器人群体的协同操作,与单个机器人相比,集群可获得更高的力和力矩,具有更高的效率。
除了研究磁微群的产生机理、图案构形、可逆转换、物体的2维操作以及在生理溶液中的产生外,磁性微纳米机器人集群的实际应用也值得探索。磁性微纳米机器人集群可以显著提高去污能力,Zhang等[60]制备的磁性孢子微米机器人,是一种生物混合吸附剂,该机器人的集群状态可以显著增强去污能力;Sun等[61]制备的基于向日葵花粉粒(SPG)的微米机器人在旋转磁场的作用下会形成链状,可以实现较大结构的运输,提高去污能力,如图 1(i)所示。除了用于治理环境,微纳米机器人的集群还可以实现局部强化热疗的作用[62],用于微血管溶栓[63]等。
磁驱动微纳米机器人经历了从个体到群体、从体外到体内的研究过程。研究者通过不断的努力,从大自然中汲取灵感,制备出了不同结构和形状的微纳米机器人,在磁场作用下实现了在低雷诺数环境中高效的运动。但关于高场强下磁控微纳米机器人的跨尺度精准运动仍然存在挑战。得益于磁场易于调节、能够穿透组织且无害的特点,磁驱动微纳米机器人目前已在生物医学领域被广泛研究。
2.1.2 光驱动微纳米机器人光能是方向可控、功率可变的一种无线能量。光驱动微纳米机器人具有多种优势,比如远程可控、高时空分辨率等。光驱动微纳米机器人主要是基于光催化反应,通过在微纳米机器人附近产生物质或电荷梯度,亦或是气泡[64-65]进行驱动。光驱动微纳米机器人中通常含有可以被光激活的材料,如光催化材料或光热材料等。根据光波长的不同,可以简单地将光驱动微纳米机器人分为近红外光激活机器人、紫外光激活机器人、可见光激活机器人3类。
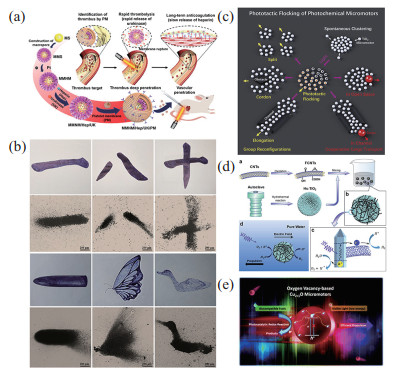
近红外光照射可以使微米机器人自主向前运动,同时可以通过激光强度调节微米机器人的运动速度[16]。利用红外光驱动的微米机器人的运动速度可以高达17.60 mm/s,可以克服水流,实现逆流运动[66]。得益于红外光穿透性强的特性,近红外光驱动的微纳米机器人可以用于生物医疗领域,如图 2(a)所示,血小板膜修饰的二氧化硅/铂纳米机器人,在近红外光作用下不仅可以运动,还可以按照理想的顺序实现药物释放,例如快速释放(3 h)溶栓性尿激酶和缓慢释放(> 20 d)抗凝剂肝素,分别用于血栓治疗中的溶栓和抗凝[67]。除此之外,近红外光驱动的微纳米机器人还可以渗透到肿瘤细胞中,对肿瘤的化疗和光热治疗起到协同作用[68-69];可以在不经过预处理的情况下安全有效地捕获和检测整个血液环境中的循环肿瘤细胞(CTC)[70];可以穿过细胞膜,进行药物递送[71];可以实现肿瘤的深层渗透[17]等。红外光可以诱导微纳米机器人汇聚,从而产生一定的集群行为。Deng等[72]通过近红外光感应的对流流动创建一个微纳米机器人群体,通过移动近红外光斑移动集群,这种策略可以应用于多种微米机器人,如TiO
|
图 2 光驱动微纳米机器人 Fig.2 Photopropelled micro-nano robots (a) 近红外光驱动血小板膜修饰的二氧化硅/铂纳米机器人,按顺序释放药物[67];(b) 聚集成不同的图案的近红外光驱动微米机器人[73];(c) 在紫外光照射下可以形成丰富集群行为的微米机器人[74];(d) 可以通过紫外光精确控制方向的微米机器人[75];(e) 可见光驱动的高效Cu2+1O微米机器人[76] |
紫外光可以诱导微纳米机器人的聚集,从而产生集群行为。比如氧化石墨烯(GO)粒子可以自发地移动到紫外光光源上,在连续的光刺激下聚集并自动周期性地收缩和膨胀[77]。同时用紫外光可以诱导赤铁矿(Fe
除了近红外光和紫外光,利用可见光驱动的微纳米机器人正成为光驱动微纳米机器人的主要发展趋势。可见光驱动的微纳米机器人更适合用于生物环境,提高微纳米机器人在可见光环境中的运动特性在微纳米机器人的研究中扮演着重要角色。Wang等[80]在纯水中利用蓝光驱动基于Ag/AgCl的球形Janus微米机器人,证明了微米机器人可以将均方位移(MSD)值在8 s内提升到800 µm
光驱动微纳米机器人的运动速度和方向可以很容易地通过光的强度和方向进行调节。但光在人体组织中的穿透深度有限,在人体较深的环境中,光驱动微纳米机器人将会失效,很难正常工作。若通过提高光的能量,保持在较深环境中的运动效果,则会对人体产生伤害,因此光驱动微纳米机器人在应用于人体组织深处时具有一定局限性,这将限制其面向生物应用。
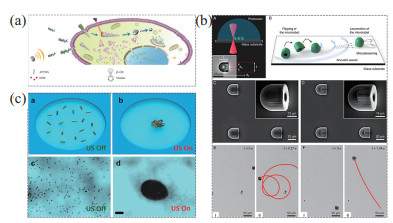
2.1.3 超声驱动微纳米机器人超声波具有按需控制、寿命长、无侵入性、非接触性和生物相容性等优点,因此声驱动方式在微纳米机器人的驱动中占有重要地位,声驱动微纳米机器人在生物体内应用方面具有很大的潜力[85]。超声具有无侵入性的特点,对人体伤害小,因此常被设计用于体内应用。例如de Avila等[86]设计了一种携带小干扰RNA(siRNA)的超声驱动纳米机器人,该机器人可以进行基因沉默,是解决RNA传输和细胞内递送相关挑战的有效工具。Wang等[87]制备了一种带白细胞膜涂层的纳米机器人,可以通过超声场的频率和电压来调节该机器人的运动速度和方向,如图 3(a)所示,该纳米机器人对癌细胞有靶向识别能力,并且可以携带抗癌药物,增强癌症治疗。同时,超声驱动的微纳米机器人在血液中运动仍具有一定的优势,如图 3(b)所示,Aghakhani等[88]利用双光子聚合技术设计制备了一个半球形圆柱微米机器人,直径为24 µm,底部有一个孔,旁边有一个“鳍”,通过优化运动性能,此微米机器人最终可以克服血液流动的影响。此外,超声波具有非接触性的特点,可以将超声波作为一个操纵手,通过设计一种新型的超声波传感阵列,操纵水中的微米机器人进行药物递送[89]。通过声场诱导粒子之间的相互作用,实现微纳米机器人的自组装[90]。利用粒子向压力节点聚集的方式,超声驱动实现了微纳米机器人的集群,如图 3(c)所示,利用声场诱导催化Au-Pt纳米机器人的可逆装配,控制集群运动[91]。相对于其他的驱动方式,超声驱动微纳米机器人操作精度不高。但超声波的穿透能力可用于深层组织成像,如果将超声驱动与超声成像完美地集成在一起,则超声控制的微纳米机器人将在生物体内发挥更大的作用。
|
图 3 超声驱动微纳米机器人 Fig.3 Ultrasonically propelled micro-nano robots (a) 能够有效地靶向、穿透并杀死癌细胞的超声驱动微米机器人[87];(b) 用双光子聚合技术制备的超声驱动微米机器人[88];(c) 超声波诱导纳米机器人的汇聚和分离[91] |
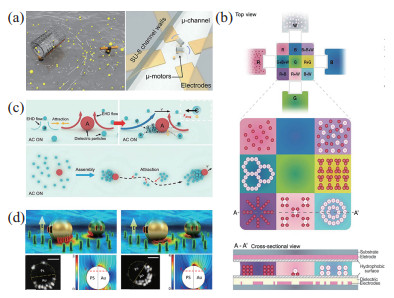
外部电场是一种驱动微纳米机器人的备选方案。通过施加电场,控制粒子附近的电流体向特定方向流动,可以实现组装和集群行为。利用这样的原理,Ma等[92]通过使用交流(AC)电场将非手性构件(即不对称胶体二聚体)组装为手性簇,证明了在手性簇中,对称性的破坏会引起周围不平衡的电动流体流动,通过施加垂直电场,可以引起手性簇的旋转。随后该课题组通过垂直施加交流电场来驱动不对称聚苯乙烯二聚体,发现了4种不同类型的集群行为[93]。同时粒子的介电泳也可以实现集群行为[94]。电场还可以用来操纵微纳米粒子,实现运动和旋转,可以将其组装成微电机阵列,如图 4(a)所示[95]。也可以利用电场制备并组装水凝胶,如图 4(b)所示,Chiang等[96]在电微流体平台上制备微凝胶并组装水凝胶结构,克服了相位、尺度和物体属性之间的操作障碍。有趣的是,通过施加交流电场,利用局部电流体动力学和扩散电泳的相互作用,可以使不同尺寸和介电性能的介电微粒子(不同尺寸的TiO
|
图 4 电驱动微纳米机器人 Fig.4 Electrically propelled micro-nano robots (a) 电场驱动硅藻壳旋转[95];(b) 在电微流体平台上制备并组装微凝胶[96];(c) 在电场驱动下不同尺寸和介电性能的介电微粒子自组织成“领导者-跟随者”微群[97];(d) 利用交流电场推动Janus粒子,选择性地收集大肠杆菌并进行电穿孔[98] |
微气泡产生速度快,容易获取且成本低,因此利用微气泡驱动微纳米机器人也是一种常见的驱动方式。气泡可以作为驱动力或本身作为微米机器人来执行操作。在实验过程中可以通过改变气泡的产生条件,制备大小不同的气泡,从而适应不同的应用需求。
首先,气泡微米机器人可以作为操作工具,在微流控芯片中,操控周围的液体或者细胞[99-100]等。如图 5(a)所示,利用微气泡阵列振荡,在多矩形结构的微流体装置中实现单细胞水平的声孔[101]。Tang等[102]利用超声波在规则的马蹄形状中产生气泡,实现了HeLa细胞和酵母细胞的捕获和旋转,如图 5(b)所示,马蹄的结构以及微流体设计的几何参数对气泡的均一性以及细胞的捕获率都有影响。Gao等[103]利用微流体中不同尺寸的腔产生不同尺寸的气泡,利用不同尺寸气泡的共振频率的不同实现了高效的双向微泵,可以用来改变流体和微粒的流动方向,如图 5(c)所示。
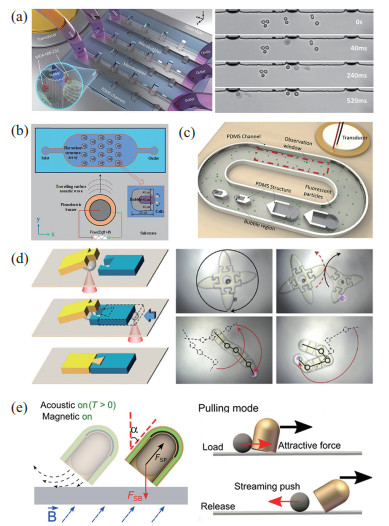
|
图 5 气泡微纳米机器人 Fig.5 Bubble micro-nano robots (a) 气泡机器人在多矩形结构微流控中实现细胞声孔效应[101];(b) 气泡机器人在微流控中实现了细胞的捕获和旋转[102];(c) 气泡在微流体中实现了高效的双向微泵[103];(d) 气泡机器人对微零件进行 3D组装并实现了整体运动[104];(e) 气泡驱动微纳米机器人实现物体操作[105] |
其次,气泡本身可以作为一个微纳米机器人,常被用来进行微操作和微装配。Dai等[106]利用近红外光在基底上产生微气泡,实现了微结构的3D操作和组装。之后又利用气泡微米机器人实现了微结构的集成组装,如图 5(d)所示,使不同类型的零件被整合组装成各种微结构,而且该结构在运动过程中不会散开[104]。气泡微米机器人还可以裂解细胞,不需要复杂的微流体结构[107]。
此外,气泡还可以作为一个推进力,推动微纳米机器人的运动。过氧化氢催化分解产生的气泡,可以推动Janus微纳米机器人产生运动[108-109]。除了化学反应产生气泡外,还可以利用声波产生气泡,如图 5(e)所示,半胶囊形状的微米机器人可以用超声波产生的气泡推进,该机器人不需要标记、表面修饰或者和附近的物体有相互作用,可以选择性地操纵单个粒子和哺乳动物细胞[105]。
微气泡可以为微纳米机器人的制备、驱动和控制提供新的解决方案。为了提高气泡微纳米机器人的效率,产生多个气泡并对各气泡进行独立控制是其发展的一个方向。另外,气泡操作通过与其他操作技术(磁控、声控、微流控等)相结合,可以完成更为复杂的微操作和装配任务。
2.2 化学驱动微纳米机器人化学驱动一般是基于化学反应进行驱动,常见的是催化反应,如酶催化反应、过氧化氢(H
过氧化氢是目前化学驱动中使用最多的一种燃料[110-111]。基于过氧化氢催化反应驱动微纳米机器人的结构设计丰富多样,有圆盘状、棒状、烧瓶状等。微纳米机器人的不同结构设计会实现不同的运动特性。如图 6(a)所示,Hu等[112]基于纳米机电系统(NEMS)技术的逐层沉积方法制造了一个圆盘状的纳米机器人,该机器人由金(Au)、镍(Ni)和铂(Pt)组成,通过改变H
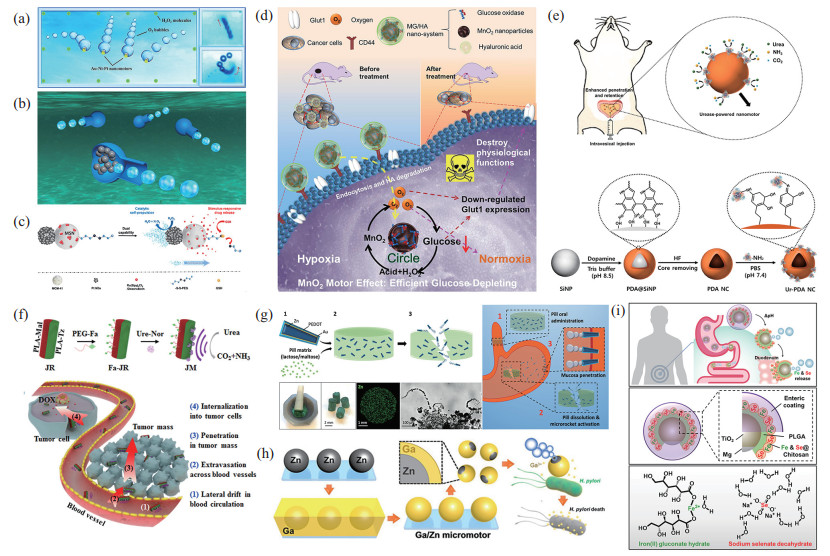
|
图 6 化学驱动微纳米机器人 Fig.6 Chemically propelled micro-nano robots (a) 圆盘状纳米机器人的推进示意图[112];(b) 烧瓶状中空碳质纳米机器人的推进示意图[114];(c) 可定向运动、释放药物杀死癌细胞的纳米机器人[117];(d) 具有葡萄糖氧化酶的纳米机器人[123];(e) 表面修饰脲酶的聚多巴胺(PDA)空心纳米粒子[124];(f) 修饰有脲酶的棒状 Janus微米机器人[15];(g) 增强口服给药的锌基微米机器人[129];(h) 可靶向治疗幽门螺旋杆菌的锌基微米机器人[130];(i) 可以输送矿物质铁和硒,治疗缺铁性贫血的镁基微米机器人[131] |
然而高浓度的过氧化氢对人体的伤害很大,这个缺点会限制其在生物体内的应用,因此需要不断改善微纳米机器人的设计,使其在低浓度下依然可以具有优异的运动性能。Ye等[115]通过电化学共还原的方法制备了FeOx-MnO
酶的生物兼容性比H
如图 6(d)所示,Zhang等[123]设计了利用葡萄糖作为燃料的二氧化锰纳米机器人,通过消耗葡萄糖进行驱动从而实现了饥饿治疗,同时该表面还有以糖蛋白CD44为靶点的高分子透明质酸,提高了饥饿治疗效果,显著抑制了肿瘤生长。尿素在泌尿系统中较为常见,利用尿素作为燃料的微纳米机器人常被用于治疗各种膀胱疾病,如图 6(e)所示,在聚多巴胺(PDA)空心纳米粒子表面修饰脲酶,制备了酶驱动的纳米机器人,该纳米机器人可以深入膀胱壁的黏膜层,并在膀胱内长期停留,有助于提高药物的疗效[124]。同时尿素驱动的微纳米机器人还可以用于肿瘤治疗,如图 6(f)所示,Zhang等[15]设计了一种棒状的Janus微米机器人,脲酶和叶酸分别结合在两侧,脲酶侧的自推进力增强了侧向漂移和跨血管壁的外渗能力,增加了微米机器人在肿瘤组织中的积累,同时增加了抗癌药物阿霉素的积累,显著抑制了肿瘤生长。除此之外,还可以在血小板细胞上修饰脲酶形成Janus马达,该机器人保留了血小板的固有生物功能,可以特异性结合癌细胞和细菌并实现靶向运输[125]。利用乳糖作为燃料,微纳米机器人将其催化分解可以用于食品加工,例如Maria-Hormigos等[126]首次在碳管纳米机器人上固定生物催化剂,通过
除了酶和过氧化氢外,利用镁或锌等材料在酸性环境中通过化学反应产生气泡实现驱动也是一种常见的微纳米机器人化学驱动方式[65, 128]。人体的胃部环境是酸性的,因此常将这种微纳米机器人用于此微环境中。如图 6(g)所示,Mundaca-Uribe等[129]制备了一种基于锌的微米机器人,可以将其装入口服的药丸中,在胃中被酸性环境激活,起到增强口服给药的作用。还可以将微纳米机器人用于靶向治疗肠胃细菌,如图 6(h)所示,Lin等[130]制备了镓/锌(Ga/Zn)微米机器人,这种锌基微米机器人可以在模拟胃酸(pH = 0.5)环境中以383 µm/s的速度进行自推进,具有良好的生物相容性和生物降解性。Karshalev等[131]制备了一种以Mg/TiO
化学驱动的微纳米机器人通常需要复杂的设计和制造工艺,使其具备更好的运动特性完成既定任务。化学驱动的微纳米机器人灵活性好,但是它的运动方向和精度存在不可控的问题,而且化学驱动微纳米机器人的运动需要不断消耗燃料或者催化剂,导致整体运动时间有限。
2.3 生物驱动微纳米机器人体内应用是微纳米机器人一个极具潜力的发展方向,如靶向治疗、去除毒素、生物传感等[135],因此制备微纳米机器人时需要考虑制备材料的生物相容性。自然界中有很多具有自运动能力的微生物,如精子[136]、藻类细胞[137-138]、细菌[139-140]和心肌细胞[141]等,这些生物体表现出高能量转换效率以及生物相容性,将它们作为驱动马达可以制备出具有特定功能的微纳米机器人[142-143],比如在药物递送时可以和癌细胞特异性靶向结合等。
Xie等[144]详细分析了莱茵衣藻机器人的游泳轨迹、速度和力。随后又利用光诱导介电泳技术(ODEP)对快速游动的莱茵衣藻细胞进行捕获和移动,形成微米级马达阵列,如图 7(a)所示,细胞的旋转频率为50~120 r/min,这样具有旋转运动能力的可编程细胞微阵列可作为生物微泵,用来驱动微流控芯片中的液体流动[145]。之后又建立了藻类引导系统,控制一群藻类细胞沿特定轨迹运动,实现了藻类细胞和微结构之间的粘附和释放,证明了藻类细胞驱动的微纳米机器人在靶向药物递送中的应用潜力[146]。
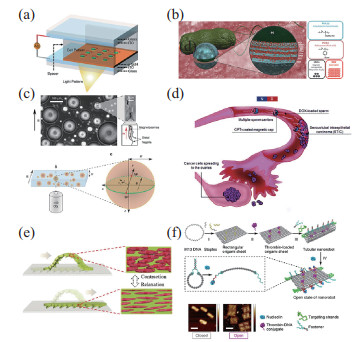
|
图 7 生物驱动微纳米机器人 Fig.7 Biologically propelled micro-nano robots (a) 莱茵衣藻细胞形成的微米机器人阵列[145];(b) 将微粒附着在大肠杆菌上形成微米机器人[147];(c) 趋磁细菌自组装成一个旋转马达[148];(d) 用于治疗宫颈癌和卵巢癌的精子微米机器人[150];(e) 心肌细胞驱动的软体机器人[152];(f) 可以在肿瘤血管中诱发血栓形成的DNA纳米机器人[153] |
除了具有鞭毛的藻类细胞可以自主运动外,部分细菌也具有运动的能力,如大肠杆菌、趋磁细菌等。Park等[147]在大肠杆菌上附着载有药物和磁性纳米粒子的聚电解质多层(PEM)微粒子,如图 7(b)所示,在趋化因子梯度和外部磁场的引导下,此大肠杆菌可以靶向癌细胞进行癌症治疗,平均运动速度可达22.5 µm/s,与被动的PEM粒子相比,细菌驱动型微米机器人在进行靶向药物递送时具有更强的药物转移能力。趋磁细菌的体内会形成纳米磁性颗粒磁小体,在外部磁场的作用下可以运动。如图 7(c)所示,将含有趋磁细菌的球形水滴悬浮在油中,在外部恒定磁场的作用下,趋磁细菌自组装成旋转机器人,趋磁细菌浓度高时,可以在水滴中心以大漩涡的形式集群运动[148]。趋磁细菌还可以作为磁性热疗剂,具有较低的细胞毒性,能够有效内化到癌细胞,通过磁热疗影响癌细胞的增殖[149]。
精子可作为高效的微米机器人,特别适合在雌性生殖系统中运动,因此将精子驱动的机器人用来治疗宫颈癌和卵巢癌具有很大潜力。如图 7(d)所示,Xu等[150]利用人类精子细胞携带阿霉素,治疗宫颈癌和卵巢癌,利用来自健康捐赠者和辅助生殖患者的精子样本,评估随着时间推移药物对精子活力和生存能力的影响,同时还利用一种常用的宫颈癌细胞系和具有患者代表性的卵巢癌细胞进行体外实验验证,表明其设计的精子微米机器人具有很强的抗癌作用。精子在前往卵母细胞的途中会遇到很多复杂流体环境,例如输卵管液的黏弹性特性等。Striggow等[151]分析了早期黄体期牛输卵管液(BOF-EL)的黏弹性特性,并评估了精子微米机器人在牛输卵管液(BOF)中的游动性能,通过优化用于捕捉精子的微结构的几何形状,精子微米机器人在输卵管液体或胶体悬浮液中的速度提高了一倍。
生物肌细胞也能作为微型驱动器,例如心肌细胞的自发性收缩力可以驱i动生物混合微米机器人。如图 7(e)所示,受到自然界中蛇和毛虫爬行机制的启发,Sun等[152]制备了一种心肌细胞驱动的软体机器人,这些机器人在微流控器官芯片中可以沿着轨道运动,并且在不同浓度的药物中表现出不同的速度。除了利用具有动力的肌细胞作为微纳米机器人的驱动器外,DNA纳米机器人在药物递送和在靶细胞附近执行特定功能上具有巨大的应用前景[154]。Li等[153]利用DNA折纸,制备了一个DNA纳米机器人,利用在肿瘤相关内皮细胞上特异性表达的核仁素对其进行功能化,核仁素靶向适配体既是一个靶向域,也是DNA纳米机器人打开的分子触发器。这个DNA纳米机器人可以在肿瘤相关的血管内诱发血栓的形成,导致肿瘤坏死,抑制肿瘤生长,如图 7(f)所示。
生物驱动的微纳米机器人具有良好的生物相容性。该类机器人通过加载药物分子,并结合外场驱动及其自身趋向性运动,在人体内药物靶向递送、癌症治疗方面将发挥重要作用,但特定的生物都需要特定的培养条件,因此生物驱动微纳米机器人的应用环境具有限制。
2.4 混合驱动微纳米机器人物理驱动、化学驱动、生物驱动这3种驱动方式都具有自己独特的优势,同时也存在一定的局限性,表 1分别将这些驱动方式的特点进行了总结和比较。在面对复杂的应用环境以及特定的功能任务时,具有单一驱动方式的微纳米机器人可能无法实现目标任务,通常使用多种控制方式共同驱动,使其具有更高效的运动能力、更复杂的功能。
|
|
表 1 微纳米机器人不同驱动方式对比 Tab. 1 Comparison of propulsion methods of micro-nano robots |
化学驱动和磁驱动方式的结合是目前研究较多的一种方式。化学驱动微纳米机器人的运动方向难以控制但运动速度较快,磁驱动微纳米机器人的控制精度较高,但是实现较高的运动速度对磁系统以及微纳米机器人制备的要求较高。因此,采用化学驱动和磁驱动方式共同驱动的微纳米机器人与采用单一驱动方式的机器人相比将具有更高的控制精度和更快的运动速度[155-159]。光驱动与磁驱动结合也是一种常见的混合驱动方式[35, 160-165]。如图 8(a)所示,Ji等[166]通过集成磁场和光在水溶液中形成了一个类似龙卷风的顺磁微群,磁场的旋进引起微群在平面内旋转,光促进平面微群向龙卷微群转换,实现了2维图形向3维图形的转换。
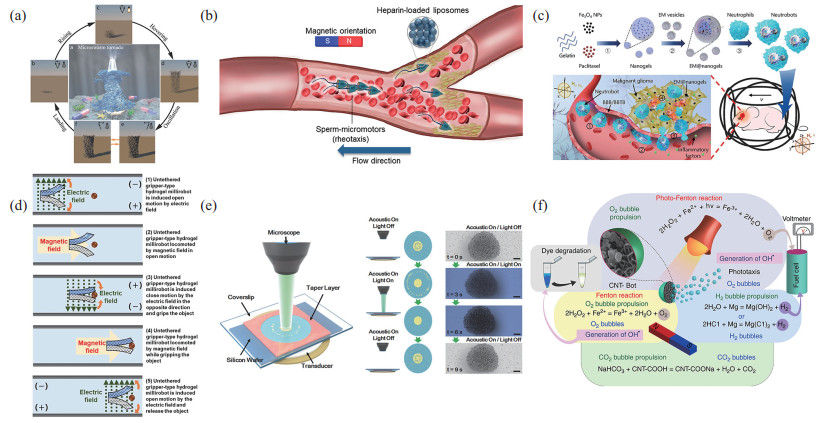
|
图 8 混合驱动微纳米机器人 Fig.8 Hybrid propulsion micro-nano robots (a) 磁驱动和光驱动结合的微纳米机器人[166];(b) 生物驱动和磁驱动结合的微纳米机器人[176];(c) 生物驱动和磁驱动结合的微纳米机器人[177];(d) 磁场和电场驱动结合的微纳米机器人[178];(e) 光驱动和声驱动结合的微纳米机器人[179];(f) 具有磁、光、化学 3种驱动方式的微纳米机器人[180] |
同时,科研人员也研究了超声驱动[167-168]、电场驱动、生物驱动[169]分别与磁驱动的结合。将超声驱动和磁驱动结合,利用磁场控制微纳米机器人的运动,利用超声成像技术定位微纳米机器人的位置[170-172];超声驱动和磁驱动的结合也可以实现超顺磁粒子沿边界的滚动式运动[173]。将生物细胞与磁驱动方式结合,使制备的微纳米机器人的生物相容性更好,同时还可以保留生物细胞自身的活力以及独特性[174]。Santomauro等[175]将生物细胞与磁相结合,在莱茵衣藻细胞中加入铽(Tb),使微藻细胞除了具有趋光性外,在磁场中还具有趋磁行为,Tb
除此之外,其他的驱动方式也可以相互结合,比如化学和光驱动结合[181-182]、电场和光驱动混合[183]、化学和声驱动结合[184]、声场和光驱动结合[185]等,使微纳米机器人具有2种及2种以上的推进方式,从而产生更优异的运动性能和特性。如图 8(e)所示,可以利用光声结合的方法来控制金纳米机器人的聚集/分离,纳米机器人在声场的压力节点处聚集,在光的照射下呈现出“烟火”样的集群分离行为[179]。除了结合2种推进方式外,图 8(f)展示了一种具有磁、光、化学3种推进模式的微米机器人,该机器人在羧基功能化多壁碳纳米管上掺杂磁铁矿纳米颗粒、亚铁离子和二氧化钛纳米颗粒[180]。
将磁、光、超声、化学、生物等多种驱动方式灵活地结合在一起,有望设计出具有更好性能、更大灵活性、更多功能的微纳米机器人。但是具有多种驱动方式的微纳米机器人则需要复杂的结构设计、系统或操纵方式,比如磁和光的结合,首先需要微纳米机器人对这两种外部能量有响应,同时在验证功能性时,需要在光学显微镜上耦合磁驱动系统和光驱动系统。另外,为了达到更好的控制效果,则需要协调地操纵光和磁。从自然界中汲取灵感,优化微纳米机器人的结构设计、系统以及操纵方式将使混合驱动微纳米机器人更具有竞争优势,使其应用于实际的可能性更高。
3 微纳米机器人发展面临的挑战(Chal- lenges in the development of micro-nano robots)随着机器人技术、微纳米技术和生物医学技术的不断发展,微纳米机器人在近年来发展迅速。过去的几十年里,对微纳米机器人设计、制造、驱动和控制的研究取得了很多杰出的成果,同时对它们在生物医学以及环境治理方面的应用进行了深入的探索。然而,微纳米机器人的实际应用还存在很多挑战。
关于微纳米机器人的制备。材料的选择将决定微纳米机器人的性能以及应用潜力[186]。目前制备的微纳米机器人多数不能重复利用,制备过程中通常都会涉及对生物有害的材料。例如,镍是一种常用于制备磁性微纳米机器人的材料,但镍对于生物细胞和组织具有毒性,虽然研究者会通过覆盖生物相容性材料等方式避免镍和生物细胞的直接接触,但对于这种含有有毒材料的微纳米机器人在失效或完成既定任务后的处理方式缺少探索。向大自然学习,开发具有生物相容性的环境友好型微纳米机器人,是微纳米机器人发展的长期目标。
关于微纳米机器人的定位及成像。目前超声、核磁共振(MRI)、X射线、正电子发射断层-X射线计算机断层组合系统(PET-CT)、荧光已被用于对微纳米机器人进行定位。例如,Wang等[170]利用超声波多普勒成像,在体外实验中对猪冠状动脉内形成的磁性纳米粒子群进行跟踪导航;Vilela等[187]利用PET-CT跟踪圆柱形管道中大量的金纳米机器人等。多数相关研究仅能跟踪其总体位置,对于微纳米机器人的体内成像很难分辨微纳米机器人的确切特征,因此大多数体内成像的演示都侧重于微纳米机器人群。在体内对微纳米机器人进行精确定位、实时跟踪是微纳米机器人未来走向临床至关重要的一步。微纳米机器人的成像对比度与尺寸成正比,成像对比度是实现体内实时成像的主要问题,可以通过增大微纳米机器人的尺寸去解决这个问题。但对于体内应用,缩小微纳米机器人的尺寸与提高成像对比度存在矛盾。
关于微纳米机器人的功能化。微纳米机器人应用于体内环境时面对的不是均匀的牛顿环境,而是更复杂的生物环境,如复杂的非牛顿流体(血液、黏液、玻璃体等)、血脑屏障以及生物组织等。这样的复杂环境对于微纳米机器人的多功能性提出了需求,包括高效的运动、感知交互、作业能力等。但目前研究制备的大多数微纳米机器人仅具有单一的功能,或者缺少某项功能。由于尺寸限制,在微纳米机器人中集成多个功能模块(如运动、感知、传感、定位、智能等)仍然是巨大的挑战。从微观世界里生物体的巧妙构造和功能中汲取灵感将有望制造出新颖而完善的微纳米机器人。同时,可以根据不同的应用需求结合不同的功能模块,以实现微纳米机器人最大限度的优化。
关于微纳米机器人的集群研究。目前,很多科学家都投入到微纳米机器人集群控制的研究中,已经实现了微纳米机器人集群的构形变化,展示了微纳米机器人群操纵物体,用于生物医疗的能力[188]。但对于集群的运动控制和形态控制仍要进一步完善,比如实现微纳米机器人集群内部的信息交流、面对复杂环境形态的自主变换、个体之间的分工协作以及集群中个体的单独控制等。利用微纳米机器人的不同形状以及对外部驱动的不同响应特性等,可以实现集群的不同功能性,从而有望实现分工协作。同时微纳米机器人对环境的敏感性可以使其集群内部间的相互作用发生变化,从而实现集群的内部交流。
微纳米机器人的诸多未来应用中,面向生物医学领域的应用将是非常令人期待的[189-190]。目前关于微纳米机器人在生物医学领域的研究已经取得了巨大的进展和丰富的成果,但微纳米机器人的生物相容性、生物降解性、在体内的实时成像能力、穿透生物细胞和组织屏障的能力、进入活体之后的免疫安全性等都是将其应用于临床亟需攻克的难题。同时,目前制备的微纳米机器人主要通过血液循环到达人体目标位置,但是在像血液这样复杂的非牛顿流体环境中,使微纳米机器人维持结构稳定和优异的运动能力、保持活性等等也是巨大挑战。除此之外,体内对微纳米机器人的驱动还有很多局限性,比如操作空间受限、驱动形式对人体有伤害、对组织器官不具良好的穿透性等。因此通过将多种驱动方式结合起来,取长补短,发挥其联合优势,则有望研制出生物相容性好、运动性能优异、功能多样的微纳米机器人。
4 结论与展望(Conclusion and outlook)尺寸小到微米甚至纳米的微纳米机器人,自从诞生以来就吸引了各领域科研人员的注意力。因此在过去的几十年中,微纳米机器人发展迅速,涌现了许多令人瞩目的研究成果。本文介绍了近5年来微纳米机器人的研究成果,首先从物理驱动、化学驱动、生物驱动和混合驱动4个方面综述了微纳米机器人的最新研究进展。接着讨论了微纳米机器人未来发展面临的挑战。
虽然目前制备的微纳米机器人存在结构简单、功能有限、欠缺智能化等问题,但随着研究的不断深入和发展,微纳米机器人将逐步发挥出其巨大潜力,在微纳米尺度上造福人类。针对微纳米机器人的发展,本文提出如下几个科学问题供相关科研人员参考:
(1) 人体内白细胞可以在血管及组织内自主游走,寻找并吞噬外来细菌等异物。能否将白细胞、红细胞等体自身细胞打造成微米机器人,结合分子修饰、DNA(脱氧核糖核酸)编辑、场控等技术,使其可在体内长期停留,按人的意愿运动,杀死病变细胞,治疗疾病。
(2) 生物细胞内广泛存在着形态各异、功能独特的纳米级别分子机器,它们互相配合,有条不紊地执行着细胞内各种功能,维持着细胞乃至整个生命体的运行。能否通过跨领域深入研究分子机器的机理、结构和功能,仿效分子机器研制出超越现有技术的新型纳米机器人?
(3) 微纳米机器人作为一种外来异物进入生物体内发挥功能性作用,除了提高它的作用效果以外,还需要探索它完成使命或失效后的去向。在最初设计微纳米机器人时,应充分考虑其最终能否被降解、回收,以及和人体生命过程共存等问题,同时这些技术的突破将有助于微纳米机器人未来走进临床。
(4) 考虑到实际的生物医学用途,微纳米机器人面临的生物环境比简单的牛顿流体更为复杂。目前,研究人员已经探索了在生物系统中可能产生的复杂性因素的影响,如生物流体的环境异质性以及非牛顿特性(如剪切变稀、黏弹性特性)等。然而,关于这些复杂生物流体对微纳米机器人运动影响的理解仍然非常有限。新一代的微纳米机器人在各种生物流体中的运动特性需要被考虑,迫切需要更适用于复杂流体(特别是血液、黏液、玻璃体和其他细胞外基质)环境的新型功能材料和推进机制。
微纳米机器人领域是多学科交叉的前沿研究领域,涵盖生物、化学、物理、材料、电子等领域。随着这些领域的不断发展,微纳米机器人也将不断地融入新技术、新材料,产生新的突破与成果。微纳米机器人可以继续从自然界中汲取灵感,仿效生物细胞内种类繁多、功能多样的分子机器,不断提升微纳米机器人的能力。如同宏观世界中各种工业机器人为人类社会发展带来的巨大推动作用一样,微观世界中微纳米机器人的不断发展也将为人类社会的生活、医疗、健康等带来积极而深远的影响。
| [1] |
Freiwald A, Beuck L, Rüggeberg A, et al. The white coral community in the central Mediterranean Sea revealed by ROV surveys[J]. Oceanography, 2009, 22(1): 58-74. DOI:10.5670/oceanog.2009.06 |
| [2] |
Bingham B, Foley B, Singh H, et al. Robotic tools for deep water archaeology: Surveying an ancient shipwreck with an autonomous underwater vehicle[J]. Journal of Field Robotics, 2010, 27(6): 702-717. DOI:10.1002/rob.20350 |
| [3] |
Sintov A, Avramovich T, Shapiro A. Design and motion planning of an autonomous climbing robot with claws[J]. Robotics and Autonomous Systems, 2011, 59(11): 1008-1019. DOI:10.1016/j.robot.2011.06.003 |
| [4] |
Burgard W, Cremers A B, Fox D, et al. Experiences with an interactive museum tour-guide robot[J]. Artificial Intelligence, 1999, 114(1-2): 3-55. DOI:10.1016/S0004-3702(99)00070-3 |
| [5] |
Kulakov F M. Remote control of space robots[J]. Journal of Computer and Systems Sciences International, 2016, 55: 635-682. DOI:10.1134/S1064230716030126 |
| [6] |
Wang J J, Dong R F, Wu H Y, et al. A review on artificial micro/nanomotors for cancer-targeted delivery, diagnosis, and therapy[J]. Nano-Micro Letters, 2020, 12. DOI:10.1007/s40820-019-0350-5 |
| [7] |
Luo M, Feng Y Z, Wang T W, et al. Micro-/nanorobots at work in active drug delivery[J]. Advanced Functional Materials, 2018, 28(25). DOI:10.1002/adfm.201706100 |
| [8] |
刘美焕, 涂彬彬, 刘璐, 等. 自驱动微纳米马达在主动药物递送中的应用进展[J]. 南方医科大学学报, 2020, 40(3): 445-452. Liu M H, Tu B B, Liu L, et al. Application of self-propelled micro-/nanomotors in active targeted drug delivery[J]. Journal of Southern Medical University, 2020, 40(3): 445-452. |
| [9] |
Ding J, Venkatesan R, Zhai Z H, et al. Micro- and nanoparticles-based immunoregulation of macrophages for tissue repair and regeneration[J]. Colloids and Surfaces B: Biointerfaces, 2020, 192. DOI:10.1016/j.colsurfb.2020.111075 |
| [10] |
Wei F N, Zhong T L, Zhan Z H, et al. Self-assembled micro-nanorobots: From assembly mechanisms to applications[J]. Chemnanomat, 2021, 7(3): 238-252. DOI:10.1002/cnma.202000608 |
| [11] |
Jurado-Sanchez B, Wang J. Micromotors for environmental applications: A review[J]. Environmental Science: Nano, 2018, 5(7): 1530-1544. DOI:10.1039/C8EN00299A |
| [12] |
Thirunavukkarasu A, Nithya R, Sivashankar R. A review on the role of nanomaterials in the removal of organic pollutants from wastewater[J]. Reviews in Environmental Science and Bio/Technology, 2020, 19: 751-778. DOI:10.1007/s11157-020-09548-8 |
| [13] |
Zhang L, Abbott J J, Dong L X, et al. Artificial bacterial flagella: Fabrication and magnetic control[J]. Applied Physics Letters, 2009, 94(6). DOI:10.1063/1.3079655 |
| [14] |
Yang L, Chen X X, Wang L, et al. Targeted single-cell therapeutics with magnetic tubular micromotor by one-step exposure of structured femtosecond optical vortices[J]. Advanced Functional Materials, 2019, 29(45). DOI:10.1002/adfm.201905745 |
| [15] |
Zhang Z L, Yan H, Li S, et al. Janus rod-like micromotors to promote the tumor accumulation and cell internalization of therapeutic agents[J]. Chemical Engineering Journal, 2021, 404. DOI:10.1016/j.cej.2020.127073 |
| [16] |
Wang D L, Gao C Y, Si T Y, et al. Near-infrared light propelled motion of needlelike liquid metal nanoswimmers[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021, 611. DOI:10.1016/j.colsurfa.2020.125865 |
| [17] |
Jiao X Y, Wang Z M, Xiu J D, et al. NIR powered Janus nanocarrier for deep tumor penetration[J]. Applied Materials Today, 2020, 18. DOI:10.1016/j.apmt.2019.100504 |
| [18] |
Lin Z H, Fan X J, Sun M M, et al. Magnetically actuated peanut colloid motors for cell manipulation and patterning[J]. ACS Nano, 2018, 12(3): 2539-2545. DOI:10.1021/acsnano.7b08344 |
| [19] |
金东东, 俞江帆, 黄天云, 等. 磁性微纳米尺度游动机器人: 现状与应用前景[J]. 科学通报, 2017, 62(2/3): 136-151. Jin D D, Yu J F, Huang T Y, et al. Magnetic micro-/nanoscale swimmers: Current status and potential applications[J]. Chinese Science Bulletin, 2017, 62(2/3): 136-151. |
| [20] |
Meng F L, Matsunaga D, Golestanian R. Clustering of magnetic swimmers in a poiseuille flow[J]. Physical Review Letters, 2018, 120(18). DOI:10.1103/PhysRevLett.120.188101 |
| [21] |
Oulmas A, Andreff N, Regnier S. 3D closed-loop swimming at low Reynolds numbers[J]. International Journal of Robotics Research, 2018, 37(11): 1359-1375. DOI:10.1177/0278364918801502 |
| [22] |
Qiu F M, Fujita S, Mhanna R, et al. Magnetic helical microswimmers functionalized with lipoplexes for targeted gene delivery[J]. Advanced Functional Materials, 2015, 25(11): 1666-1671. DOI:10.1002/adfm.201403891 |
| [23] |
Su Y C, Qiu T, Song W, et al. Melt electrospinning writing of magnetic microrobots[J]. Advanced Science, 2021, 8(3). DOI:10.1002/advs.202003177 |
| [24] |
Yu J F, Wang B, Du X Z, et al. Ultra-extensible ribbon-like magnetic microswarm[J]. Nature Communications, 2018, 9. DOI:10.1038/s41467-018-05749-6 |
| [25] |
Vilfan M, Osterman N, Vilfan A. Magnetically driven omni- directional artificial microswimmers[J]. Soft Matter, 2018, 14(17): 3415-3422. DOI:10.1039/C8SM00230D |
| [26] |
Ghosh S, Ghosh A. Mobile nanotweezers for active colloidal manipulation[J]. Science Robotics, 2018, 3(14). DOI:10.1126/scirobotics.aaq0076 |
| [27] |
Patil G, Ghosh A. Anomalous behavior of highly active helical swimmers[J]. Frontiers in Physics, 2021, 8. DOI:10.3389/fphy.2020.628276 |
| [28] |
Alsaadawi Y, Eichler-Volf A, Heigl M, et al. Control over self-assembled Janus clusters by the strength of magnetic field in H2O2[J]. The European Physical Journal E, 2021, 44. DOI:10.1140/epje/s10189-021-00010-3 |
| [29] |
Sun M M, Liu Q, Fan X J, et al. Autonomous biohybrid urchin-like microperforator for intracellular payload delivery[J]. Small, 2020, 16(23). DOI:10.1002/smll.201906701 |
| [30] |
Ceylan H, Yasa I C, Yasa O, et al. 3D-printed biodegradable microswimmer for theranostic cargo delivery and release[J]. ACS Nano, 2019, 13(3): 3353-3362. DOI:10.1021/acsnano.8b09233 |
| [31] |
Park J, Kim J Y, Pane S, et al. Acoustically mediated controlled drug release and targeted therapy with degradable 3D porous magnetic microrobots[J]. Advanced Healthcare Materials, 2021, 10(2). DOI:10.1002/adhm.202001096 |
| [32] |
Sun M M, Fan X J, Meng X H, et al. Magnetic biohybrid micromotors with high maneuverability for efficient drug loading and targeted drug delivery[J]. Nanoscale, 2019, 11(39): 18382-18392. DOI:10.1039/C9NR06221A |
| [33] |
Lee S, Kim J Y, Kim J, et al. A needle-type microrobot for targeted drug delivery by affixing to a microtissue[J]. Advanced Healthcare Materials, 2020, 9(7). DOI:10.1002/adhm.201901697 |
| [34] |
Kadiri V M, Bussi C, Holle A W, et al. Biocompatible magnetic micro- and nanodevices: Fabrication of FePt nanopropellers and cell transfection[J]. Advanced Materials, 2020, 32(25). DOI:10.1002/adma.202001114 |
| [35] |
Alapan Y, Bozuyuk U, Erkoc P, et al. Multifunctional surface microrollers for targeted cargo delivery in physiological blood flow[J]. Science Robotics, 2020, 5(42). DOI:10.1126/scirobotics.aba5726 |
| [36] |
Liu Z Y, Xu T T, Wang M, et al. Magnetic mesoporous silica/ε-polylysine nanomotor-based removers of blood Pb2+[J]. Journal of Materials Chemistry B, 2020, 8(48): 11055-11062. DOI:10.1039/D0TB02270E |
| [37] |
Zhang Y B, Zhang L, Yang L D, et al. Real-time tracking of fluorescent magnetic spore—based microrobots for remote detection of C. diff toxins[J]. Science Advances, 2019, 5(1). DOI:10.1126/sciadv.aau9650 |
| [38] |
Yang L D, Zhang Y B, Wang Q Q, et al. An automated microrobotic platform for rapid detection of C.diff toxins[J]. IEEE Transactions on Biomedical Engineering, 2020, 67(5): 1517-1527. DOI:10.1109/TBME.2019.2939419 |
| [39] |
Wu Z G, Chen Y, Mukasa D, et al. Medical micro/nanorobots in complex media[J]. Chemical Society Reviews, 2020, 49(22): 8088-8112. DOI:10.1039/D0CS00309C |
| [40] |
Choi J, Hwang J, Kim J Y, et al. Recent progress in magnetically actuated microrobots for targeted delivery of therapeutic agents[J]. Advanced Healthcare Materials, 2021, 10(6). DOI:10.1002/adhm.202001596 |
| [41] |
Wu Z G, Troll J, Jeong H H, et al. A swarm of slippery micropropellers penetrates the vitreous body of the eye[J]. Science Advances, 2018, 4(11). DOI:10.1126/sciadv.aat4388 |
| [42] |
Zhong D N, Li W L, Qi Y C, et al. Photosynthetic biohybrid nanoswimmers system to alleviate tumor hypoxia for FL/PA/MR imaging-guided enhanced radio-photodynamic synergetic therapy[J]. Advanced Functional Materials, 2020, 30(17). DOI:10.1002/adfm.201910395 |
| [43] |
Yan X H, Zhou Q, Vincent M, et al. Multifunctional biohybrid magnetite microrobots for imaging-guided therapy[J]. Science Robotics, 2017, 2(12). DOI:10.1126/scirobotics.aaq1155 |
| [44] |
Yasa I C, Ceylan H, Bozuyuk U, et al. Elucidating the interaction dynamics between microswimmer body and immune system for medical microrobots[J]. Science Robotics, 2020, 5(43). DOI:10.1126/scirobotics.aaz3867 |
| [45] |
Cabanach P, Pena-Francesch A, Sheehan D, et al. Zwitterionic 3D-printed non-immunogenic stealth microrobots[J]. Advanced Materials, 2020, 32(42). DOI:10.1002/adma.202003013 |
| [46] |
Yu J F, Zhang L. Reversible swelling and shrinking of paramagnetic nanoparticle swarms in biofluids with high ionic strength[J]. IEEE/ASME Transactions on Mechatronics, 2019, 24(1): 154-163. DOI:10.1109/TMECH.2018.2876617 |
| [47] |
Wang Q Q, Yang L D, Wang B, et al. Collective behavior of reconfigurable magnetic droplets via dynamic self-assembly[J]. ACS Applied Materials & Interfaces, 2019, 11(1): 1630-1637. |
| [48] |
Yu J F, Zhang L. Reconfigurable colloidal microrobotic swarm for targeted delivery[C]//16th International Conference on Ubiquitous Robot. Piscataway, USA: IEEE, 2019: 615-616.
|
| [49] |
Yu J F, Wang Q Q, Li M Z, et al. Characterizing nanoparticle swarms with tuneable concentrations for enhanced imaging contrast[J]. IEEE Robotics and Automation Letters, 2019, 4(3): 2942-2949. DOI:10.1109/LRA.2019.2924055 |
| [50] |
Yu J F, Jin D D, Chan K F, et al. Active generation and magnetic actuation of microrobotic swarms in bio-fluids[J]. Nature Communications, 2019, 10. DOI:10.1038/s41467-019-13576-6 |
| [51] |
Yu J F, Xu T T, Lu Z Y, et al. On-demand disassembly of paramagnetic nanoparticle chains for microrobotic cargo delivery[J]. IEEE Transactions on Robotics, 2017, 33(5): 1213-1225. DOI:10.1109/TRO.2017.2693999 |
| [52] |
Ji F T, Li T L, Yu S M, et al. Propulsion gait analysis and fluidic trapping of swinging flexible nanomotors[J]. ACS Nano, 2021, 15(3): 5118-5128. DOI:10.1021/acsnano.0c10269 |
| [53] |
Xie H, Fan X J, Sun M M, et al. Programmable generation and motion control of a snakelike magnetic microrobot swarm[J]. IEEE/ASME Transactions on Mechatronics, 2019, 24(3): 902-912. DOI:10.1109/TMECH.2019.2910269 |
| [54] |
Xie H, Sun M M, Fan X J, et al. Reconfigurable magnetic microrobot swarm: Multimode transformation, locomotion, and manipulation[J]. Science Robotics, 2019, 4(28). DOI:10.1126/scirobotics.aav8006 |
| [55] |
Fan X J, Sun M M, Sun L N, et al. Ferrofluid droplets as liquid microrobots with multiple deformabilities[J]. Advanced Functional Materials, 2020, 30(24). DOI:10.1002/adfm.202000138 |
| [56] |
Sun M M, Fan X J, Tian C Y, et al. Swarming microdroplets to a dexterous micromanipulator[J]. Advanced Functional Materials, 2021, 31(19). DOI:10.1002/adfm.202011193 |
| [57] |
Dong X G, Sitti M. Controlling two-dimensional collective formation and cooperative behavior of magnetic microrobot swarms[J]. International Journal of Robotics Research, 2020, 39(5): 617-638. DOI:10.1177/0278364920903107 |
| [58] |
Yigit B, Alapan Y, Sitti M. Cohesive self-organization of mobile microrobotic swarms[J]. Soft Matter, 2020, 16(8): 1996-2004. DOI:10.1039/C9SM01284B |
| [59] |
Yigit B, Alapan Y, Sitti M. Programmable collective behavior in dynamically self-assembled mobile microrobotic swarms[J]. Advanced Science, 2019, 6(6). DOI:10.1002/advs.201801837 |
| [60] |
Zhang Y B, Yan K, Ji F T, et al. Enhanced removal of toxic heavy metals using swarming biohybrid adsorbents[J]. Advanced Functional Materials, 2018, 28(52). DOI:10.1002/adfm.201806340 |
| [61] |
Sun M M, Chen W N, Fan X J, et al. Cooperative recyclable magnetic microsubmarines for oil and microplastics removal from water[J]. Applied Materials Today, 2020, 20. DOI:10.1016/j.apmt.2020.100682 |
| [62] |
Wang B, Chan K F, Yu J F, et al. Reconfigurable swarms of ferromagnetic colloids for enhanced local hyperthermia[J]. Advanced Functional Materials, 2018, 28(25). DOI:10.1002/adfm.201705701 |
| [63] |
Xie M H, Zhang W, Fan C Y, et al. Bioinspired soft microrobots with precise magneto-collective control for microvascular thrombolysis[J]. Advanced Materials, 2020, 32(26). DOI:10.1002/adma.202000366 |
| [64] |
Kong L, Mayorga-Martinez C C, Guan J G, et al. Photocatalytic micromotors activated by UV to visible light for environmental remediation, micropumps, reversible assembly, transportation, and biomimicry[J]. Small, 2020, 16(27). DOI:10.1002/smll.201903179 |
| [65] |
Fernandez-Medina M, Ramos-Docampo M A, Hovorka O, et al. Recent advances in nano- and micromotors[J]. Advanced Functional Materials, 2020, 30(12). DOI:10.1002/adfm.201908283 |
| [66] |
Zhou X, Li Z T, Tan L H, et al. Near-infrared light-steered graphene aerogel micromotor with high speed and precise navigation for active transport and microassembly[J]. ACS Applied Materials & Interfaces, 2020, 12(20): 23134-23144. |
| [67] |
Wan M M, Wang Q, Wang R L, et al. Platelet-derived porous nanomotor for thrombus therapy[J]. Science Advances, 2020, 6(22). DOI:10.1126/sciadv.aaz9014 |
| [68] |
Wan M M, Wang Q, Li X Y, et al. Systematic research and evaluation models of nanomotors for cancer combined therapy[J]. Angewandte Chemie, 2020, 59(34): 14458-14465. DOI:10.1002/anie.202002452 |
| [69] |
Zhou M Y, Xing Y, Li X Y, et al. Cancer cell membrane camouflaged semi-yolk@spiky-shell nanomotor for enhanced cell adhesion and synergistic therapy[J]. Small, 2020, 16(39). DOI:10.1002/smll.202003834 |
| [70] |
Xu P, Yu Y Q, Li T, et al. Near-infrared-driven fluorescent nanomotors for detection of circulating tumor cells in whole blood[J]. Analytica Chimica Acta, 2020, 1129: 60-68. DOI:10.1016/j.aca.2020.06.061 |
| [71] |
Shao J X, Cao S P, Williams D S, et al. Photoactivated polymersome nanomotors: Traversing biological barriers[J]. Angewandte Chemie, 2020, 132(39): 17066-17073. DOI:10.1002/ange.202003748 |
| [72] |
Deng Z Y, Mou F Z, Tang S W, et al. Swarming and collective migration of micromotors under near infrared light[J]. Applied Materials Today, 2018, 13: 45-53. DOI:10.1016/j.apmt.2018.08.004 |
| [73] |
Sun Y Y, Liu Y, Zhang D M, et al. Calligraphy/painting based on a bioinspired light-driven micromotor with concentration-dependent motion direction reversal and dynamic swarming behavior[J]. ACS Applied Materials & Interfaces, 2019, 11(43): 40533-40542. |
| [74] |
Mou F Z, Zhang J H, Wu Z, et al. Phototactic flocking of photochemical micromotors[J]. iScience, 2019, 19: 415-424. DOI:10.1016/j.isci.2019.07.050 |
| [75] |
Jiang H D, He X L, Ma Y M, et al. Isotropic hedgehog-shaped-TiO2/functional-multiwall-carbon-nanotube micromotors with phototactic motility in fuel-free environments[J]. ACS Applied Materials & Interfaces, 2021, 13(4): 5406-5417. |
| [76] |
Wang Q L, Dong R F, Yang Q X, et al. Highly efficient visible-light-driven oxygen-vacancy-based Cu2+1O micromotors with biocompatible fuels[J]. Nanoscale Horizons, 2020, 5(2): 325-330. DOI:10.1039/C9NH00592G |
| [77] |
Qin H, Wu X R, Xue X, et al. Light actuated swarming and breathing-like motion of graphene oxide colloidal particles[J]. Communications Chemistry, 2018, 1. DOI:10.1038/s42004-018-0073-4 |
| [78] |
Zhou D K, Gao Y, Liu H, et al. Light-induced patterned self-assembly behavior of isotropic semiconductor nanomotors[J]. Chemistry — An Asian Journal, 2019, 14(14): 2445-2449. DOI:10.1002/asia.201900394 |
| [79] |
Maric T, Nasir M Z M, Webster R D, et al. Tailoring metal/TiO2 interface to influence motion of light-activated Janus micromotors[J]. Advanced Functional Materials, 2020, 30(9). DOI:10.1002/adfm.201908614 |
| [80] |
Wang X, Baraban L, Nguyen A, et al. High-motility visible light-driven Ag/AgCl Janus micromotors[J]. Small, 2018, 14(48). DOI:10.1002/smll.201803613 |
| [81] |
Wang X, Baraban L, Misko V R, et al. Visible light actuated efficient exclusion between plasmonic Ag/AgCl micromotors and passive beads[J]. Small, 2018, 14(44). DOI:10.1002/smll.201802537 |
| [82] |
Villa K, Dekanovsky L, Plutnar J, et al. Swarming of perovskite-like Bi2WO6 microrobots destroy textile fibers under visible light[J]. Advanced Functional Materials, 2020, 30(51). DOI:10.1002/adfm.202007073 |
| [83] |
Tong J T, Wang D L, Wang D C, et al. Visible-light-driven water-fueled ecofriendly micromotors based on iron phthalocyanine for highly efficient organic pollutant degradation[J]. Langmuir, 2020, 36(25): 6930-6937. DOI:10.1021/acs.langmuir.9b02479 |
| [84] |
Orozco C A, Liu D D, Li Y J, et al. Visible-light-activated molecular nanomachines kill pancreatic cancer cells[J]. ACS Applied Materials & Interfaces, 2020, 12(1): 410-417. |
| [85] |
Xu T L, Xu L P, Zhang X J. Ultrasound propulsion of micro-/nanomotors[J]. Applied Materials Today, 2017, 9: 493-503. DOI:10.1016/j.apmt.2017.07.011 |
| [86] |
de Avila B E F, Angell C, Soto F, et al. Acoustically propelled nanomotors for intracellular siRNA delivery[J]. ACS Nano, 2016, 10(5): 4997-5005. DOI:10.1021/acsnano.6b01415 |
| [87] |
Wang D L, Gao C Y, Zhou C, et al. Leukocyte membrane-coated liquid metal nanoswimmers for actively targeted delivery and synergistic chemophotothermal therapy[J]. Research, 2020. DOI:10.34133/2020/3676954 |
| [88] |
Aghakhani A, Yasa O, Wrede P, et al. Acoustically powered surface-slipping mobile microrobots[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(7): 3469-3477. DOI:10.1073/pnas.1920099117 |
| [89] |
Cao H X, Jung D, Lee H S, et al. Micromotor manipulation using ultrasonic active traveling waves[J]. Micromachines, 2021, 12(2). DOI:10.3390/mi12020192 |
| [90] |
Xu T L, Cheng G Z, Liu C H, et al. Dynamic assembly of microspheres under an ultrasound field[J]. Chemistry–An Asian Journal, 2019, 14(14): 2440-2444. DOI:10.1002/asia.201900066 |
| [91] |
Xu T L, Soto F, Gao W, et al. Reversible swarming and separation of self-propelled chemically powered nanomotors under acoustic fields[J]. Journal of the American Chemical Society, 2015, 137(6): 2163-2166. DOI:10.1021/ja511012v |
| [92] |
Ma F D, Wang S J, Wu D T, et al. Electric-field-induced assembly and propulsion of chiral colloidal clusters[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(20): 6307-6312. DOI:10.1073/pnas.1502141112 |
| [93] |
Yang X F, Wu N. Change the collective behaviors of colloidal motors by tuning electrohydrodynamic flow at the subparticle level[J]. Langmuir, 2018, 34(3): 952-960. DOI:10.1021/acs.langmuir.7b02793 |
| [94] |
Yan J, Han M, Zhang J, et al. Reconfiguring active particles by electrostatic imbalance[J]. Nature Materials, 2016, 15: 1095-1099. DOI:10.1038/nmat4696 |
| [95] |
Kim K, Liang Z X, Liu M L, et al. Biobased high-performance rotary micromotors for individually reconfigurable micromachine arrays and microfluidic applications[J]. ACS Applied Materials & Interfaces, 2017, 9(7): 6144-6152. |
| [96] |
Chiang M Y, Hsu Y W, Hsieh H Y, et al. Constructing 3D heterogeneous hydrogels from electrically manipulated prepolymer droplets and crosslinked microgels[J]. Science Advances, 2016, 2(10). DOI:10.1126/sciadv.1600964 |
| [97] |
Liang X, Mou F Z, Huang Z, et al. Hierarchical microswarms with leader-follower-like structures: Electrohydrodynamic self-organization and multimode collective photoresponses[J]. Advanced Functional Materials, 2020, 30(16). DOI:10.1002/adfm.201908602 |
| [98] |
Wu Y, Fu A, Yossifon G. Active particles as mobile microelectrodes for selective bacteria electroporation and transport[J]. Science Advances, 2020, 6(5). DOI:10.1126/sciadv.aay4412 |
| [99] |
Ahmed D, Ozcelik A, Bojanala N, et al. Rotational manipulation of single cells and organisms using acoustic waves[J]. Nature Communications, 2016, 7. DOI:10.1038/ncomms11085 |
| [100] |
Läubli N F, Shamsudhin N, Vogler H, et al. 3D manipulation and imaging of plant cells using acoustically activated microbubbles[J]. Small Methods, 2019, 3(3). DOI:10.1002/smtd.201800527 |
| [101] |
Meng L, Liu X F, Wang Y C, et al. Sonoporation of cells by a parallel stable cavitation microbubble array[J]. Advanced Science, 2019, 6(17). DOI:10.1002/advs.201900557 |
| [102] |
Tang Q, Liang F, Huang L, et al. On-chip simultaneous rotation of large-scale cells by acoustically oscillating bubble array[J]. Biomedical Microdevices, 2020, 22. DOI:10.1007/s10544-020-0470-1 |
| [103] |
Gao Y, Wu M R, Lin Y, et al. Acoustic bubble-based bidirectional micropump[J]. Microfluidics and Nanofluidics, 2020, 24. DOI:10.1007/s10404-020-02334-6 |
| [104] |
Dai L G, Lin D J, Wang X D, et al. Integrated assembly and flexible movement of microparts using multifunctional bubble microrobots[J]. ACS Applied Materials & Interfaces, 2020, 12(51): 57587-57597. |
| [105] |
Ren L Q, Nama N, McNeill J M, et al. 3D steerable, acoustically powered microswimmers for single-particle manipulation[J]. Science Advances, 2019, 5(10). DOI:10.1126/sciadv.aax3084 |
| [106] |
Dai L G, Ge Z X, Jiao N D, et al. 2D to 3D manipulation and assembly of microstructures using optothermally generated surface bubble microrobots[J]. Small, 2019, 15(45). DOI:10.1002/smll.201902815 |
| [107] |
Fan Q H, Hu W Q, Ohta A T. Localized single-cell lysis and manipulation using optothermally-induced bubbles[J]. Micromachines, 2017, 8(4). DOI:10.3390/mi8040121 |
| [108] |
Zhang J, Zheng X, Cui H H, et al. The self-propulsion of the spherical Pt-SiO2 Janus micro-motor[J]. Micromachines, 2017, 8(4). DOI:10.3390/mi8040123 |
| [109] |
黄秋月, 张亚茹, 李佳贤, 等. 自驱动二氧化锰纳米马达的制备与性能[J]. 材料导报, 2020, 34(6): 6033-6038. Huang Q Y, Zhang Y R, Li J X, et al. Preparation and properties of self-propelled manganese dioxide nanomotor[J]. Materials Reports, 2020, 34(6): 6033-6038. |
| [110] |
Zhang Y F, Hess H. Chemically-powered swimming and diffusion in the microscopic world[J]. Nature Reviews Chemistry, 2021, 5: 500-510. DOI:10.1038/s41570-021-00281-6 |
| [111] |
Naeem S, Naeem F, Mujtaba J, et al. Oxygen generation using catalytic nano/micromotors[J]. Micromachines, 2021, 12(10). DOI:10.3390/mi12101251 |
| [112] |
Hu L X, Miao J M, Gruber G. Temperature effects on disk-like gold-nickel-platinum nanoswimmer's propulsion fuelled by hydrogen peroxide[J]. Sensors and Actuators B: Chemical, 2017, 239: 586-596. DOI:10.1016/j.snb.2016.08.028 |
| [113] |
Rao D V, Reddy N, Fransaer J, et al. Self-propulsion of bent bimetallic Janus rods[J]. Journal of Physics D: Applied Physics, 2018, 52(1). DOI:10.1088/1361-6463/aae6f6 |
| [114] |
Zhou C, Gao C Y, Lin Z H, et al. Autonomous motion of bubble-powered carbonaceous nanoflask motors[J]. Langmuir, 2020, 36(25): 7039-7045. DOI:10.1021/acs.langmuir.9b03398 |
| [115] |
Ye H, Ma G F, Kang J, et al. Pt-free microengines at extremely low peroxide levels[J]. Chemical Communications, 2018, 54(37): 4653-4656. DOI:10.1039/C8CC01548A |
| [116] |
Shah Z H, Wang S, Xian L B, et al. Highly efficient chemically-driven micromotors with controlled snowman-like morphology[J]. Chemical Communications, 2020, 56(97): 15301-15304. DOI:10.1039/D0CC06812H |
| [117] |
Diez P, Lucena-Sanchez E, Escudero A, et al. Ultrafast directional Janus Pt-mesoporous silica nanomotors for smart drug delivery[J]. ACS Nano, 2021, 15(3): 4467-4480. DOI:10.1021/acsnano.0c08404 |
| [118] |
Hermanova S, Pumera M. Biocatalytic micro- and nanomotors[J]. Chemistry—A European Journal, 2020, 26(49): 11085-11092. DOI:10.1002/chem.202001244 |
| [119] |
Chen W, Huang T, Shi K, et al. Chemotaxis-based self-accumulation of surface-engineered mitochondria for cancer therapeutic improvement[J]. Nano Today, 2020, 35. DOI:10.1016/j.nantod.2020.100966 |
| [120] |
Luo M, Li S L, Wan J S, et al. Enhanced propulsion of urease-powered micromotors by multilayered assembly of ureases on Janus magnetic microparticles[J]. Langmuir, 2020, 36(25): 7005-7013. |
| [121] |
Hortelao A C, Garcia-Jimeno S, Cano-Sarabia M, et al. LipoBots: Using liposomal vesicles as protective shell of urease-based nanomotors[J]. Advanced Functional Materials, 2020, 30(42). DOI:10.1002/adfm.202002767 |
| [122] |
Arque X, Andres X, Mestre R, et al. Ionic species affect the self-propulsion of urease-powered micromotors[J]. Research, 2020. DOI:10.34133/2020/2424972 |
| [123] |
Zhang Y H, Qiu W X, Zhang M K, et al. MnO2 motor: A prospective cancer-starving therapy promoter[J]. ACS Applied Materials & Interfaces, 2018, 10(17): 15030-15039. |
| [124] |
Choi H, Cho S H, Hahn S K. Urease-powered polydopamine nanomotors for intravesical therapy of bladder diseases[J]. ACS Nano, 2020, 14(6): 6683-6692. DOI:10.1021/acsnano.9b09726 |
| [125] |
Tang S S, Zhang F Y, Gong H, et al. Enzyme-powered Janus platelet cell robots for active and targeted drug delivery[J]. Science Robotics, 2020, 5(43). DOI:10.1126/scirobotics.aba6137 |
| [126] |
Maria-Hormigos R, Jurado-Sanchez B, Escarpa A. Surfactant-free β-galactosidase micromotors for "on-the-move" lactose hydrolysis[J]. Advanced Functional Materials, 2018, 28(25). DOI:10.1002/adfm.201704256 |
| [127] |
Wang L, Hortelao A C, Huang X, et al. Lipase-powered mesoporous silica nanomotors for triglyceride degradation[J]. Angewandte Chemie, 2019, 58(24): 7992-7996. DOI:10.1002/anie.201900697 |
| [128] |
Srivastava S K, Clergeaud G, Andresen T L, et al. Micromotors for drug delivery in vivo: The road ahead[J]. Advanced Drug Delivery Reviews, 2019, 138: 41-55. DOI:10.1016/j.addr.2018.09.005 |
| [129] |
Mundaca-Uribe R, de Avila B E F, Holay M, et al. Zinc microrocket pills: Fabrication and characterization toward active oral delivery[J]. Advanced Healthcare Materials, 2020, 9(18). DOI:10.1002/adhm.202000900 |
| [130] |
Lin Z H, Gao C Y, Wang D L, et al. Bubble-propelled Janus gallium/zinc micromotors for the active treatment of bacterial infections[J]. Angewandte Chemie, 2021, 60(16): 8750-8754. DOI:10.1002/anie.202016260 |
| [131] |
Karshalev E, Zhang Y, de Avila B E F, et al. Micromotors for active delivery of minerals toward the treatment of iron deficiency anemia[J]. Nano Letters, 2019, 19(11): 7816-7826. DOI:10.1021/acs.nanolett.9b02832 |
| [132] |
de Avila B E F, Angsantikul P, Li J X, et al. Micromotor-enabled active drug delivery for in vivo treatment of stomach infection[J]. Nature Communications, 2017, 8. DOI:10.1038/s41467-017-00309-w |
| [133] |
Coburn P S, Miller F C, LaGrow A L, et al. Disarming pore-forming toxins with biomimetic nanosponges in intraocular infections[J]. mSphere, 2019, 4(3). DOI:10.1128/mSphere.00262-19 |
| [134] |
Wang S H, Liu K, Zhou Q, et al. Hydrogen-powered microswimmers for precise and active hydrogen therapy towards acute ischemic stroke[J]. Advanced Functional Materials, 2021, 31(19). DOI:10.1002/adfm.202009475 |
| [135] |
Li J X, de Avila B E F, Gao W, et al. Micro/nanorobots for biomedicine: Delivery, surgery, sensing, and detoxification[J]. Science Robotics, 2017, 2(4). DOI:10.1126/scirobotics.aam6431 |
| [136] |
Schwarz L, Medina-Sanchez M, Schmidt O G. Sperm-hybrid micromotors: On-board assistance for nature's bustling swimmers[J]. Reproduction, 2020, 159(2): R83-R96. DOI:10.1530/REP-19-0096 |
| [137] |
Akolpoglu M B, Dogan N O, Bozuyuk U, et al. High-yield production of biohybrid microalgae for on-demand cargo delivery[J]. Advanced Science, 2020, 7(16). DOI:10.1002/advs.202001256 |
| [138] |
Shchelik I S, Sieber S, Gademann K. Green algae as a drug delivery system for the controlled release of antibiotics[J]. Chemistry—A European Journal, 2020, 26(70): 16644-16648. DOI:10.1002/chem.202003821 |
| [139] |
Li Q L, Chen H T, Feng X Y, et al. Nanoparticle-regulated semiartificial magnetotactic bacteria with tunable magnetic moment and magnetic sensitivity[J]. Small, 2019, 15(15). DOI:10.1002/smll.201900427 |
| [140] |
陈昌友, 宋涛, 杨岑玉, 等. 趋磁细菌动力学分析及细菌机器人的构建[J]. 机器人, 2015, 37(5): 588-593. Chen C Y, Song T, Yang C Y, et al. Dynamic analysis of magnetotactic bacteria and construction of bacterial microrobot[J]. Robot, 2015, 37(5): 588-593. DOI:10.13973/j.cnki.robot.2015.0588 |
| [141] |
Yoon J, Eyster T W, Mishra A C, et al. Cardiomyocyte-driven actuation in biohybrid microcylinders[J]. Advanced Materials, 2015, 27(30): 4509-4515. DOI:10.1002/adma.201501284 |
| [142] |
Gao L, Akhtar M U, Yang F, et al. Recent progress in engineering functional biohybrid robots actuated by living cells[J]. Acta Biomaterialia, 2021, 121: 29-40. DOI:10.1016/j.actbio.2020.12.002 |
| [143] |
Sun L Y, Yu Y R, Chen Z Y, et al. Biohybrid robotics with living cell actuation[J]. Chemical Society Reviews, 2020, 49(12): 4043-4069. DOI:10.1039/D0CS00120A |
| [144] |
Xie S X, Jiao N D, Tung S, et al. Controlled regular locomotion of algae cell microrobots[J]. Biomedical Microdevices, 2016, 18. DOI:10.1007/s10544-016-0074-y |
| [145] |
Xie S X, Wang X D, Jiao N D, et al. Programmable micrometer-sized motor array based on live cells[J]. Lab on a Chip, 2017, 17(12): 2046-2053. DOI:10.1039/C7LC00017K |
| [146] |
Xie S X, Qin L L, Li G X, et al. Robotized algal cells and their multiple functions[J]. Soft Matter, 2021, 17(11): 3047-3054. DOI:10.1039/D0SM02096F |
| [147] |
Park B W, Zhuang J, Yasa O, et al. Multifunctional bacteria-driven microswimmers for targeted active drug delivery[J]. ACS Nano, 2017, 11(9): 8910-8923. DOI:10.1021/acsnano.7b03207 |
| [148] |
Vincenti B, Ramos G, Cordero M L, et al. Magnetotactic bacteria in a droplet self-assemble into a rotary motor[J]. Nature Communications, 2019, 10. DOI:10.1038/s41467-019-13031-6 |
| [149] |
Gandia D, Gandarias L, Rodrigo I, et al. Unlocking the potential of magnetotactic bacteria as magnetic hyperthermia agents[J]. Small, 2019, 15(41). DOI:10.1002/smll.201902626 |
| [150] |
Xu H F, Medina-Sánchez M, Zhang W N, et al. Human spermbots for patient-representative 3D ovarian cancer cell treatment[J]. Nanoscale, 2020, 12(39): 20467-20481. DOI:10.1039/D0NR04488A |
| [151] |
Striggow F, Medina-Sanchez M, Auernhammer G K, et al. Sperm-driven micromotors moving in oviduct fluid and viscoelastic media[J]. Small, 2020, 16(24). DOI:10.1002/smll.202000213 |
| [152] |
Sun L Y, Chen Z Y, Bian F K, et al. Bioinspired soft robotic caterpillar with cardiomyocyte drivers[J]. Advanced Functional Materials, 2020, 30(6). DOI:10.1002/adfm.201907820 |
| [153] |
Li S P, Jiang Q, Liu S L, et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo[J]. Nature Biotechnology, 2018, 36: 258-264. DOI:10.1038/nbt.4071 |
| [154] |
Yoon Y, Lee C, Kim S J. Structural DNA nanotechnology towards therapeutic applications[J]. Journal of the Korean Physical Society, 2021, 78: 343-350. DOI:10.1007/s40042-020-00049-z |
| [155] |
Ye H, Wang Y, Liu X J, et al. Magnetically steerable iron oxides-manganese dioxide core-shell micromotors for organic and microplastic removals[J]. Journal of Colloid and Interface Science, 2021, 588: 510-521. DOI:10.1016/j.jcis.2020.12.097 |
| [156] |
Chen L, Sun X Y, Wang H G, et al. Preparation of dual-drive hybrid micromotors by swelling and selective surface modification of polymeric colloids[J]. Colloid and Interface Science Communications, 2020, 38. DOI:10.1016/j.colcom.2020.100300 |
| [157] |
Zhang X Y, Zhang B R, Wu G H, et al. Epitaxial-assembled monolayer superlattices for efficient micromotor propulsion[J]. Journal of Physics D: Applied Physics, 2020, 53(27). DOI:10.1088/1361-6463/ab810f |
| [158] |
Yuan K S, Jurado-Sanchez B, Escarpa A. Dual-propelled lanbiotic based Janus micromotors for selective inactivation of bacterial biofilms[J]. Angewandte Chemie, 2021, 60(9): 4915-4924. DOI:10.1002/anie.202011617 |
| [159] |
Yang J, Li J, Ng D H L, et al. Micromotor-assisted highly efficient Fenton catalysis by a laccase/Fe-BTC-NiFe2O4 nanozyme hybrid with a 3D hierarchical structure[J]. Environmental Science: Nano, 2020, 7(9): 2573-2583. DOI:10.1039/C9EN01443H |
| [160] |
Ji F T, Wang B, Zhang L. Light-triggered catalytic performance enhancement using magnetic nanomotor ensembles[J]. Research, 2020. DOI:10.34133/2020/6380794 |
| [161] |
Wang Q, Li T, Fang D, et al. Micromotor for removal/detection of blood copper ion[J]. Microchemical Journal, 2020, 158. DOI:10.1016/j.microc.2020.105125 |
| [162] |
Xing J H, Yin T, Li S M, et al. Sequential magneto-actuated and optics-triggered biomicrorobots for targeted cancer therapy[J]. Advanced Functional Materials, 2021, 31(11). DOI:10.1002/adfm.202008262 |
| [163] |
Sridhar V, Podjaski F, Kroeger J, et al. Carbon nitride-based light-driven microswimmers with intrinsic photocharging ability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(40): 24748-24756. DOI:10.1073/pnas.2007362117 |
| [164] |
Niese L, Wang L L, Das S, et al. Apparent phototaxis enabled by Brownian motion[J]. Soft Matter, 2020, 16(47): 10585-10590. DOI:10.1039/D0SM01603A |
| [165] |
Jiang W, Ye G Y, Chen B D, et al. A dual-driven biomimetic microrobot based on optical and magnetic propulsion[J]. Journal of Micromechanics and Microengineering, 2021, 31(3). DOI:10.1088/1361-6439/abd8de |
| [166] |
Ji F T, Jin D D, Wang B, et al. Light-driven hovering of a magnetic microswarm in fluid[J]. ACS Nano, 2020, 14(6): 6990-6998. DOI:10.1021/acsnano.0c01464 |
| [167] |
Gao C Y, Lin Z H, Zhou C, et al. Acoustophoretic motion of erythrocyte-mimicking hemoglobin micromotors[J]. Chinese Journal of Chemistry, 2020, 38(12): 1589-1594. DOI:10.1002/cjoc.202000347 |
| [168] |
Caldag H O, Yesilyurt S. Acoustic radiation forces on magnetically actuated helical swimmers[J]. Physics of Fluids, 2020, 32(9). DOI:10.1063/5.0020930 |
| [169] |
Xu H F, Medina-Sánchez M, Maitz M F, et al. Sperm micromotors for cargo delivery through flowing blood[J]. ACS Nano, 2020, 14(3): 2982-2993. DOI:10.1021/acsnano.9b07851 |
| [170] |
Wang Q Q, Chan K F, Schweizer K, et al. Ultrasound Doppler-guided real-time navigation of a magnetic microswarm for active endovascular delivery[J]. Science Advances, 2021, 7(9). DOI:10.1126/sciadv.abe5914 |
| [171] |
Magdanz V, Khalil I S M, Simmchen J, et al. IRONSperm: Sperm-templated soft magnetic microrobots[J]. Science Advances, 2020, 6(28). DOI:10.1126/sciadv.aba5855 |
| [172] |
Niedert E E, Bi C H, Adam G, et al. A tumbling magnetic microrobot system for biomedical applications[J]. Micromachines, 2020, 11(9). DOI:10.3390/mi11090861 |
| [173] |
Ahmed D, Baasch T, Blondel N, et al. Neutrophil-inspired propulsion in a combined acoustic and magnetic field[J]. Nature Communications, 2017, 8. DOI:10.1038/s41467-017-00845-5 |
| [174] |
Alapan Y, Yasa O, Schauer O, et al. Soft erythrocyte-based bacterial microswimmers for cargo delivery[J]. Science Robotics, 2018, 3(17). DOI:10.1126/scirobotics.aar4423 |
| [175] |
Santomauro G, Singh A V, Park B W, et al. Incorporation of terbium into a microalga leads to magnetotactic swimmers[J]. Advanced Biosystems, 2018, 2(12). DOI:10.1002/adbi.201800039 |
| [176] |
Xu H F, Medina-Sanchez M, Maitz M F, et al. Sperm micromotors for cargo delivery through flowing blood[J]. ACS Nano, 2020, 14(3): 2982-2993. DOI:10.1021/acsnano.9b07851 |
| [177] |
Zhang H Y, Li Z S, Gao C Y, et al. Dual-responsive biohybrid neutrobots for active target delivery[J]. Science Robotics, 2021, 6(52). DOI:10.1126/scirobotics.aaz9519 |
| [178] |
Kim D I, Song S, Jang S, et al. Untethered gripper-type hydrogel millirobot actuated by electric field and magnetic field[J]. Smart Materials and Structures, 2020, 29(8). DOI:10.1088/1361-665X/ab8ea4 |
| [179] |
Zhou D K, Gao Y, Yang J J, et al. Light-ultrasound driven collective "firework" behavior of nanomotors[J]. Advanced Science, 2018, 5(7). DOI:10.1002/advs.201800122 |
| [180] |
Mitra S, Roy N, Maity S, et al. Multimodal chemo-/magneto-/phototaxis of 3G CNT-bots to power fuel cells[J]. Microsystems & Nanoengineering, 2020, 6. DOI:10.1038/s41378-019-0122-x |
| [181] |
Zhou X, Huang X H, Wang B C, et al. Light/gas cascade-propelled Janus micromotors that actively overcome sequential and multi-staged biological barriers for precise drug delivery[J]. Chemical Engineering Journal, 2021, 408. DOI:10.1016/j.cej.2020.127897 |
| [182] |
Xing Y, Du X, Xu T L, et al. Janus dendritic silica/carbon@Pt nanomotors with multiengines for H2O2, near-infrared light and lipase powered propulsion[J]. Soft Matter, 2020, 16(41): 9553-9558. DOI:10.1039/D0SM01355B |
| [183] |
Xiao Z Y, Duan S F, Xu P Z, et al. Synergistic speed enhancement of an electric-photochemical hybrid micromotor by tilt rectification[J]. ACS Nano, 2020, 14(7): 8658-8667. DOI:10.1021/acsnano.0c03022 |
| [184] |
Ren L Q, Zhou D K, Mao Z M, et al. Rheotaxis of bimetallic micromotors driven by chemical-acoustic hybrid power[J]. ACS Nano, 2017, 11(10): 10591-10598. DOI:10.1021/acsnano.7b06107 |
| [185] |
Tang S S, Zhang F Y, Zhao J, et al. Structure-dependent optical modulation of propulsion and collective behavior of acoustic/light-driven hybrid microbowls[J]. Advanced Functional Materials, 2019, 29(23). DOI:10.1002/adfm.201809003 |
| [186] |
Yang G Z, Bellingham J, Dupont P E, et al. The grand challenges of science robotics[J]. Science Robotics, 2018, 3(14). DOI:10.1126/scirobotics.aar7650 |
| [187] |
Vilela D, Cossío U, Parmar J, et al. Medical imaging for the tracking of micromotors[J]. ACS Nano, 2018, 12(2): 1220-1227. DOI:10.1021/acsnano.7b07220 |
| [188] |
张立, 俞江帆, 杨立冬. 微纳机器人: 从个体到集群[M]. 北京: 科学出版社, 2020. Zhang L, Yu J F, Yang L D. Micro- and nanorobots: From individual to swarm[M]. Beijing: Science Press, 2020. |
| [189] |
Yang J, Zhang C, Wang X D, et al. Development of micro- and nanorobotics: A review[J]. Science China: Technological Sciences, 2019, 62: 1-20. DOI:10.1007/s11431-018-9339-8 |
| [190] |
孙猛猛, 谢晖. 面向靶向医疗的微纳米机器人[J]. 自然杂志, 2020, 42(3): 187-200. Sun M M, Xie H. Micro/nanorobots for targeted therapy[J]. Chinese Journal of Nature, 2020, 42(3): 187-200. |
 2022, Vol. 44
2022, Vol. 44


