2. 南开大学人工智能学院机器人与信息自动化研究所, 天津 300350;
3. 北京理工大学智能机器人与系统高精尖创新中心, 北京 100081;
4. 天津大学机械工程学院, 天津 300354;
5. 天津医科大学生物医学工程与技术学院, 天津 300070
2. Institute of Robotics and Automatic Information System, College of Artificial Intelligence, Nankai University, Tianjin 300350, China;
3. Beijing Advanced Innovation Center for Intelligent Robots and Systems, Beijing Institute of Technology, Beijing 100081, China;
4. College of Mechanical Engineering, Tianjin University, Tianjin 300354, China;
5. College of Biomedical Engineering and Technology, Tianjin Medical University, Tianjin 300070, China
21世纪是脑科学的时代。脑科学是寻求人或动物神智活动的细胞及分子层次生物机制的科学[1]。脑科学研究需要在动物层次的神智过程中捕捉其细胞层次乃至分子层次的电生理信号变化。这不仅仅是操作尺度上从米、毫米到微米的跨越,更有待测信号从强到弱、再到微弱的跨越,因此需要专门的精密仪器对微弱的细胞电生理信号进行检测。1976年,德国科学家Neher和Sakmann创建了膜片钳技术[2],并荣获1991年诺贝尔医学和生理学奖。该技术使用特制的微米级尺寸的玻璃微吸管(玻璃电极)紧密吸附于细胞表面,使之形成吉欧级电阻的密封(giga-seal),又称巨阻封接,来排除环境中的电磁干扰。由于被吸附于玻璃电极的细胞膜膜片尺度为微米量级,内中仅有少数离子通道,通过对该膜片实行电压或电流钳制,可以测量单个离子通道开放产生的皮安(10
与其他脑科学研究方式如光遗传成像技术[6-7]相比,当前人工膜片钳操作的步骤复杂,操作难度大,对操作人员的专业水平要求极高,因此膜片钳操作在世界范围内仅极少数实验室可以完成,这严重限制了膜片钳技术在脑科学中的推广应用。使用标准化、重复性好、操作精度高的机器人化操作取代人工操作,提高膜片钳操作的自动化程度,有助于降低膜片钳操作难度以及对操作者专业水平的要求,促进膜片钳技术在脑科学中的推广应用。近年来,国外的公司与科研团队率先开展了机器人化膜片钳系统的研究。目前针对悬浮细胞的自动化平面膜片钳系统已经实现了商用化[8-10];面向贴壁细胞与离体脑片神经细胞的机器人化传统膜片钳系统也取得了重大进展,部分系统已接近实现全自动化操作[11-13];针对清醒鼠类动物大脑神经细胞的自动化盲插法膜片钳系统[14-17]已经问世;最近有视觉引导的机器人化双光子膜片钳研究也取得重大突破,可以对被固定的鼠类大脑神经细胞进行机器人化膜片钳封接操作[18-19]。然而,对人类脑科学研究具有重大意义的针对清醒非人灵长类动物的膜片钳操作目前依然需要手动进行,与之对应的机器人化双光子膜片钳系统研究还未见相关报道。
作为人类的近亲,非人灵长类动物在人类脑科学研究中具有不可替代的作用。非人灵长类动物的眼睛、动眼神经结构、视网膜、上丘、膝外侧核,特别是视觉皮质都与人类非常接近。清醒状态下的视觉行为如视觉引导的自然探索行为、社会交往行为和视觉引导的伸展和抓握行为等方面非人灵长类动物也与人类近似[20-23]。不仅如此,非人灵长类动物的大脑有沟壑纵横的沟回,在组织结构等方面与人类高度近似。利用清醒非人灵长类动物进行脑科学研究对探索人类大脑的秘密有着更直接的借鉴意义。因此,顺应人类脑科学发展,亟需突破适用于清醒非人灵长类动物的膜片钳技术。
清醒状态下非人灵长类动物大脑膜片钳操作面对的是比清醒鼠类大脑结构更为复杂、动物运动扰动更大的体内操作环境。而同时,操作的对象却是反映分子水平离子通道的微小的细胞膜片。这二者的矛盾使这样的膜片钳系统一方面要像医疗机器人一样面对复杂的动物体内环境,另一方面还要像微操作机器人一样高精度地操作神经元胞体。这无论是对动物稳定固定,还是对显微图像反馈、3维目标定位、路径规划与避障、膜片钳封接与破膜操作,都提出了巨大的挑战。根据文献报道,目前仅有天津医科大学和重庆第三军医大学的联合团队实现了麻醉状态狨猴的膜片钳操作[24],而清醒非人灵长类动物的双光子膜片钳手动操作还未见报道,更不用说对应的机器人化操作。
本文首先根据操作对象的升级和操作原理改进过程对机器人化膜片钳的发展历程进行综述;进而聚焦当前人类脑科学研究前沿亟需的、面向清醒非人灵长类动物的机器人化膜片钳系统的研发;针对动物大脑体内环境显示、玻璃电极与目标细胞定位、玻璃电极的运动控制、细胞封接破膜与测量,以及清醒动物稳定固定5个方面分别存在的“盲”“拙”“缺”“难”“跟不上”五大挑战进行分析;进而结合现有技术对每项挑战潜在的解决方案进行探讨,最终实现“显示清”“定位准”“动得巧”“测得真”和“跟得上”的面向清醒非人灵长类动物脑科学研究的机器人化膜片钳系统;最后,对面向脑科学研究的机器人化膜片钳系统的发展前景进行展望。
2 机器人化膜片钳系统发展历程回顾(Review of the development process of robotic patch clamp systems)膜片钳技术自诞生以来,随着操作对象的升级衍生出包括平面膜片钳[8-10]、传统膜片钳[11-13]、盲法膜片钳[14-17]和双光子膜片钳[18-19]在内的多种操作方法。同时根据要记录离子通道对象的不同,发展出贴附式、全细胞式、内面朝外和外面朝外等4种基本记录模式[25],并进一步衍生出穿孔膜片钳[26-27]、巨阻膜片钳[28]和压力钳[29]等多种新型记录模式。但从总体上看,相较于其他脑科学研究手段如光遗传技术,膜片钳技术存在操作步骤复杂、操作难度大、对操作者专业程度要求高等不足,这严重限制了膜片钳技术在脑科学研究中的应用。为此,国外研究者率先致力于通过提高膜片钳操作自动化程度来降低操作难度和对操作者专业水平的要求,研发了一系列的机器人化膜片钳系统。
图 1总结了机器人化膜片钳系统的发展过程和几类典型系统的工作原理。可以看出,机器人化膜片钳系统的操作对象经历了悬浮细胞、贴壁细胞、离体脑片细胞、麻醉动物大脑细胞到清醒动物大脑细胞的升级过程。相应的,其操作方式也经历了基于玻璃电极的自动化膜片钳、自动化平面膜片钳,到机器人化传统膜片钳,再到自动化盲法膜片钳和机器人化双光子膜片钳的发展过程。下面对这一发展过程中各阶段的典型系统及其优缺点进行介绍。

|
图 1 机器人化膜片钳系统的发展过程及各类典型系统原理示意图 Fig.1 The development process of robotic patch clamp system and the schematics of different typical systems |
早期的自动化膜片钳系统主要围绕玻璃电极展开,针对的操作对象主要是悬浮状态的神经细胞。1998年丹麦的NeuronSearch和Pfizer公司开发了最早的自动化膜片钳系统Neuropatch;2003年之后德国的Flyion公司又先后推出了Flyscreen 8500、Patchbox和iPach等全自动化膜片钳设备。这些设备都采用一种叫做“尖端反转”(flip-the-tip)的技术对细胞进行膜片钳封接操作。如图 1所示,该技术将含有悬浮神经细胞的培养液灌注入垂直放置的玻璃电极内;待细胞下沉到电极尖端处,在电极处施加压强,使细胞与电极尖端形成稳定的高阻封接;最后,通过破坏露在外侧的细胞膜形成全细胞模式。由于这类自动化膜片钳系统在记录时细胞内液在玻璃电极尖端外,细胞外液在尖端内,与传统膜片钳的全细胞记录方式下的细胞内、外液分布正好相反,因而被称为“尖端反转”。由于无法进行高通量细胞操作且仅能进行全细胞模式的记录,该类自动化膜片钳的应用受到很大限制,目前已经逐步退出了市场。
2015年,Danker等[30]仿照传统的吸持针-注射针的细胞操作模式,提出了一种被称为“抓取与封接”的全自动膜片钳系统,并与美国Havard公司合作研发了第一套自动化膜片钳产品PatchServer。如图 1所示,该系统使用一对与传统悬浮细胞操作系统中的吸持针和注射针类似的捕捉电极和记录电极对悬浮细胞进行自动化膜片钳操作。操作时系统首先使用捕捉电极自动吸住目标细胞,再使用记录电极自动接触被吸住的细胞并进行封接与破膜操作。这种方式虽然可以实现自动化全细胞封接操作,并可以进行4种基本记录模式的膜片钳操作。然而,由于操作通量受捕捉电极-记录电极对数的限制,在平面膜片钳诞生之后,上述基于玻璃电极的自动化膜片钳操作方式已经很少应用。
2.2 自动化平面膜片钳系统研究文献中报道的最早的平面膜片钳操作可追溯到1975年,前苏联科学家Kostyuk等[31]使用平面电极记录到蜗牛神经元的电流。该技术经进一步的改进发展,最终在2002年由美国Axon公司推出了第一台采用平面芯片电极的全自动膜片钳系统IonWorksHT。此后德国Nanion公司和Cytocentrics公司、美国MD公司和Fluxion公司等相继推出了商用或科研用平面膜片钳系统。这些系统的核心部件被称为平面芯片电极。该电极通过在石英、玻璃或其他材料上制造微米级尺寸的微孔阵列,每个孔通过微管道与气泵连接。使用时气泵施加负压,通过微孔阵列将多个悬浮细胞一起吸住,细胞下充满细胞内液,细胞膜被吸破以后形成全细胞记录模式(如图 1所示)。目前使用先进的微加工工艺可以在芯片电极上加工几十、几百甚至上千个微孔,因此平面膜片钳系统可以进行高通量的细胞操作。该优势使其目前被广泛地应用于药物筛选[32-34]等进行高通量细胞测量的领域。
平面膜片钳系统具有操作过程全自动化和高通量的特点,这保证了测量结果的均一性,受操作者的影响极小;微孔道式的结构可以节省大量测量液体;此外,片上化的测量电路极易于集成,节省了设备空间。但平面膜片钳系统一般无显微视觉反馈,因此用户无法通过观察来筛选合适的细胞;而且平面膜片钳系统只能进行贴附模式和全细胞模式记录,无法完成内面朝外和外面朝外[25]两种对离子通道功能研究至关重要的记录模式。另外,平面电极式的设计使其只适用于对悬浮细胞进行操作,而无法对贴壁细胞和离体脑片细胞进行操作。
2.3 机器人化传统膜片钳系统研究针对贴壁细胞与离体脑片细胞的自动化操作需求,近年来研究者通过对传统膜片钳的部分操作步骤进行自动化来实现机器人化的传统膜片钳操作。
2016年Wu等[11]对目标神经元进行荧光标记和自动定位,为自动化膜片钳系统增添了“眼睛”,因此获得全细胞记录的成功率相比盲法膜片钳技术提高了2倍;本课题组前期使用离焦成像法获得贴壁细胞轮廓,并基于电极电阻变化实现了细胞高度的检测,最终在贴壁细胞上实现了自动化全细胞封接[35];2019年Kolb等[12]对微分干涉相差(DIC)显微镜脑片图像进行目标神经细胞和电极的定位,通过图像的反卷积操作来定位和跟踪脑片中的神经细胞[36],并且添加了自动清洗电极功能,实现了长达3 h无人干预的自动化膜片钳操作;2021年Koos等[13]利用深度学习算法对脑片神经细胞进行定位,并实现了电极的自动化定位和神经细胞的跟踪,在动物和人类脑片上实现了神经细胞的机器人化膜片钳操作。
相比于传统的手动式膜片钳操作,以上这些机器人化操作降低了贴壁细胞和脑片神经细胞膜片钳操作的难度,部分系统的操作成功率已经接近或达到了手动操作者的水平。同时这些系统具备的电极自动位置校准和自动洗针等新功能也有助于缩短更换电极的操作时间,提高操作速度。然而,如同传统膜片钳一样,这些系统的载体均为明场显微镜,仅能观察厚度有限(一般为300 µm以下)且透光性较好的离体脑片中的神经细胞。对于不透明的活体动物大脑皮层环境,这类系统则无法提供清晰的视觉反馈,因此无法进行在体膜片钳操作。
2.4 自动化盲法膜片钳系统研究针对在体操作环境透光性差,难以进行显微视觉反馈的问题,盲法膜片钳技术通过观察检测电极电阻的变化来完成在体环境中神经细胞的封接和记录操作。2012年Kodandaramaiah等[14]将机器人技术应用到活体动物的盲法膜片钳操作中,通过自动测量电极阻抗的变化在无体内视觉反馈的情况下完成在体小鼠神经元自动封接和全细胞记录。2018年Kodandaramaiah等[16]改进了盲法活体膜片钳系统的硬件结构,用四电极代替原来的单电极,能够同时获得多个神经元的全细胞膜片钳记录,以此研究神经元之间的电信号传递。当膜片钳电极接触到微血管时检测电极阻值会上升,此时可能将微血管误认为是神经细胞,Stoy等[15]针对这种情况下的电阻升高,采用电极往回撤并向旁边移动绕开微血管的方法进行避障。
自动化盲法膜片钳系统具有操作简单、易于实现自动化操作的优点,且由于不依赖于视觉反馈,没有成像深度的限制,因此理论上可以操作的细胞位于大脑皮层的深度也不受限制。但盲法膜片钳没有细胞图像反馈,无法观察神经元形态结构及钙信号和其他荧光信号的变化,也无法获得细胞周围的环境状况,因此盲法膜片钳的下电极过程具有很大的随机性,操作成功率相较于有视觉引导的膜片钳操作较低。
2.5 自动化双光子膜片钳系统研究盲法膜片钳缺乏对活体内环境的视觉反馈,而双光子显微镜[37]具有极强的生物组织穿透能力,近年来被应用于膜片钳操作中,对在体细胞提供视觉反馈。双光子显微镜是一种特殊的激光共聚焦显微镜,采用间隔为飞秒级的2个光子去激发1个荧光分子,因而能用能量较低、波长较长、穿透生物组织能力较强的红光来激发染色细胞的荧光分子,从而看到大脑皮层数百微米以下的神经细胞[38]。
目前双光子膜片钳技术主要分为2类:双光子活体靶向膜片钳技术[39]和双光子阴影膜片钳技术[40]。前者先将活体动物细胞进行荧光标记(如采用钙敏感指示剂)以显示兴奋的神经元,再通过玻璃电极吹出不同颜色的荧光染料来显示出电极;后者直接使用玻璃电极吹出荧光场,主动显示电极本身和周围成阴影状态的细胞与组织,无需对细胞进行染色,但也因此无法通过荧光信号来区分神经细胞是否兴奋。2017年Annecchino等[18]和Suk等[19]分别在《Neuron》杂志报道将机器人技术应用到活体麻醉小鼠双光子靶向膜片钳操作研究中。他们的系统实现了电极、细胞自动定位,电极压强自动控制和自动封接破膜操作,能够进行机器人化的全细胞封接,大大提高了机器人化双光子活体膜片钳的操作水平。
2.6 当前面向脑科学研究的机器人化膜片钳系统的局限性脑科学研究的主要操作对象为离体脑片神经细胞和活体动物大脑神经细胞。脑片厚度一般小于300 µm,具有良好的透光性,在明场显微镜下即可通过传统膜片钳操作进行电生理信号记录。然而脑片中的神经细胞在垂直方向的连接在切割制片时受到破坏,相比之下活体动物大脑神经连接完整,因而对脑科学研究更具借鉴意义。目前,面向活体动物的机器人化双光子膜片钳的操作对象多是体型较小、容易固定的鼠类动物,对体型较大、与人类大脑结构最为类似的非人灵长类动物的机器人化膜片钳操作还未见报道。
3 面向清醒非人灵长类动物脑科学研究的机器人化膜片钳操作的挑战分析(Chal- lenges in robotic patch clamp operation for brain science research of awake non-human primates)非人灵长类动物是人类的近亲,在组织结构等方面与人类高度近似,二者的大脑都有鼠类所没有的沟回结构。因此,利用它们进行脑科学研究对探索人类大脑的秘密相较于鼠类有着更直接的借鉴意义。以人类大脑视觉形成机制的研究为例,人类认识世界的过程中,外界信息的80% 是经视觉系统传入大脑;视觉系统与脑的许多高级功能密切相关,因而视觉研究正成为脑科学、认知科学的热门课题[20]。非人灵长类动物的眼睛、动眼神经结构、视网膜、上丘、膝外侧核,特别是视觉皮质,都与人类非常接近;清醒状态下的视觉行为,如视觉引导的自然探索行为、社会交往行为和视觉引导的伸展和抓握行为等方面,非人灵长类动物也与人类近似[20-23]。因此,非人灵长类动物的视觉生理与病理发生机制研究,在人类脑科学研究中具有不可替代的作用。由于麻醉状态下动物对光刺激几乎不会产生反应,上述研究也就无法进行,因此亟需突破适用于清醒非人灵长类动物的膜片钳技术。
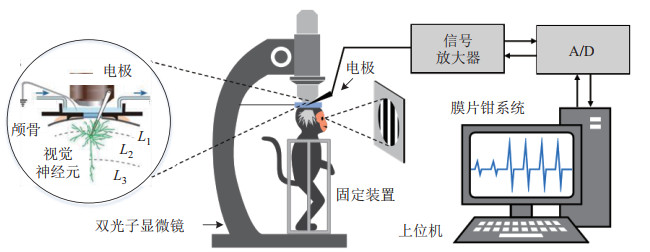
图 2所示为一个典型的清醒非人灵长类动物(狨猴)的视觉机制研究场景。狨猴观察动态图像引起视觉刺激,膜片钳电极深入狨猴大脑皮层中的视觉皮层寻找在视觉刺激下兴奋的神经元细胞,并将测量的神经元兴奋信号进行采集、显示,由此研究视觉机制。上述过程中,膜片钳电极需要穿透狨猴大脑视觉皮层,在L2/3皮层(约200~450 µm)钳制目标视觉神经元,记录动物视觉过程中的神经元电信号。这一过程中,该膜片钳系统面对的是活体动物的复杂体内操作环境和反映分子水平离子通道的微小膜片级操作对象的矛盾。这样的膜片钳系统,一方面要像医疗机器人一样面对复杂的动物体内环境,另一方面还要像微操作机器人一样高精度地操作神经元胞体。这无论是对清醒动物的固定,还是对显微图像反馈、3维目标定位、路径规划与避障、膜片钳封接与破膜操作都提出了巨大的挑战。本文将这些困难与挑战归纳如下。
|
图 2 基于膜片钳系统的非人灵长类视觉机制研究示意图 Fig.2 Schematic of the vision mechanism research for non-human primates based on patch clamp system |
如前所述,当前在体环境下的手动双光子膜片钳操作主要依靠玻璃电极注出的荧光溶液形成的光场来显示电极位置和照亮脑内环境。在此过程中,操作者主要通过“眼看”观察显微镜下膜片钳电极吹出的荧光场的形状和大小来估计荧光溶液的注出流速,再通过吸管“口吹”调节电极内的压强来调整针口流速,维持稳定的荧光场用于照明。与此同时,操作者还要利用“手动”移动膜片钳电极去接近细胞。这种“眼-口-手”协调操作严重依赖操作者的经验,对操作者的体力、精力甚至肺活量都是考验,因此人工操作难以实现稳定荧光场意义下的“显示清”,很多时候依然处于“盲”的状态。Annecchino等[18]和Suk等[19]发明的自动化双光子膜片钳系统通过在玻璃电极中施加一个恒定的注射压,对流速进行开环控制。开环系统没有引入电极堵塞状况作为反馈,也就无法实时进行必要的注射压调节,极易造成流速逐渐降低直至最后导致电极堵塞,视野陷入“盲”状态,使得后续操作无法进行。因此进行机器人化双光子膜片钳在体操作必须解决脑内环境的稳定显示问题。
3.2 定位“缺”——在体细胞与电极定位问题双光子显微镜虽然提供了膜片钳操作环境的视觉反馈,但要实现自动化膜片钳操作还缺乏电极与细胞的3维位置信息,也即要解决定位“缺”的问题。玻璃电极内一般充满荧光溶液,使得电极成为黑暗荧光环境中的一束“荧光棒”,可通过常规图像处理方法对电极进行定位。双光子活体靶向膜片钳技术事先以荧光标记兴奋的神经细胞,只需要进一步进行显微图像处理,就能获得自动化操作所需的神经元位置信息。相比之下,双光子活体阴影膜片钳技术未对神经元进行荧光标记,仅靠膜片钳电极吹出荧光染料照亮视野,组织间隙显示荧光染料,神经元则因无荧光染料呈黑色阴影。虽然该方法排除了染色荧光的干扰,能更准确地记录黑色阴影细胞内发生的变化,但也无法根据细胞荧光信号判断神经细胞是否兴奋(只能根据膜片钳记录的离子通道电流数据来判断)。而且从显微图像处理角度,与识别有荧光标记的神经元相比,模糊的阴影神经元更难以识别。另外,活体动物脉动造成的细胞图像的移动和离焦也会给细胞的定位带来困难。以上问题给解决细胞定位“缺”带来极大挑战。
3.3 动作“拙”——玻璃电极的路径规划与主动避障问题非人灵长类动物脑科学研究过程中,膜片钳玻璃电极穿过大脑皮层达到几百微米深度处的目标神经元进行电生理记录,这期间需要规避血管等层层障碍物。手动膜片钳操作中,操作者调节双光子显微镜聚焦的成像深度在大脑皮层中逐步深入,每成像一步,看清障碍,避开障碍,控制电极向深处走一步;再调节下一层,看清障碍,绕开障碍,再向深处前进一步。由于膜片钳电极是十分锋利的玻璃针,沿着玻璃针轴向下电极时只有针尖与大脑皮层接触,运动时是“刺入”组织,创口仅仅是一条线,创伤最小;而斜向下针时膜片钳电极侧面与组织接触,移动时会“划开”组织,有变为“开刀”的危险,大大增加对脑组织和非靶标细胞的机械损伤。因此,操作者既要保持轴向下电极,又要避障;往往表现为“左支右绌”,会给人动作“拙”的感觉。因此,为了实现活体动物大脑皮层神经细胞的操作,减少对活体动物大脑的机械伤害,需要在下电极过程中对玻璃电极进行路径规划与主动避障。
3.4 测量“难”——在体细胞的封接、破膜与信号检测问题膜片钳技术最后一步是在膜片钳封接和破膜基础上使用电极对目标神经元的小膜片或整个细胞体实行电压或电流钳制,来测量细胞离子通道开放产生的电流及电压变化。一方面,离子通道释放的生物电非常微弱,为皮安量级;另一方面,这种离子通道开放是一种随机过程。这就造成实验成功率极低。同时,尽管活体动物脑部的脉动等环境噪声对封接过程机械接触的影响不大,但会对电测量信号造成较大影响;此外,测量过程中的膜片钳参数漂移也会对测量结果产生较大的影响。传统的被动去噪方法,如检波和滤波,仅仅利用噪声的共性去除噪声,无法去除动物运动和膜片钳参数漂移造成的个性化噪声[41],因此膜片钳操作还存在测量结果误差大,获得真实结果“难”的问题。
3.5 “跟不上”——清醒动物的固定问题相比于体型较小、性格温顺、易于进行头部固定的鼠类,非人灵长类动物(如狨猴)的体型更大且生性好动,这给实验中动物的稳定固定带来艰巨的挑战。实验过程中不可避免地会发生动物主动运动而带来脑部残余位移,这类情况是造成实验失败的主要因素。这种运动如果发生在膜片钳下电极过程中,就会引起目标神经元胞体位置改变,需要面向新目标重新规划路径;发生在封接过程中,会引起玻璃电极末端与细胞脱离,导致封接失败。当前常用来固定活体小鼠的被动式颅骨固定方式由于狨猴体型大、运动幅度大,往往难以消除狨猴运动造成的残余位移,造成“跟不上”的问题。为了保证对清醒狨猴的膜片钳操作的正常进行,需要专门研发面向清醒非人灵长类动物的头部固定系统。
4 面向清醒非人灵长类动物脑科学研究的机器人化膜片钳操作的关键技术分析(Key technologies of robotic patch clamp operation for brain science research of awake non-human primates)仔细分析清醒非人灵长类动物膜片钳操作存在的显示“盲”、定位“缺”、动作“拙”、测量“难”与“跟不上”五大挑战,可以看出:突破“显示清”“定位准”可以为膜片钳系统提供“眼”;突破“动得巧”“测得真”就能为膜片钳系统提供“手”;此外,还需要研制固定动物头部的主动平台才能“跟得上”清醒动物。突破上述五大挑战,集成“眼”“手”“平台”使其协调工作是实现清醒非人灵长类动物脑科学研究的机器人化膜片钳操作的关键,如图 3所示。下面对上述5项挑战的潜在解决方法进行讨论。

|
图 3 面向清醒非人灵长类动物脑科学研究的机器人化膜片钳系统设计方案 Fig.3 Design of the robotic patch clamp system for the brain research of awake non-human primates |
如前所述,“显示清”的关键是保证玻璃电极在体内环境移动过程中注出的荧光溶液形成一个稳定的荧光场,这需要对电极口的流速进行动态调控保证在堵塞等情况下荧光场的稳定。完成这一任务需要以荧光溶液流速作为中介建立注射气压与形成荧光场之间的关系。膜片钳电极内荧光染料流速除了受注射压的影响之外还受到大脑皮层组织环境内压和电极形状等多重因素的影响;获取针口流速分布需要求解纳维-斯托克斯方程,该方程目前仅能在少数高度对称的管道(如圆柱形微管)条件下获得解析解,而在锥形电极条件下很难求得解析解。
实验建模是这一难题的潜在解决办法。通过电极在石蜡油中注射荧光溶液球,通过溶液球体积的动态变化获得流速。进而,通过训练建立电极内注射压强、管外环境压强与溶液流速之间的关系,为后续的流速控制提供实验模型。进一步的,通过荧光显微镜下的注射实验,利用显微图像处理技术可以获得不同流速下形成的荧光场形状与范围,能够确定气压-流速-光场的动态模型。最终利用该模型对荧光场进行实时反馈,确定针口动态流速,通过气压调节流速,以维持稳定的光场。
4.2 如何“定位准”——基于双光子显微图像的膜片钳电极与目标细胞3维定位技术虽然活体动物大脑皮层环境非常复杂,但通过膜片钳电极内荧光染料的恒定流速控制获得均匀荧光场后,在黑暗环境中在水平方向定位荧光标记的目标并不难。因此,基于双光子显微图像的膜片钳电极与神经元3维定位主要难点是深度方向定位。
膜片钳电极深度方向定位方面,Suk等[19]通过在玻璃电极内施加正压克服毛细作用,使电极充满荧光染料从而获得电极的轮廓,利用聚焦下的电极轮廓最细的特征,对不同离焦深度的电极轮廓直径进行检测获得电极的聚焦平面,作为电极深度方向定位信息;同时通过聚焦平面上的电极轮廓定位电极的水平方向位置;最终实现电极的3维定位。该方法对活体非人灵长类动物的大脑膜片钳电极3维定位具有借鉴意义。
神经元深度方向定位方面,Annecchino等[18]利用聚焦状态的染色细胞与背景的荧光亮度差异最大这一特点对细胞进行自动聚焦,获取细胞深度位置。Suk等[19]在双光子靶向膜片钳实验中,利用聚焦状态下的细胞最亮的特征,通过平均像素数极大值点进行聚焦获得细胞的深度信息。上述方法在清醒动物的心跳、血管脉动等引起的细胞变形和离焦条件下无法进行准确的细胞定位。北京大学Li等[42]采用2维互相关计算获得每一帧细胞图像的偏移量,从而降低脑组织运动对细胞图像产生的干扰,进行了荧光显微图像平面定位。这对于清醒非人灵长类动物大脑荧光图像中的神经细胞3维定位具有很好的借鉴意义。
双光子阴影膜片钳操作中,处在阴影中的神经元即使在聚焦状态下轮廓依然十分模糊,因此使用上述2种基于聚焦时细胞图像特征的方法难以获得其准确的3维位置。考虑到传统膜片钳操作中脑片中的细胞边界因被组织遮挡,在明场显微镜中的成像也有轮廓模糊的情况,因此前面所述的明场显微镜下脑片神经细胞自动定位中使用的基于深度学习[13]和基于离焦成像的细胞定位方法[35]有可能对于阴影状态下的神经细胞定位有所帮助。
4.3 如何“动得巧”——机器人化膜片钳电极的运动规划与主动避障“动得巧”的主要任务是进行以轴向下电极主导的路径规划与主动避障。活体动物脑科学研究中,膜片钳电极需要穿越含有微血管等障碍物的区域才能到达目标神经元,实时识别微血管并成功避障是实验成功的关键之一。目前利用在体膜片钳系统对微血管进行识别的研究较少。同时,由于双光子显微图像中微血管相比细胞更加模糊,因此传统的图像处理方法对微血管辨识不再适用。
本课题组前期采用改进的U-Net深度学习分割网络对微血管进行分割和辨识,由于将Inception模块引入U-Net,该模块包含了多个小卷积核,因此改进后的网络能够处理不同尺度的微血管[43]。以狨猴为例,从膜片钳电极进入动物大脑皮层开始,到其达到视觉皮层神经元为止,所面临的是一个约1 mm
膜片钳下电极过程需要考虑电极与软组织交互导致的软组织变形和目标细胞偏移问题。文[13] 使用Kanade-Lucas-Tomasi(KLT)特征算法估计电极运动引起的脑片神经细胞水平方向位移,通过模板匹配来估计深度方向的位移,可以对体内环境中玻璃电极移动造成的细胞偏移的估计提供借鉴。
4.4 如何“测得真”——机器人化精准封接、破膜和信号检测测量皮安级信号需要极高的信噪比。为此,测量信号前需要将一小部分细胞膜吸入玻璃电极内并与之形成GΩ级的高阻封接,以隔离环境中的电磁信号,因此高阻封接效果对最终测量结果影响极大。为实现精准的高阻封接,除前述的膜片钳电极与细胞精准定位外,还需要进行精准封接负压控制。目前的自动化膜片钳操作中[18-19],操作者事先设定固定负压进行封接,无法根据具体状况进行调整。而手动操作中通常由操作者以“口吸”方式调整封接中的负压,也很难满足细胞精准封接的需求。课题组前期实现了一种基于平衡压模型的玻璃微管内压强的精准控制方法[44],有望解决该问题。
动物呼吸、脉动产生的扰动和测量过程中的膜片钳参数漂移都会对细胞电生理信号测量结果产生干扰。通过对膜片钳系统的关键参数(如探头反馈电阻、等效电阻抗、快电容和串联电阻等)进行基于状态子空间的在线参数辨识,建立膜片钳系统的动态模型,可以对膜片钳参数漂移造成的信号误差进行修正。实验动物对膜片钳电生理信号的干扰主要来自清醒动物的呼吸及随机抖动。呼吸产生的扰动是一种周期性信号,其周期可以根据动物的宏观位移来检测确定。而动物的随机抖动则可以建模为随机阶跃扰动,同样可以根据动物宏观位移通过检测扰动的持续时间和频率等来确定。进一步的,结合膜片钳动态模型,可以确定这些扰动的时域和频域特性,辨识并去除这2类扰动产生的干扰信号,实现细胞电生理信号的精准测量。
4.5 如何“跟得上”——面向清醒动物的主动固定与跟踪技术针对脑部手术操作中的活体动物运动干扰问题,英国生理学家与神经外科医生Horsley和Clarke首次提出将动物头部进行完全固定的单元[45],称为脑部固定单元。此固定单元由1个刚性的不规则圆环、4根支杆和4根别针组成。后续研究人员将上述固定单元改进成在同一水平面安装刚性不规则圆环与别针的新型脑部固定单元[46-47]。这种固定单元将刚性不规则圆环做成同一平面或阶梯平面[48-50],将别针沿圆环径向插入颅骨中,以灵活适应头部的固定需求。此类侵入式固定单元中,插入脑部的别针在与颅骨长时间接触后会引发颅骨缝隙处慢性感染、骨坏死及其他并发症,不适合用于清醒非人灵长类动物膜片钳操作中的动物固定。
鉴于上述侵入式固定单元的不足,非侵入式脑部固定单元[51-53]近年来成为研究的热点。它是在原侵入式圆环固定单元的基础上增加直接放置在头部的石膏模具和固定在其上方的盖玻片,实验中操作者通过盖玻片可以进行观察。由于膜片钳电极无法穿透盖玻片,因此在操作膜片钳电极时需采用琼脂覆盖[54-56]。这些脑部固定单元皆为被动型,一般在实验对象麻醉状态下使用,对于清醒动物则存在“跟不上”其主动运动的问题。
为了“跟得上”清醒实验动物的残余运动,膜片钳系统需要主动补偿动物运动恢复后的残余位移。Wilbert[57]与Menten[58]采用自适应滤波预测和预先确定运动模型的方法确定了实现目标位姿的补偿定位命令;Buzurovic[59]提出基于协调动力学的PID控制策略来控制机器人系统连续运动的方法,实时跟踪补偿了目标的平移运动;Herrmann等[60]将模型预测控制方法成功应用于机器人治疗台的运动补偿,解决了临床中治疗台的位置漂移问题。然而,这些方法大多局限于3维平动的运动补偿,而清醒动物的残余位移是不会限于“平动”的。Liu等[61]提出一种适用于6维运动的反馈规划运动补偿方法,但此方法需在每个周期内对整个6维运动轨迹空间进行全局搜索以寻求最优解,求解过程的计算量大、冗余高、耗时长。清醒非人灵长类动物固定装置的主动补偿需要兼顾最佳补偿路径和最短补偿时间。
5 面向脑科学研究的机器人化膜片钳操作前景展望(Prospect of robotic patch clamp operation for brain research)表 1总结了目前文献中报道的典型的机器人化膜片钳系统在“显示清”“定位准”“动得巧” “测得真”“跟得上”5个方面的工作。不难看出,虽然近年来世界范围的研究者都在努力推进膜片钳系统的自动化,但相关系统的自动化成果方面都是零星的,缺乏系统性的推进。在本文所总结的五大挑战方面,也仅有局部功能上的进展。面向清醒动物脑科学研究的机器人化主动膜片钳的系统研制,迫切需要突破的技术挑战,及成功的清醒非人灵长类动物脑科学实验等方面,均未见相关报道。鉴于清醒非人灵长类动物在人类脑科学中不可替代的作用,以及膜片钳操作作为脑科学研究中的关键技术这一事实,可以预见在将来较长的一段时间内,面向清醒非人灵长类动物的机器人化膜片钳系统将是脑科学领域的研究热点之一。
|
|
表 1 机器人化膜片钳研究现状总结 Tab. 1 A summary of robotic patch clamp research |
当前依赖视觉导引的机器人化膜片钳操作主要针对深度在500 µm内的视觉皮层、听觉皮层等浅层区域的操作。这主要是受当前的双光子显微镜成像深度的限制所致。近年来,多光子显微镜的研发取得了显著进展[62]。相较于双光子显微镜,多光子显微镜使用多于2个的光子来激发荧光分子,因此相较于双光子显微镜可以使用能量更低、波长更长、组织穿透力更强的光源激发,可以对活体动物大脑深度大于1 mm级的脑区进行成像。即便成像深度不变,通过增加光子数目也可以有效改善在体组织内的成像质量,将有助于细胞、电极的定位和环境3维重建,并有力地促进“定位准”和“动得巧”2项挑战的解决。虽然目前关于多光子膜片钳系统的研究仍处于探索阶段,但相信在不久的将来,配备多光子显微成像设备的机器人化膜片钳系统的应用将会有力地促进视觉引导的活体动物深层脑区(如海马区)功能研究。
另外,从表 1还可以看出,当前文献报道的机器人化膜片钳系统的记录模式多为全细胞模式和贴附式(在全细胞模式形成之前的必经步骤)。而对于脑科学离子通道功能研究至关重要的内面朝外式和外面朝外式2类记录模式的机器人操作还未见报道。这主要是由于这2类方法需要通过控制管内压强和玻璃电极的运动速度来制作膜片,必要时还需要将细胞膜暴露在空气中或者低钙溶液中使得囊泡破裂形成膜片,因此相较于全细胞膜片钳操作步骤更为复杂,对操作者的经验要求更高,成功率也更低。但相信随着膜片钳电极内气压控制系统的精度的提升和电极运动控制算法的改进,这2类记录模式的自动化研究也将取得进展。
| [1] |
Bear M F, Connors B W, Paradiso M A. Neuroscience: Exploring the brain[M]. 4th ed. Burlinton, USA: Jones & Bartlett Learning, 2016.
|
| [2] |
Neher E, Sakmann B. Single-channel currents recorded from membrane of denervated frog muscle fibres[J]. Nature, 1976, 260(5554): 799-802. DOI:10.1038/260799a0 |
| [3] |
Sakmann B, Neher E. Single-channel recording[M]. 2th ed. Boston, USA: Springer, 1995.
|
| [4] |
Verkhratsky A, Parpura V. History of electrophysiology and the patch clamp[M]//Patch-Clamp Methods and Protocols. New York, USA: Humana, 2014: 1-19.
|
| [5] |
Hodge R D, Bakken T E, Miller J A, et al. Conserved cell types with divergent features in human versus mouse cortex[J]. Nature, 2019, 573(7772): 61-68. DOI:10.1038/s41586-019-1506-7 |
| [6] |
Adam Y, Kim J J, Lou S, et al. Voltage imaging and optogenetics reveal behaviour-dependent changes in hippocampal dynamics[J]. Nature, 2019, 569(7756): 413-417. DOI:10.1038/s41586-019-1166-7 |
| [7] |
Piatkevich K D, Suk H J, Kodandaramaiah S B, et al. Near-infrared fluorescent proteins engineered from bacterial phytochromes in neuroimaging[J]. Biophysical Journal, 2017, 113(10): 2299-2309. DOI:10.1016/j.bpj.2017.09.007 |
| [8] |
Okada Y. Patch clamp techniques: From beginning to advanced protocols[M]. Tokyo, Japan: Springer, 2012.
|
| [9] |
Milligan C J, Jiang L H. Automated planar patch-clamp recording of P2X receptors[M]//Purinergic Signaling. Methods in Molecular Biology. New York, USA: Humana, 2019: 285-300.
|
| [10] |
Obergrussberger A, Friis S, Brüggemann A, et al. Automated patch clamp in drug discovery: Major breakthroughs and innovation in the last decade[J]. Expert Opinion on Drug Discovery, 2021, 16(1): 1-5. DOI:10.1080/17460441.2020.1791079 |
| [11] |
Wu Q Y, Kolb I, Callahan B M, et al. Integration of autopatching with automated pipette and cell detection in vitro[J]. Journal of Neurophysiology, 2016, 116(4): 1564-1578. DOI:10.1152/jn.00386.2016 |
| [12] |
Kolb I, Landry C R, Yip M C, et al. PatcherBot: A single-cell electrophysiology robot for adherent cells and brain slices[J]. Journal of Neural Engineering, 2019, 16(4). DOI:10.1088/1741-2552/ab1834 |
| [13] |
Koos K, Olah G, Balassa T, et al. Automatic deep learning-driven label-free image-guided patch clamp system[J]. Nature Communication, 2021, 12(1). DOI:10.1038/s41467-021-21291-4 |
| [14] |
Kodandaramaiah S B, Franzesi G T, Chow B Y, et al. Automated whole-cell patch-clamp electrophysiology of neurons in vivo[J]. Nature Methods, 2012, 9(6): 585-587. DOI:10.1038/nmeth.1993 |
| [15] |
Stoy W A, Kolb I, Holst G L, et al. Robotic navigation to subcortical neural tissue for intracellular electrophysiology in vivo[J]. Journal of Neurophysiology, 2017, 118(2): 1141-1150. DOI:10.1152/jn.00117.2017 |
| [16] |
Kodandaramaiah S B, Flores F J, Holst G L, et al. Multi-neuron intracellular recording in vivo via interacting autopatching robots[J]. eLife, 2018, 7. DOI:10.7554/eLife.24656 |
| [17] |
Desai N S, Siegel J J, Taylor W, et al. MATLAB-based automated patch-clamp system for awake behaving mice[J]. Journal of Neurophysiology, 2015, 114(2): 1331-1345. DOI:10.1152/jn.00025.2015 |
| [18] |
Annecchino L A, Morris A R, Copeland C S, et al. Robotic automation of in vivo two-photon targeted whole-cell patch-clamp electrophysiology[J]. Neuron, 2017, 95(5): 1048-1055. DOI:10.1016/j.neuron.2017.08.018 |
| [19] |
Suk H J, van Welie I, Kodandaramaiah S B, et al. Closed-loop real-time imaging enables fully automated cell-targeted patch-clamp neural recording in vivo[J]. Neuron, 2017, 95(5): 1037-1047. DOI:10.1016/j.neuron.2017.08.011 |
| [20] |
Mitchell J F, Leopold D A. The marmoset monkey as a model for visual neuroscience[J]. Neuroscience Research, 2015, 93: 20-46. DOI:10.1016/j.neures.2015.01.008 |
| [21] |
Mitchell J F, Reynolds J H, Miller C T. Active vision in marmosets: A model system for visual neuroscience[J]. Journal of Neuroscience, 2014, 34(4): 1183-1194. DOI:10.1523/JNEUROSCI.3899-13.2014 |
| [22] |
de Boer R A, Overduin-de Vries A M, Louwerse A L, et al. The behavioral context of visual displays in common marmosets (Callithrix jacchus)[J]. American Journal of Primatology, 2013, 75(11): 1084-1095. DOI:10.1002/ajp.22167 |
| [23] |
Nummela S U, Jutras M J, Wixted J T, et al. Recognition memory in marmoset and macaque monkeys: A comparison of active vision[J]. Journal of Cognitive Neuroscience, 2019, 31(9): 1318-1328. DOI:10.1162/jocn_a_01361 |
| [24] |
Ding R, Liao X, Li J, et al. Targeted patching and dendritic Ca2+ imaging in nonhuman primate brain in vivo[J]. Scientific Reports, 2017, 7. DOI:10.1038/s41598-017-03105-0 |
| [25] |
刘振伟. 实用膜片钳技术[M]. 2版. 北京: 北京科学技术出版社, 2016. Liu Z W. Practical patch clamp techniques[M]. 2nd ed. Beijing: Beijing Science and Technology Publishing Co., Ltd, 2016. |
| [26] |
Neupert S, Fusca D, Kloppenburg P, et al. Analysis of single neurons by perforated patch clamp recordings and MALDI-TOF mass spectrometry[J]. ACS Chemical Neuroscience, 2018, 9(8): 2089-2096. DOI:10.1021/acschemneuro.8b00163 |
| [27] |
Hess S, Pouzat C, Paeger L, et al. Analysis of neuronal Ca2+ handling properties by combining perforated patch clamp recordings and the added buffer approach[J]. Cell Calcium, 2021, 97. DOI:10.1016/j.ceca.2021.102411 |
| [28] |
Hilgemann D W, Lu C C. Giant membrane patches: Improvements and applications[J]. Methods in Enzymology, 1998, 293: 267-280. |
| [29] |
Besch S R, Suchyna T, Sachs F. High-speed pressure clamp[J]. Pflugers Archiv – European Journal of Physiology, 2002, 445(1): 161-166. DOI:10.1007/s00424-002-0903-0 |
| [30] |
Danker T, Braun F, Silbernagl N, et al. Catch and patch: A pipette-based approach for automating patch clamp that enables cell selection and fast compound application[J]. Assay and Drug Development Technologies, 2016, 14(2): 144-155. DOI:10.1089/adt.2015.696 |
| [31] |
Kostyuk P G, Krishtal O A, Pidoplichko V I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells[J]. Nature, 1975, 257(5528): 691-693. DOI:10.1038/257691a0 |
| [32] |
Kikuchi K, Sugiura M, Nishizawa-Harada C, et al. The application of the Escherichia coli giant spheroplast for drug screening with automated planar patch clamp system[J]. Biotechnology Reports, 2015, 7: 17-23. DOI:10.1016/j.btre.2015.04.007 |
| [33] |
Obergrussberger A, Brueggemann A, Goetze T A, et al. Automated patch clamp meets high-throughput screening: 384 cells recorded in parallel on a planar patch clamp module[J]. Journal of Laboratory Automation, 2016, 21(6): 779-793. DOI:10.1177/2211068215623209 |
| [34] |
Milligan C J, Li J, Sukumar P, et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells[J]. Nature Protocols, 2009, 4(2): 244-255. DOI:10.1038/nprot.2008.230 |
| [35] |
Zhao Q L, Han Y, Jia Y Q, et al. Robotic whole-cell patch clamping based on three dimensional location for adherent cells [C]//International Conference on Manipulation, Automation and Robotics at Small Scales. Piscataway, USA: IEEE, 2020. DOI: 10.1109/MARSS49294.2020.9307890.
|
| [36] |
Lee J, Kolb I, Forest C R, et al. Cell membrane tracking in living brain tissue using differential interference contrast microscopy[J]. IEEE Transactions on Image Processing, 2018, 27(4): 1847-1861. DOI:10.1109/TIP.2017.2787625 |
| [37] |
Jouhanneau J S, Poulet J F A. Multiple two-photon targeted whole-cell patch-clamp recordings from monosynaptically connected neurons in vivo[J]. Frontiers in Synaptic Neuroscience, 2019, 11. DOI:10.3389/fnsyn.2019.00015 |
| [38] |
Hsiao Y T, Huang Y F, Borah B J, et al. Single-laser-based simultaneous four-wavelength excitation source for femtosecond two-photon fluorescence microscopy[J]. Biomedical Optics Express, 2021, 12(8): 4661-4679. DOI:10.1364/BOE.428771 |
| [39] |
Margrie T W, Meyer A H, Caputi A, et al. Targeted whole-cell recordings in the mammalian brain in vivo[J]. Neuron, 2003, 39(6): 911-918. DOI:10.1016/j.neuron.2003.08.012 |
| [40] |
Kitamura K, Judkewitz B, Kano M, et al. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo[J]. Nature Methods, 2008, 5(1): 61-67. DOI:10.1038/nmeth1150 |
| [41] |
Harrison R R, Kolb I, Kodandaramaiah S B, et al. Microchip amplifier for in vitro, in vivo, and automated whole cell patch-clamp recording[J]. Journal of Neurophysiology, 2015, 113(4): 1275-1282. DOI:10.1152/jn.00629.2014 |
| [42] |
Li M, Liu F, Jiang H F, et al. Long-term two-photon imaging in awake macaque monkey[J]. Neuron, 2017, 93(5): 1049-1057. DOI:10.1016/j.neuron.2017.01.027 |
| [43] |
Wang Y Q, Liu Y W, Sun M Z, et al. Deep-learning-based polar-body detection for automatic cell manipulation[J]. Micromachines, 2019, 10(2). DOI:10.3390/mi10020120 |
| [44] |
Zhao Q L, Wu M, Cui M S, et al. A novel pneumatic micropipette aspiration method using a balance pressure model[J]. Review of Scientific Instruments, 2013, 84(12). DOI:10.1063/1.4832979 |
| [45] |
Marshall L H, Magoun H W. The Horsley-Clarke stereotaxic instrument: The beginning[R]. Tujunga, USA: Kopf Instruments, 1990.
|
| [46] |
Isoda M, Tsutsui K I, Katsuyama N, et al. Design of a head fixation device for experiments in behaving monkeys[J]. Journal of Neuroscience Methods, 2005, 141(2): 277-282. DOI:10.1016/j.jneumeth.2004.07.003 |
| [47] |
Davis T S, Torab K, House P, et al. A minimally invasive approach to long-term head fixation in behaving nonhuman primates[J]. Journal of Neuroscience Methods, 2009, 181(1): 106-110. DOI:10.1016/j.jneumeth.2009.04.012 |
| [48] |
Azimi K, Prescott I A, Marino R A, et al. Low profile halo head fixation in non-human primates[J]. Journal of Neuroscience Methods, 2016, 268: 23-30. DOI:10.1016/j.jneumeth.2016.04.018 |
| [49] |
Lanz F, Lanz X, Scherly A, et al. Refined methodology for implantation of a head fixation device and chronic recording chambers in non-human primates[J]. Journal of Neuroscience Methods, 2013, 219(2): 262-270. DOI:10.1016/j.jneumeth.2013.07.015 |
| [50] |
Adams D L, Economides J R, Jocson C M, et al. A biocompatible titanium headpost for stabilizing behaving monkeys[J]. Journal of Neurophysiology, 2007, 98(2): 993-1001. DOI:10.1152/jn.00102.2007 |
| [51] |
Itoh K, Nejime M, Konoike N, et al. Noninvasive scalp recording of cortical auditory evoked potentials in the alert macaque monkey[J]. Hearing Research, 2015, 327: 117-125. DOI:10.1016/j.heares.2015.05.007 |
| [52] |
Machado C J, Nelson E E. Eye-tracking with nonhuman primates is now more accessible than ever before[J]. American Journal of Primatology, 2011, 73(6): 562-569. DOI:10.1002/ajp.20928 |
| [53] |
Udayakumaran S, Onyia C U. Customizable rigid head fixation for infants: Technical note[J]. Child's Nervous System, 2016, 32(1): 159-161. DOI:10.1007/s00381-015-2896-y |
| [54] |
Amemori S, Amemori K, Cantor M L, et al. A non-invasive head-holding device for chronic neural recordings in awake behaving monkeys[J]. Journal of Neuroscience Methods, 2015, 240: 154-160. DOI:10.1016/j.jneumeth.2014.11.006 |
| [55] |
Drucker C B, Carlson M L, Toda K, et al. Non-invasive primate head restraint using thermoplastic masks[J]. Journal of Neuroscience Methods, 2015, 253: 90-100. DOI:10.1016/j.jneumeth.2015.06.013 |
| [56] |
Slater H, Milne A E, Wilson B, et al. Individually customisable non-invasive head immobilisation system for non-human primates with an option for voluntary engagement[J]. Journal of Neuroscience Methods, 2016, 269: 46-60. DOI:10.1016/j.jneumeth.2016.05.009 |
| [57] |
Wilbert J, Meyer J, Baier K, et al. Tumor tracking and motion compensation with an adaptive tumor tracking system (ATTS): System description and prototype testing[J]. Medical Physics, 2008, 35(9): 3911-3921. DOI:10.1118/1.2964090 |
| [58] |
Menten M J, Guckenberger M, Herrmann C, et al. Comparison of a multileaf collimator tracking system and a robotic treatment couch tracking system for organ motion compensation during radiotherapy[J]. Medical Physics, 2012, 39(11): 7032-7041. DOI:10.1118/1.4761868 |
| [59] |
Buzurovic I, Huang K, Yu Y. A robotic approach to 4D real-time tumor tracking for radiotherapy[J]. Physics in Medicine and Biology, 2011, 56(5): 1299-1318. DOI:10.1088/0031-9155/56/5/005 |
| [60] |
Herrmann C, Ma L, Schilling K. Model predictive control for tumor motion compensation in robot assisted radiotherapy[J]. IFAC Proceedings Volumes, 2011, 44(1): 5968-5973. DOI:10.3182/20110828-6-IT-1002.00342 |
| [61] |
Liu X M, Wiersma R D. Optimization based trajectory planning for real-time 6DoF robotic patient motion compensation systems[J]. PLOS ONE, 2019, 14(1). DOI:10.1371/journal.pone.0210385 |
| [62] |
Li B, Wu C Y, Wang M R, et al. An adaptive excitation source for high-speed multiphoton microscopy[J]. Nature Methods, 2020, 17(2): 163-166. DOI:10.1038/s41592-019-0663-9 |
| [63] |
Dunlop J, Bowlby M, Peri R, et al. High-throughput electrophysiology: An emerging paradigm for ion-channel screening and physiology[J]. Nature Reviews: Drug Discovery, 2008, 7(4): 358-368. DOI:10.1038/nrd2552 |
| [64] |
Peng Y F, Mittermaier F X, Planert H, et al. High-throughput microcircuit analysis of individual human brains through next-generation multineuron patch-clamp[J]. eLife, 2019, 8. DOI:10.7554/eLife.48178 |
| [65] |
Kodandaramaiah S B, Holst G L, Wickersham I R, et al. Assembly and operation of the autopatcher for automated intracellular neural recording in vivo[J]. Nature Protocols, 2016, 11(4): 634-654. DOI:10.1038/nprot.2016.007 |
| [66] |
Komai S, Denk W, Osten P, et al. Two-photon targeted patching (TPTP) in vivo[J]. Nature Protocols, 2006, 1(2): 647-652. DOI:10.1038/nprot.2006.100 |
| [67] |
Lee A K, Epsztein J, Brecht M. Head-anchored whole-cell recordings in freely moving rats[J]. Nature Protocols, 2009, 4(3): 385-392. DOI:10.1038/nprot.2009.5 |
 2022, Vol. 44
2022, Vol. 44


