2. 南开大学天津市智能机器人技术重点实验室,天津 300350;
3. 天津市环湖医院康复医学科,天津 300350;
4. 中国科学院沈阳自动化研究所机器人学国家重点实验室,辽宁 沈阳 110016;
5. 中国科学院机器人与智能制造创新研究院,辽宁 沈阳 110169;
6. 天津市环湖医院神经内科,天津 300350
2. Tianjin Key Laboratory of Intelligent Robotics, Nankai University, Tianjin 300350, China;
3. Department of Rehabilitation Medicine, Tianjin Huanhu Hospital, Tianjin 300350, China;
4. State Key Laboratory of Robotics, Shenyang Institute of Automation, Chinese Academy of Sciences, Shenyang 110016, China;
5. Institutes for Robotics and Intelligent Manufacturing, Chinese Academy of Sciences, Shenyang 110169, China;
6. Department of Neurology, Tianjin Huanhu Hospital, Tianjin 300350, China
帕金森病是世界第二大神经退行性疾病(neurodegenerative disease,亦称为“神经变性病”),在老龄人口中发病率较高[1]。预计到2030年全球前10位的人口大国50岁以上的帕金森病患者人数将达到930万人[2]。中国是帕金森病的第一大国,患者人数约占全球患者总数的一半[3],而且随着中国进入老龄化社会,预计每年新增帕金森病患者约20万例[2]。帕金森病患者的运动障碍情况往往是日益加重的,并可能伴随认知功能障碍[4],严重影响患者的日常生活。例如,帕金森病患者的行动迟缓,因动作执行能力受损导致生活参与度降低,生活质量下降;由于平衡能力低下,患者容易跌倒导致骨折或身体损伤;晚期患者往往完全丧失生活自理能力,长期卧床,还可能出现吞咽障碍[5-6]或呼吸困难[7-8]等症状,甚至由此引发肺炎等并发症造成死亡[9]。帕金森病为患者带来身体与心理方面的巨大痛苦。
康复训练是帕金森病的重要、有效的治疗方法,能激活大脑可塑性机制,促进神经康复,有效缓解帕金森病运动障碍症状,避免药物带来的副作用等。总体而言,帕金森病康复训练的目标是最大化患者的运动能力、独立生活能力、适应能力等,最小化并发症的影响,以最终提升患者的生活质量。帕金森病患者需要长期接受康复治疗,以减缓疾病造成的身体功能的退行,维持甚至提升生活质量。帕金森病康复训练需求庞大,但我国专业康复医疗中心数量不足、专业康复人才缺口大。国内康复师占总人口的比例远低于西方发达国家[10],难以适应当前帕金森病康复治疗需求迅速上升的情况,更难以保证患者获得专业的康复训练指导。智能机器人辅助康复技术,有望成为解决这些挑战的方案。
与传统人工辅助康复训练相比,机器人辅助神经康复训练具有独特的优势。首先,康复机器人可以提供高强度、可重复的康复训练,一旦普及应用,可以大大缓解康复机构的人员投入压力以及降低临床康复医师的工作负担。而更为突出的优势还在于,机器人可以提供灵活、量化的康复训练,提升患者康复训练的效果。主要体现在,机器人可以在训练中结合现代多媒体交互技术,激发患者参与康复训练的兴趣与热情,调动其主动参与训练的意识与能力,从而促进患者神经功能的恢复与补偿;与此同时,机器人还可以结合多种模态的传感器技术,实时精准地检测患者的身体情况变化,并用于康复训练策略的调整[11]。帕金森病康复机器人研究对于缓解资源、人力投入的压力,提升患者康复训练效果等方面具有重要意义。
但是,目前的神经康复机器人,系统设计、康复方法和临床应用等方面的研究多是针对脑卒中和脊髓损伤等神经系统损伤疾病[12-16],而没有针对帕金森病等神经退行性疾病。目前,虽然已经有研究将脑卒中或脊髓损伤康复机器人应用于帕金森病临床康复,但特别针对帕金森病理特点和康复需求的专病康复机器人还没有出现。为此,本文对帕金森病康复机器人研究进行综述和展望。
2 帕金森病的病理特点与康复机理(Pathological characteristics and rehabilitation mechanisms of PD)帕金森病特殊的病理特点,决定了帕金森病康复具有独特的康复机理与训练要求。为了突出说明帕金森病独特的病理特点与康复治疗机理,本节把帕金森病与脑卒中进行了详细对比,如表 1所示。脑卒中是一种具有代表性的神经系统疾病:目前关于脑卒中的康复训练体系已比较成熟,很多康复机器人是基于脑卒中的病理特点与康复需求进行开发的,并且已经在脑卒中临床康复中获得了疗效验证。因此,帕金森病与脑卒中的对比,更能说明帕金森病独特的康复需求。
|
|
表 1 脑卒中与帕金森病的病理特点与康复机理对比[4, 17-51] Tab. 1 Comparison of pathological characteristics and rehabilitation mechanisms between PD and stroke[4, 17-51] |
帕金森病的病变部位主要位于锥体外系,特别是基底神经节。基底神经节连接着大脑皮层、脑干、丘脑等结构[17],主要参与肌肉张力调节、肌肉运动启动与维持的调控、人体位姿平衡维持、感觉皮层的运动感觉信息整合等重要功能的实现。基底神经节的病变导致帕金森病患者出现了一系列运动症状,包括运动迟缓、肌肉强直、静息性震颤、姿势平衡障碍、冻结步态等[4]。
运动迟缓是帕金森病最为独特的症状之一。主要表现为,患者在主动运动时肢体动作缓慢、不灵活,并在执行重复性动作时运动幅度与运动速度逐渐减小[18-19]。运动迟缓产生的原因是,帕金森病患者基底神经节病变,多巴胺分泌不足,导致患者进行关节运动时肌肉难以启动,而且启动后施加力矩不足,无法达到预期目标位置[20-21]。然而,临床研究发现,如果患者以更大幅度的运动作为预期目标位置,激发更大量的多巴胺分泌,往往可以实现比原先运动幅度更大的肢体运动。这反映了帕金森病患者并非不能进行更大幅度的运动,而是患者选择执行的运动幅度小于实际运动任务所需的幅度[19]。与此相关联的,帕金森病患者的感觉运动整合功能存在异常。正常人的自主运动往往需要依靠感觉反馈才能实现。基底神经节参与整合来自大脑皮层的感觉信息,用以作为自主运动的反馈。而帕金森病导致的基底神经节病变,导致患者对时间与空间相关的运动感觉信息整合能力异常、感觉阈值异常、对动作响应选择存在障碍等[22-23],间接影响了依赖运动反馈的自主运动能力。运动迟缓的另一个特点是序列效应,即患者在连续执行重复的序列动作时,动作的幅度与速度逐渐减小[24]。序列效应综合表现为“小写症”,即连续书写时字体大小逐渐变小[25],行走时步长变异性增大[26]等症状。随病情恶化,序列效应往往会演变成动作“冻结”,即自主运动的丧失。例如,晚期患者受累部位肌肉激活程度过低,已经无法激活运动,导致冻结步态。另外,患者在单一运动时,身体采用皮层—小脑代偿回路辅助病变的锥体外系进行运动控制,但当患者需要同时执行多个任务,特别是包含认知任务时,由于运动控制能力无法满足任务需求,因而症状更为显著。如患者在执行多关节同时运动时,动作会更慢,幅度更小[19, 27];患者一边行走一边进行颜色区分任务时,容易触发步态冻僵的症状[28]。
肌肉强直以及静息性震颤也是帕金森病的重要临床症状。基底神经节病变导致患者对肌肉张力控制出现障碍,在患者松弛状态下主动肌和拮抗肌的肌张力仍然偏高,呈现出肌肉僵硬,肢体在外力作用下不容易屈曲运动的症状[29]。而静息性震颤,是指在患者患肢静止时出现频率在4 Hz~6 Hz的震颤,特别是当患者内心紧张时,震颤症状更加显著,但当患者进行运动时,震颤就会消失[30]。两种症状均源自于基底神经节对肌张力的控制异常,影响着患者的日常活动。
不同于帕金森病,造成脑卒中运动障碍的根源,是突发血管堵塞或破损事件损害了大脑运动皮层等高级神经中枢。这部分大脑区域属于锥体系。有别于锥体外系的控制功能,锥体系主要负责高级运动控制,例如人的自主运动控制等。因此,脑卒中造成的运动障碍往往表现为运动功能突然丧失,出现肢体瘫痪、偏瘫等症状[31-32]。由于受损的高级神经中枢失去对低级神经中枢的支配能力,低级神经中枢产生的异常反射无法被抑制,导致患者出现姿势与运动模式异常、肌肉痉挛等症状。例如,患者在脑卒中发生后,肩膀与手肘、手腕与手指的屈曲或伸展运动之间发生异常的协同作用[33-34]。
通过上述的对比可以发现,帕金森病与脑卒中在发病位置、症状表现以及产生机理等方面均存在显著差异。因此,帕金森病康复不能完全照搬脑卒中的康复模式。
2.2 康复机理康复训练是帕金森病治疗的有效手段。通过科学的康复训练方法,可以激活大脑可塑性机制[35-37],促进患者神经康复,改善患者运动控制能力,维持甚至提升患者运动功能的储备以抵御退行性运动症状影响,同时可以预防二次并发症[38-40]。
帕金森病具有特殊的病理特点,这从根本上决定了其康复机理有别于脑卒中等脑损伤疾病。首先,帕金森病是一种神经退行性疾病,即神经系统病变引起的运动及非运动症状会随着病情恶化而不断加重。由于神经系统的代偿机制作用,部分症状在早期可能并不会显现;而随着病情恶化,当代偿机制已不足以补偿退行的能力时,相应症状就会显现,且日益严重。与之相应的,帕金森病康复需要及早发现被掩藏的退行能力,并根据病情进展,针对性调整康复策略。因此,临床上,在帕金森病康复训练过程中需要不断对病情进行诊断评估。帕金森病的诊断与康复是密切相连的。此外,由于神经退行的特性,不同病情时期,帕金森病康复有不同的训练重点。在疾病的早、中期,帕金森病康复重点关注涉及患者日常生活中的重要运动能力,例如:行走步态、平衡能力以及手部操作能力等[41-42],以抵抗病情的退行。而到了患病晚期,由于患者的运动能力已经严重下降,康复治疗的重点是尽量保持患者关键运动能力,减少并发症,例如:从躺卧到坐起的起床策略,吞咽康复训练等。不同时期的训练重点以及需求对帕金森病康复机器人提出了不同的训练内容与要求。
运动迟缓是帕金森病康复中重点关注的症状之一。针对患者多巴胺分泌不足而导致的运动幅度与速度偏小等症状,帕金森病康复训练中,鼓励患者进行尽量大幅度的运动,激发大脑产生更多多巴胺。同时鼓励患者选择更大幅度运动作为预期目标位置来调整实际运动幅度,让患者重新校正被疾病改变的运动幅度与动作期望之间的比例关系,并通过重复训练,形成自我提示,从而改善患者的运动能力。帕金森病专科康复训练方法LSVT-BIG鼓励患者重复进行大幅度的运动训练,使动作幅度正常化[43]。临床研究已经充分证明,经过LSVT-BIG训练后,患者在指向任务中的指向误差显著减小,本体感觉能力得到提升[44]。
帕金森病康复训练常借助外部提示帮助患者改善运动障碍症状。例如,加拿大研发的“步歌”(AmbuloSono)训练法,通过训练建立动作与音乐等声音提示之间的关联关系以及奖励机制,帮助患者自主调整步态[45-46]。使用时,传感器对患者动作进行实时检测识别,设备根据患者动作检测结果在适当时机播放预先定制的音乐作为外部提示信号,帮助帕金森病患者启动动作与调整动作幅度。使用这种康复辅助方法后,患者的行走步态得到显著改善[47]。除了声音外,视觉也是常见的外部提示方式。例如通过在鞋面上设置激光射灯,在患者向前行走时,触发激光射灯投射出下一个脚步需要达到的参考位置,可以辅助帕金森病患者启动脚步,显著减少冻结步态的发生[48-49]。
与帕金森病相比,脑卒中康复需要优先帮助患者重新习得正确的运动模式。为此,脑卒中的康复方式是根据肢体反射、本体感觉刺激等规律帮助患者重新建立正常的运动模式。如Bobath康复技术通过特定的肢体反射规律,抑制脑卒中后肌肉之间收缩或伸展的异常协同症状,并诱导正常的运动模式,从而辅助患者重新习得正常的运动控制能力[50]。而本体感觉神经肌肉促进疗法(proprioceptive neuro-muscular facilitation,PNF)则是利用本体感觉刺激,促进神经肌肉产生合适的反应,以辅助患者重新建立正常的运动控制模式[51]。通过比较可以看出,帕金森病与脑卒中康复训练具有截然不同的康复任务:脑卒中康复是通过训练重新获得丧失的能力,需要重新建立正确的运动控制模式;而帕金森病康复则是通过训练纠正因疾病而改变的能力,需要重新校正运动幅度、通过一定策略辅助肌肉启动运动。
总结本节的介绍与对比分析,康复训练是治疗帕金森病的重要手段。通过康复训练,帕金森病患者的运动障碍症状可以获得改善,使患者的生活质量得以提升。与脑卒中相比,帕金森病的发病部位、病理特点具有特殊性,决定了两者在康复训练当中有截然不同的康复机理与训练需求。这些差异为帕金森病康复机器人的研发提出了特定的需求。
3 帕金森病康复机器人研究现状(Current research on PD rehabilitation robots)帕金森病致病机理复杂,导致帕金森病康复机器人的研究受到了一定的制约。近年来,帕金森病病理研究以及康复理论不断发展,为康复机器人技术提供了医学理论基础。同时一大批神经康复机器人在脑卒中[52-54]、脊髓损伤[55-57]、脑瘫[58-60]等疾病康复研究中取得成功,促进了神经康复的共性技术发展,其中不少康复机器人逐渐被用于帕金森病康复(如表 2所示)。在上肢运动康复方面,有德国RehaStim公司的Bi-Manu-Track[61]康复机器人;而下肢运动康复方面,有瑞士Reha Technology公司的G-EO[62]机器人以及德国RehaStim公司的Gait Trainer GT1[63]等。此外,部分高校也自主研发用于帕金森病康复研究的机器人系统,如美国麻省理工学院(MIT)研发的MIT-MANUS[64-65]机器人,美国明尼苏达大学(UMN)研发的WristBot[66]机器人,美国加州大学圣迭戈分校(UCSD)研发的用于手眼协调能力评估的机器人系统[67],美国哥伦比亚大学(Columbia U)研发的A-TPAD [68-69]机器人。这些康复机器人的训练功能涵盖了帕金森病康复所关注的多项重要运动能力,包括手部操作能力,下肢行走步态以及姿态平衡能力等。其系统如图 1所示。
|
|
表 2 帕金森病康复机器人系统 Tab. 2 Rehabilitation robotic systems for PD |

|
图 1 应用于帕金森病康复的机器人系统 Fig.1 Robotic systems applied to PD rehabilitation |
本节将系统介绍目前机器人技术在帕金森病上肢和下肢运动康复、震颤抑制以及病情评估方面的研究与应用情况。尽管运动迟缓、肌肉强直与静息震颤等是帕金森病典型的运动症状,但现有帕金森病康复机器人并非直接针对运动迟缓与肌肉强直症状的,而往往根据受累部位对上肢或下肢运动能力进行综合训练。临床实验表明,上、下肢综合训练对患者肢体的运动迟缓、肌肉强直等运动障碍均有一定改善作用。而震颤抑制技术,由于具有其他任务场景需求,如精密操作时手部生理震颤抑制等,因此受到了多方研究人员的关注。此外,病情评估也是帕金森病康复的关键环节,实时、准确地量化评估病情,有利于监测病情变化、预测康复效果,并实现机器人“按需辅助”。
3.1 上肢运动康复基于患者上肢运动症状,不少团队通过机器人提供阻抗、体感、视觉等感觉反馈,探究帕金森病患者在特定任务中的反应变化情况,并分析总结出患者与机器人交互过程中的运动特点与症状变化,以推动新的帕金森病康复方式与策略的制定。
应用于帕金森病上肢运动康复的机器人系统,在结构上的共同点是设置有进行上肢交互的末端结构(如手柄或者手指拉环等),一方面测试人员可以牵引机器人运动;另一方面,机器人可以向使用者提供力觉反馈。这种功能特点使机器人既可以对用户运动表现进行精确记录,同时也可以在运动中辅助或干扰用户进行训练。相较之下,多连杆结构的MIT-MANUS允许更大的运动幅度,而WristBot与UCSD搭建的手眼能力测试机器人等机器人系统则关注腕关节与手指在小范围内的运动干预。与前述机器人系统不同,Bi-Manu-Track可以同时对用户双手进行康复训练,并具有双侧同步协调运动的训练模式。此外,如MIT-MANUS、WristBot以及UCSD搭建的手眼能力测试机器人等机器人系统还具备虚拟游戏的交互方式,通过机器人控制屏幕中的虚拟体完成指定任务。游戏的交互方式使得训练富有趣味,有利于提高用户的训练热情,调动运动能力与运动意识主动参与康复训练。
Krebs等[78]使用MIT-MANUS机器人(见图 1 (a))探究帕金森病对患者程序学习能力的影响。研究中采用的MIT-MANUS机器人,是一款多连杆机器人康复系统,其末端设置有交互手柄。使用者通过控制握杆牵引机器人运动;同时,机器人可以为使用者提供特定的力觉反馈。实验使用MIT-MANUS机器人提供特定的干扰力场,让患者根据提示完成特定方向运动的任务,以探究帕金森病患者在不同学习阶段下的任务表现情况。实验结果显示,帕金森病患者与正常人相比在程序性运动学习能力上存在缺损,表现为学习率较低,而且在学习新任务或者动作迁移时的学习率下降幅度更大。
Elangovan等[73]采用WristBot机器人(见图 1(b))探究体感反馈训练对患者本体感觉的改善作用。WristBot是一款具有触觉反馈的机器人外骨骼[79],允许使用者手腕进行屈曲/伸展、外展/内拗,以及前臂的轴向旋转等3自由度运动;同时,机器人可以实现反向驱动,对前臂和手腕提供力觉反馈。实验中,招募的帕金森病患者和作为对照组的健康人分别通过机器人控制一个可运动的虚拟桌子,使桌面上的小球运动到指定区域并保持位置。实验结果表明,训练可以提升患者手部的空间操作精度,运动迟缓症状得到改善,而且提升后的效果可以实现局部迁移,即受训练关节执行其他未经训练的运动任务时,空间精度同样获得提升。该工作不但证明了帕金森病上肢运动康复的有效性,同时揭示了训练对本体感觉能力的提升是可以局部迁移的,而并不仅是对特定任务能力的提升。
Lukos等[67]探讨了帕金森病患者手眼协调以及实时调整能力的受累情况。实验中,测试者在药物治疗的“开期”与“关期”分别通过机器人控制屏幕上的虚拟手指,接近并抓住虚拟目标方块。实验中,2台小机械臂分别通过末端拉环与拇指、食指连接,提供力觉反馈,如图 1(d)所示。执行任务时,虚拟手指会随机消失,迫使测试者必须在无外部参考情况下通过自身内在的手眼协调能力完成动作;同时,虚拟手指接近时,目标虚拟方块会随机转动90
另外,针对帕金森病上肢康复的机器人临床效果验证研究目前仍相对较少。Picelli等[80]采用Bi-Manu-Track机器人进行手臂及腕部康复训练的有效性验证。Bi-Manu-Track机器人是一款可以同时进行双臂康复训练的机器人系统,如图 1(c)所示。机器人平台的两侧都可以独立选择主动或被动训练模式。实验招募的患者进行了为期2周的上肢康复训练,均包含双臂被动及双臂主动运动训练2种模式。实验结果显示,患者完成所有训练后,在九孔柱测试(nine-hole peg test,NHPT)[81]以及Fugl-Meyer[82]评估等上肢能力测评中,手部运动障碍症状得到了改善,手部运动能力显著提升。而且在训练2周后的随访中,患者在NHPT中依然保持着显著优于治疗前的表现,证明了上肢康复机器人具备改善患者手部动作能力的作用,而且改善的效应在至少2周内依然获得保留。
总结上述的工作,一方面,从技术研究方面看,经过专门设计的机器人系统可以创造出特定训练条件,使一些日常检查或训练中难以发现的症状特点及康复机理更加显著。这类工作加深了对帕金森病患者与机器人交互特点的认识,对研发新一代的帕金森病康复机器人及其相关技术有重要的启发意义。另一方面,关于临床效果验证的工作,目前仍比较少,但从现有临床验证试验的结果可以确定,机器人辅助康复对帕金森病上肢运动障碍有长期、显著的改善作用。
3.2 下肢运动康复行走步态控制以及行走时的姿势平衡能力是日常生活中的重要运动能力,深刻影响患者的生活质量。帕金森病导致的冻结步态、行走时失稳摔倒等症状严重限制了患者对日常活动的参与程度。因此,在帕金森病下肢康复研究中,机器人辅助改善行走步态以及姿势平衡能力等方面受到重点关注。
当前用于帕金森病下肢运动康复的机器人,均具备悬挂结构,用于帮助患者保持身体平衡,提高训练的安全性。其中,Gait Trainer GT1(见图 1(e))与G-EO(见图 1(f))均采用踏板式的机器人结构,即患者脚步踩踏在特制踏板结构上,通过对踏板进行控制,模拟不同路面情况,辅助患者进行步态训练;与之不同的,Lokomat机器人(见图 1(g))则采用基于外骨骼的结构。相比之下,采用踏板式构形的机器人更容易穿戴,而且可以直接控制踏板模拟平地、阶梯等不同的地形,而外骨骼式的结构虽然穿戴更加复杂,但可以对腿部不同关节实施针对性干预,通过跑步机调整也可以实现不同的坡度地形调整。而A-TPAD(见图 1(h))机器人则关注对用户重心的干预,通过拉索对患者的骨盆进行牵引实现对用户平衡状态的辅助或者干扰,并采用双列分离式跑步机配合用户进行步态训练。
下肢康复机器人产品的训练效果已经在脑卒中、脊椎损伤、脑瘫等神经损伤疾病的康复研究中得到了验证,而帕金森病的康复与这些神经疾病的康复具有一定的相似性,因此这些康复机器人在帕金森病康复中的有效性一直备受期待。
部分工作关注机器人辅助步态训练前后患者运动能力的提升效果。Lo等[83]采用Lokomat康复机器人进行了帕金森病康复效果验证。患者使用FOG-Q[84]量表对训练前后自身的行走能力进行自我评价。患者普遍认为训练后冻结步态情况有所减少。实验对患者步态参数进行了测量与分析,证明患者步行速度、步长、节奏性与协调性等步态参数在训练后得到了提升。这反映了患者下肢运动迟缓等运动障碍得到了综合的改善,运动能力得到了提升。Nardo等[85]以及Barbe等[86]的工作中也获得相似的结论。机器人辅助步态训练对冻结步态以及患者步态参数方面有改善效果。
另外,作为一种新兴的康复方式,机器人辅助训练与传统训练方式康复效果的比较也受到了关注。Picelli等[87]在2013年对机器人步态训练、跑步机步态训练以及物理治疗等3种形式的康复训练效果进行了对比。实验的机器人步态训练部分采用Gait Trainer GT1机器人负责完成。经过4周、每周3次45 min的训练后,测评结果显示机器人步态训练与跑步机步态训练的效果显著优于物理治疗训练,但机器人步态训练与跑步机步态训练对患者的改善效果没有显著差异。Capecci等[88]和Sale等[89]采用康复机器人系统G-EO与跑步机训练进行康复效果比较,同样获得类似的结论。上述验证实验中,机器人步态训练的康复效果至少与跑步机步态训练、传统物理治疗等康复形式相当,甚至可能获得更好的改善效果。
此外,部分研究还验证了机器人辅助训练对平衡能力的提升效果。Picelli等[90]通过随机单盲试验,证明了机器人步态训练对于轻度到中度的PD患者平衡能力的改善效果与传统平衡训练相当,但未达到显著优于传统平衡训练的改善效果。
一些团队还对机器人康复训练方法进行了新尝试。美国哥伦比亚大学Martelli等在自主研发的机器人A-TPAD[68]的基础上提出了一种平衡能力训练的方法[69]。机器人在训练中通过拉索对患者盆骨随机施加不同方向的牵拉干扰,旨在通过干扰对抗练习,加强患者对随机扰动的适应能力,从而提升患者在行走时的平衡能力。实验结果证明了患者在短期训练后,抵抗姿态不稳的能力得到了提升。
从整体来看,下肢康复机器人辅助帕金森病康复训练的效果是积极的。训练后患者的行走步态及平衡能力在部分指标上获得改善,且可以达到与传统康复训练相当、甚至更好的效果。然而,机器人辅助帕金森病康复仍处于初步尝试与探索阶段,亟需针对其神经机制、病症特点和康复原理,探索更有效的机器人控制方法、人机交互方式以及康复训练策略等帕金森病康复机器人技术,以充分发挥机器人辅助帕金森病康复的优势。
3.3 震颤抑制帕金森病患者肌肉会出现不自主的震颤现象,影响患者手部动作的准确性。生物力加载技术,可以广泛抑制常见震颤类型(如静息震颤、位姿震颤、运动震颤等),是对于药物不敏感或者脑深部电刺激术(deep brain stimulation,DBS)反应不佳的帕金森病患者抑制震颤症状的重要方法。其原理是通过外部系统对人体肌肉施加适当载荷干预,改变肌肉—骨骼系统生物力学特性,从而抑制震颤症状[91]。传统康复治疗时,康复医师仅凭自身经验向患者肢体施加机械负载,暂时缓解受累肢体的震颤症状,而无法精准持续地缓解患者震颤症状;而依靠震颤识别技术以及精确的生物力加载技术,机器人可以持续有效抑制肢体震颤症状,提升患者的运动能力。
震动抑制策略主要分2种:一种是主动震颤抑制策略,即实时评估患者非意向运动,并施加与非意向运动相反的作用力以抵消震颤力矩;另一种是被动震颤抑制策略,即改变系统阻抗、惯量等特性实现震颤抑制,诸如电机调节[92-95]、磁流体[96-97]、气动活塞[98-99]等多种干预手段被用于震颤抑制矫形器的设计。例如,英国雷丁大学(University of Reading)利用一种磁流体在层流剪切运动时产生黏弹性阻尼的原理,设计出一款震颤抑制的机器人(见图 2(a))。由于磁流体特殊的性质,可以通过控制磁场以调节执行器的阻尼系数,实现良好的震颤抑制效果。美国南卫理公会大学(SMU)采用气缸作为阻尼器研发了震颤抑制机器人(见图 2(b)),并基于正弦模型、自适应频率估计模型以及非线性控制等不同的基本思路,研发了3种不同的控制方法以确定震颤抑制的力矩大小。西班牙国家高级研究委员会(CSIC)[92]研发了可穿戴式手臂震颤抑制机器人WOTAS(见图 2(c))。WOTAS是一款具有3自由度的外骨骼机器人,采用电动机控制实现震颤抑制,兼具主动及被动2种震颤抑制模式。用户可以选择不同的模式实现震颤抑制。
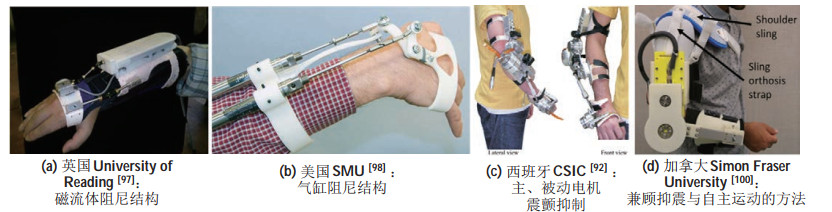
|
图 2 应用于震颤抑制的机器人系统 Fig.2 Robot systems for tremor suppression |
机器人采用传统主动震颤抑制策略时施加过大的震颤抑制力矩容易影响患者的自主运动,造成不良的使用体验。加拿大西蒙弗雷泽大学(Simon Fraser University)的Herrnstadt等[100]提出一种主动震颤抑制方法,并设计出一款对用户准透明的震颤抑制机器人样机(见图 2(d))。该机器人没有直接检测非意向运动,而是通过力反馈信号估计患者自主运动的意图,并拒绝自主运动外的震颤运动,从而实现震颤抑制。通过患者佩戴测试的结果,证明了机器人对患者自主运动仅产生很小的交互力矩影响,能在抑制患者震颤的同时使其仍保持良好的自主运动能力。
3.4 病情评估病情评估是康复治疗的关键环节,而且对帕金森病康复尤为重要。一方面,基于神经退行性疾病的特点,患者的运动能力逐步下降,出现日益加重的运动障碍,帕金森病康复过程中医师需要密切关注患者能力的退行情况,及早发现加重或者新出现的症状,并开展针对性治疗;另一方面,病情评估可以反映药物、功能神经调控(DBS手术等)、康复治疗等干预手段的效果,为医师调整治疗处方提供依据。帕金森病与脑卒中的病情评估方法有相同之处,也存在明显差异,比如:两者都关心运动的幅度与速度、力的幅度等;此外,脑卒中病情评估关注异常运动模式,如联合运动、运动分离、以及健/患侧对比等,而帕金森病病情评估则关注运动迟缓所导致的步行和对指等动作的变异性、冻结步态、震颤等[101-102]。目前临床上对帕金森病病情评估往往由多名评估人员根据量表对患者完成特定任务的表现进行打分。这种评估方法容易受到测评人员的主观影响,并且需要投入较大人力与时间。不少研究基于相机视频[103-105]或者可穿戴设备[106-108]对患者肢体运动能力进行客观、量化的分析与评价,为患者的早期诊断、家中康复评估带来便利。然而,上述技术的测评效果,与设备设置以及数据采集的品质密切相关,如:基于相机视频的评估技术对视频拍摄环境亮度、图像清晰度等有一定要求[105];可穿戴设备佩戴与使用设置不方便[108]。因此,还需要进一步地提升分析算法的鲁棒性与检测设备的易用性。
除了上述基于肢体运动表现的病情评估之外,诸如脑电图(electroencephalogram,EEG)、肌电图(electromyogram,EMG)等生理信号,在病情评估中也具有独特的优势。大脑与肌肉等组织的生理信号来源于病变脑区或者受到病变脑区的神经调控,对病情变化敏感,而且其响应早于肢体运动表现。因此,脑、肌生理信号与帕金森病病情发展[109-112]以及康复效果[113-116]的关系也受到研究人员的关注,以获得有效的生物标志物(biomarker)用于量化病情以及验证康复治疗的效果。
4 帕金森病康复需求与康复机器人技术展望(Rehabilitation demands of PD and the prospective of PD rehabilitation robots) 4.1 现有研究的讨论借助机器人辅助,帕金森病康复训练可以实现从人工辅助到机器自动辅助患者进行康复训练的转变。从效果来看,目前的帕金森病康复机器人辅助患者进行康复训练,可以取得与康复医师辅助的传统康复训练相近、甚至更优的康复效果。在康复机器人的辅助下,患者的一些运动症状,如冻结步态、震颤、姿态不稳等得到了一定程度的缓解。然而,机器人辅助帕金森病康复仍处于初步尝试与探索阶段,在技术上存在局限性。
康复机器人对帕金森病的针对性不足,可能是限制机器人辅助训练效果的重要原因。一方面,不同神经疾病的康复机理具有一定共性特点。比如,神经康复的重要医学理论基础在于神经可塑性,即通过合适的外界物理干预激活相关生理机制,促使神经网络的结构改变与功能提升,从而恢复或部分恢复相关的神经调节功能[117-118]。为形成充分的刺激干预,神经康复过程中往往都需要患者进行大量针对性的康复训练,并且患者主动调动神经和肌肉参与康复训练可获得更好的康复效果[118]。现有的康复机器人遵循神经康复基本原则,对包括帕金森病在内的多种神经疾病,均可产生一定的康复改善效果。然而另一方面,如本文第2节的介绍,帕金森病具有特殊的病理特点以及康复要求,仅基于神经损伤疾病康复基本原则开发出的康复机器人,缺乏对帕金森病这一神经退行性疾病的针对性。这很可能是现有康复机器人难以在帕金森病康复中取得显著提升效果的重要原因。因此,帕金森病康复机器人的研究需要针对帕金森病专病特点,研发专科型康复机器人,才能进一步提升康复效果。
另外,仅从肢体层面出发进行病情评估以及施加干预,可能是限制当前帕金森病康复机器人康复效果的另一个重要原因。帕金森病具有神经退行性特点,使得帕金森病康复干预与病情评估必须紧密联系。通过在康复过程中定期进行病情评价,及时调整康复方案。目前的帕金森病康复机器人在进行机体设计和性能评价时,都仅仅关注患者的肢体运动表现,如手指运动的轨迹、行走步态的参数、手部的震颤情况等。但是,帕金森病根源在于大脑功能病变,患者的肢体运动表现仅能在一定程度上反映其脑功能损伤状况,肢体症状上的改善并不能保证患者在脑神经功能上的改善。而且,采用基于肢体表现的量表来评估康复方法的有效性,存在一定的滞后性。由于患者的康复训练遵循着运动学习规律[118-119],患者通过训练获得肢体表现的改善往往需要长时间、大量的训练。但是,医学研究表明,帕金森病患者的奖励学习机制存在障碍,在进行运动学习时需要接受比正常人更大量的运动训练才能达到相近的能力水平[120]。患者肢体运动的改善效果往往需要几周甚至数月,才能形成显著、稳定的差异。反馈的严重滞后导致机器人无法及时根据患者病情调整康复训练方案,限制了康复效果提升。因此,准确性、实时性更好的脑—肢融合的康复效果评估方法,以及基于这些评估方法的康复处方调整策略,是目前帕金森病康复机器人所亟需的。
4.2 技术展望 4.2.1 机器人辅助运动康复技术目前帕金森病康复机器人的临床改善效果存在局限。要取得更显著的康复效果,应该充分结合帕金森病病理特点及康复理论,研究针对帕金森病的专科型康复机器人系统以及专病康复技术。
帕金森病康复训练的一大特点是鼓励患者进行大幅度的关节运动,以促进患者分泌更多的多巴胺[19, 43]。同时,通过引导与反馈,让患者注意到肢体动作速度、幅度与自身对动作的期望不匹配,并进行重新校正与适应[43-44]。为此,可以借鉴LSVT-BIG等帕金森病专病康复训练方法的核心思想,康复机器人系统应当充分发挥精准运动与人机交互方式的优势,通过设计特定的康复训练任务以及实时调整难度,让帕金森病患者在特定的情境下主动进行尽量大幅度的动作,并且引导患者重新校正在不同的动作中变异的动作速度、幅度的比例关系,以适应变异后的比例关系。
辅助提示也是帕金森病康复中重要的康复方法。通过在合适的时机为帕金森病患者提供感觉提示,可以帮助患者启动运动、调整运动节奏、提供运动参考等[40, 121-122]。经过训练适应后,帕金森病患者的动作有显著的改善。帕金森病康复机器人可以通过更灵活的提示交互方法帮助患者更高效地学习基于提示的动作补偿策略,同时还可以通过逐渐调整提示的时机与强度,最小化患者对提示的依赖,把基于外部提示的运动代偿策略转化成为一种基于自我提示的动作调整能力,从而提升患者的运动能力。
双任务康复训练方式是帕金森病康复训练中常见的评估及训练形式[40, 123]。在双任务下,由于大脑代偿机制无法完全代偿病情带来的能力损伤,帕金森病患者的症状变得更加显著[28, 124]。这更有利于对患者目前的病情状况进行准确的量化评估,更早发现运动障碍症状,及时进行康复干预。同时,通过创设双任务康复训练场景,让帕金森病患者的特定症状的表现被触发、或高概率被触发,使受疾病退行影响的神经控制能力及代偿能力被更频繁、更有针对性地调动使用,有利于提升身体抵御疾病退行的能力储备,促进神经康复。双任务训练的关键在于,难度设置需要适当。过难的任务,容易引发过分严重的症状,患者难以开展训练,甚至形成恐惧心理;而过于容易的任务,可能无法触发相应症状的呈现,无法实现针对性康复训练。与传统康复医师相比,机器人系统在对任务场景控制上具有独特优势。机器人创设的双任务场景可以在可控、安全范围内诱导患者症状呈现,并进行针对性的康复训练,促进患者能力的提升;同时,基于患者任务表现的量化评价,调整合适的任务难度,使患者可以逐步提升运动能力。
4.2.2 神经刺激和虚拟现实等多种康复技术近年来,以神经、肌肉等为刺激目标的康复干预技术越来越受到研究人员的关注。在神经康复方面,采用硬膜外电刺激(epidural electrical stimulation,EES)与物理治疗联合方法在脊髓损伤康复上取得了突破性的进展。瑞士洛桑联邦理工学院(EPFL)[125]以及美国梅奥诊所(Mayo Clinic)[126]的研究人员先后分别采用不同触发模式的硬膜外电刺激技术与运动康复训练相结合的方法,对因脊髓损伤而导致的下肢瘫痪患者进行康复治疗,帮助患者在运动过程中控制肌肉协调运动。在经过长期训练后,患者重新恢复了对先前瘫痪肌肉的自主控制。上述2项工作均反映出,基于特定触发模式的神经刺激技术与运动训练的联合康复方法,可以促进脑部与脊髓之间的神经连接,具有激活神经可塑性的效果。基于神经刺激与机器人的联合康复技术应用于帕金森病康复具有神经调控的潜力,有利于患者重新校正动作幅度与速度,提升运动训练的康复效果。而帕金森病治疗中植入的脑起搏器(deep brain stimulation,DBS)可以直接刺激大脑深部区域,也为相关研究提供了特殊的刺激介入途径。而且,基于闭环DBS技术的研究也取得了一定的进展[127-128],为下一步与机器人康复技术的结合提供了良好的基础。
此外,经颅磁刺激(transcranial magnetic stimulation,TMS)、经颅电刺激(transcranial electrical stimulation,TES)、功能电刺激(functional electrical stimulation,FES)等非侵入式电/磁刺激技术对帕金森病的康复效果也备受研究人员关注。这些技术无需手术植入设备,即可对特定脑区、神经或肌肉进行刺激[129-131],一方面,可以激活特定的神经或肌肉活动,提升患者神经兴奋度,加强神经康复训练效果[132-134];另一方面,还可以调节异常的神经或肌肉活动,缓解干扰运动的症状(如冻结步态[135-136]、肌肉震颤[137]等),提升运动能力,使患者以更好的状态参与康复训练;此外,还可以作为一种外部感觉提示,改善帕金森病患者的步态,减少冻结步态发生[138-139]。
神经刺激技术(侵入式/非侵入式、电刺激/磁刺激)与帕金森病康复机器人技术结合研究,可以借鉴其他神经疾病中的相关研究经验,充分发挥2项技术的优势。一方面,神经刺激技术可以通过神经调控作用,帮助提升机器人辅助运动康复的效果。在瘫痪病人康复上,脊髓电刺激(spinal cord electrical stimulation,SCES)可以激活运动神经,提升外骨骼机器人的康复效果[140];FES可以在算法调控下帮助患者抑制不当的肌肉动作,协调控制肢体动作,使手部准确跟随既定轨迹运动,并最大化自主参与程度[141],以提升康复效果。而针对帕金森病康复,患者大脑奖励机制存在障碍,需要较大的训练量与训练时长才能获得改善,因此需要更有效的康复技术。神经刺激对神经的调控功能,有利于激活相关神经网络,甚至改善患者大脑奖励机制[142],提升机器人辅助康复的效果。神经刺激技术还可以抑制不良的神经或肌肉活动,缓解患者肌肉震颤、冻结步态等症状,有利于让患者以更佳的状态参与康复训练。另一方面,借助对患者的实时量化评估技术,机器人可以帮助神经刺激调整合适的刺激触发时机、刺激模式与干预施加部位等,使干预施加更加精准、有效。在机械臂末端安装TMS刺激设备形成的TMS机器人,可以在患者进行训练时主动跟随头部靶点实施刺激,帮助患者调控任务状态下的脑部活动,提升康复效果[143]。在帕金森病康复过程中往往需要进行大幅度的运动训练,传统固定式的TMS系统难以在运动状态下进行刺激。而具备主动定位功能的TMS机器人可以在机器人辅助训练中有针对性地调控患者“任务态”下的神经活动,可以提升患者的任务表现。
虚拟现实技术(virtual reality,VR)同样可以辅助康复训练。灵活控制沉浸式的训练场景,是虚拟现实技术用于康复训练的一大优势。虚拟现实技术可以提供如临其境的视觉与听觉反馈,帮助患者排除外界干扰,集中注意力,同时创设灵活可控的虚拟场景,为康复训练提供条件[144]。帕金森病康复训练,往往需要先诱导出特定障碍症状,再进行针对性训练,VR技术可以创建特定训练场景,以配合康复训练。例如:在窄门与转弯处可以诱导帕金森病患者发生冻结步态,从而开展缓解冻结步态的运动策略训练,然而在真实窄门与转弯处往往难以进行安全保护[145],特别当患者使用外骨骼机器人等辅助设备时更容易发生碰撞意外。而VR技术可以在实际安全的环境内创建与日常生活场景紧密相关的交互场景(如带有虚拟窄门与转弯、甚至摆放杂物的家居环境,或者人员密集的动态环境等)诱导冻结步态的发生,从而配合机器人开展针对性的康复治疗。此外,VR技术可以灵活控制听觉、视觉等感官反馈,为患者提供适当的外部提示或者任务奖励等,既可以辅助帕金森病患者改善动作[146],也可以调动起患者参与训练的积极性。
此外,传统帕金森病康复中还有不少康复方式未被充分挖掘利用。临床康复中,采用水浴疗法可以降低患者肌张力,缓解患者疼痛感;同时利用水流的触觉刺激增强患者对肢体的感觉,并借助水的浮力帮助患者维持平衡,使患者可以在重量减轻后更容易地进行康复运动[147-148]。传统中医理论中的针灸治疗也被认为对帕金森病有康复效果[149]。这些技术仍未充分结合利用。机器人技术的引入将有利于发挥这些康复技术的优势。
上述介绍的多种康复技术,为帕金森病康复提供了多样的干预手段,可以针对大脑、肌肉等不同干预对象,开展康复治疗。这些方法与现有的康复机器人技术深度结合,可以发挥不同干预方式的优势,增强康复训练的效果。
4.2.3 “脑—肌—肢”协同康复训练技术在帕金森病康复机器人技术当中,应该将脑神经、肌肉和肢体等多个层面的技术融合,充分发挥机器人量化康复效果评估和干预的优势,如图 3所示。
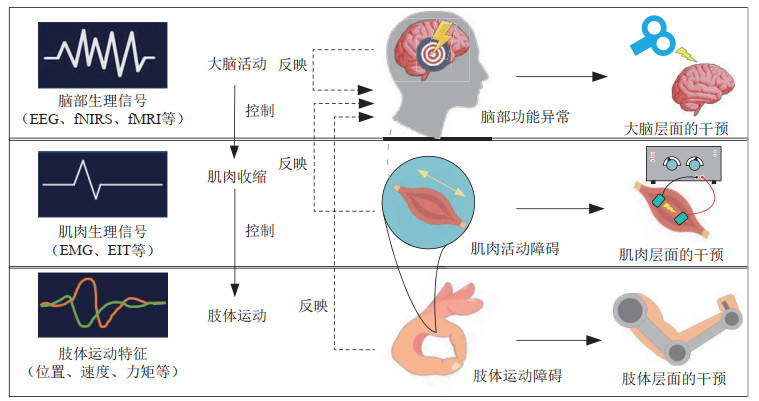
|
图 3 “脑—肌—肢”协同康复示意图。帕金森病源自脑神经退行性病变,症状涉及脑神经功能、肌肉控制以及肢体运动障碍。在帕金森病康复机器人研究中,采用从“脑—肌—肢”采集的患者数据进行在线量化评估,进而再从“脑—肌—肢”层面对患者进行协同干预,并基于评估结果实时调整干预方案,实现个性化的闭环康复治疗 Fig.3 Illustration of brain-muscle-limb fused rehabilitation. Parkinson's disease originates from neurodegeneration, and the symptoms involve cranial neural function, muscle control, and limb movement disorders. In PD rehabilitation robot research, data can be acquired from brain, muscle and limb, and be processed online for the quantitative assessment. Rehabilitation interventions are coordinated in the brain, muscle and limb levels, then conducted on patients; and also the intervention schemes can be adjusted online with respect to the assessment outputs. Thus, the loop is closed for individuated rehabilitation 注:EEG(脑电图);fNIRS(功能近红外成像);fMRI(功能核磁);EMG(肌电图);EIT(电阻抗成像) |
在病情评估方面,帕金森病根源在于大脑结构的病变,并沿着“脑—肌—肢”控制回路经过复杂的生理学、病理学作用,最终表现为患者肢体的运动异常。尽管基于肢体运动的评价对于康复医师而言更直观,但仅以肢体运动情况来评价病情或者康复效果是片面的,容易受到“脑—肌—肢”控制回路上各种因素的影响。大脑与肌肉位于控制回路的上位,其产生的生理信号与病变脑区有更紧密的联系,对病情变化更加敏感,对干预的响应早于肢体动作,为控制机器人干预肢体动作提供了时间窗口。因此,“脑—肌—肢”协同的康复效果评估可以实现优势互补,获得实时、鲁棒的康复效果评价。
另一方面,在干预手段方面,除了肢体运动训练的干预方式外,大脑与肌肉可以成为直接干预的对象。诸如经颅磁刺激、经颅电刺激、功能电刺激等针对大脑特定部位或者特定肌肉的康复干预方式近年来也备受关注。这些技术可以提高大脑皮层的兴奋性、抑制肌肉震颤,使患者以更良好的神经、肌肉状态参与肢体训练,从而提升康复训练效果。因此,“脑—肌—肢”层面上的联合干预,可以实现干预方法之间的相互加强,提高康复效果。
综合来说,在帕金森病康复机器人研究中,通过从“脑—肌—肢”等多个层面上采集患者数据进行分析,可以实现实时、量化的病情评估;基于定量评估结果,可以在“脑—肌—肢”多个层面上对患者进行联合干预,并根据量化康复效果实时调整个性化康复策略,最终获得更优的康复效果。帕金森病康复是通过运动训练纠正因疾病而改变的能力。“脑—肌—肢”协同的康复效果评估与干预策略调整需要形成控制闭环,帮助患者纠正异常动作,并逐渐减少患者对外部辅助的依赖。例如:在帕金森病训练中通过“脑—肌—肢”的信息对患者症状进行量化评估,并以此优化机器人控制参数,使其辅助患者进行有效的运动幅度校正训练。而诸如FES、TMS等可以作为机器人运动康复的加强手段,在训练过程中根据脑肌生理信号或者肢体运动表现触发刺激,以帮助激活患者特定神经的兴奋性,并调控患者大脑奖励机制,进一步提升运动康复训练的效果。在症状得到缓解的同时,机器人逐步减少辅助干预与外部提示的强度,使患者最终在无辅助或者最小辅助下重新适应病变后对肢体运动幅度的控制。
目前,研究人员对基于“脑—肌—肢”不同层面的量化评估与康复干预技术已经开展了一些探索,例如:在量化评价上,研究人员探索了脑肌信号与帕金森病症状/康复方式之间的关系[115, 150],为实时量化病情与疗效提供了参考;在干预方法上,基于脑部信号控制的康复干预技术也获得了一定的成果,例如,闭环DBS技术[127-128]、EEG/EMG触发的FES干预技术[151-152]以及基于EEG/EMG的康复机器人控制技术[153-154]等。然而,相关技术的深入以及面向帕金森病康复的系统集成与应用仍有待进一步的研究与探索。
5 结论(Conclusion)本文先通过帕金森病与脑卒中的对比,深入介绍了帕金森病的病理特点与康复机理,阐明帕金森病康复的特殊需求。然后,从上肢运动康复、下肢运动康复以及震颤抑制3个方面分别介绍了目前帕金森病康复机器人的研究现状。接着,讨论了现有帕金森病康复机器人工作的局限性,主要是对帕金森病的针对性不足,并局限于肢体运动层面,限制了相关技术的发展和临床效果。
进而,提出帕金森病康复机器人研究需要结合帕金森病病理特点与康复机理,研发专病康复机器人。再者,还应该进一步拓宽视野范围,考虑联合不同的干预方式。最后,从帕金森病是由神经退行性病变导致运动障碍这一本源出发,提出“脑—肌—肢”协同康复方案,融合不同层面信息进行病情量化评估和协同干预,实现对病、对症的闭环康复治疗。
| [1] |
Poewe W, Seppi K, Tanner C M, et al. Parkinson disease[J]. Nature Reviews Disease Primers, 2017, 3. DOI:10.1038/nrdp.2017.13 |
| [2] |
Dorsey E R, Constantinescu R, Thompson J P, et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030[J]. Neurology, 2007, 68(5). DOI:10.1212/01.wnl.0000247740.47667.03 |
| [3] |
中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 中华医学会《中华全科医师杂志》编辑委员会, 神经系统疾病基层诊疗指南编写专家组. 帕金森病基层诊疗指南(2019年)[J]. 中华全科医师杂志, 2020, 19(1): 5-17. Chinese Medical Association, Chinese Medical Journals Publishing House, Chinese Society of General Practice, Editorial Board of Chinese Journal of General Practitioners of Chinese Medical Association, Expert Group of Guidelines for Primary Care of Nervous System Disease. Guideline for primary care of Parkinson's disease (2019)[J]. Chinese Journal of General Practitioners, 2020, 19(1): 5-17. DOI:10.3760/cma.j.issn.1671-7368.2020.01.003 |
| [4] |
Kalia L V, Lang A E. Parkinson's disease[J]. The Lancet, 2015, 386(9996): 896-912. DOI:10.1016/S0140-6736(14)61393-3 |
| [5] |
Suttrup I, Warnecke T. Dysphagia in Parkinson's disease[J]. Dysphagia, 2016, 31: 24-32. DOI:10.1007/s00455-015-9671-9 |
| [6] |
Potulska A, Friedman A, Królicki L, et al. Swallowing disorders in Parkinson's disease[J]. Parkinsonism & Related Disorders, 2003, 9(6): 349-353. |
| [7] |
Inzelberg R, Peleg N, Nisipeanu P, et al. Inspiratory muscle training and the perception of dyspnea in Parkinson's disease[J]. Canadian Journal of Neurological Sciences, 2005, 32(2): 213-217. DOI:10.1017/S0317167100003991 |
| [8] |
Baille G, Chenivesse C, Perez T, et al. Dyspnea: An underestimated symptom in Parkinson's disease[J]. Parkinsonism & Related Disorders, 2019, 60: 162-166. |
| [9] |
Fall P A, Saleh A, Fredrickson M, et al. Survival time, mortality, and cause of death in elderly patients with Parkinson's disease. A 9-year follow-up[J]. Movement Disorders, 2003, 18(11): 1312-1316. DOI:10.1002/mds.10537 |
| [10] |
Jones A, Skinner M A. The current status of physical therapy in China[J]. Chinese Journal of Rehabilitation Medicine, 2013, 28(6): 493-501. |
| [11] |
Yu N B, Riener R. A robotic approach to investigate rehabilitation induced recovery of sensorimotor function[C]//32nd Chinese Control Conference. Piscataway, USA: IEEE, 2013: 6004-6009.
|
| [12] |
Liang X, Wang W Q, Hou Z G, et al. Interactive control methods for rehabilitation robot[J]. Scientia Sinica: Informationis, 2018, 48(1): 24-46. DOI:10.1360/N112017-00072 |
| [13] |
胡进, 侯增广, 陈翼雄, 等. 下肢康复机器人及其交互控制方法[J]. 自动化学报, 2014, 40(11): 2377-2390. Hu J, Hou Z G, Chen Y X, et al. Lower limb rehabilitation robots and interactive control methods[J]. Acta Automatica Sinica, 2014, 40(11): 2377-2390. |
| [14] |
郭晓辉, 王晶, 徐光华. 手部功能康复机器人研究最新进展[J]. 中国康复医学杂志, 2017, 32(2): 235-240. Guo X H, Wang J, Xu G H. Recent advances in functional hand rehabilitation robot research[J]. Chinese Journal of Rehabilitation Medicine, 2017, 32(2): 235-240. DOI:10.3969/j.issn.1001-1242.2017.02.025 |
| [15] |
Deng W H, Papavasileiou I, Qiao Z, et al. Advances in automation technologies for lower extremity neurorehabilitation: A review and future challenges[J]. IEEE Reviews in Biomedical Engineering, 2018, 11: 289-305. DOI:10.1109/RBME.2018.2830805 |
| [16] |
Demofonti A, Carpino G, Zollo L, et al. Affordable robotics for upper limb stroke rehabilitation in developing countries: A systematic review[J]. IEEE Transactions on Medical Robotics and Bionics, 2021, 3(1): 11-20. DOI:10.1109/TMRB.2021.3054462 |
| [17] |
Nelson A B, Kreitzer A C. Reassessing models of basal ganglia function and dysfunction[J]. Annual Review of Neuroscience, 2014, 37: 117-135. DOI:10.1146/annurev-neuro-071013-013916 |
| [18] |
Berardelli A, Rothwell J C, Thompson P D, et al. Pathophysiology of bradykinesia in Parkinson's disease[J]. Brain, 2001, 124(11): 2131-2146. DOI:10.1093/brain/124.11.2131 |
| [19] |
Bologna M, Paparella G, Fasano A, et al. Evolving concepts on bradykinesia[J]. Brain, 2020, 143(3): 727-750. DOI:10.1093/brain/awz344 |
| [20] |
Berardelli A, Dick J P, Rothwell J C, et al. Scaling of the size of the first agonist EMG burst during rapid wrist movements in patients with Parkinson's disease[J]. Journal of Neurology, Neurosurgery & Psychiatry, 1986, 49(11): 1273-1279. |
| [21] |
Magrinelli F, Picelli A, Tocco P, et al. Pathophysiology of motor dysfunction in Parkinson's disease as the rationale for drug treatment and rehabilitation[J]. Parkinson's Disease, 2016. DOI:10.1155/2016/9832839 |
| [22] |
Conte A, Khan N, Defazio G, et al. Pathophysiology of somatosensory abnormalities in Parkinson disease[J]. Nature Reviews Neurology, 2013, 9: 687-697. DOI:10.1038/nrneurol.2013.224 |
| [23] |
Konczak J, Corcos D M, Horak F, et al. Proprioception and motor control in Parkinson's disease[J]. Journal of Motor Behavior, 2009, 41(6): 543-552. DOI:10.3200/35-09-002 |
| [24] |
Tinaz S, Pillai A S, Hallett M. Sequence effect in Parkinson's disease is related to motor energetic cost[J]. Frontiers in Neurology, 2016, 7. DOI:10.3389/fneur.2016.00083 |
| [25] |
Wu T, Zhang J R, Hallett M, et al. Neural correlates underlying micrographia in Parkinson's disease[J]. Brain, 2016, 139(1): 144-160. DOI:10.1093/brain/awv319 |
| [26] |
Blin O, Ferrandez A M, Serratrice G. Quantitative analysis of gait in Parkinson patients: Increased variability of stride length[J]. Journal of the Neurological Sciences, 1990, 98(1): 91-97. DOI:10.1016/0022-510X(90)90184-O |
| [27] |
Delval A, Defebvre L, Tard C. Freezing during tapping tasks in patients with advanced Parkinson's disease and freezing of gait[J]. PLoS One, 2017, 12(9). DOI:10.1371/journal.pone.0181973 |
| [28] |
Spildooren J, Vercruysse S, Desloovere K, et al. Freezing of gait in Parkinson's disease: The impact of dual-tasking and turning[J]. Movement Disorders, 2010, 25(15): 2563-2570. DOI:10.1002/mds.23327 |
| [29] |
Postuma R B, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson's disease[J]. Movement Disorders, 2015, 30(12): 1591-1601. DOI:10.1002/mds.26424 |
| [30] |
郝蔓钊. 帕金森病静息震颤的脊髓神经机理及其外周电刺激抑制的研究[D]. 上海: 上海交通大学, 2018. Hao M Z. Spinal neural mechanism underlying Parkingsonian rest tremor and effectiveness of inhibition by transcutaneous electrical nerve stimulation[D]. Shanghai: Shanghai Jiao Tong University, 2018. |
| [31] |
Langhorne P, Bernhardt J, Kwakkel G. Stroke rehabilitation[J]. The Lancet, 2011, 377(9778): 1693-1702. DOI:10.1016/S0140-6736(11)60325-5 |
| [32] |
Donnan G A, Fisher M, Macleod M, et al. Stroke[J]. The Lancet, 2008, 371(9624): 1612-1623. DOI:10.1016/S0140-6736(08)60694-7 |
| [33] |
Yao J, Dewald J P A. The increase in overlap of cortical activity preceding static elbow/shoulder motor tasks is associated with limb synergies in severe stroke[J]. Neurorehabilitation and Neural Repair, 2018, 32(6-7): 624-634. DOI:10.1177/1545968318781028 |
| [34] |
O'Sullivan S B, Schmitz T J, Fulk G. Physical rehabilitation[M]. 7th ed. Philadelphia, USA: F.A. Davis, 2019.
|
| [35] |
Petzinger G M, Fisher B E, McEwen S, et al. Exerciseenhanced neuroplasticity targeting motor and cognitive circuitry in Parkinson's disease[J]. The Lancet Neurology, 2013, 12(7): 716-726. DOI:10.1016/S1474-4422(13)70123-6 |
| [36] |
Hirsch M A, Iyer S S, Sanjak M. Exercise-induced neuroplasticity in human Parkinson's disease: What is the evidence telling us?[J]. Parkinsonism & Related Disorders, 2016, 22(S1): S78-S81. |
| [37] |
Hou L J, Chen W, Liu X L, et al. Exercise-induced neuroprotection of the nigrostriatal dopamine system in Parkinson's disease[J]. Frontiers in Aging Neuroscience, 2017, 9. DOI:10.3389/fnagi.2017.00358 |
| [38] |
Ellis T, Rochester L. Mobilizing Parkinson's disease: The future of exercise[J]. Journal of Parkinson's Disease, 2018, 8(S1): S95-S100. DOI:10.3233/JPD-181489 |
| [39] |
Mak M K, Wong-Yu I S, Shen X, et al. Long-term effects of exercise and physical therapy in people with Parkinson disease[J]. Nature Reviews Neurology, 2017, 13: 689-703. DOI:10.1038/nrneurol.2017.128 |
| [40] |
Keus S, Munneke M, Graziano M, et al. European physiotherapy guideline for Parkinson's disease[R/OL]. (2019-03-11)[2020-05-25]. https://www.parkinsonnet.nl/app/uploads/sites/3/2019/11/eu_guideline_parkinson_guideline_for_pt_s1.pdf.
|
| [41] |
Keus S H J, Bloem B R, Hendriks E J M, et al. Evidence-based analysis of physical therapy in Parkinson's disease with recommendations for practice and research[J]. Movement Disorders, 2007, 22(4): 451-460. DOI:10.1002/mds.21244 |
| [42] |
Morris M E. Movement disorders in people with Parkinson disease: A model for physical therapy[J]. Physical Therapy, 2000, 80(6): 578-597. DOI:10.1093/ptj/80.6.578 |
| [43] |
Bloem B R, de Vries N M, Ebersbach G. Nonpharmacological treatments for patients with Parkinson's disease[J]. Movement Disorders, 2015, 30(11): 1504-1520. DOI:10.1002/mds.26363 |
| [44] |
Peterka M, Odorfer T, Schwab M, et al. LSVT-BIG therapy in Parkinson's disease: Physiological evidence for proprioceptive recalibration[J]. BMC Neurology, 2020, 20. DOI:10.1186/s12883-020-01858-2 |
| [45] |
Hu B. Sustained relief of multiple types of gait freezing in Parkinson's disease: A novel, music-based meta-conditioning treatment protocol (Ambulosono) (P4.328)[J]. Neurology, 2016, 86(15S). |
| [46] |
Chomiak T, Sidhu A S, Watts A, et al. Development and validation of Ambulosono: A wearable sensor for bio-feedback rehabilitation training[J]. Sensors, 2019, 19(3). DOI:10.3390/s19030686 |
| [47] |
邱纪方, 徐聪琴, 胡滨, 等. 步歌在帕金森病康复治疗中的应用[J]. 中国康复医学杂志, 2019, 34(3): 349-353. Qiu J F, Xu C Q, Hu B, et al. The application of Ambulosono in the rehabilitation of Parkinson's disease[J]. Chinese Journal of Rehabilitation Medicine, 2019, 34(3): 349-353. |
| [48] |
Barthel C, Nonnekes J, van Helvert M, et al. The laser shoes: A new ambulatory device to alleviate freezing of gait in Parkinson disease[J]. Neurology, 2018, 90(2). DOI:10.1212/WNL.0000000000004795 |
| [49] |
Ferraye M U, Fraix V, Pollak P, et al. The laser-shoe: A new form of continuous ambulatory cueing for patients with Parkinson's disease[J]. Parkinsonism & Related Disorders, 2016, 29: 127-128. |
| [50] |
Graham J V, Eustace C, Brock K, et al. The Bobath concept in contemporary clinical practice[J]. Topics in Stroke Rehabilitation, 2009, 16(1): 57-68. DOI:10.1310/tsr1601-57 |
| [51] |
Adler S S, Beckers D, Buck M. PNF in practice: An illustrated guide[M]. Berlin, Germany: Springer, 2008.
|
| [52] |
Hesse S, Werner C, Schonhardt E M, et al. Combined transcranial direct current stimulation and robot-assisted arm training in subacute stroke patients: A pilot study[J]. Restorative Neurology and Neuroscience, 2007, 25(1): 9-15. |
| [53] |
Hesse S, Tomelleri C, Bardeleben A, et al. Robot-assisted practice of gait and stair climbing in nonambulatory stroke patients[J]. Journal of Rehabilitation Research & Development, 2012, 49(4): 613-622. |
| [54] |
Krebs H I, Hogan N, Volpe B T, et al. Overview of clinical trials with MIT-MANUS: A robot-aided neuro-rehabilitation facility[J]. Technology and Health Care, 1999, 7(6): 419-423. DOI:10.3233/THC-1999-7606 |
| [55] |
Zariffa J, Kapadia N, Kramer J L K, et al. Relationship between clinical assessments of function and measurements from an upper-limb robotic rehabilitation device in cervical spinal cord injury[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2012, 20(3): 341-350. DOI:10.1109/TNSRE.2011.2181537 |
| [56] |
Varoqui D, Niu X, Mirbagheri M M. Ankle voluntary movement enhancement following robotic-assisted locomotor training in spinal cord injury[J]. Journal of NeuroEngineering and Rehabilitation, 2014, 11. DOI:10.1186/1743-0003-11-46 |
| [57] |
Nam K Y, Kim H J, Kwon B S, et al. Robot-assisted gait training (Lokomat) improves walking function and activity in people with spinal cord injury: A systematic review[J]. Journal of NeuroEngineering and Rehabilitation, 2017, 14. DOI:10.1186/s12984-017-0232-3 |
| [58] |
Gilliaux M, Renders A, Dispa D, et al. Upper limb robotassisted therapy in cerebral palsy: A single-blind randomized controlled trial[J]. Neurorehabilitation and Neural Repair, 2015, 29(2): 183-192. DOI:10.1177/1545968314541172 |
| [59] |
Cherni Y, Girardin-Vignola G, Ballaz L, et al. Reliability of maximum isometric hip and knee torque measurements in children with cerebral palsy using a paediatric exoskeletonLokomat[J]. Neurophysiologie Clinique, 2019, 49(4): 335-342. DOI:10.1016/j.neucli.2018.12.001 |
| [60] |
van Kammen K, Reinders-Messelink H A, Elsinghorst A L, et al. Amplitude and stride-to-stride variability of muscle activity during Lokomat guided walking and treadmill walking in children with cerebral palsy[J]. European Journal of Paediatric Neurology, 2020, 29: 108-117. DOI:10.1016/j.ejpn.2020.08.003 |
| [61] |
Hesse S, Schulte-Tigges G, Konrad M, et al. Robot-assisted arm trainer for the passive and active practice of bilateral forearm and wrist movements in hemiparetic subjects[J]. Archives of Physical Medicine and Rehabilitation, 2003, 84(6): 915-920. DOI:10.1016/S0003-9993(02)04954-7 |
| [62] |
Hesse S, Waldner A, Tomelleri C. Innovative gait robot for the repetitive practice of floor walking and stair climbing up and down in stroke patients[J]. Journal of NeuroEngineering and Rehabilitation, 2010, 7. DOI:10.1186/1743-0003-7-30 |
| [63] |
Hesse S, Uhlenbrock D. A mechanized gait trainer for restoration of gait[J]. Journal of Rehabilitation Research and Development, 2000, 37(6): 701-708. |
| [64] |
Hogan N, Krebs H I, Sharon A, et al. Interactive robotic therapist: US5466213[P]. 1995-11-14.
|
| [65] |
Hogan N, Krebs H I, Charnnarong J, et al. MIT-MANUS: A workstation for manual therapy and training. I[C]//IEEE International Workshop on Robot and Human Communication. Piscataway, USA: IEEE, 1992: 161-165.
|
| [66] |
Cappello L, Elangovan N, Contu S, et al. Robot-aided assessment of wrist proprioception[J]. Frontiers in Human Neuroscience, 2015, 9. DOI:10.3389/fnhum.2015.00198 |
| [67] |
Lukos J R, Snider J, Hernandez M E, et al. Parkinson's disease patients show impaired corrective grasp control and eye-hand coupling when reaching to grasp virtual objects[J]. Neuroscience, 2013, 254: 205-221. DOI:10.1016/j.neuroscience.2013.09.026 |
| [68] |
Martelli D, Vashista V, Micera S, et al. Direction-dependent adaptation of dynamic gait stability following waist-pull perturbations[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2016, 24(12): 1304-1313. DOI:10.1109/TNSRE.2015.2500100 |
| [69] |
Martelli D, Luo L, Kang J, et al. Adaptation of stability during perturbed walking in Parkinson's disease[J]. Scientific Reports, 2017, 7. DOI:10.1038/s41598-017-18075-6 |
| [70] |
Jezernik S, Colombo G, Keller T, et al. Robotic orthosis Lokomat: A rehabilitation and research tool[J]. Neuromodulation: Technology at the Neural Interface, 2003, 6(2): 108-115. DOI:10.1046/j.1525-1403.2003.03017.x |
| [71] |
Lünenburger L, Colombo G, Riener R. Biofeedback for robotic gait rehabilitation[J]. Journal of NeuroEngineering and Rehabilitation, 2007, 4. DOI:10.1186/1743-0003-4-1 |
| [72] |
Hidler J, Nichols D, Pelliccio M, et al. Advances in the understanding and treatment of stroke impairment using robotic devices[J]. Topics in Stroke Rehabilitation, 2005, 12(2): 22-35. DOI:10.1310/RYT5-62N4-CTVX-8JTE |
| [73] |
Elangovan N, Tuite P J, Konczak J. Somatosensory training improves proprioception and untrained motor function in Parkinson's disease[J]. Frontiers in Neurology, 2018, 9. DOI:10.3389/fneur.2018.01053 |
| [74] |
Wu C Y, Yang C L, Chen M D, et al. Unilateral versus bilateral robot-assisted rehabilitation on arm-trunk control and functions post stroke: A randomized controlled trial[J]. Journal of NeuroEngineering and Rehabilitation, 2013, 10. DOI:10.1186/1743-0003-10-35 |
| [75] |
Hesse S, Uhlenbrock D, Werner C, et al. A mechanized gait trainer for restoring gait in nonambulatory subjects[J]. Archives of Physical Medicine and Rehabilitation, 2000, 81(9): 1158-1161. DOI:10.1053/apmr.2000.6280 |
| [76] |
Reha Technology. Reha Technology: Products[EB/OL]. [2021-06-20]. https://www.rehatechnology.com/en/.
|
| [77] |
Díaz I, Gil J J, Sánchez E. Lower-limb robotic rehabilitation: Literature review and challenges[J]. Journal of Robotics, 2011. DOI:10.1155/2011/759764 |
| [78] |
Krebs H, Hogan N, Hening W, et al. Procedural motor learning in Parkinson's disease[J]. Experimental Brain Research, 2001, 141: 425-437. DOI:10.1007/s002210100871 |
| [79] |
Masia L, Casadio M, Sandini G, et al. Eye-hand coordination during dynamic visuomotor rotations[J]. PLoS One, 2009, 4(9). DOI:10.1371/journal.pone.0007004 |
| [80] |
Picelli A, Tamburin S, Passuello M, et al. Robot-assisted arm training in patients with Parkinson's disease: A pilot study[J]. Journal of NeuroEngineering and Rehabilitation, 2014, 11. DOI:10.1186/1743-0003-11-28 |
| [81] |
Mathiowetz V, Weber K, Kashman N, et al. Adult norms for the nine hole peg test of finger dexterity[J]. The Occupational Therapy Journal of Research, 1985, 5(1): 24-38. DOI:10.1177/153944928500500102 |
| [82] |
Fugl-Meyer A R, Jääskö L, Leyman I, et al. The post-stroke hemiplegic patient. 1. A method for evaluation of physical performance[J]. Scandinavian Journal of Rehabilitation Medicine, 1975, 7(1): 13-31. |
| [83] |
Lo A C, Chang V C, Gianfrancesco M A, et al. Reduction of freezing of gait in Parkinson's disease by repetitive robotassisted treadmill training: A pilot study[J]. Journal of NeuroEngineering and Rehabilitation, 2010, 7. DOI:10.1186/1743-0003-7-51 |
| [84] |
Jenkinson C, Fitzpatrick R, Peto V, et al. The Parkinson's disease questionnaire (PDQ-39): Development and validation of a Parkinson's disease summary index score[J]. Age and Ageing, 1997, 26(5): 353-357. DOI:10.1093/ageing/26.5.353 |
| [85] |
Nardo A, Anasetti F, Servello D, et al. Quantitative gait analysis in patients with Parkinson treated with deep brain stimulation: The effects of a robotic gait training[J]. NeuroRehabilitation, 2014, 35(4): 779-788. DOI:10.3233/NRE-141173 |
| [86] |
Barbe M T, Cepuran F, Amarell M, et al. Long-term effect of robot-assisted treadmill walking reduces freezing of gait in Parkinson's disease patients: A pilot study[J]. Journal of Neurology, 2013, 260: 296-298. DOI:10.1007/s00415-012-6703-3 |
| [87] |
Picelli A, Melotti C, Origano F, et al. Robot-assisted gait training versus equal intensity treadmill training in patients with mild to moderate Parkinson's disease: A randomized controlled trial[J]. Parkinsonism & Related Disorders, 2013, 19(6): 605-610. |
| [88] |
Capecci M, Pournajaf S, Galafate D, et al. Clinical effects of robot-assisted gait training and treadmill training for Parkinson's disease. A randomized controlled trial[J]. Annals of Physical and Rehabilitation Medicine, 2019, 62(5): 303-312. DOI:10.1016/j.rehab.2019.06.016 |
| [89] |
Sale P, de Pandis M F, le Pera D, et al. Robot-assisted walking training for individuals with Parkinson's disease: A pilot randomized controlled trial[J]. BMC Neurology, 2013, 13. DOI:10.1186/1471-2377-13-50 |
| [90] |
Picelli A, Melotti C, Origano F, et al. Robot-assisted gait training is not superior to balance training for improving postural instability in patients with mild to moderate Parkinson's disease: A single-blind randomized controlled trial[J]. Clinical Rehabilitation, 2015, 29(4): 339-347. DOI:10.1177/0269215514544041 |
| [91] |
孙建, 向馗, 高理富, 等. 基于外骨骼机器人技术的人体手臂震颤抑制的理论和方法[J]. 智能系统学报, 2012, 7(4): 283-293. Sun J, Xiang K, Gao L F, et al. A comprehensive review of fundamental theory and methodology for tremor suppression of human arm based on robotic exoskeleton technology[J]. CAAI Transactions on Intelligent Systems, 2012, 7(4): 283-293. DOI:10.3969/j.issn.1673-4785.201112006 |
| [92] |
Rocon E, Belda-Lois J M, Ruiz A F, et al. Design and validation of a rehabilitation robotic exoskeleton for tremor assessment and suppression[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2007, 15(3): 367-378. DOI:10.1109/TNSRE.2007.903917 |
| [93] |
孙建. 基于外骨骼机器人技术的人体手臂震颤抑制关键技术研究[D]. 合肥: 中国科学技术大学, 2010. Sun J. The study of key techniques for hand tremor suppression based on the wearable exoskeleton robot techniques[D]. Hefei: University of Science and Technology of China, 2010. |
| [94] |
Kiguchi K, Hayashi Y, Asami T. An upper-limb power-assist robot with tremor suppression control[C]//IEEE International Conference on Rehabilitation Robotics. Piscataway, USA: IEEE, 2011. DOI: 10.1109/ICORR.2011.5975390.
|
| [95] |
李军强. 面向病理性震颤的抑震机器人及其关键技术研究[D]. 哈尔滨: 哈尔滨工业大学, 2010. Li J Q. Research on tremor suppression robot and key techniques for pathological tremor[D]. Harbin: Harbin Institute of Technology, 2010. |
| [96] |
Manto M, Topping M, Soede M, et al. Dynamically responsive intervention for tremor suppression[J]. IEEE Engineering in Medicine Biology Magazine, 2003, 22(3): 120-132. DOI:10.1109/MEMB.2003.1213635 |
| [97] |
Loureiro R C V, Belda-Lois J M, Lima E R, et al. Upper limb tremor suppression in ADL via an orthosis incorporating a controllable double viscous beam actuator[C]//9th International Conference on Rehabilitation Robotics. Piscataway, USA: IEEE, 2005: 119-122.
|
| [98] |
Taheri B. Real-time pathological tremor identification and suppression in human arm via active orthotic devices[D]. Dallas, USA: Southern Methodist University, 2013.
|
| [99] |
Taheri B, Case D, Richer E. Adaptive suppression of severe pathological tremor by torque estimation method[J]. IEEE/ASME Transactions on Mechatronics, 2015, 20(2): 717-727. DOI:10.1109/TMECH.2014.2317948 |
| [100] |
Herrnstadt G, McKeown M J, Menon C. Controlling a motorized orthosis to follow elbow volitional movement: Tests with individuals with pathological tremor[J]. Journal of NeuroEngineering and Rehabilitation, 2019, 16. DOI:10.1186/s12984-019-0484-1 |
| [101] |
Goetz C G, Tilley B C, Shaftman S R, et al. Movement disorder society-sponsored revision of the unified Parkinson's disease rating scale (MDS-UPDRS): Scale presentation and clinimetric testing results[J]. Movement Disorders, 2008, 23(15): 2129-2170. DOI:10.1002/mds.22340 |
| [102] |
Gladstone D J, Danells C J, Black S E. The Fugl-Meyer assessment of motor recovery after stroke: A critical review of its measurement properties[J]. Neurorehabilitation and Neural Repair, 2002, 16(3): 232-240. DOI:10.1177/154596802401105171 |
| [103] |
Ospina B M, Chaparro J A V, Paredes J D A, et al. Objective arm swing analysis in early-stage Parkinson's disease using an RGB-D camera (Kinect)[J]. Journal of Parkinson's Disease, 2018, 8(4): 563-570. DOI:10.3233/JPD-181401 |
| [104] |
Liu Y, Chen J S, Hu C H, et al. Vision-based method for automatic quantification of Parkinsonian bradykinesia[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2019, 27(10): 1952-1961. DOI:10.1109/TNSRE.2019.2939596 |
| [105] |
Sibley K G, Girges C, Hoque E, et al. Video-based analyses of Parkinson's disease severity: A brief review[J]. Journal of Parkinson's Disease, 2021, 11(S1): S83-S93. DOI:10.3233/JPD-202402 |
| [106] |
Aghanavesi S, Bergquist F, Nyholm D, et al. Motion sensorbased assessment of Parkinson's disease motor symptoms during leg agility tests: Results from levodopa challenge[J]. IEEE Journal of Biomedical and Health Informatics, 2020, 24(1): 111-119. DOI:10.1109/JBHI.2019.2898332 |
| [107] |
Godinho C, Domingos J, Cunha G, et al. A systematic review of the characteristics and validity of monitoring technologies to assess Parkinson's disease[J]. Journal of NeuroEngineering and Rehabilitation, 2016, 13. DOI:10.1186/s12984-016-0136-7 |
| [108] |
Ancona S, Faraci F D, Khatab E, et al. Wearables in the homebased assessment of abnormal movements in Parkinson's disease: A systematic review of the literature[J]. Journal of Neurology, 2021. DOI:10.1007/s00415-020-10350-3 |
| [109] |
Geraedts V J, Boon L I, Marinus J, et al. Clinical correlates of quantitative EEG in Parkinson disease: A systematic review[J]. Neurology, 2018, 91(19). DOI:10.1212/WNL.0000000000006473 |
| [110] |
Chaturvedi M, Bogaarts J G, Kozak V V, et al. Phase lag index and spectral power as QEEG features for identification of patients with mild cognitive impairment in Parkinson's disease[J]. Clinical Neurophysiology, 2019, 130(10): 1937-1944. DOI:10.1016/j.clinph.2019.07.017 |
| [111] |
Abtahi M, Borgheai S B, Jafari R, et al. Merging fNIRSEEG brain monitoring and body motion capture to distinguish Parkinsons disease[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2020, 28(6): 1246-1253. |
| [112] |
Wang K L, Burns M, Xu D, et al. Electromyography biomarkers for quantifying the intraoperative efficacy of deep brain stimulation in Parkinson's patients with resting tremor[J]. Frontiers in Neurology, 2020, 11. DOI:10.3389/fneur.2020.00142 |
| [113] |
Ruonala V, Pekkonen E, Airaksinen O, et al. Levodopainduced changes in electromyographic patterns in patients with advanced Parkinson's disease[J]. Frontiers in Neurology, 2018, 9. DOI:10.3389/fneur.2018.00035 |
| [114] |
Miller A M, Miocinovic S, Swann N C, et al. Effect of levodopa on electroencephalographic biomarkers of the Parkinsonian state[J]. Journal of Neurophysiology, 2019, 122(1): 290-299. DOI:10.1152/jn.00141.2019 |
| [115] |
Islam A, Alcock L, Nazarpour K, et al. Effect of Parkinson's disease and two therapeutic interventions on muscle activity during walking: A systematic review[J]. npj Parkinson's Disease, 2020, 6. DOI:10.1038/s41531-020-00119-w |
| [116] |
Maggioni E, Arienti F, Minella S, et al. Effective connectivity during rest and music listening: An EEG study on Parkinson's disease[J]. Frontiers in Aging Neuroscience, 2021, 13. DOI:10.3389/fnagi.2021.657221 |
| [117] |
Masiero S, Carraro U. Rehabilitation medicine for elderly patients[M]//Practical Issues in Geriatrics. Berlin, Germany: Springer, 2018.
|
| [118] |
Reinkensmeyer D J, Dietz V. Neurorehabilitation technology[M]. Berlin, Germany: Springer, 2016.
|
| [119] |
Krakauer J W, Hadjiosif A M, Xu J, et al. Motor learning[J]. Comprehensive Physiology, 2019, 9(2): 613-663. |
| [120] |
Olson M, Lockhart T E, Lieberman A. Motor learning deficits in Parkinson's disease (PD) and their effect on training response in gait and balance: A narrative review[J]. Frontiers in Neurology, 2019, 10. DOI:10.3389/fneur.2019.00062 |
| [121] |
Sweeney D, Quinlan L R, Browne P, et al. A technological review of wearable cueing devices addressing freezing of gait in Parkinson's disease[J]. Sensors, 2019, 19(6). DOI:10.3390/s19061277 |
| [122] |
Nieuwboer A. Cueing for freezing of gait in patients with Parkinson's disease: A rehabilitation perspective[J]. Movement Disorders, 2008, 23(S2): S475-S481. |
| [123] |
Canning C G. The effect of directing attention during walking under dual-task conditions in Parkinson's disease[J]. Parkinsonism & Related Disorders, 2005, 11(2): 95-99. |
| [124] |
Raffegeau T E, Krehbiel L M, Kang N, et al. A meta-analysis: Parkinson's disease and dual-task walking[J]. Parkinsonism & Related Disorders, 2019, 62: 28-35. |
| [125] |
Wagner F B, Mignardot J B, le Goff-Mignardot C G, et al. Targeted neurotechnology restores walking in humans with spinal cord injury[J]. Nature, 2018, 563: 65-71. |
| [126] |
Gill M L, Grahn P J, Calvert J S, et al. Neuromodulation of lumbosacral spinal networks enables independent stepping after complete paraplegia[J]. Nature Medicine, 2018, 24: 1677-1682. |
| [127] |
Bouthour W, Mégevand P, Donoghue J, et al. Biomarkers for closed-loop deep brain stimulation in Parkinson disease and beyond[J]. Nature Reviews Neurology, 2019, 15: 343-352. |
| [128] |
Parastarfeizabadi M, Kouzani A Z. Advances in closed-loop deep brain stimulation devices[J]. Journal of NeuroEngineering and Rehabilitation, 2017, 14. DOI:10.1186/s12984-017-0295-1 |
| [129] |
Boddington L J, Reynolds J N J. Targeting interhemispheric inhibition with neuromodulation to enhance stroke rehabilitation[J]. Brain Stimulation, 2017, 10(2): 214-222. |
| [130] |
Lefaucheur J P, Andre-Obadia N, Antal A, et al. Evidencebased guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS)[J]. Clinical Neurophysiology, 2014, 125(11): 2150-2206. |
| [131] |
Lefaucheur J P, Aleman A, Baeken C, et al. Evidencebased guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014-2018)[J]. Clinical Neurophysiology, 2020, 131(2): 474-528. |
| [132] |
Yang Y R, Tseng C Y, Chiou S Y, et al. Combination of rTMS and treadmill training modulates corticomotor inhibition and improves walking in Parkinson disease: A randomized trial[J]. Neurorehabilitation and Neural Repair, 2013, 27(1): 79-86. |
| [133] |
Nardone R, Versace V, Brigo F, et al. Transcranial magnetic stimulation and gait disturbances in Parkinson's disease: A systematic review[J]. Neurophysiologie Clinique, 2020, 50(3): 213-225. |
| [134] |
Chung C L H, Mak M K Y, Hallett M. Transcranial magnetic stimulation promotes gait training in Parkinson disease[J]. Annals of Neurology, 2020, 88(5): 933-945. |
| [135] |
Valentino F, Cosentino G, Brighina F, et al. Transcranial direct current stimulation for treatment of freezing of gait: A crossover study[J]. Movement Disorders, 2014, 29(8): 1064-1069. |
| [136] |
Dagan M, Herman T, Harrison R, et al. Multitarget transcranial direct current stimulation for freezing of gait in Parkinson's disease[J]. Movement Disorders, 2018, 33(4): 642-646. |
| [137] |
Copur E H, Freeman C, Chu B, et al. FES based tremor suppression using repetitive control[C]//54th IEEE Conference on Decision and Control. Piscataway, USA: IEEE, 2015: 6023-6028.
|
| [138] |
Djurić-JovičićM, Radovanović S, Petrović I, et al. The impact of functional electrical stimulation (FES) on freezing of gait (FOG) in patients with Parkinson's disease[J]. Clinical Neurophysiology, 2013, 124(7). DOI:10.1016/j.clinph.2012.12.019 |
| [139] |
Sijobert B, Azevedo C, Andreu D, et al. Effects of sensitive electrical stimulation-based somatosensory cueing in Parkinson's disease gait and freezing of gait assessment[J]. Artificial Organs, 2017, 41(11): E222-E232. |
| [140] |
Shapkova E Y, Pismennaya E V, Emelyannikov D V, et al. Exoskeleton walk training in paralyzed individuals benefits from transcutaneous lumbar cord tonic electrical stimulation[J]. Frontiers in Neuroscience, 2020, 14. DOI:10.3389/fnins.2020.00416 |
| [141] |
Sampson P, Freeman C, Coote S, et al. Using functional electrical stimulation mediated by iterative learning control and robotics to improve arm movement for people with multiple sclerosis[J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2016, 24(2): 235-248. |
| [142] |
Biernacki K, Lin M H, Baker T E. Recovery of reward function in problematic substance users using a combination of robotics, electrophysiology, and TMS[J]. International Journal of Psychophysiology, 2020, 158: 288-298. |
| [143] |
Noccaro A, Mioli A, D'Alonzo M, et al. Development and validation of a novel calibration methodology and control approach for robot-aided transcranial magnetic stimulation (TMS)[J]. IEEE Transactions on Biomedical Engineering, 2021, 68(5): 1589-1600. |
| [144] |
Perez-Marcos D. Virtual reality experiences, embodiment, videogames and their dimensions in neurorehabilitation[J]. Journal of NeuroEngineering and Rehabilitation, 2018, 15. DOI:10.1186/s12984-018-0461-0 |
| [145] |
Georgiades M J, Gilat M, Martens K A E, et al. Investigating motor initiation and inhibition deficits in patients with Parkinson's disease and freezing of gait using a virtual reality paradigm[J]. Neuroscience, 2016, 337: 153-162. |
| [146] |
Canning C G, Allen N E, Nackaerts E, et al. Virtual reality in research and rehabilitation of gait and balance in Parkinson disease[J]. Nature Reviews Neurology, 2020, 16: 409-425. |
| [147] |
Carroll L M, Morris M E, O'Connor W T, et al. Is aquatic therapy optimally prescribed for Parkinson's disease? A systematic review and meta-analysis[J]. Journal of Parkinson's Disease, 2020, 10(1): 59-76. |
| [148] |
Volpe D, Giantin M G, Maestri R, et al. Comparing the effects of hydrotherapy and land-based therapy on balance in patients with Parkinson's disease: A randomized controlled pilot study[J]. Clinical Rehabilitation, 2014, 28(12): 1210-1217. |
| [149] |
陈鹏, 刘慧林, 王少松, 等. 火针颅底穴配合体针治疗原发性帕金森病27例[J]. 中国针灸, 2021, 41(1): 71-72. Chen P, Liu H L, Wang S S, et al. Fire needling and body acupuncture for 27 cases of primary Parkinson's disease[J]. Chinese Acupuncture & Moxibustion, 2021, 41(1): 71-72. |
| [150] |
Wang Q, Meng L, Pang J, et al. Characterization of EEG data revealing relationships with cognitive and motor symptoms in Parkinson's disease: A systematic review[J]. Frontiers in Aging Neuroscience, 2020, 12. DOI:10.3389/fnagi.2020.587396 |
| [151] |
Biasiucci A, Leeb R, Iturrate I, et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke[J]. Nature Communications, 2018, 9. DOI:10.1038/s41467-018-04673-z |
| [152] |
Ambrosini E, Gasperini G, Zajc J, et al. A robotic system with EMG-triggered functional eletrical stimulation for restoring arm functions in stroke survivors[J]. Neurorehabilitation and Neural Repair, 2021, 35(4): 334-345. |
| [153] |
Berger A, Horst F, Müller S, et al. Current state and future prospects of EEG and fNIRS in robot-assisted gait rehabilitation: A brief review[J]. Frontiers in Human Neuroscience, 2019, 13. DOI:10.3389/fnhum.2019.00172 |
| [154] |
Tariq M, Trivailo P M, Simic M. EEG-based BCI control schemes for lower-limb assistive-robots[J]. Frontiers in Human Neuroscience, 2018, 12. DOI:10.3389/fnhum.2018.00312 |
 2022, Vol. 44
2022, Vol. 44


