随着全球变暖问题的加剧,减少温室气体排放成为当今世界面临的重要任务。CO2是占比最大的温室气体,其主要来自于人类利用化石燃料过程中的碳排放。提升零碳或低碳能源在世界能源消费结构中的占比,有助于减少温室气体排放,推动实现全球碳循环体系的“碳中和”[1]。在船舶航运领域,氨作为一种零碳燃料引起广泛关注。氨为富氢载体,完全燃烧产物为N2和H2O;工业应用成熟,成本较低;常压沸点为–33.3℃,易于存储和运输;体积能量密度高于氢气,与汽油柴油相当;辛烷值较高,抗爆性能好。以上特性使得氨成为碳中和背景下最具优势的燃料之一。国际能源署发布的《能源技术展望2021》预测,到2050年氢基能源(氨、甲醇等)在船舶燃料应用中占比约为45%[2]。
氨燃烧存在燃烧速度慢、火焰温度低、可燃范围窄和点火能量高等问题,在燃烧中掺混助燃剂是改善其燃烧性能的有效措施,常用助燃剂有柴油、汽油、氢等[3]。在理想条件下,氨完全燃烧的产物仅有氮气和水,但在实际燃烧过程中会产生相当数量的污染物,包括NOx、N2O和部分未燃烧的NH3。其中,NOx是有毒气体,是形成酸雨和光化学烟雾的主要物质;N2O是主要温室气体之一,其在大气中长期留存会加剧全球变暖并造成臭氧层破坏,而NH3作为有毒气体也被严格限制排放。以上因素阻碍了氨作为船用燃料的发展,通过尾气处理技术将尾气中污染物消除后排放是有效的解决方案。本文介绍氨燃烧反应原理,总结当前氨燃烧尾气排放特性的研究现状,对不同污染物的处理方法进行探讨,最后介绍船用氨燃料燃烧尾气处理的整体解决思路,为氨燃烧尾气处理技术的开发提供参考。
1 氨燃烧反应原理NH3燃烧产生氮氧化物的反应动力学机理非常复杂,涉及几十种组分和几百个基元反应。其中,几个重要的化学反应如下[4]:
| $ {\text{2N}}{{\text{H}}_{\text{3}}}{\text{ + 2}}{{\text{O}}_{\text{2}}}{\text{ }} \rightleftharpoons}{{\text{N}}_{\text{2}}}{\text{O}} + 3{{\text{H}}_{\text{2}}}{\text{O}} $ |
| $ {\text{4N}}{{\text{H}}_{\text{3}}}{\text{ + 3}}{{\text{O}}_{\text{2}}}{\text{ }} \rightleftharpoons}_{\text{2}}} + 6{{\text{H}}_{\text{2}}}{\text{O}} $ |
| $ {\text{4N}}{{\text{H}}_{\text{3}}}{\text{ + 5}}{{\text{O}}_{\text{2}}}{\text{ }} \rightleftharpoons} $ |
| $ {\text{4N}}{{\text{H}}_{\text{3}}}{\text{ + 7}}{{\text{O}}_{\text{2}}}{\text{ }} \rightleftharpoons}_{\text{2}}} + 6{{\text{H}}_{\text{2}}}{\text{O}} $ |
在一定条件下,上述反应生成的NO、NO2和N2O又会与NH3反应生成N2和H2O,相关化学方程式如下:
| $ {\text{4N}}{{\text{H}}_{\text{3}}}{\text{ + 6NO }} \rightleftharpoons}_{\text{2}}} + 6{{\text{H}}_{\text{2}}}{\text{O}} $ |
| $ {\text{8N}}{{\text{H}}_{\text{3}}}{\text{ + 6N}}{{\text{O}}_{\text{2}}}{\text{ }} \rightleftharpoons}_{\text{2}}} + 12{{\text{H}}_{\text{2}}}{\text{O}} $ |
| $ {\text{2N}}{{\text{H}}_{\text{3}}}{\text{ + 3}}{{\text{N}}_{\text{2}}}{\text{O }} \rightleftharpoons}_{\text{2}}} + 3{{\text{H}}_{\text{2}}}{\text{O}} $ |
上述反应皆为可逆反应,即氨燃烧过程中,生成N2和H2O的同时还会形成NO、NO2、N2O等氮氧化物,而这些氮氧化物又可与氨反应转化成N2和H2O。
2 氨燃烧尾气排放特性氨燃烧的尾气排放特性与当量比、燃料组成、压力、燃料室入口温度、燃料是否预混、燃烧器结构、停留时间等多种因素有关。目前,关于氨在不同工况的燃烧反应动力学机理的研究还处于研发阶段,现有机理均无法同时准确预测不同工况的燃烧特性[5]。燃烧尾气排放特性亦不明确,这使得尾气处理设计的难度大大增加。
部分学者研究了当量比对氨燃烧尾气排放特性的影响。Tang等[6]研究了氨/空气燃烧的NOx排放特性。实验固定空气流量为50 L/min,并利用等离子体来增强氨燃烧。结果表明,尾气中NO和NO2的排放量均随当量比的增加呈现先增加后减少趋势。二者的排放峰值在当量比0.8附近,其中NO排放浓度约为1 500×106,NO2浓度约为90×106。Okafor等[7]对以纯氨为燃料的微型燃气轮机燃烧情况进行了实验研究,重点研究了燃油喷射角、当量比、燃烧室入口温度和环境压力对火焰稳定和排放的影响。结果表明,与沿燃烧室中轴垂直喷油相比,沿燃烧室中轴倾斜喷油方式提高了火焰稳定性,降低了NH3和NOx的排放,NO排放在上游当量比为1.1时达到最小值。该研究采用的富贫燃烧策略中,预混燃烧的NOx排放比非预混燃烧低,说明混合均匀性对氨燃烧NOx排放的影响较大。在总当量比小于1、燃烧室入口温度为298 K时,排放尾气中NO2与N2O的浓度相当,均在0~60×106之间;而NO的浓度远高于NO2与N2O,为(1000~3 000)×106。NO浓度较高的原因是在富氧燃烧情况下,燃烧室下游缺乏燃料燃烧,使得NO浓度较高,而OH浓度明显较低。当总当量比大于1时,NH3排放浓度大幅增加,由0上升至5 000×106以上。Westlye等[8]对富氢氨燃料单缸发动机的氮氧化物排放特性进行了实验研究。实验采用1台压缩比为7~15的0.612L CFR单缸发动机,所用燃料成分体积百分比为80% NH3和20% H2。结果表明,在最佳点火条件下,NO的排放浓度随过量空气系数的增加呈现先增加后减少的趋势,总体浓度范围在(3000~6 000)×106之间;NO2、N2O的排放浓度均随过量空气系数的增加而增大,其中,NO2浓度在(10~150)×106范围内,N2O浓度范围为(20~100)×106。作者分析NO来源于其他反应途径,而不是分子氮的解离,由于火焰温度较低,NO排放量可与汽油燃料相媲美。与汽油相比,氨燃烧形成的NO2浓度更高,在氮氧化物排放总量中所占比例为3%~4%。N2O是在一定温度条件下(1000~1 400 K)NH3与NO反应的中间产物;在膨胀和排气过程中,NO2与NH2自由基的低温反应是产生N2O的主要因素。N2O浓度与点火时间和过量空气系数有关,延迟点火提高了温度从而促进了N2O的形成。较高的过量空气系数会刺激NH2自由基的形成,使NO2浓度增加,也会促进N2O的形成。未燃烧的氨气主要来源于余隙容积,其浓度取决于压缩比的大小,约为(1000~3 000)×106,但该部分氨不能满足脱除NOx的需求量。SCR模拟表明,在添加过量氨的情况下,尾气中的温度足以处理氮氧化物排放。
燃料比和负载水平也是影响氨燃烧排放特性的重要因素。Reiter等[9]研究了使用氨/柴油双燃料的压缩点火发动机的燃烧和排放特性。实验采用1台四缸涡轮增压柴油发动机,测试功率在10~30 kW之间。实验采用2种方案,一种是使用氨和柴油的不同组合来实现恒定发动机功率,另一种是使用少量柴油并改变氨量以实现可变发动机功率。结果表明,在恒定发动机功率运行下,为了实现有利的燃油效率,最佳运行范围是柴油燃料提供能量占比在40%~60%的工况。相比于纯柴油燃料,相同功率下采用双燃料方法的废气CO和碳氢化合物排放量更高,而NOx排放量随不同的燃料组合而变化。如果氨占燃料总能量的40%以下,则NOx排放减少,因为较低的燃烧温度使热力型NOx减少;如果氨能量占60%以上,由于氨燃料包含氮元素,废气NO排放量显著增加;当氨能量占比达到80%时,NO排量为32 g/kWh。尽管氨转化效率总体较高(近100%),但尾气中氨气排放量仍在(1000~3000)×106之间;当氨能量占比超过80%时,尾气中NH3排量超过8 g/kWh。另一方面,由于缺乏柴油助燃,可变发动机功率运行工况的燃油效率较低且废气氨排放较多,氨排放浓度在(3000~12 000)×106之间。Ryu等[10]研究了直接喷射气态氨对火花点火发动机燃烧特性和尾气排放特性的影响,实验采用汽油作助燃剂。结果表明,燃烧尾气中的NOx浓度随负载的增加呈现先增加后降低的趋势。当负载水平在1~3 kW时,NOx浓度维持在(3000~6 000)×106之间,排量在55~100 g/kWh之间。尾气中NH3含量随负载的增加而增加,浓度在(350~500)×106之间,排量在2~5 g/kWh之间。Oh等[11]研究了天然气/氨双燃料发动机在船用发动机中使用的可行性。实验采用1台11L 6缸涡轮增压火花点火发动机,开展了多种空燃比和燃料比工况的燃烧实验。研究选择低转速(840 r/min)和低负载工况运行,以模拟典型船用发动机工况。结果表明,当空燃比为1.2、氨燃料占比大于50%时,氮氧化物排放量达到最高35 g/kWh;尾气中氨排放最高值约为16 g/kWh,出现在空燃比1.5、氨燃料占比约45%的工况。
总体而言,NH3燃烧尾气排放特性与燃烧工况密切相关。一般来说,主要污染物排放浓度由大到小为NO、NH3、NO2和N2O。
3 NOx脱除方法NOx的脱除工艺主要包括干法脱硝和湿法脱硝两大类,其中干法脱硝中的选择性催化还原法(SCR)因其脱除效率高、成本低廉成为工业上应用最广泛的NOx脱除方法,该方法最常用的还原剂为NH3[12]。
NH3-SCR指的是在催化剂作用及O2存在的条件下,NH3优先与烟气中的NOx反应,生成无毒无害的N2和H2O的方法。目前有2种NH3-SCR反应机理得到广泛认可[13],一是Eley-Rideal (E-R)机理,即NH3首先被催化剂吸附在表面形成活化态,之后气相NOx与被吸附的NH3反应形成中间体,中间体进一步分解成N2和H2O。另一个是Langmuir-Hinshelwood (L-H)机理,即NOx和NH3都先被吸附在催化剂表面,并进一步反应形成N2和H2O后被解吸。许多研究人员[14-15]证实了E-R机理和L-H机理在NH3-SCR反应中,是共存的。NH3-SCR脱硝反应方程式如下:
| $ {\text{4NO+4NH}}_{\text{3}}{\text{+O}}_{\text{2}}\text{ }\rightleftharpoons{催化剂} {\text{ 4N}}_{\text{2}}+6{\text{H}}_{\text{2}}\text{O} $ |
| $ 6{\text{NO}}_{\text{2}}{\text{+8NH}}_{\text{3}}\text{ }\rightleftharpoons}_{\text{2}}+12{\text{H}}_{\text{2}}\text{O} $ |
催化剂是NH3-SCR技术的核心要素,高效NH3-SCR催化剂的制备是当前的研究热点。Boningari等[16]概述了NH3-SCR技术及其催化剂的发展历程。早先Englehard公司于1957年开发了由铂族、钴、镍和铁金属组成的NH3-SCR催化剂,并申请了美国专利。之后其他多家公司陆续开发了相似类型的SCR催化剂,如Ethyl Corp采用Pd增强的Cu催化剂,BASF开发了V、Mo和W的氧化物催化剂,Hamburger Gaswerkes采用Cr和Fe氧化物作催化剂。由于该类催化剂的使用需要高温环境,容易产生爆炸性物质硝酸铵,这种特性限制了此类催化剂的应用。20世纪60年代初,日本和美国继续推进实用型SCR催化剂的研究,开发了V2O5/TiO2催化剂,该催化剂具有成本低廉、使用寿命长且在中等温度下催化效率高等优点。但钒催化剂在高温下不稳定,并且具有将SO2氧化成SO3的催化作用,这可能造成含硫烟气设备的酸性腐蚀。通过添加WO3或MoO3可提高热稳定性、耐久性和阻碍SO2的氧化,因此商业上通常采用TiO2负载的V2O5和WOx或MoOx的混合氧化物作催化剂。由于在300~400℃具有优异的NOx脱除效率,V2O5-WO3(MoO3)/TiO2成为当前工业脱硝中使用最广泛的SCR催化剂[17]。
现有SCR系统多放置在排气烟道中下游,在很多工况下,烟气温度无法满足V2O5-WO3(MoO3)/TiO2的催化要求,需配备加热器对烟气进行升温,增加了运行成本。此外,300~400℃温度下依然存在相当数量的SO2氧化问题,造成管道腐蚀隐患,以上问题促进了低温高效SCR催化剂的开发。近年来对于低温SCR催化剂的研究主要集中于过渡金属氧化物,其中锰基催化剂因其在低温下,具有优异的SCR性能而备受关注。Li等[18]研究了前驱体对MnOx/TiO2催化剂的低温NH3-SCR催化性能的影响。结果表明,以醋酸锰为原料制备的催化剂因具有较高的表面Mn浓度和Mn2O3含量,其低温活性更高。在150~200℃时,NOx转化率接近100%。Zhou等[19]测试了添加过渡金属(Cr、Zr、Mo)对MnOx-FeOx的低温NH3-SCR催化性能的影响。结果表明,Cr的加入可显著拓宽Mn-Fe催化剂的高效率温区,在120~300℃范围内的NOx转化率接近100%。原因是掺杂Cr可增强催化剂表面活性组分的分散性,使催化剂比面积增加,提高反应效率。Ren等[20]研究了煅烧温度对Ce-Mn-Ru/TiO2催化还原NOx性能的影响。结果表明,350℃下煅烧的催化剂表现出最佳低温脱硝活性,在100℃时的NOx转化率大于95%,在120~250℃时,NOx转化率接近100%。Niu等[21]测试了Tm改性的MnOx/TiO2催化剂对NOx低温NH3-SCR催化性能的影响。结果表明,引入适量的Tm可提高催化剂表面的Mn4+浓度、化学吸附氧性能、NH3和NO的化学吸附性能,有助于提升反应效率。在120~300℃时的NOx转化率大于90%,在150~270℃时的NOx转化率接近100%。
综上所述,当前工业应用中脱除NOx的主流方法为NH3-SCR,而V2O5/TiO2是应用最广泛的NH3-SCR催化剂。在低温应用中,锰基催化剂因其良好的低温催化性能成为最具潜力的低温NH3-SCR催化剂。
4 N2O脱除方法目前用于脱除N2O的方法有高温热分解法[22]、选择性催化还原法[23]和直接催化分解法[24]等。高温分解法是将N2O在高温条件下,直接分解为N2和O2的方法。该方法无需催化剂、工艺简单;但所需反应温度高(通常大于1000℃),能耗大且对反应装置的耐温要求高,维护难度大。此外,该方法的N2O转化率偏低。以上特点使得高温分解法在工业中的应用受到限制。选择性催化还原法是在催化剂的作用下,利用还原剂将N2O选择性地还原为N2和其他无害产物的方法。该方法的优势在于所需反应温度较低(一般为200~600℃)[25-26],但需消耗额外的还原剂,使运行成本有所增加。直接催化分解法是在合适的条件下,通过催化剂的作用直接将N2O催化分解为N2和O2的方法。与选择性催化还原法相比,该方法无需额外的还原剂、工艺流程简单,使得运行成本降低且不会产生其他污染;与高温分解法相比,催化剂的引入使得反应温度降低,从而有效减少运行能耗。以上特性使得直接催化分解法成为最有前景的N2O脱除方法[27]。其反应方程式为:
| $ {\text{2N}}_{\text{2}}\text{O } {\rightleftharpoons}_{\text{2}}+{\text{O}}_{\text{2}} $ |
催化剂的选型和制备是直接催化分解法的核心,开发催化效率高、低温活性好的直接分解法催化剂是当前的研究热点。关于N2O直接分解反应及其催化剂的研究始于20世纪70年代,研究主要涉及金属氧化物[28-29]和复合金属氧化物催化剂[30-31]的催化机理,大多催化剂反应速率较低,实际应用价值不高[32]。20世纪90年代以来,研究人员开始广泛关注高效实用型催化剂。目前,研究较多的N2O分解催化剂主要分为贵金属[33]、分子筛[34 - 36]和金属氧化物[37-38]。相较于贵金属和分子筛,金属氧化物催化剂的催化活性更优、低温性能更好、成本更加低廉,因而成为最具潜力的工业用催化剂[39]。金属氧化物催化剂主要分为单一金属氧化物催化剂和混合金属氧化物催化剂,常用单一金属氧化物催化剂主要包括NiO、Co3O4、CuO、CaO、MgO、Fe3O4、MnO2、ZnO等。单一金属氧化物催化N2O的分解反应起始温度一般在300°C以上,不同金属氧化物对O2的耐受程度不同。单一金属氧化物结构简单、抗氧性能不佳、低温适应性不高,目前研究者对单一氧化物的研究着重于催化反应机理,而非其催化性能[40]。
混合金属氧化物是通过向单一金属氧化物中掺杂其他金属制备而成的,与单一金属氧化物相比,其结构、离子分散度及化学性能均会发生变化[40]。N2O的催化分解包含2步:首先是N2O在活性位上吸附分解并消耗金属活性位,其次是吸附态氧脱附和活性位再生。其中,表面氧化还原性能与活性位的氧化再生都会影响催化反应进程,添加金属助剂可有效改善金属氧化物表面化学性能,有益于N2O的催化分解[39]。Asano等[41]实验探究了碱金属K对金属氧化物催化活性的影响。结果表明,K掺杂的Co3O4催化剂即使在有水的情况下也表现出高活性,且其活性很大程度上取决于催化剂中K的含量,K/Co原子比为0.02时活性最高。反应从100℃开始进行,至400℃时,N2O转化率达到100%。Yoshino等[42]发现制备方法和钾源对K/Co3O4催化剂直接分解N2O的活性有很大影响。原因在于催化剂的制备方法以及钾源显著影响了Co3+到Co2+在低温(约200℃)下的还原程度,而这对N2O分解活性有重要影响。在测试的催化剂中,采用KOH水溶液浸渍CoCO3制备的催化剂活性最高,其催化分解反应从100℃开始进行,约300℃时,N2O的转化率达到100%。Grzybek等[43]研究了碱金属助剂Cs对尖晶石催化剂分解N2O性能的影响。采用浸渍法制备了不同前驱体(Cs2CO3、CsNO3、CH3COOCs和CsOH)负载的钴尖晶石催化剂进行性能测试。结果表明,添加碱金属对催化分解N2O性能有促进作用。Cs2CO3的催化活性最高,催化反应从50℃开始进行,至200℃时,N2O转化率达到100%。Pasha等[44]通过实验研究了碱金属Cs对金属氧化物催化活性的影响。结果表明,在CuO中加入Cs可有效提高其催化分解N2O的活性。原因在于Cs可增强Cu2+到Cu0的还原能力,从而提高Cs/CuO的催化分解活性。实验显示,Cs/CuO催化剂在Cs/Cu比为0.1时的活性最佳。分解反应从100℃开始进行,至约300℃时,N2O的转化率达到100%。该团队还探究了Cs掺杂的Co3O4催化剂用于N2O的催化分解性能[45]。结果表明,Cs的加入可有效提高Co3O4催化分解N2O的活性。其原因是Cs减弱了Co-O键的强度,使氧在反应过程中,更易脱附,从而使催化活性提高。当Cs的掺杂量为0.05时,Cs/Co3O4催化剂的活性最佳。分解反应从150℃开始进行,至约250℃时,N2O的转化率达到100%。研究还发现O2或H2O会减缓分解反应,使得所需反应温度升高。Abu-Zied等[46]通过实验研究了掺杂稀土金属助剂(Nd、Pr、Tb、Y、Gd、La和Sm)对金属氧化物NiO的催化活性的影响。结果表明,所制备的催化剂均具有N2O催化分解活性,其催化性能均高于纯NiO。通过技术表征发现稀土的加入使NiO的形态和结构发生显著变化,包括NiO微晶尺寸减小、中孔度增加、表面积和孔体积增加,这些变化使得催化性能得到改善。
综合而言,主要N2O脱除方法中潜在应用价值最高的是直接催化分解法,而金属氧化物是直接催化分解法的优势催化剂。通过向金属氧化物中掺杂金属助剂可增强其化学活性、改善其表面结构特征,从而提升催化性能。相关的N2O催化分解温度一般从100℃左右开始,至200~400℃达到100%转化率。
5 氨燃烧尾气处理方案氨燃料发动机尾气中污染物主要为NOx、NH3和N2O。对于NOx的处理,可设置选择性催化还原(SCR)设备脱除。一般而言,尾气中逃逸的氨气量不足以还原全部的氮氧化物[10],因此需引入额外的氨参与还原反应。结合系统自带氨燃料的特点,可引入燃料氨/尿素溶液作为补充还原剂。对于N2O的处理,可采用混合金属氧化物催化剂,通过催化分解反应予以脱除。
作为船用氨燃料主机的主要开发商,曼恩能源方案公司提出2种氨燃烧尾气处理解决思路。一种是通过调整发动机燃烧状态来消除N2O排放,通过SCR反应消除未燃烧的NH3和NOx,根据需求可在SCR反应中加入额外的还原剂NH3/尿素溶液,图1为其原理示意图。
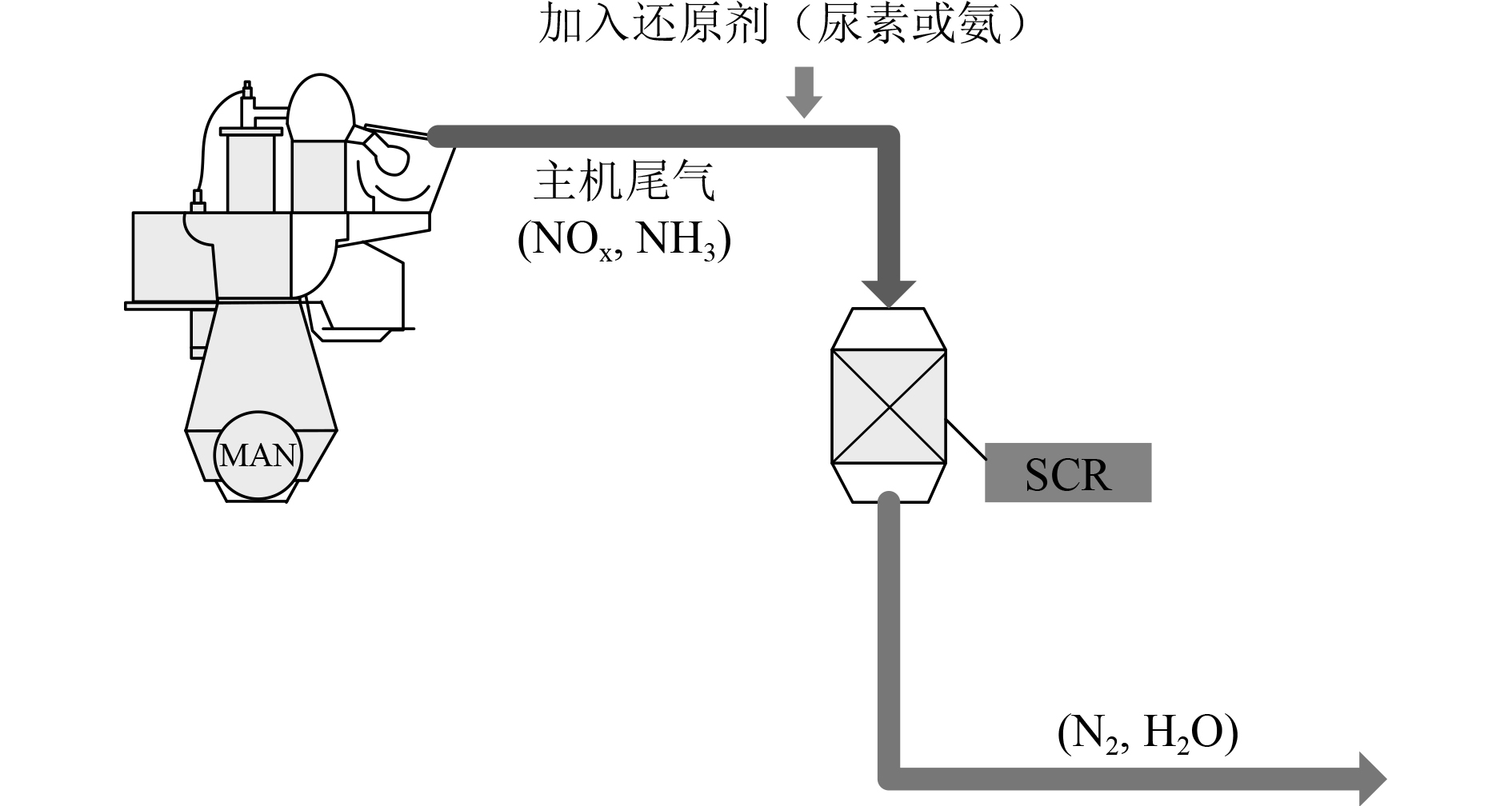
|
图 1 NOx和NH3处理方案 Fig. 1 NOx and NH3 treatment scheme |
另一种方案如图2所示,通过后处理消除N2O,以避免发动机调整不能完全消除N2O的情况。具体通过催化还原反应去除N2O,其中优选NH3/尿素溶液作为还原剂;通过SCR反应脱除NOx;在柴油燃料运行模式下,采用旁通替代N2O反应器。
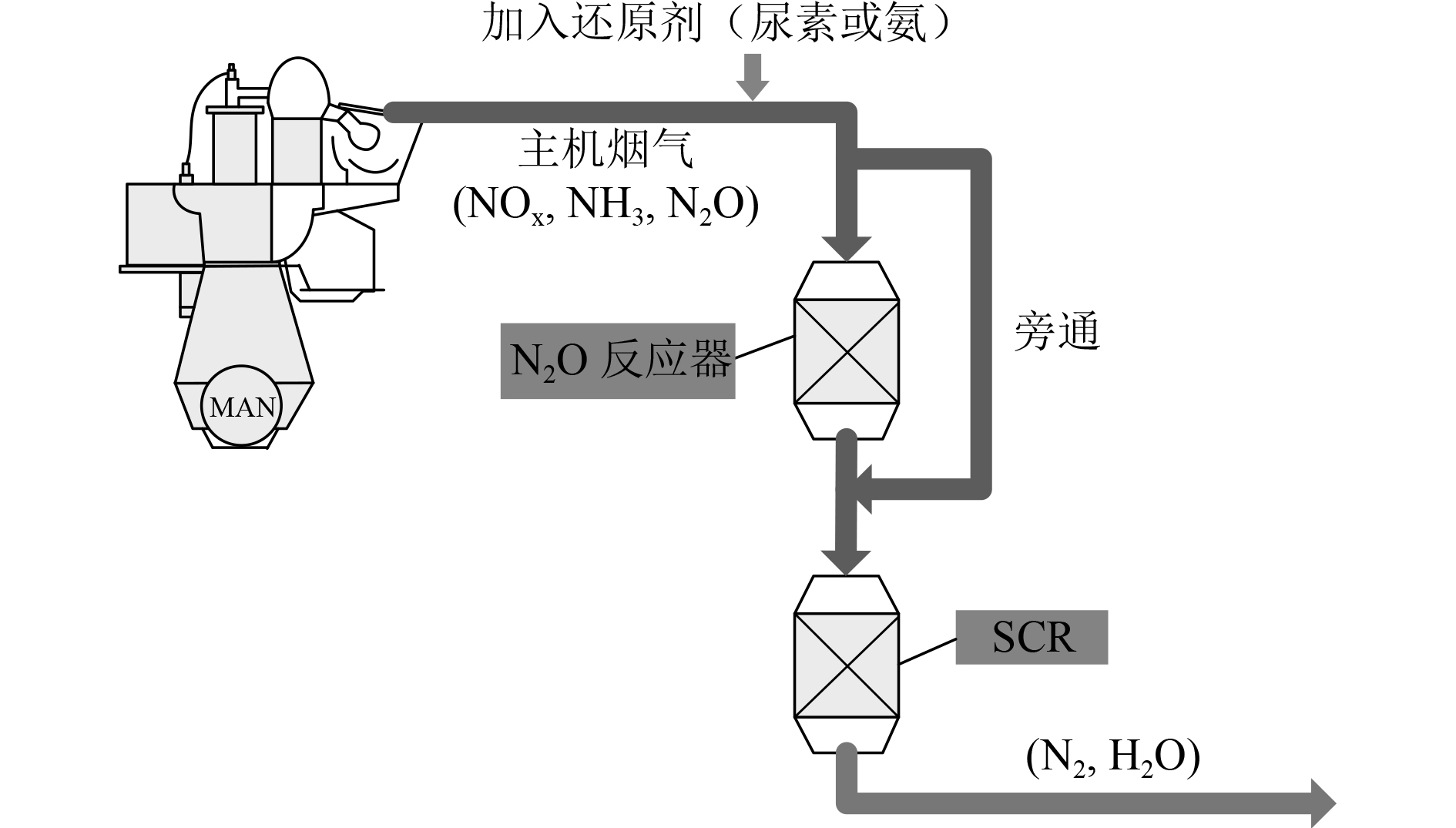
|
图 2 NOx、NH3和N2O处理方案 Fig. 2 NOx, NH3 and N2O treatment scheme |
格兰杰[47]提出了一种从气体中去除NOx和N2O的方法和装置,其流程简图如图3所示。首先将尾气与适量NOx还原剂NH3混合,NH3的量可还原大部分NOx;之后在第一NOx催化床中对尾气中NOx进行脱除,剩余部分NOx在脱N2O催化床中参与并促进全部N2O的催化分解,最后添加适量NH3在第二脱NOx催化床中将剩余NOx完全脱除。其中,第一脱NOx催化床采用铜交换的沸石作催化剂,N2O催化床的催化剂为铁交换的沸石,第二脱NOx催化床采用氧化钒作催化剂。
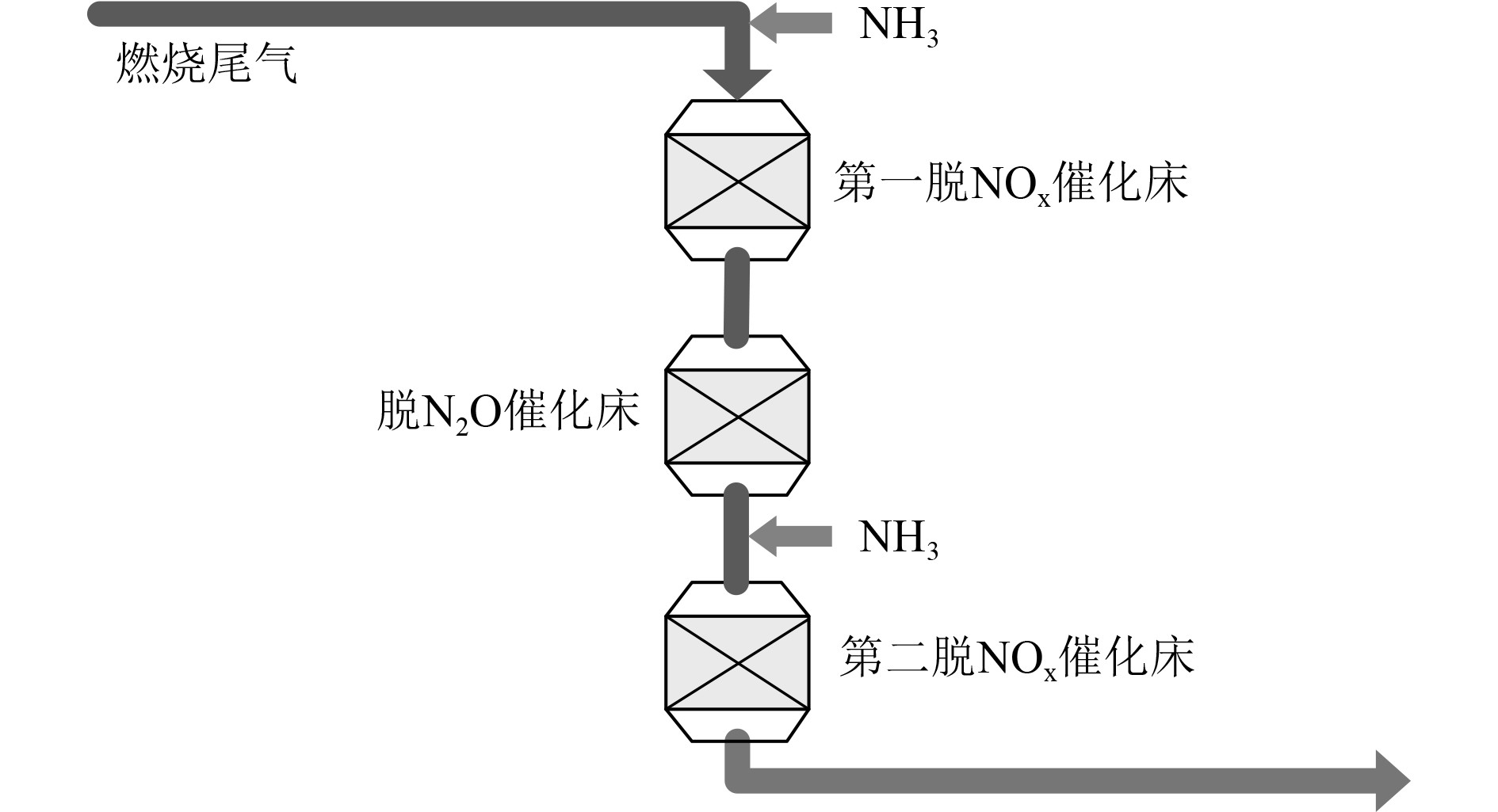
|
图 3 从气体中去除NOx和N2O的方法和装置[47] Fig. 3 Method and apparatus for removing NOx and N2O from gases |
氨是实现“碳中和”过程中最重要的零碳燃料之一,其作为船舶燃料的应用尚处于实验室研发阶段。本文首先介绍氨燃烧反应原理,之后从氨燃烧尾气排放特性、NOx脱除方法、N2O脱除方法和氨燃烧尾气处理方案4个方面对当前船用氨燃料燃烧尾气处理技术研究进展情况进行总结,主要得到以下结论:
1)氨燃烧的反应动力学机理非常复杂,尾气排放特性与燃烧工况密切相关,对氨燃烧尾气处理技术的开发可依据燃烧器特性进行针对性设计,按浓度顺序重点考虑NOx、NH3和N2O的处理。
2)NH3-SCR法是当前工业上NOx处理的主流方法,而V2O5/TiO2是应用最广泛的NH3-SCR催化剂;此外新型锰基催化剂表现出良好的低温催化性能,具有巨大应用潜力。
3)直接催化分解法是最具前景的N2O脱除方法。因在催化活性、低温适应性、成本等方面的优势,掺杂金属助剂的混合金属氧化物作为直接催化分解法催化剂具有广泛的工业应用前景。
4)氨燃烧尾气处理方案的设计可分两步进行,其中,N2O可通过调整发动机燃烧状态或催化分解反应予以消除;NOx可通过设置NH3-SCR设备脱除,根据尾气温度可选用V2O5/TiO2或新型锰基催化剂,根据系统特点可引入燃料氨作还原剂。
| [1] |
邹才能, 何东博, 贾成业, 等. 世界能源转型内涵、路径及其对碳中和的意义[J]. 石油学报, 2021, 42(2): 233-247. |
| [2] |
IEA. World energy outlook 2021 [M]. Paris; IEA. 2021.
|
| [3] |
楚育纯, 周梅, 王兆林, 等. 掺氨燃料在四冲程内燃机中的排放特性[J]. 厦门大学学报(自然科学版), 2021, 60(1): 50-57. |
| [4] |
周梅, 楚育纯, 王兆林, 等. 氨-丙烷混合燃料降碳燃烧的排放特性[J]. 燃烧科学与技术, 2020, 26(3): 257-264. |
| [5] |
王智化, 余作超, 陈晨霖, 等. 新型零碳氨燃料的燃烧特性研究进展[J]. 华中科技大学学报(自然科学版), 2022, 50(7): 24-40. DOI:10.13245/j.hust.220703 |
| [6] |
TANG Y, XIE D, SHI B, et al. Flammability enhancement of swirling ammonia/air combustion using AC powered gliding arc discharges[J]. Fuel, 2022, 313: 122674. DOI:10.1016/j.fuel.2021.122674 |
| [7] |
OKAFOR E C, SOMARATHNE K D K A, HAYAKAWA A, et al. Towards the development of an efficient low-NOx ammonia combustor for a micro gas turbine[J]. Proceedings of the Combustion Institute, 2019, 37(4): 4597-4606. DOI:10.1016/j.proci.2018.07.083 |
| [8] |
WESTLYE F R, IVARSSON A, SCHRAMM J. Experimental investigation of nitrogen based emissions from an ammonia fueled SI-engine[J]. Fuel, 2013, 111: 239-247. DOI:10.1016/j.fuel.2013.03.055 |
| [9] |
REITER A J, KONG S-C. Combustion and emissions characteristics of compression-ignition engine using dual ammonia-diesel fuel[J]. Fuel, 2011, 90(1): 87-97. DOI:10.1016/j.fuel.2010.07.055 |
| [10] |
RYU K, ZACHARAKIS-JUTZ G E, KONG S-C. Effects of gaseous ammonia direct injection on performance characteristics of a spark-ignition engine[J]. Applied Energy, 2014, 116: 206-215. DOI:10.1016/j.apenergy.2013.11.067 |
| [11] |
OH S, PARK C, KIM S, et al. Natural gas–ammonia dual-fuel combustion in spark-ignited engine with various air–fuel ratios and split ratios of ammonia under part load condition[J]. Fuel, 2021, 290: 120095. DOI:10.1016/j.fuel.2020.120095 |
| [12] |
赵琳, 刘庆岭, 周伟, 等. 工业烟气脱硝技术国内外研究进展[J]. 化学试剂, 2021, 43(6): 747-756. |
| [13] |
GAO F, TANG X, YI H, et al. A review on selective catalytic reduction of NOx by NH3 over Mn–based catalysts at low temperatures: catalysts, mechanisms, kinetics and DFT calculations[J]. Catalysts, 2017, 7(7): 14-25. DOI:10.3390/catal7070199 |
| [14] |
QI G, YANG R T, CHANG R. MnOx-CeO2 mixed oxides prepared by co-precipitation for selective catalytic reduction of NO with NH3 at low temperatures[J]. Applied Catalysis B:Environmental, 2004, 51(2): 93-106. DOI:10.1016/j.apcatb.2004.01.023 |
| [15] |
YANG S, WANG C, LI J, et al. Low temperature selective catalytic reduction of NO with NH3 over Mn–Fe spinel: performance, mechanism and kinetic study[J]. Applied Catalysis B:Environmental, 2011, 110: 71-80. DOI:10.1016/j.apcatb.2011.08.027 |
| [16] |
BONINGARI T, SMIRNIOTIS P G. Impact of nitrogen oxides on the environment and human health: Mn-based materials for the NOx abatement[J]. Current Opinion in Chemical Engineering, 2016, 13: 133-141. DOI:10.1016/j.coche.2016.09.004 |
| [17] |
QI C, BAO W, WANG L, et al. Study of the V2O5-WO3/TiO2 catalyst synthesized from waste catalyst on selective catalytic reduction of NOx by NH3[J]. Catalysts, 2017, 7(4): 110-121. |
| [18] |
LI J, CHEN J, KE R, et al. Effects of precursors on the surface Mn species and the activities for NO reduction over MnOx/TiO2 catalysts[J]. Catalysis Communications, 2007, 8(12): 1896-1900. DOI:10.1016/j.catcom.2007.03.007 |
| [19] |
ZHOU C, ZHANG Y, WANG X, et al. Influence of the addition of transition metals (Cr, Zr, Mo) on the properties of MnOx–FeOx catalysts for low-temperature selective catalytic reduction of NOx by Ammonia[J]. Journal of colloid and interface science, 2013, 392: 319-324. DOI:10.1016/j.jcis.2012.10.002 |
| [20] |
REN Z, ZHANG H, WANG G, et al. Effect of calcination temperature on the activation performance and reaction mechanism of Ce–Mn–Ru/TiO2 catalysts for selective catalytic reduction of NO with NH3[J]. ACS Omega, 2020, 5(51): 33357-33371. DOI:10.1021/acsomega.0c05194 |
| [21] |
NIU C, WANG B, XING Y, et al. Thulium modified MnOx/TiO2 catalyst for the low-temperature selective catalytic reduction of NO with ammonia[J]. Journal of Cleaner Production, 2021, 290: 125858. DOI:10.1016/j.jclepro.2021.125858 |
| [22] |
GöLDEN V, SOKOLOV S, KONDRATENKO V A, et al. Effect of the preparation method on high-temperature de-N2O performance of Na–CaO catalysts. A mechanistic study[J]. Applied Catalysis B:Environmental, 2010, 101(1): 130-136. |
| [23] |
MAUVEZIN M, DELAHAY G, KIßLICH F, et al. Catalytic reduction of N2O by NH3 in presence of oxygen using Fe‐exchanged zeolites[J]. Catalysis Letters, 1999, 62(1): 41-44. DOI:10.1023/A:1019078401694 |
| [24] |
WóJTOWICZ M A, PELS J R, MOULIJN J A. Combustion of coal as a source of N2O emission[J]. Fuel Processing Technology, 1993, 34(1): 1-71. DOI:10.1016/0378-3820(93)90061-8 |
| [25] |
ZHANG X, SHEN Q, HE C, et al. Investigation of selective catalytic reduction of N2O by NH3 over an Fe–mordenite catalyst: reaction mechanism and O2 effect[J]. ACS Catalysis, 2012, 2(4): 512-520. DOI:10.1021/cs200568w |
| [26] |
RUIZ-MARTı́NEZ E, SáNCHEZ-HERVáS J M, OTERO-RUIZ J. Catalytic reduction of nitrous oxide by hydrocarbons over a Fe-zeolite monolith under fluidised bed combustion conditions[J]. Applied Catalysis B:Environmental, 2004, 50(3): 195-206. DOI:10.1016/j.apcatb.2004.01.013 |
| [27] |
杨波, 沈岳松, 祝社民. 催化分解N2O催化剂的研究新进展[J]. 环境工程, 2012, 30(2): 114-119. |
| [28] |
YAMASHITA T, VANNICE A. N2O Decomposition over Manganese Oxides[J]. Journal of Catalysis, 1996, 161(1): 254-262. DOI:10.1006/jcat.1996.0183 |
| [29] |
ŽEMVA P, LESAR A, KOBAL I, et al. Interpretation of kinetic isotope effects in the decomposition of N2O over CoO[J]. Chemical Physics, 2001, 264(3): 413-418. DOI:10.1016/S0301-0104(01)00247-6 |
| [30] |
MORTERRA C, GIAMELLO E, CERRATO G, et al. Role of surface hydration state on the nature and reactivity of copper ions in Cu-ZrO2 catalysts: N2O Decomposition[J]. Journal of Catalysis, 1998, 179(1): 111-128. DOI:10.1006/jcat.1998.2207 |
| [31] |
GAO L Z, AU C T. Studies on the decomposition of N2O over Nd2CuO4, Nd1.6Ba0.4CuO4 and Nd1.8Ce0.2CuO4[J]. Journal of Molecular Catalysis A:Chemical, 2001, 168(1): 173-186. |
| [32] |
吴波, 庄亚辉. N2O直接分解催化剂的研究进展[J]. 环境科学进展, 1997(5): 2-18. |
| [33] |
HO P H, JABŁOŃSKA M, PALKOVITS R, et al. N2O catalytic decomposition on electrodeposited Rh-based open-cell metallic foams[J]. Chemical Engineering Journal, 2020, 379: 122259. DOI:10.1016/j.cej.2019.122259 |
| [34] |
KIWI-MINSKER L, BULUSHEV D A, RENKEN A. Active sites in HZSM-5 with low Fe content for the formation of surface oxygen by decomposing N2O: is every deposited oxygen active?[J]. Journal of Catalysis, 2003, 219(2): 273-285. DOI:10.1016/S0021-9517(03)00222-7 |
| [35] |
SMEETS P J, MENG Q, CORTHALS S, et al. Co–ZSM-5 catalysts in the decomposition of N2O and the SCR of NO with CH4: Influence of preparation method and cobalt loading[J]. Applied Catalysis B:Environmental, 2008, 84(3): 505-513. |
| [36] |
GUZMáN-VARGAS A, DELAHAY G, COQ B. Catalytic decomposition of N2O and catalytic reduction of N2O and N2O + NO by NH3 in the presence of O2 over Fe-zeolite[J]. Applied Catalysis B:Environmental, 2003, 42(4): 369-379. DOI:10.1016/S0926-3373(02)00268-0 |
| [37] |
WEI X, WANG Y, LI X, et al. Co3O4 supported on bone-derived hydroxyapatite as potential catalysts for N2O catalytic decomposition[J]. Molecular Catalysis, 2020, 491: 111005. DOI:10.1016/j.mcat.2020.111005 |
| [38] |
BAHAA M A-Z, SOLIMAN A S, SARAH E A. 纯相和镍取代的Co3O4尖晶石催化剂用于N2O直接分解[J]. 催化学报, 2014, 35(7): 1105-1112.
|
| [39] |
王涵啸. SCR脱硝催化剂改性协同催化分解N2O的实验研究[D]. 北京: 华北电力大学, 2021.
|
| [40] |
张峰峰. Ni基复合氧化物催化分解N2O的研究[D]. 大连: 大连理工大学, 2015.
|
| [41] |
ASANO K, OHNISHI C, IWAMOTO S, et al. Potassium-doped Co3O4 catalyst for direct decomposition of N2O[J]. Applied Catalysis B:Environmental, 2008, 78(3): 242-249. |
| [42] |
YOSHINO H, OHNISHI C H, HOSOKAWA S, et al. Optimized synthesis method for K/Co3O4 catalyst towards direct decomposition of N2O[J]. Journal of Materials Science, 2011, 46(3): 797-805. DOI:10.1007/s10853-010-4818-4 |
| [43] |
GRZYBEK G, STELMACHOWSKI P, GUDYKA S, et al. Insights into the twofold role of Cs doping on deN2O activity of cobalt spinel catalyst—towards rational optimization of the precursor and loading[J]. Applied Catalysis B:Environmental, 2015, 168-169: 509-514. DOI:10.1016/j.apcatb.2015.01.005 |
| [44] |
PASHA N, LINGAIAH N, REDDY P S S, et al. Direct decomposition of N2O over cesium-doped CuO catalysts[J]. Catalysis Letters, 2009, 127(1): 101-106. |
| [45] |
PASHA N, LINGAIAH N, BABU N S, et al. Studies on cesium doped cobalt oxide catalysts for direct N2O decomposition in the presence of oxygen and steam[J]. Catalysis Communications, 2008, 10(2): 132-136. DOI:10.1016/j.catcom.2008.06.006 |
| [46] |
ABU-ZIED B M, BAWAKED S M, KOSA S A, et al. Effects of Nd-, Pr-, Tb- and Y-doping on the structural, textural, electrical and N2O decomposition activity of mesoporous NiO nanoparticles[J]. Applied Surface Science, 2017, 419: 399-408. DOI:10.1016/j.apsusc.2017.05.040 |
| [47] |
J·F·格兰杰. 从气体中去除NOx和N2O的方法和装置. CN108136329B[P]. 2021.
|
 2024, Vol. 46
2024, Vol. 46
