2. 中国船舶集团有限公司第七一八研究所,河北 邯郸 056027
2. The 718 Research Institute of CSSC, Handan 056027, China
在发生核生化物质沾染情况下,水面船舶作为海上主要的航行运输平台,其内置运行设备与人员高度聚集。海上航行需面临特殊天气环境、执行特殊的任务工作,这些特性造成了与陆地运输相比更为复杂、更为尖锐的矛盾。水面船舶舱室内部属于相对封闭的空间,人员活动范围有限,化学毒剂、生物细菌病毒的传播速率与几率都比陆地上大得多,且中央空调等空气循环装置又进一步加大传播范围。因此,如何有效地阻断化学毒剂扩散、切断生物细菌病毒传播途径成为了船舶密闭舱消毒工作的重中之重[1]。
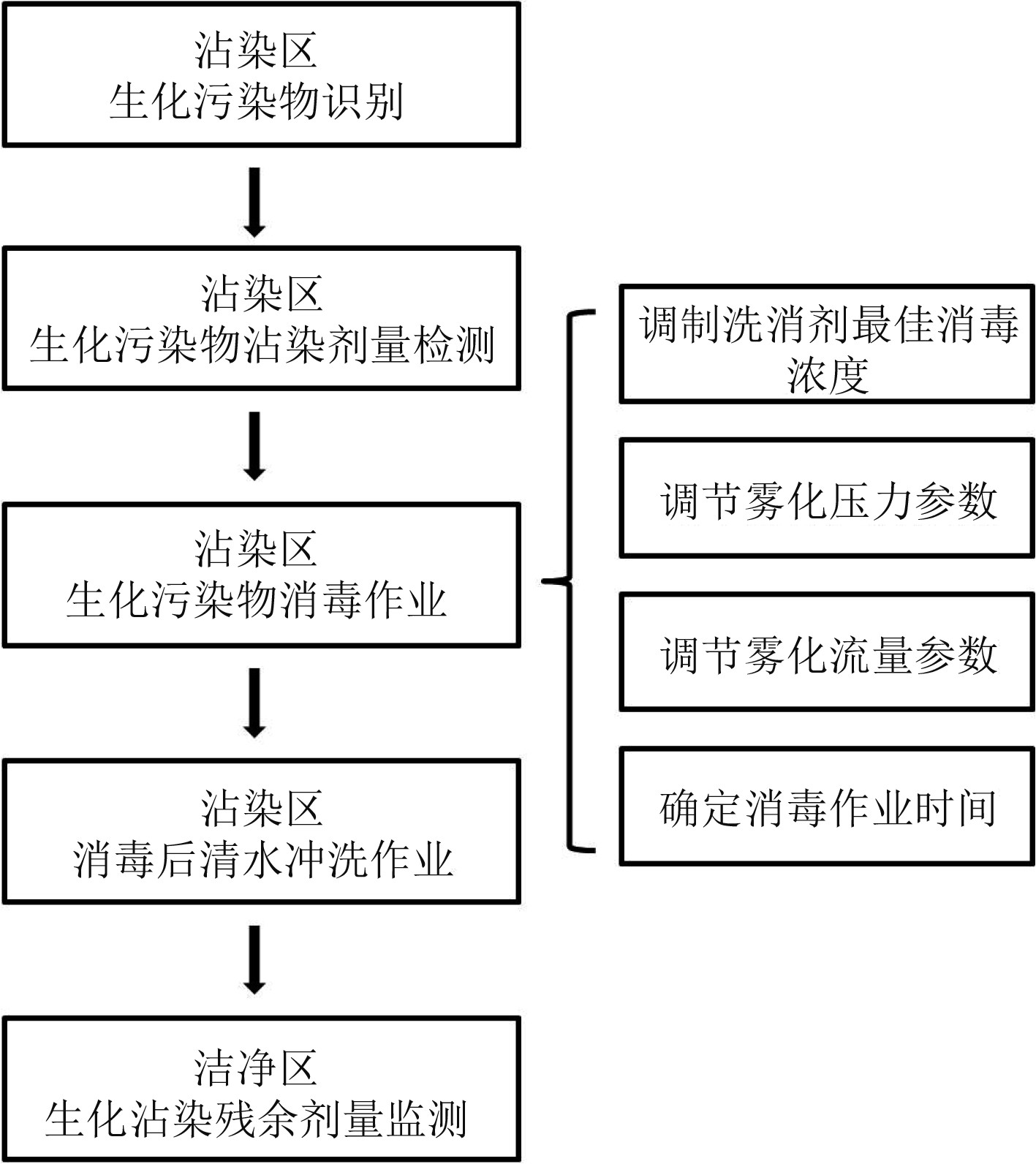
在过去的几十年时间里,国内外已相继开发出了一系列用于不同应用场合生化消毒作业的洗消药剂[2-5]。其中大部分是以水溶液为主的水基洗消剂,如美国研制了对化学毒剂和生物战剂有效消毒的次氯酸盐类STB洗消剂,苏联研制的苛性碱洗消剂,国内研制的以次氯酸钙为主要成分的三合二洗消剂等[6]。这些洗消剂可适配各类移动式洗消装备使用。常见的移动式洗消装备通常由洗消液配量模块、高压模块、高压软管以及布洒喷枪等模块化结构组成。各模块均可独立工作,需要时可联动工作,这样极大降低了装备展开和撤收的工作量。针对不同的污染物,使用时可现场配制不同浓度的洗消液,采用高压引射或者低压布洒2种模式开展生化沾染消毒作业,主要的洗消流程如图1所示。尽管以上水基洗消剂在消毒技术领域展现了广泛的用途,然而其仍存在洗消效能低、广谱性差、腐蚀性强、使用时需要与大量水混合使用而造成后勤负担压力重等局限性。因此,研发减轻后勤保障压力的高效、广谱型非水体系洗消剂就显得尤为重要。本文以碱-醇-胺为消毒成分制备的非水基洗消剂,具有使用简便、易雾化、低腐蚀性以及环境适用性强等优势,研究其对G类、V类、H类化学毒剂模拟剂和生物细菌、病毒的多用途消毒效果。
|
图 1 开展移动式洗消装备集中消毒作业流程图 Fig. 1 Centralized disinfection flow chart of mobile decontamination equipment |
通过研究和筛选,采用自研非水基洗消剂为主要消毒剂。化学毒剂模拟剂采用甲基磷酸二甲酯(DMMP)作为G类沙林毒剂模拟剂,马拉硫磷作为V类维埃克斯毒剂模拟剂,2-氯乙基乙基硫醚(CEES)作为H类芥子气毒剂模拟剂。生物细菌采用革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌作为研究菌种。生物病毒采用脊髓灰质炎病毒和甲型H1N1病毒作为研究毒株。
1.2 实验步骤1)参考GJB 3638A-2020《消毒效果的评价方法》标准方法,测试非水基洗消剂对化学毒剂模拟剂DMMP、马拉硫磷以及CEES的消毒效果。实验步骤是分别配制不同浓度的DMMP、马拉硫磷和CEES标准物溶液。用1 μL微量进样器移取不同浓度的标准液,测试其对应的气相色谱图谱。根据峰面积与浓度关系,最终建立DMMP、马拉硫磷和CEES的标准曲线。
在室温条件下,测试不同反应配比的洗消剂对模拟剂的消毒性能。将洗消剂与模拟剂分别加入烧杯中,放置于磁力搅拌台上,搅速为800 r/min,反应时间为30 min。待反应完全后,加入一定量的10%盐酸溶液终止反应,再加入一定量的二氯甲烷萃取,取下层清液备用。用1 μL微量进样器取样,分别测试得到不同反应配比条件下试样的气相色谱图谱(测试条件:气相色谱柱箱温度为90℃,气化室温度为180℃,检测器温度为190℃)。根据峰面积与浓度关系,对应代入标准曲线中,以此计算得到非水基洗消剂对DMMP、马拉硫磷以及CEES的消毒效率。
2)参考《消毒技术规范》-2002版标准方法,测试非水基洗消剂对生物细菌的杀菌效果。实验步骤是将洗消剂分别和两类细菌(大肠杆菌、金黄色葡萄球菌)在室温下培养1h后,采用悬液定量杀菌分析方法得到其细菌杀灭效率。
3)参照《消毒技术规范》-2002版标准方法,测试非水基洗消剂对生物病毒的灭活效果。实验步骤是将洗消剂分别和两类病毒(甲型流感病毒H1N1、脊髓灰质炎病毒)在室温下培养1h后,利用残留消毒剂物理去除方法的鉴定试验-病毒灭活分析方法得到其病毒灭活效率。
2 结果与讨论 2.1 非水基洗消剂的化学消毒效果评价非水基洗消剂是由碱-醇-胺类化学组分组成的消毒材料。其对化学毒剂的消毒原理,主要是利用配方中的醇和胺类组分在碱性环境中,可以释放带有氧负结构的亲核试剂。与各类化学毒剂发生亲核取代反应,使其结构中的磷氟、磷硫或磷氧键发生断裂,进而生成磷脂类结构无毒无害物质,从而达到消毒效果[7-9]。
不同的反应条件(如洗消剂用量/浓度)会影响洗消剂对化学毒剂的消毒效果。表1~表3分别列出了不同反应用量配比的非水基洗消剂对化学毒剂模拟剂DMMP、马拉硫磷以及CEES的消毒效率。本实验中的反应温度为25℃,搅拌速度为800 r/min,反应时间为30 min,这些实验条件为固定不变。通过改变洗消剂与模拟剂的用量体积比,采用气相色谱监测非水基洗消剂对于各类化学毒剂模拟剂的洗消效率变化。
|
|
表 1 非水基洗消剂对沙林模拟剂DMMP的洗消效果 Tab.1 The decontamination effect of non-aqueous decontamination agent on sarin simulant DMMP |
|
|
表 2 非水基洗消剂对维埃克斯模拟剂马拉硫磷的洗消效果 Tab.2 The decontamination effect of non-aqueous decontamination agent on VX simulant malathion |
|
|
表 3 非水基洗消剂对芥子气模拟剂CEES的洗消效果 Tab.3 The decontamination effect of non-aqueous decontamination agent on mustard gas simulant CEES |
从表1和表3可以看出,随着非水基洗消剂反应用量配比的增加,对DMMP和CEES的消毒效率逐渐增加。当洗消剂DMMP(V/V)=10∶1时,对G类神经性化学毒剂模拟剂的消毒效率仅为84.0%。反应配比为40∶1时,其消毒效率可达到最大值95.7%。当洗消剂CEES(V/V)=40∶1时,对H类糜烂性化学毒剂模拟剂的消毒效率仅为91.0%。反应配比为100∶1时,其消毒效率可达到最大值100%。从表2中可知,洗消剂马拉硫磷(V/V)仅为5∶1时,其对V类神经性化学毒剂的消毒效率就可达到最大值100%。对比非水基洗消剂对3种不同化学毒剂模拟剂的消毒效果可以发现,马拉硫磷>DMMP>CEES。以上结果表明,不同化学毒剂模拟剂分子结构特点(空间位阻、成键方式)的差异性,影响了非水基洗消剂中消毒活性成分与毒剂模拟剂分子的亲核取代反应速率,进而导致其消毒效果的不同。
2.2 非水基洗消剂的生物细菌和病毒消毒效果评价致病微生物中的细菌、真菌具有细胞膜、细胞壁等基本细胞结构。病毒则属于非细胞结构微生物,其结构仅为核酸和蛋白质外壳组成。而核酸、脂肪、糖和蛋白质4类生物大分子是这些致病微生物生长繁殖过程中不可缺少的重要营养物质。非水基洗消剂对生物细菌和病毒的消毒原理是由于其配方中的有机化学组分和碱性物质可以通过破坏这些微生物的细胞膜和细胞壁结构,破坏生物大分子活性位点,破坏核酸的分子结构或复制条件,影响、抑制和终止微生物生长代谢和繁殖过程,进而可以实现对生物细菌和病毒消毒的作用[10]。
表4列出了非水基洗消剂对生物细菌的杀菌效果评价实验结果。实验是将非水基洗消剂分别和典型的革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌在室温下培养1h,利用悬液定量杀菌分析方法进行其杀灭效率的评估。通过3次重复性实验,可以发现非水基洗消剂对大肠杆菌和金黄色葡萄球菌的杀菌率均>99.9999%。
|
|
表 4 非水基洗消剂对生物细菌的杀灭效果 Tab.4 The bactericidal effect of non-aqueous decontamination agent on bacteria |
表5给出了非水基洗消剂对生物病毒的灭活效果评价实验结果。实验是将非水基洗消剂分别和2种不同病毒甲型流感病毒H1N1和脊髓灰质炎病毒在室温下培养1h,利用病毒灭活分析方法进行其灭活效率的评估。经过3次重复性实验,可以发现非水基洗消剂对甲型流感病毒H1N1和脊髓灰质炎病毒的灭活率均≥99.99%。
|
|
表 5 非水基洗消剂对生物病毒的灭活效果 Tab.5 The inactivation effect of non-aqueous decontamination agent on virus |
以碱-醇-胺为消毒成分的非水基洗消剂,采用不同化学毒剂模拟剂和生物细菌、病毒的消毒效率作为考核指标,进行非水基洗消剂的洗消性能评价,并得到以下结论:
1)非水基洗消剂对G类毒剂模拟剂DMMP、V类毒剂模拟剂马拉硫磷和H类毒剂模拟剂CEES具有很好的广谱性消毒效能。化学消毒反应速率依次为马拉硫磷>DMMP>CEES。
2)非水基洗消剂对生物细菌大肠杆菌和金黄色葡萄球菌均具有>99.9999%的杀菌效率,展现了优异的灭菌性能。
3)非水基洗消剂对生物病毒甲型流感病毒H1N1和脊髓灰质炎病毒具有很高的病毒灭活效果,病毒灭活率≥99.99%。总之,非水基洗消剂是一种兼备生化消毒功能的广谱型消毒剂。因其易雾化、可操作性强等优势,有望被应用到船舶密闭舱空间消毒用途。
| [1] |
钱润生, 唐谋生, 张骧等. 舰船核化生防御技术[M]. 北京: 解放军出版社, 2005: 415–423.
|
| [2] |
WAGNER G W, PROCELL L R, SORRICK D C, et al. All-weather hydrogen peroxide-based decontamination of CBRN conterninants[J]. Industrial Engineering Chemical Research, 2010, 49 (7): 3099–3105.
|
| [3] |
YANG J X, ZUO G M, Qi L H, et al. Nucleophilic degradation of chemical warfare agents using nonaqueous decontamination formula[J]. Industrial Engineering Chemical Research, 2017, 56: 14933–14939.
|
| [4] |
YANG Y C, BAKER J A, WARD J R. Decontamination of chemical warfare agents[J]. Chemical Reviews, 1992, 92: 1729-1743. DOI:10.1021/cr00016a003 |
| [5] |
唐金库, 过氧化氢泡沫洗消剂实验[J]. 舰船科学技术, 2010, 32(12): 84–87. TANG J K. Experiment research on foam decontaminant of hydrogen peroxide[J]. Ship Science and Technology, 2010, 32(12): 84–87. |
| [6] |
程振兴, 王连鸳, 朱海燕, 等. 核生化洗消剂及应用[M] 北京: 清华大学出版社, 2018: 6–13.
|
| [7] |
BAE S Y, WINEMILLER M D. Mechanistic insights into the hydrolysis of 2-chloroethyl ethyl sulfide: the expanded roles of sulfonium salts[J]. Journal Orgauic Chemical, 2013, 78(13): 6457–6470.
|
| [8] |
WAGNER G W, SORRICK D C, PROCELL L R, et al. Decontamination of VX, GD, and HD on a surface using modified vaporized hydrogen peroxide[J]. Langmuir, 2007, 23: 1178-1186. DOI:10.1021/la062708i |
| [9] |
QI L H, ZUO G M, ChENG Z. X et al. Oxidative degradation of chemical warfare agents in water by bleaching powder[J]. Water Science Technology, 2012, 66: 1377–1383.
|
| [10] |
RUSSELL A D. Mechanisms of antimicrobial action of antiseptics and disinfectants: an increasingly important area of invetigation[J]. Journal of Antimicrobial Chemotherapy, 2002, 49(4): 597–599.
|
 2023, Vol. 45
2023, Vol. 45
