2. 武汉第二船舶设计研究所,湖北 武汉 430205
2. Wuhan Second Ship Design and Research Institute, Wuhan 430205, China
舱室污染是指潜艇舱室空气中污染物质的浓度达到有害程度,以致造成对艇员和武器装备危害的现象。由于潜艇自身的结构复杂,空间较小,存在人员活动,需要在水下长时间航行等,导致了潜艇舱室内的空气污染具有很强综合性、长久性、人为性和扩散性。建造潜艇所使用的艇体材料、艇内各种复杂多样的仪器设备的运转,以及众多艇员的活动,使得舱室中的有害污染物多达上千种[1]。
潜艇舱室内的污染物主要可分为无机污染物、挥发性有机污染物和气溶胶(油雾)三大类。其中,无机污染物主要包括CO2,SO2,NO2,H2,CO,O3,C12,H2S,HCl,氟利昂,HF,AsH3,NH3等。这些有害污物气体达到一定浓度后,会对艇员和设备带来不同程度的影响和危害,进而影响潜艇的战斗力。因此舱室空气处理技术成为各国海军的研究重点,在当今和未来战争中具有举足轻重的作用[2]。
无机污染物数量虽然比有机污染物的种类少很多,其影响也不容易忽视。一般来说,它们造成危害的程度与其浓度和对人体作用的时间长短有关。CO2对人的中枢神经具有一定的刺激兴奋作用,作为密闭空间内对人体生命和潜艇安全具有影响意义的常量气体[3],主要来源于艇员的呼吸排放,其释放同时具有持续性和间歇性的特点,应优先重点监测。NOx,SO2和H2S三种气体均对人体呼吸道具有刺激作用,会影响人的呼吸作用,对艇员的健康造成一定的损害。其中,NOx污染的释放源较多,主要来源于有害气体燃烧装置废气、导弹中氧化剂的泄漏、胺吸收液过热分解等,静电滤尘器等电火花式器材也会产生一部分。SO2主要来源于厕所和柴油机废气,部分也来源于非金属材料,如电缆绝缘材料、油漆、滑油、粘结剂等的挥发、老化分解。H2S主要来源于人体排泄物所挥发的臭气中,如人体呼出的气体、皮肤表面排泄的汗液、尿液、粪便等。
因此,在各类无机气体污染物中,本文依据其浓度以及对人体健康的影响程度等因素(见表1),针对几种主要的废气(CO2)或污染物(NOx,SO2和H2S),对其净化处理技术的发展历程及研究现状进行综述。通过学习现有净化技术,加深对环境控制方法的了解,为今后潜艇舱室环境净化技术的优化改进提供一定的指导。
|
|
表 1 潜艇舱室应该优先监测的几种无机气体污染物种类及依据 Tab.1 Types and principles of prior-testing inorganic gas pollutants in submarine cabin |
CO2捕获技术的关键点是富集效率问题,如何快速地将CO2迅速富集起来集中处理是目前急需解决的问题。现有的CO2捕获方法主要有2条技术路线:预处理,从上游气化装置改造后的合成气中捕集;后处理,从燃烧后的烟气中捕集CO2。目前的CO2捕集分离技术主要包括吸附剂捕获法、溶剂捕获法和膜捕获法,捕集机理取决于捕集方法或捕集材料的化学性质。
1.1 吸附剂捕获法目前已经研究了多种材料通过化学反应和物理吸附,用作CO2吸附剂。广泛包括碱石灰、活性炭、沸石、分子筛、碱金属氧化物、氧化银、氧化锂、硅酸锂、碳酸盐、硅胶、氧化铝、胺固体、金属有机框架等。例如,最早在1931年的专利GB341748[4]中,固体碱碳酸盐在蒸汽存在下,以常压或高压的条件下去除CO2。碳酸盐与浮石等惰性载体混合或分布在其上。吸附剂通过在真空中加热到220 ℃进行再生,或者可以在180 ℃下通过氨水混合物生成碳酸铵进行升华,除去杂质进行再生。
1.2 溶剂捕获法最简单的CO2溶剂捕获方法是高压下用水冲洗吸收。当压力降低到环境压力时,CO2从水中排出,因此水可以通过变压再生。最早的此类专利之一是1929年出版的专利GB286622[5],其中CO2在压力下被水吸收并随后再生。然而,水对CO2的洗涤吸收效率较低。因此,许多改进的溶剂技术也随之发展起来。例如,相关的碱金属材料、空间受阻胺、氨基酸和离子液体的技术已经有报道。近年来,空间受阻胺作为新型烷醇胺吸附剂的研究正在蓬勃开展。其中,Guido[6]通过将气体混合物与胺水溶液接触的过程来完成CO2去除,其中至少一种胺是空间受阻胺,如2-氨基-2-甲基-1-丙醇。
1.3 膜捕获法膜分离法可以被认为是一种仿生方法,几乎所有生物系统中的分离过程都是通过膜进行的。膜分离本质上能量有效,然而,在膜材料选择和膜设计中存在有效CO2分离的挑战。聚合物膜和复合膜已经发展起来。专利JP61133118[7]公开了一种CO2分离膜,其包含具有优异的耐热性和耐化学性以及优异的CO2分离性能的聚酰亚胺。William[8-9]和Stephen等[10]描述了在聚合物基质中加入多孔和分子筛实体以提高CO2的去除效率。特殊尺寸和形状的选择性分子筛(如沸石)的加入可显著提高膜的整体选择性,因为它们能够在聚合物基质中区分渗透剂。由此看出,混合基质膜的选择性远高于单独使用纯聚合物作为膜所能达到的选择性。
2 NOx的净化氮氧化物(主要是NO)也是导致许多环境问题的主要大气污染物之一。NO催化氧化到NO2被认为是NOx消除的关键步骤。近几十年来,已经开发了多种NO氧化催化剂用于可能的应用,其可分为4类,即负载型(包括贵金属和金属氧化物)、多金属氧化物、钙钛矿型和碳基催化剂。
迄今为止,贵金属催化剂,特别是铂催化剂已成为NO氧化的催化剂,具有优异的催化性能。金属氧化物催化剂具有成本低、催化活性高、稳定性好等优点,越来越受到人们的关注。通过与其他金属氧化物的掺杂,贵金属或金属氧化物已被证明是增强催化活性,这是由于协同效应。碳基催化剂在常温NO氧化中也有广阔的应用前景。
2.1 负载型催化剂对于负载型催化剂(包括贵金属和金属氧化物),活性组分主要存在于催化剂表面。这些载体提供了一个巨大的表面来分离活性相,并提供催化反应发生的场所。主要可分为负载型贵金属催化剂和负载型金属氧化物催化剂。
1)负载型贵金属催化剂
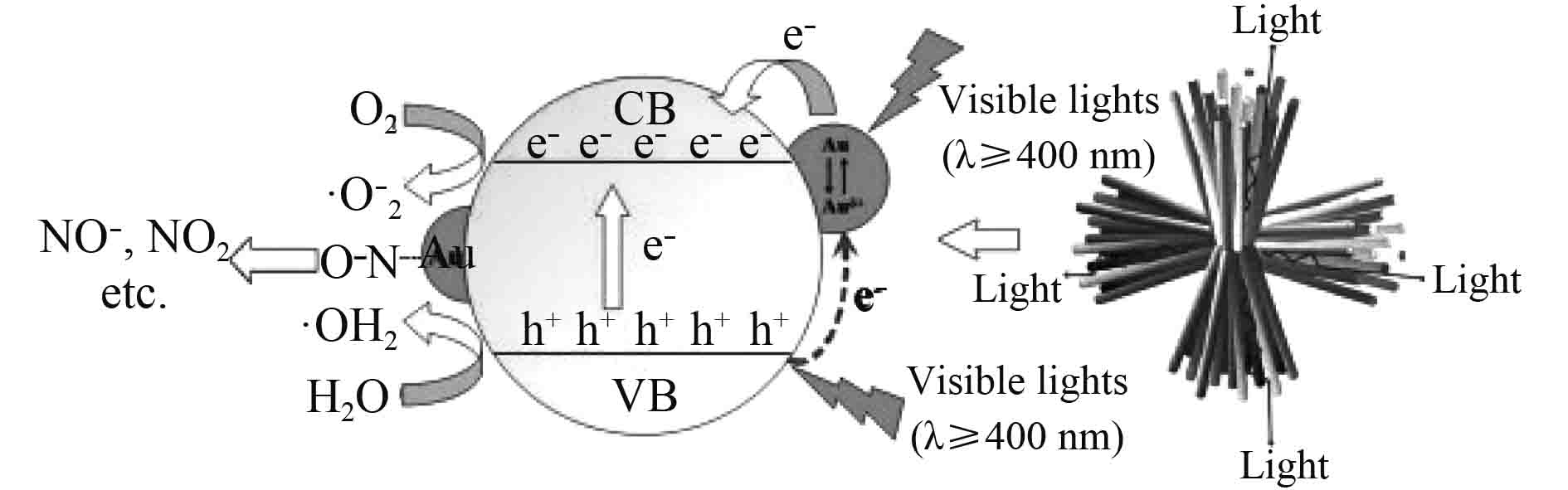
铂催化剂由于其优异的活性和使用寿命,是单一贵金属的首选催化剂活性组分。在不同的组分下,Pt催化剂已经被广泛地应用于各个领域[11-12]。在早期的研究中,TiO2被证明是一种优良的催化剂载体,并且在许多非均相催化反应中显示出较好的活性。Li等[13]通过湿浸渍和光沉积方法制备了Pt/TiO2催化剂。在这些催化剂中,经H2/He气预处理的Pt/TiO2的活性高于经O2/He预处理的样品,而经O2/He预处理的Pt/TiO2的活性略高于经H2/He预处理的样品。其他贵金属也被研究用作单金属催化剂。Nalula等[14]证实,在354 ℃下,单原子Pd负载在α-Al2O3(010)表面上仅表现出17%的NO转化,并且催化剂上没有硝酸盐生成,证明该催化剂对NO催化氧化作用是不活泼的。Zhang等[15]开发了一种新型的Au/TiO2可见光催化剂,Au纳米粒子均匀分散在金红石型TiO2纳米棒束上。由于金量子点和TiO2纳米棒的协同促进作用,该Au/TiO2在光催化NO氧化中表现出高活性和强耐久性,可以产生光电子从而活化NO分子、降低光电子-空穴复合和稳定金量子点。由于协同促进作用,催化剂在可见光诱导的光催化NO氧化反应中表现出良好的活性和耐久性,其作用机理如图1所示。
|
图 1 可见光催化氧化Au/TiO2氧化NO的可能机理 Fig. 1 The possible mechanism of NO visible-light catalytic oxidation on Au/TiO2 |
2)负载型金属氧化物催化剂
虽然贵金属展示出相当大的催化活性,但高昂的成本很大程度上限制了其应用推广。此外,在强氧化条件下负载贵金属的活性损失仍不清楚。而负载型金属氧化物催化剂具有成本低、催化活性高、稳定性好等优点,越来越受到人们的关注。如以Al2O3为载体:Al2O3是一种理想的氧化物催化剂载体,具有良好的热稳定性、比表面积和酸性位点多等优点,有利于氮的吸附[16];以TiO2为载体:与Al2O3相比,TiO2的酸性较小,但它可以为活性成分提供良好分散性和抗SO2性,硫酸盐物种可在TiO2表面容易分解[17];以ZrO2为载体:ZrO2是一种有趣的载体材料,由于其表面的双功能性、酸碱性,能显著提高负载型金属催化剂的活性。
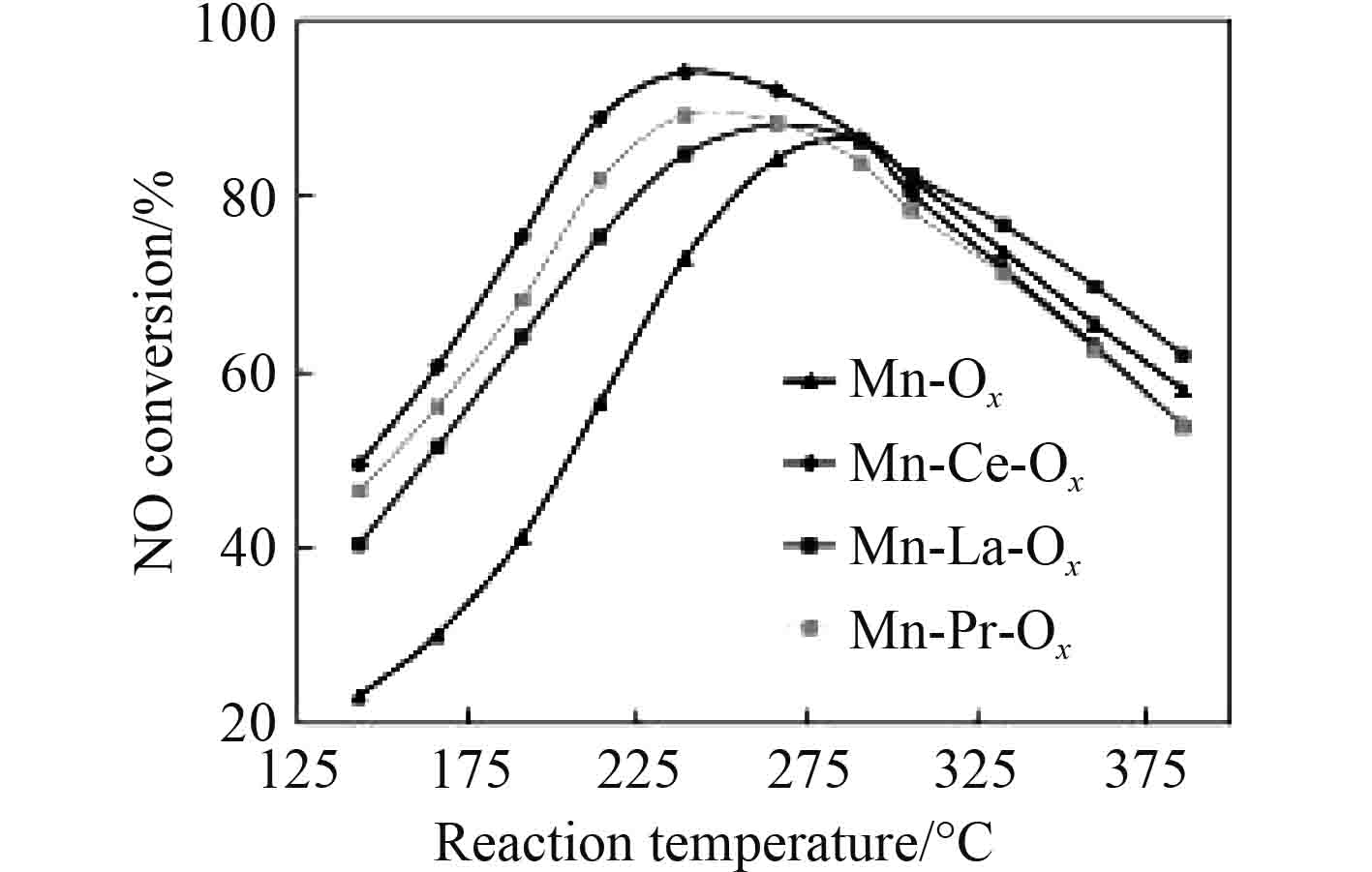
2.2 多金属氧化物催化剂多金属氧化物催化剂中不同助剂的协同作用可以提高催化剂的催化性能。Mn在多种金属氧化物催化剂中具有复杂的价态和良好的活性,CeO2因其储氧和氧化还原性质而被广泛研究。Sun等[18]研究了稀土金属(Ce,La,或Pr)掺杂的Mn基催化剂对NO氧化的促进作用(见图2)。发现所有催化剂的NO转化率均随温度升高而先升高后下降,其原因是NO的催化氧化是一种放热反应。该转化反应在低温时受动力学控制,而在高温时受热力学控制。掺杂稀土金属在一定程度上提高了氧化效率,Mn-Ce-Ox样品对NO的催化活性最高。氧化效率依次为Mn-Ce-Ox >Mn-Pr-O x > Mn-La-O x > Mn-O x。
|
图 2 不同稀土金属掺杂的Mn基催化剂上对NO的氧化活性 Fig. 2 The catalytic activity of Mn-based catalysts doping rare earth elements |
如上所述,多金属氧化物作为催化剂时由于其在低温下的高催化活性而被广泛研究。不同的掺杂剂对催化剂的催化活性有不同的影响。通常,Mn-CeOx和Co-CeOx催化剂与上述催化剂中的其他多金属氧化物相比,具有最高的NO氧化活性。
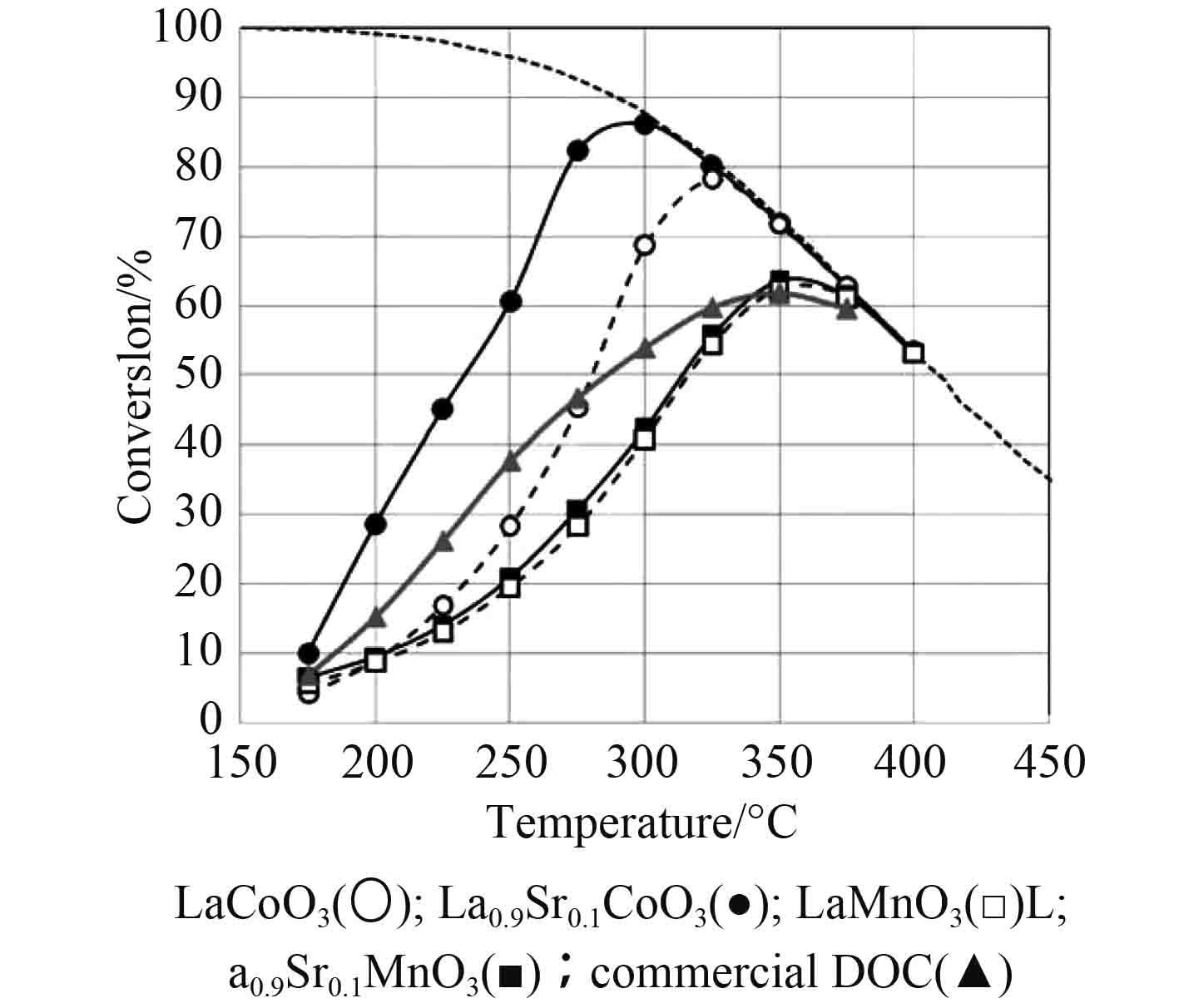
2.3 钙钛矿型催化剂近年来,钙钛矿型氧化物用于催化剂引起了学者的兴趣,因为钙钛矿易获得,成本低,具有良好的活性和热稳定性[19-20]。Kim等[21]发现Sr掺杂钙钛矿催化剂(La0.9Sr0.1CoO3)与Pt基催化剂相比具有优异的NO氧化活性,在300 ℃下,NO的转化率最大,约为86%,结果如图3所示。
|
图 3 相同条件下不同催化剂对NO的氧化活性 Fig. 3 The catalytic activity of different NO oxidation catalysts in the same reaction condition |
碳基催化剂,如活性炭纤维(ACFs),由于其吸附、催化、氧化还原性能和酸性位点多等优点,被认为是一种良好的NO氧化物催化剂[22-25]。Mochida等[26]发现湿度对沥青活性炭纤维的活性有抑制作用。在干燥空气中,NO在室温下的转化率可达87%,而在相对湿度为80%的空气中的转化率则降至62%。因此,推断沥青活性炭纤维对NO的吸附可能受到湿度的限制,最终抑制NO氧化的催化活性。
3 SO2的净化SO2也是空气环境主要污染物之一。从废气中去除SO2的技术有很多。有些是商用的,有些还属于实验室水平。其主要可以分为5类:湿法洗涤、干法吸附、电子束、电化学催化法和电脉冲法。
3.1 湿法洗涤采用吸收式湿法洗涤工艺,可同时去除SO2和NOx。湿法洗涤过程中使用的吸收剂有NaOH,Na2SO3,Ca(OH)2,NH4OH,Mg(OH)2等。商用上最常用的去除SO2方法是烟气脱硫法,它通过与石灰或石灰石反应而起作用[27]。这些技术仅常被用来去除低浓度的含SO2有害废气。水吸收不是一种非常有效的方法,因为NO在水中的溶解度很低。这意味着需要加入一些添加剂如H2O2,HClO2等用于氧化络合(亚铁螯合物)或还原NO[28]。目前的研究旨在找出新的吸收溶液或添加剂,并且这些吸收溶液或添加剂的成本不能太高。
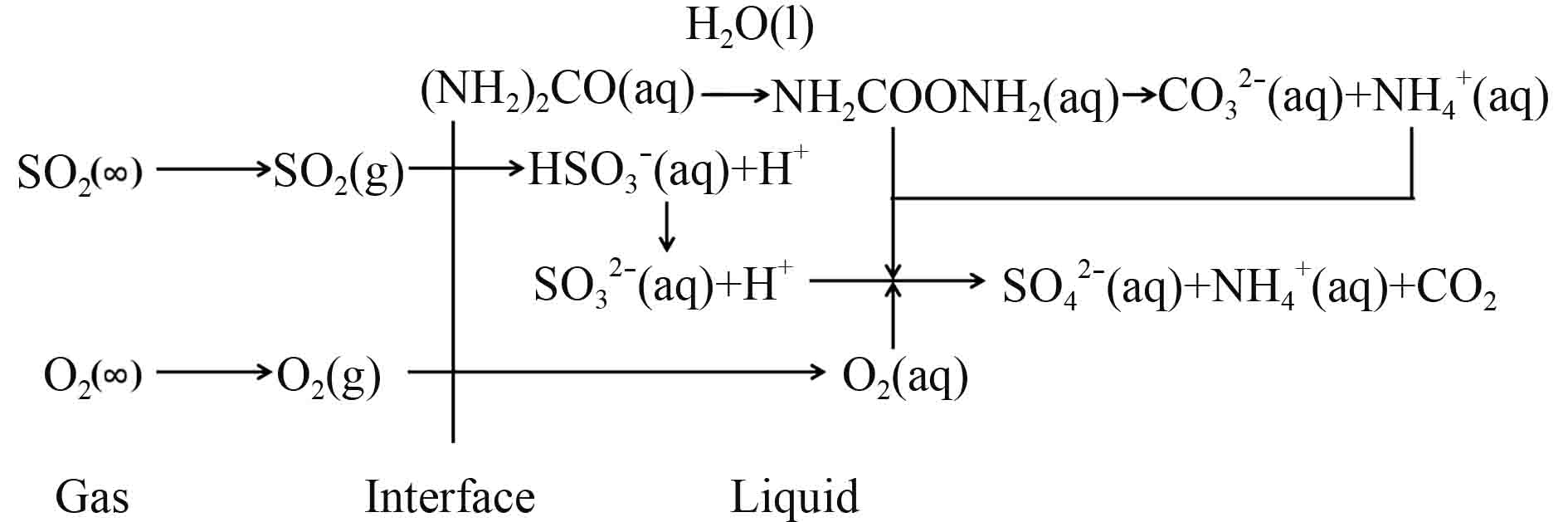
近年来,该方向的研究主要集中在用含有尿素的溶液吸收SO2[29-30],这是一种多成分吸收剂组成的低成本吸收液,如图4所示。尿素无毒低价,可以很容易地得到。湿法洗涤技术的优势在于,它可以在较低的环境温度下进行,并且对烟气高负荷适应性强。此外,因为无催化剂意味着不会发生催化中毒或失活的现象。然而,这个过程产生大量的液体废物。有些废物是可回收的,但有的剩余废物需要大量的运输和储存。总的来说,新化合物的使用和工艺的改进很容易净化初始浓度较高的SO2废气。然而从商用价值上来说,一些技术没有足够高的去除效率和较低的成本导致难以推广。
|
图 4 SO2在尿素溶液中吸收的反应机理 Fig. 4 The reaction mechanism of SO2 dissolution in urea solvent |
干法吸附过程主要用于从多组分气体中清除SO2。近几年来,已经研究开发了多种针对各种废气的吸附剂[31-34]。吸附是一种干燥方法,不会产生任何液体废物。在优化的条件下,当污染物的浓度很高时,可以实现较高的吸附净化效率。该方法的优点是所需设备简单,操作方便,缺点是技术成本高,使用的设备体积庞大。
3.3 电子束电子束(EB)是一种非常有前途的新技术,在环境保护领域不断发展[35]。20世纪70年代初,日本首先对脱硫工艺进行了示范,后来又开发出可同时脱除SO2和NOx的脱硫工艺。SO2的去除要比NO容易得多,因为它比NOx的去除需要更少的能量(即更低的剂量)。Calinescu等[36]发现,由于反应介质密度较高,水雾的增加提高了SO2和NOx的去除效率。此外,废气中SO2浓度的增加会同时提高NO去除效率。
3.4 电化学催化法电化学催化发(ECC)对不同条件下高浓度SO2的净化处理具有明显的优势,其电催化电池的原理如图5所示。Huang等[37]的研究表明,即使对于非常高的SO2浓度(例如3000 ppm),SO2转化率也很高(该规则仅适用于较高的SO2浓度范围)。ECC技术的另一个优点是它还能够去除碳氢化合物、碳氧化物(CO)和颗粒物质。ECC技术正处于发展的初级阶段,还需要大量的优化和研究。然而,这是一种很有前途的方法。这一过程的最大优点是还原剂在ECC过程中不消耗。同时,ECC技术去除高浓度NOx的能力也明显有利于该技术的推广应用。
|
图 5 电催化电池的原理图 Fig. 5 The scheme of electro-catalysis cell |
除了上述方法之外,目前一些学者利用脉冲电晕放电、介质阻挡放电和射频放电产生的非热等离子体对高浓度SO2的去除进行了研究。脉冲电晕放电是在快速上升的窄高压脉冲作用下非均匀电极时产生的放电[38],并在此过程中产生高能电子(5~10 eV)。脉冲电晕放电对NO和SO2的去除可分为3个阶段。在第1阶段,自由基的形成是由于电子与中性分子的直接离解作用。第2阶段是激发氧原子和环境气体分子之间的快速反应,产生额外的自由基。在最后阶段,NO和SO2分子与自由基发生反应,自由基将这些污染物清除[39, 40]。
与EB法相似,电晕放电过程可以优化,以获得更高的SO2和NOx去除效率。Wu等[41]研究了电晕放电法去除高浓度SO2(2000~2400 ppm)的效果。结果表明,通过引入一些改进措施,如降低杂散电感和/或调节相对湿度,SO2的去除率可提高到75%~80%。然而,大多数研究也都强调了电晕放电法过程的能耗非常高,需要进一步的改进和优化,才能成为一种可行的工业应用方法。
4 H2S的净化从环境角度来看,将环境空气中的硫化氢浓度含量限制在极低水平是非常重要的。在许多环境气体控制过程中,越来越看重低温脱硫工艺。处理H2S的传统工艺主要包括低温(298~373 K)下的吸附、洗涤和生物处理[42]等。这些处理技术既有优点也有缺点。其中,生物处理对硫化氢的去除较为高效,同时也降低了操作、化学和能源成本。但是,生物处理需要比工艺需要更高的设备成本。吸收液和膜工艺尽管能够通过再生工艺进行多次使用,但还是需要大量的资金和能源成本[43]。相比而言,干法吸附法是一种更有效、更环保、更经济的方法[44]。
在H2S干法吸附脱除过程中,已经开发了若干种类型的吸附剂,如金属氧化物、活性炭和沸石等。这些多孔材料通常用作吸附剂、分离介质或催化剂载体。其中活性炭具有很高的吸附能力去除硫化氢,但由于存在大量微孔,活性炭缺乏低的机械稳定性,从而导致高弯曲度和在操作过程中形成细颗粒[45]。主流金属氧化物吸附剂采用Zn,Cu,Co,Fe,Ce,Mo,Mn,Sn,W和Ni等金属氧化物去除H2S,其中MoOx和WOx具有较高的脱硫潜力,但由于碳化物的形成,其温度范围受到限制[46]。West Maland[47]在研究金属氧化物(包括Fe,Zn,Cu,Ca,Mn和Mo)的过程中,在高于300 ℃的温度下进行H2S脱除,而ZnO具有高的硫捕获能力。根据热力学分析,因为高温再生导致其表面积减少。用于捕获分子的沸石被称为多孔分子筛。沸石作为一种广泛应用的H2S脱除吸附剂,具有良好的载硫能力、良好的再生性和稳定的结构,且再生容易,成本低。天然沸石合成沸石相比具有较高的吸附容量。沸石可以通过金属或金属氧化物进行改性,以提高其吸附容量。Melo等[48]以13X沸石为吸附剂脱除天然气中的H2S。实验发现H2S脱除率取决于材料的干燥程度或活化程度。13X沸石的比表面积为16.15 m2/g,适合于天然气中H2S的吸附。
5 结 语潜艇舱室环境空气质量是环境控制评价的一个重要方面,对艇员的健康产生直接影响。通过依次对舱室环境中4种主要的无机气体污染物CO2,NOx,SO2和H2S的净化处理技术进行阐述分析,对舱室环境空气无机污染物的处理技术有了整体的了解与把握,为舱室环境空气净化处理技术的发展提供一定的指导。
| [1] |
史德, 苏广和, 李震. 潜艇舱室空气污染与治理技术[M]. 北京: 国防工业出版社, 2005.
|
| [2] |
王朋辉, 倪伟, 颜欢, 等. 潜艇舱室空气处理技术研究进展[J]. 船舶工程, 2015, 37(12): 1-4. |
| [3] |
DIBBEN P R, NICHOLSON G. Managing air quality and setting exposure limits for RN submarines[R]. SAE Technical Paper, 2000.
|
| [4] |
GB341748. Process for the absorption of carbon-dioxide from gases and vapors[P]. 1931.
|
| [5] |
GB286622. Process for removing readily absorbed gases, more particularly carbon dioxide and sulphuretted hydrogen, from gas mixtures by absorption in water under pressure[P]. 1929.
|
| [6] |
US4112052. Process for removing carbon dioxide containing acidic gases from gaseous mixtures using aqueous amine scrubbing solutions[P]. 1978.
|
| [7] |
JP61133118. Polyimide membrane for gas separation[P]. 1986.
|
| [8] |
US6503295. Gas separations using mixed matrix membranes[P]. 2003.
|
| [9] |
US6562110. Carbon molecular sieves and methods for making the same[P]. 2003.
|
| [10] |
US7306647. Mixed matrix membrane with mesoporous particles and methods for making and using the same[P]. 2007.
|
| [11] |
JI Y, TOOPS T J, GRAHAM U M, et al. A kinetic and DRIFTS study of supported Pt catalysts for NO oxidation[J]. Catalysis Letters, 2006, 110(1-2): 29-37. DOI:10.1007/s10562-006-0100-4 |
| [12] |
DEBEILA M A, COVILLE N J, SCURRELL M S, et al. The effect of calcination temperature on the adsorption of nitric oxide on Au-TiO2: Drifts studies
[J]. Applied Catalysis A General Catalysis by Gold, 2005, 291(1–2): 98-115. |
| [13] |
LI L, SHEN Q, CHENG J, et al. Catalytic oxidation of NO over TiO2 supported platinum clusters I. Preparation, characterization and catalytic properties
[J]. applied catalysis b environmental, 2010, 93(3–4): 259-266. |
| [14] |
NARULA C K, ALLARD L F, WU Z. Ab initio density functional calculations and Infra-Red study of CO interaction with Pd atoms on θ-Al2O3(010) surface
[J]. Scientific Reports, 2017, 7(1): 6231. DOI:10.1038/s41598-017-06405-7 |
| [15] |
ZHANG D, WEN M, ZHANG S, et al. Au nanoparticles enhanced rutile TiO2 nanorod bundles with high visible-light photocatalytic performance for NO oxidation
[J]. Applied Catalysis B Environmental, 2014, 147: 610-616. DOI:10.1016/j.apcatb.2013.09.042 |
| [16] |
WANG P, LUO P, YIN J, et al. Evaluation of NO oxidation properties over a Mn-Ce/γ-Al2O3 Catalyst
[J]. Journal of Nanomaterials, 2016(1): 1-5. |
| [17] |
LI X, ZHANG S, JIA Y, et al. Selective catalytic oxidation of NO with O2 over, Ce-doped MnOx/TiO2 catalysts
[J]. Journal of Natural Gas Chemistry, 2012, 21(1): 17-24. DOI:10.1016/S1003-9953(11)60327-7 |
| [18] |
SUN Y, ZHONG S, XIN H, et al. Enhancement in oxidative property on amorphous rare earth doped Mn catalysts[J]. Catalysis Communications, 2016, 77: 94-97. DOI:10.1016/j.catcom.2016.01.018 |
| [19] |
ZIAEI-AZAD H, KHODADADI A, ESMAEILNEJAD-AHRANJANI P, et al. Effects of Pd on enhancement of oxidation activity of LaBO3(B=Mn, Fe, Co and Ni) pervoskite catalysts for pollution abatement from natural gas fueled vehicles
[J]. Applied Catalysis B Environmental, 2011, 102(1–2): 62-70. |
| [20] |
ESMAEILNEJAD-AHRANJANI P, KHODADADI A, ZIAEI-AZAD H, et al. Effects of excess manganese in lanthanum manganite perovskite on lowering oxidation light-off temperature for automotive exhaust gas pollutants[J]. Chemical Engineering Journal, 2011, 169(1–3): 282-289. |
| [21] |
KIM C H, QI G, DAHLBERG K, et al. Strontium-doped perovskites rival platinum catalysts for treating NOx in simulated diesel exhaust
[J]. Science, 2010, 327(5973): 1624-1627. DOI:10.1126/science.1184087 |
| [22] |
WANG W, MCCOOL G, KAPUR N, et al. Mixed-phase oxide catalyst based on Mn-mullite (Sm, Gd)Mn2O5 for NO oxidation in diesel exhaust
[J]. Science, 2012, 337(47): 832-835. |
| [23] |
MIYAWAKI J, SHIMOHARA T, SHIRAHAMA N, et al. Removal of NOx from air through cooperation of the TiO2 photocatalyst and urea on activated carbon fiber at room temperature
[J]. Applied Catalysis B Environmental, 2011, 110: 273-278. DOI:10.1016/j.apcatb.2011.09.012 |
| [24] |
DING J, ZHONG Q, ZHANG S, et al. Simultaneous removal of NOx and SO2 from coal-fired flue gas by catalytic oxidation-removal process with H2O2[J]. Chemical Engineering Journal, 2014, 243: 176-182. DOI:10.1016/j.cej.2013.12.101 |
| [25] |
SHEN W, FAN W. Nitrogen-containing porous carbons: synthesis and application[J]. Journal of Materials Chemistry A, 2013, 1(4): 999-1013. DOI:10.1039/C2TA00028H |
| [26] |
MOCHIDA I, SHIRAHAMA N, KAWANO S, et al. NO oxidation over activated carbon fiber (ACF). Part 1. Extended kinetics over a pitch based ACF of very large surface area[J]. Fuel, 2000, 79(14): 1713-1723. DOI:10.1016/S0016-2361(00)00034-X |
| [27] |
SRIVASTAVA R K, JOZEWICZ W. Flue gas desulfurisation: the state of the art[J]. Journal of Air and Waste Management Association, 2001(51): 1676-1688. |
| [28] |
GUO L, SHU Y, GAO J. Present and future development of flue gas control technology of deNO_X in the world[J]. Energy Procedia, 2012, 17: 397-403. DOI:10.1016/j.egypro.2012.02.112 |
| [29] |
FANG P, CEN C, TANG Z, et al. Simultaneous removal of SO2 and NOx by wet scrubbing using urea solution
[J]. Chemical Engineering Journal, 2011, 168(1): 52-59. DOI:10.1016/j.cej.2010.12.030 |
| [30] |
WEI J, LUO P, YU P, et al. Removal of NO from flue gas by wet scrubbing with NaClO2/(NH2)2CO solutions
[J]. Journal of Industrial and Engineering Chemistry, 2009, 15(1): 16-22. DOI:10.1016/j.jiec.2008.07.010 |
| [31] |
ATANES E, NIETO-MARQUEZ A, Cambra A, et al. Adsorption of SO2 onto waste cork powder-derived activated carbons
[J]. Chemical Engineering Journal, 2012, 211–212: 60-67. |
| [32] |
DAHLAN I, LEE K T, KAMARUDIN A H, et al. Selection of metal oxides in the preparation of rice husk ash (RHA)/CaO sorbent for simultaneous SO2 and NO removal
[J]. Journal of Hazardous Materials, 2009, 166(2–3): 1556-1559. |
| [33] |
LAU L C, LEE K T, MOHAMED A R. Simultaneous SO2 and NO removal using sorbents derived from rice husks: An optimisation study
[J]. Fuel, 2011, 90(5): 1811-1817. DOI:10.1016/j.fuel.2010.12.009 |
| [34] |
SUMATHI S, BHATIA S, LEE K T, et al. Cerium impregnated palm shell activated carbon (Ce/PSAC) sorbent for simultaneous removal of SO2 and NO-Process study
[J]. Chemical Engineering Journal, 2010, 162(1): 51-57. DOI:10.1016/j.cej.2010.04.056 |
| [35] |
CHMIELEWSKI A G. Industrial applications of electron beam flue gas treatment-From laboratory to practice[J]. Radiation Physics and Chemistry, 2007, 76: 1480-1484. DOI:10.1016/j.radphyschem.2007.02.056 |
| [36] |
CALINESCU I, MARTIN D, CHMIELEWSKI A, et al. E-Beam SO2 and NOx removal flue gases in the presence of fine water droplets
[J]. Radiation Physics and Chemistry, 2013, 85: 130-138. DOI:10.1016/j.radphyschem.2012.10.008 |
| [37] |
HUANG T J, WANG C H. Effect of temperature and NOx concentration on nitric oxide removal from simulated lean-burn engine exhaust via electrochemical-catalytic cells
[J]. Chemical Engineering Journal, 2011, 173(2): 530-535. DOI:10.1016/j.cej.2011.08.030 |
| [38] |
MOK Y S, HAM S W. Conversion of NO to NO2 in air by a pulsed corona discharge process
[J]. Chemical Engineering Science, 1998, 53: 1667-1678. DOI:10.1016/S0009-2509(97)00441-7 |
| [39] |
MOK Y S, NAM I S. Modeling of pulsed corona discharge process for the removal of nitric oxide and sulfur dioxide[J]. Chemical Engineering Journal, 2002, 85(1): 87-97. DOI:10.1016/S1385-8947(01)00221-2 |
| [40] |
VINOGRADOV J, RIVIN B, SHER E. NOx reduction from compression ignition engines with pulsed corona discharge
[J]. Energy, 2008, 33(3): 480-491. DOI:10.1016/j.energy.2007.06.004 |
| [41] |
WU Y, WANG N, ZHU Y, et al. SO2 removal from industrial flue gases using pulsed corona discharge
[J]. Journal of Electrostatics, 1998, 44(1–2): 11-16. |
| [42] |
GABRIEL D, DESHUSSES M A. Retrofitting existing chemical scrubbers to biotrickling filters for H2S emission control
[J]. Proceedings of the National Academy of Sciences, 2003, 100(11): 6308-6312. DOI:10.1073/pnas.0731894100 |
| [43] |
BANDOSZ T J. On the adsorption/oxidation of hydrogen sulfide on activated carbons at ambient temperatures[J]. Journal of Colloid and Interface Science, 2002, 246(1): 1-20. DOI:10.1006/jcis.2001.7952 |
| [44] |
BAGREEV A, RAHMAN H, BANDOSZ T J. Thermal regeneration of a spent activated carbon previously used as hydrogen sulfide adsorbent[J]. Carbon, 2001, 39(9): 1319-1326. DOI:10.1016/S0008-6223(00)00266-9 |
| [45] |
NHUT J M, VIEIRA R, PESANT L, et al. Synthesis and catalytic uses of carbon and silicon carbide nanostructures[J]. Catalysis Today, 2002, 76(1): 11-32. DOI:10.1016/S0920-5861(02)00206-7 |
| [46] |
ELSEVIERS W F, VERELST H. Transition metal oxides for hot gas desulphurisation[J]. Fuel, 1999, 78(5): 601-612. DOI:10.1016/S0016-2361(98)00185-9 |
| [47] |
WESTMORELAND P R, HARRISON D P. Evaluation of candidate solids for high-temperature desulfurization of low-Btu gases[J]. Environmental Science and Technology, 1976, 10(7): 659-661. DOI:10.1021/es60118a010 |
| [48] |
MELO D M A, SOUZA J R D, MELO M A F, et al. Evaluation of the zinox and zeolite materials as adsorbents to remove H2S from natural gas
[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 272(1–2): 32-36. |
 2020, Vol. 42
2020, Vol. 42
