氯酸盐因其储氧密度高、产氧速率快并且易于储存的特点,在一些地下水下作业和航空航天等密闭场所有所应用[1 – 2],尤其在潜艇方面,应急用的氧烛提供高效、可靠的氧气必不可少。LiClO4含氧量为60.09%,LiClO4单位质量含氧量高出目前氧烛广泛应用的NaClO330%,且其分解过程中的产热更少[3],分解完全后气相产物仅含氧气,但其分解温度偏高,研究促其分解的催化剂对将来的应用有很重要的帮助。
Rudloff Winfried K等[4]在研究KClO3和KClO4的分解过程中得出结论,P型半导体的金属氧化物活性优于N型半导体的金属氧化物,现有研究分解高氯酸钾和高氯酸锂的催化剂有镍粉、Fe2O3, CuO, Cr2O3, Co2O3, MnO2, TiO2[5 – 9]均符合这一理论,近些年也有研究以La, Ce为中心原子的钙钛矿型催化剂[10 – 11]。
考虑到LiCiO4的分步分解过程[3, 12],以及d轨道半充满对CIO3–催化分解的活性更高,为避免与前人工作重复,选用了Mn、Ni的氧化物作为催化剂,使用溶胶凝胶法最终制备了不同比例的MnxNi(1-x)O催化剂,之后用TG-DTA联合热重分析探究了不同比例的MnxNi(1-x)O对LiClO4的催化效果、分解速率及稳定性的影响,作为LiClO4分解用催化剂的补充与探索。
1 实验 1.1 实验试剂与仪器实验样品为上海中锂实业有限公司提供的无水LiClO4(99.5%);上海麦克林生化科技有限公司提供的Ni(NO3)2·6H2O(99.9%);50% Mn(NO3)2水溶液(99%);柠檬酸(99.9%);聚乙二醇(99.9%)。
催化剂制备使用的是DF-101S集热式恒温加热磁力搅拌器,热重分析使用的是SII纳米技术公司TG/DTA 7200型分析仪,球磨使用的是南京南大仪器厂QM-QX全方位行星式球磨机。
1.2 催化剂的制备本实验利用溶胶凝胶法制备催化剂,选用Mn、Ni的硝酸盐作为催化剂的前躯体,配置Ni:Mn=6:1,3:1,2:1,1:1,1:2,1:3,1:6于100 mL纯净水中,加入2倍Mn和Ni摩尔量的柠檬酸,在80 °C的水浴环境中反应8 h,之后将水凝胶置于100 °C烘箱中干燥12 h得到干凝胶,将干凝胶置于马弗炉中,升温0.5 h升至300 °C,保温0.5 h,再升温0.5 h升至400 °C,保温2 h,自然冷却至室温,将烧结后的催化剂置于球磨罐中,以200 Hz的频率球磨8 h,最终制得MnxNi(1-x)O催化剂。
1.3 热重分析在石英研钵中配比MnxNi(1-x)O催化剂质量分数为5%的热重样品,取20±2 mg样品放入铂金坩埚中,对其进行热重分析;实验起始温度为25±3 °C,结束温度为600 °C,升温速率10 °C/min,气体环境为氩气,流量200 mL/min。
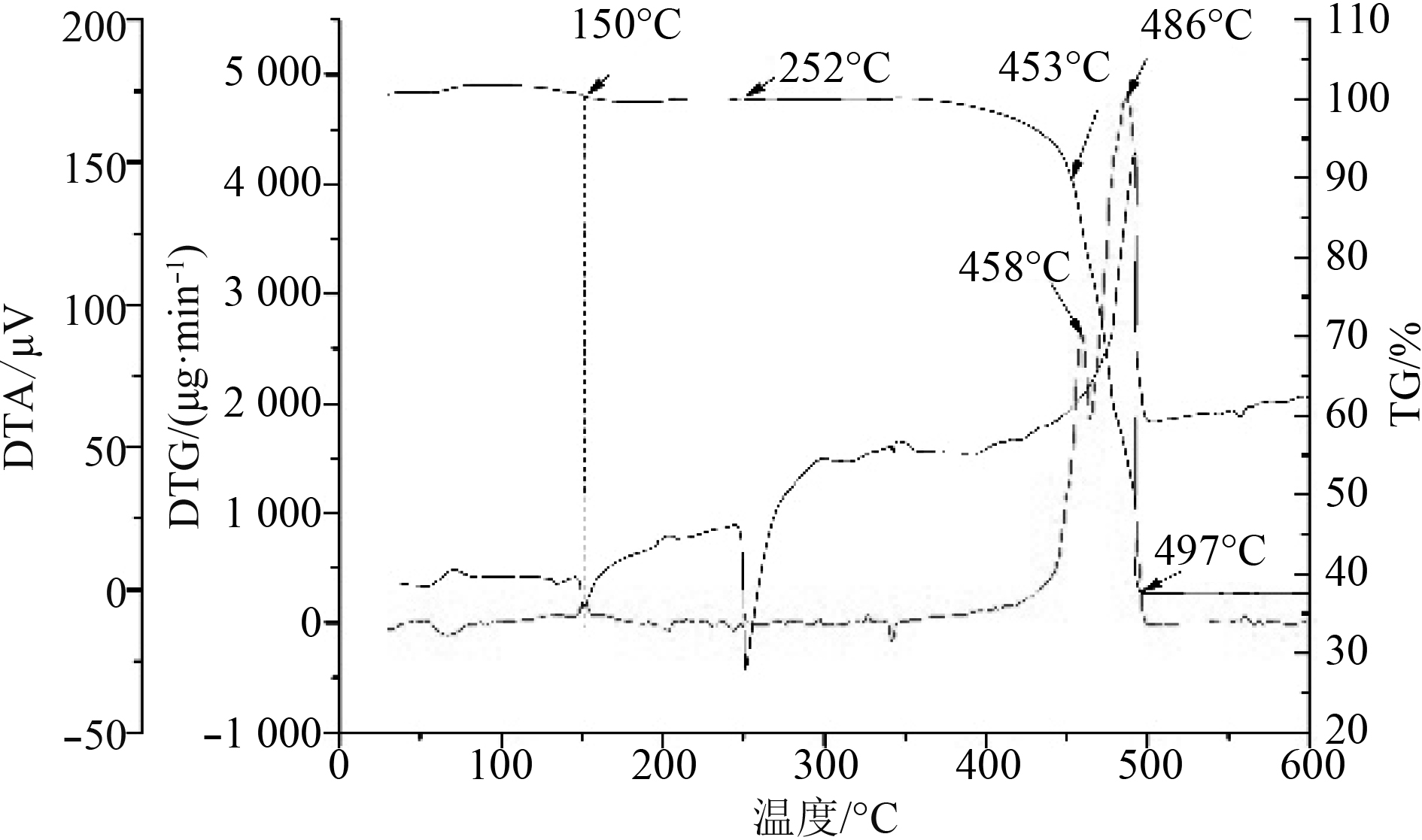
2 结果与讨论 2.1 纯LiClO4的分解过程如图1所示,纯LiClO4吸水性很强,有一个微量的增重过程,在150 °C出现失重和吸热过程,这是LiClO4失去结晶水的过程;在252 °C有个吸热过程,这是固态LiClO4熔化吸热过程。LiClO4的DTG曲线在失重率为10%处有明显的拐点,取此点为分解起始温度,其在453 °C开始分解,497 °C全部分解完全,分解率为63.2%,考虑到LiClO4的吸水性,符合式(1)的分解方程的理论产量;热解曲线平滑,随着温度升高,分解速度逐渐变快,在458 °C与486 °C分别达到2个峰值,可见LiClO4分解是分步进行,式(2)~式(6)可以基本表述此过程[12],式(2)和式(3)可以认为是LiClO4分解的决速步骤。
|
图 1 纯LiClO4分解的TG-DTA曲线 Fig. 1 TG-DTA curve of lithium perchlorate decomposition |
| $ {\rm{LiClO}}_4 \to {\rm{LiCl}} + {{\rm{O}}_2}{\text{,}} $ | (1) |
| $ 2 {\rm{ClO}}_4^ - \to 2 {\rm{ClO}}_3^ - + {{\rm{O}}_2}{\text{,}} $ | (2) |
| $ {\rm{ClO}}_4^ - \to {\rm{ClO}}_2^ - + {{\rm{O}}_2}{\text{,}} $ | (3) |
| $ {\rm{ClO}}_4^ - + {\rm{ClO }}_2^{ - } \to {\rm{ClO}}_3^ - + {\rm{ClO}}^ - + {\rm{ O}}_2{\text{,}} $ | (4) |
| $ {\rm{ClO}}_3^{ - } \to {\rm{ClO}}^ - + {\rm{O }}_2{\text{,}} $ | (5) |
| $ 2 {\rm{ClO}}^ - \to 2 {\rm{Cl}}^ - + {\rm{O }}_2{\text{。}} $ | (6) |
图2为不同含量Mn-Ni催化剂对LiClO4的催化分解过程。

|
图 2 不同含量催化剂的TG-DTG曲线 Fig. 2 TG-DTG curves of different catalyst |
随着催化剂的加入,分解曲线明显左移,初始分解温度减低Ni:Mn=6:1,3:1,2:1,1:1,1:2,1:3,1:6分别降低了138 °C,119 °C,114 °C,138 °C,114 °C,128 °C,141 °C,说明MnxNi(1-x)O催化剂对LiClO4分解有明显的助益,对式(2)和式(3)的决速步骤有很好的催化性能,且在Mn或Ni含量相等或差别比较大时,初始分解温度降低明显,结合其热重曲线,Ni:Mn=1:6、6:1时,DTG曲线为单极值曲线,说明催化剂对LiClO4分解过程出现的中间产物也有很好的催化性能,避免了纯LiClO4出现双极值的情况。
图3各催化剂热重样品的初始分解温度。

|
图 3 各催化剂热重样品的初始分解温度 Fig. 3 Initial decomposition temperature of each catalyst thermogravimetric sample |
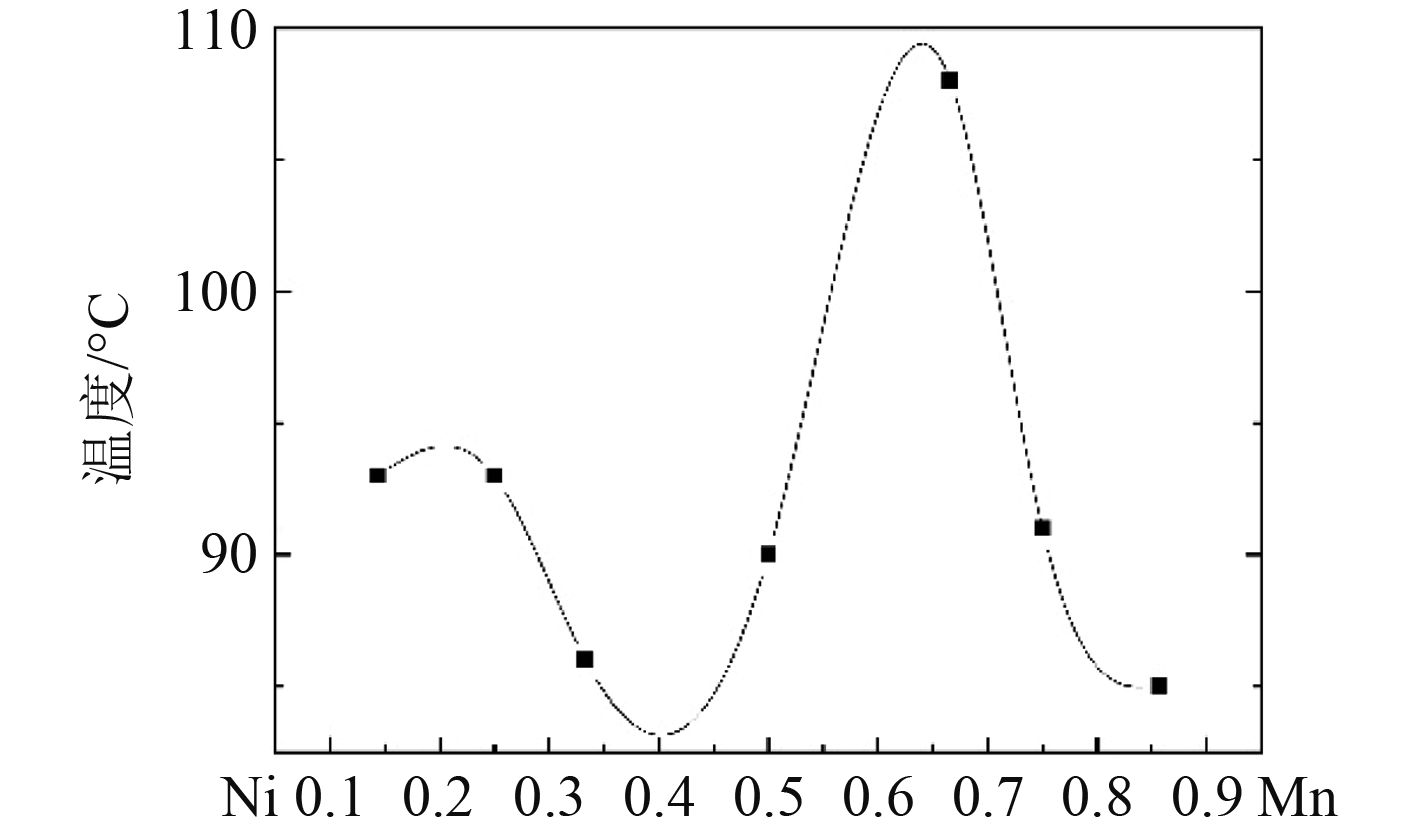
如图4所示,不同组分之间催化剂催化作用有所差别,分解温程(开始分解到分解完全的温度差)可以很好地反应催化剂的分解效率,在理论质量产氧量为60%的情况下,温程越短即分解时间越短,说明平均分解速率越大,纯LiClO4分解温程仅为45 °C,实验的各个样品中,温程最短为Ni:Mn=1:6的85 °C,此时分解的平均速率为7.1%/min。
|
图 4 各催化剂热重样品的分解温程 Fig. 4 Decomposition temperature interval of each catalyst thermogravimetric sample |
图5各催化剂热重样品最大分解速率时的温度。从LiClO4的应用角度来看,最大分解速率时的温度是实际应用中最具参考意义的点,为追求分解的稳定性和效率,通常选用此温度点来分解LiClO4,此温度点越低,提供的启动能量就越低,使其更为快捷和节能。其中Ni:Mn=1:2的温度点最低,为365 °C。

|
图 5 各催化剂热重样品最大分解速率时的温度 Fig. 5 Temperature at maximum decomposition rate of each catalyst thermogravimetric sample |
综合以上表明Ni:Mn=1:6的催化性能最好,LiClO4分解随温度的升高分解速率加快,即降低其初始分解温度便可以有更充足的温度区间可供选择和应用,而较短的温程保证了反应效率较高,分解更加稳定。
3 结 语本研究得出以下结论:
1)MnxNi(1-x)O催化剂对LiClO4的分解有明显的催化作用,使LiClO4初始分解温度降低了114 °C~141 °C;
2)其中Ni:Mn=1:6的催化效果最好,分解初始温度降低了141 °C,分解速率在372 °C达到最大值10.8%/min,温程较窄,分解效率最好;
3)LiClO4氧烛是蓄氧量最高的氯酸盐氧烛,今后有更广阔的应用空间。
| [1] |
王斌, 王雅娟, 马丽娥. 密闭空间内常用的两种化学制氧技术[J]. 船舰防化, 2010, 4: 10-14. |
| [2] |
范敏, 卜建杰, 郑邯勇. 氧烛的研究现状与发展[J]. 船舰科学技术, 2007, 28(2): 16-20. |
| [3] |
闫科, 张彦威, 王永昌. 高氯酸锂分解动力学研究[J]. 固体火箭技术, 2013, 36(3): 353-357. |
| [4] |
RUDLOFF W K, FREEMAN E S. The catalytic effect of metal oxides on thermal decomposition of potassium chlorate and potassium perchlorate as detected by thermal. analysis methods[J]. The Journal of Physical Chemistry, 1970, 74(18): 3317-3324. DOI:10.1021/j100712a002 |
| [5] |
KOVALENKO A N, IVANOV G V.. Physicochemical transformations in mixtures of lithium perchlorate with finely divided metals in shock compression[J]. Combustion Explosion&Shock Waves, 1983, 19(4): p. 481-484. |
| [6] |
CANNON J C, ZHANG T C.. Catalytic decomposition of potassium chlorate[J]. Journal of Thermal Analysis, 1994, 41: p. 981-993. DOI:10.1007/BF02547189 |
| [7] |
LEE J S, HSU C K. The DSC studies on the phase transition, decomposition and melting of potassium perchlorate with additives[J]. Thermochimica Acta, 2001, 367–368: p. 367-370. |
| [8] |
江治, 李疏芬, 赵凤起. 纳米镍粉对高氯酸铵热分解的影响[J]. 推进技术, 2003, 24(5): 460-463. DOI:10.3321/j.issn:1001-4055.2003.05.019 |
| [9] |
WACHOWSKI L, CZAJKA B.. Textural and catalytic properties of the FexOy/Fe-KClO4 system[J]. Thermochimica Acta, 2005, 435(1): p. 102-107. DOI:10.1016/j.tca.2005.05.010 |
| [10] |
戴洪兴, 何洪, 李佩珩. 稀土钙钛矿型氧化物催化剂的研究进展[J]. 中国稀土学报, 2003, 21(Spec): p. 1-15. |
| [11] |
ZHANG Yan-wei, YAN Ke, QIU Kun-zan. Catalyst for lithium perchlorate decomposition[J]. Journal of Propulsion and Power, 2015, 31(5): 1445-1451. DOI:10.2514/1.B35582 |
| [12] |
MMARKOWITZ M, D ABORYTA. The decomposition kinetics of lithium perchlorate[J]. The journal of Physical Chemistry Chemistry, 1961, 65(8): 1419-1424. DOI:10.1021/j100826a034 |
 2019, Vol. 41
2019, Vol. 41
