金属燃料水冲压发动机是一种新型水下航行器动力系统,它以金属/水反应作为动力源,利用反应热和反应产生的高压气体推动航行体在水下高速航行[1, 2]。该体系的能量密度非常高,因为氧化剂取自环境中的海水而无需携带,且金属燃料本身就具有很高的能量水平[3]。常见的水反应金属有铍、铝、镁和锂等,其中铝的优势最为突出。作为地壳中含量最多的金属元素,铝无毒,与水反应活性适中,体积能量密度为 9.75 kcal/cm3,是镁的 1.8 倍,锂的 2.4 倍,具有 3 个价电子和高达 11.1 wt.% 的储氢密度(不考虑水用量),是最理想的水冲压发动机燃料[4, 5]。
铝的氧化产物排列致密,会阻碍铝/水反应的启动与进行,只有达到 1 500 ℃以上,铝经由熔化和气化,才能与水蒸气持续反应[6],这对铝应用于水下推进系统带来了极大困难。通过电爆轰等热物理手段可以制备纳米级的超细铝粉[7],纳米粒子特有的小尺寸效应能够使铝不经气化直接与水蒸气发生反应,降低了启动温度,提高了反应效率[8, 9, 10]。但是大的比表面积造就的超强活性,使这种铝粉对空气的湿度十分敏感,极易发生氧化甚至自燃[11]。
电化学领域发现低熔点的稀有金属能够提高铝/水反应的活性[12, 13, 14],例如镓可与铝形成类似铝汞齐的结构,穿透氧化膜并破坏其致密性,使铝/水反应在室温下得以启动。铟与镓属同族元素,化学活性相似,因熔点(156.61 ℃)高于镓(29.8 ℃),而未受到制氢领域的足够重视。适中的熔点可使铟在活化铝的同时又保持铝在常温下的储存性能,适合被应用到推进剂中。金属镁为表面活性金属,常用来降低金属燃料的点火温度,可以进一步降低铝/水反应的启动条件。
本实验通过熔炼法制备一种铝铟镁合金,它在常温下不与水反应,储存性能好,高温下与水快速反应,能够代替现有铝粉作为水反应推进剂主燃料使用。
1 实验操作与条件 1.1 合金的制备按一定比例称取铝、铟、镁3种金属,将烘干的熔炼工具移至充满高纯氩气气氛的熔炼装置中。在坩埚中加热铝锭至熔融,压入铝箔包裹的铟和镁,搅拌均匀并扒渣。将液态合金倒入模具中冷却成型,通过机械方法将合金破碎成粒径一致的金属粉沫。
1.2 性能测试常温水反应实验:称取约 200 mg 合金粉末于小瓶中,快速移至装有 100 mL 蒸馏水的反应瓶,锁紧瓶口,开启数据采集系统并打翻小瓶。反应产生的氢气经过干燥瓶进入气体收集室,通过收集室内气体压力的变化计算生成氢气的体积和产生速率。
高温水反应实验:称取约 10 mg 合金粉沫于小坩埚中,将坩埚挂于 Chah THERMAX 500 高压热分析天平的悬臂上,锁闭反应室,设定加热范围和加热速率,开启程序升温和数据采集系统,水由加热带加热成水蒸气,并随载气一起进入反应室,入口温度 120 ℃。通过合金的质量变化曲线,计算合金的反应情况。
1.3 金相显微镜将合金粉沫均匀地铺撒在载玻片上,将载玻片移至 OLYPUS BX51M 系统金相显微镜载物台,观察各反应阶段合金粉沫的表面形貌。
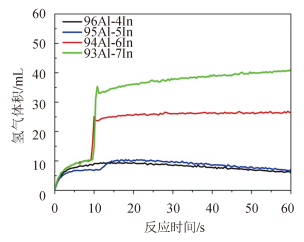
2 性能测试 2.1 常温反应性能试验 2.1.1 铟对合金性能的影响在室温下(25℃)下考察铟元素对合金/水反应性能的影响,表 1 反映了不同配方合金的最大产氢量与产氢速率,图 1 为前一分钟合金/水反应实时产氢曲线。从表 1 中可以看出,铟元素的添加含量达到 6% 以后,合金能在常温下与水反应。从图 1 可看出,合金与水的反应发生在接触的瞬间,一经启动,能在短时间内快速进行,曲线斜率非常大,但进行的不彻底。
|
|
表 1 铝铟合金产氢表 Tab.1 Hydrogen produced by Al-In alloys |
|
图 1 60 s产气图 Fig. 1 Hydrogen produced in 60 seconds |
机理分析:铟的原子半径大于铝,作为溶质溶于铝溶剂并与之形成固溶体时,能够在点阵中占据铝的阵点并引发点阵畸变,从而降低结构的稳定性、破坏氧化铝膜的致密性并活化铝/水反应。反应过程遵循溶解-再沉积理论:当铝铟固溶体正电位积累到一定程度时,部分合金元素发生溶解,以阳离子的形式游离到水中,释放活性 Al3 + 离子并暴露铝基体,反应方程式为 Al + In=Al3 + + In3 + +6e -;当电位下降到临界值,游离的 In3 + 离子通过置换反应重新沉积到铝的晶界表面,形成固溶物,并再次释放出活性 Al3 + 离子,反应方程式为In3 + + Al=Al3 + + In,这一阶段进行的非常快。想要使溶解-沉积的过程持续进行,必须达到第一步的启动条件,这就要求反应启动时,铟元素在铝的表面必须足够富集,达到临界含量 6%。后期反应速率之所以下降,是因为氧化层随反应而积累变厚,In3+ 离子与 Al3+离子在室温下难以穿透,反应变慢并最终停止。
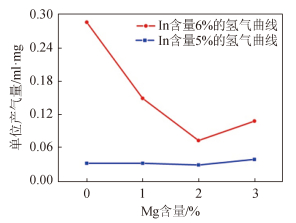
2.1.2 镁对合金性能的影响:图 2 为镁元素对合金/水反应产氢量的影响曲线,以单位质量合金反应产生的氢气体积为衡量标准,从曲线中可以看出,In含量为 5% 和 6% 时,2条曲线均在 Mg 含量 2% 处达到最低点,这是由于镁是表面活性元素,添加后能够降低合金表面铟的相对含量,抑制了常温下的反应,此时铟的富集程度已经无法有效启动反应;而含量高于 2% 以后,产气量有所回升,推测此时 In 开始与 Mg 形成固溶体,活化了镁与水的反应。又由于镁的活性比铝强,在反应启动后有助于 In3+离子的置换与沉积,加速铝/水反应。因而镁的添加能够扩大铟含量在 5% 和 6% 的合金/水反应性能间的差距,使合金在低温下更稳定,高温下活性更强,因此,在 In 含量 5%~6%的范围内,为使合金的性能最佳,Mg 的添加量应为合金质量的 2%。
|
图 2 Mg 含量对 Al-In 合金的影响曲线 Fig. 2 Curves of Mg’s infection to Al-In alloys |
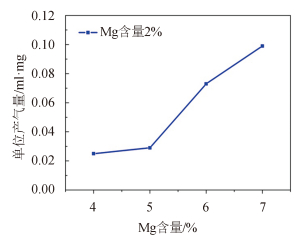
图 3 为系列 Al-In-2% Mg 合金的产气曲线,能够看出 In 对体系的大幅度活化仍开始于 6%,In 对体系的影响大于 Mg,合金 93Al-5In-2Mg 在常温下与水反应的产气量仅为 0.029 mL/mg,在系统误差范围内,能对空气中的水蒸气呈现惰性,可以安全储存和应用。
|
图 3 系列 Al-In-2% Mg 合金产气曲线 Fig. 3 Hydrogen produced by serious Al-In-2% Mg alloys |
1)Al-In-Mg 合金高温实验
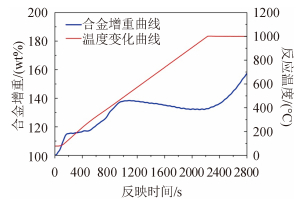
图 4 为 93Al-5In-2Mg 合金与水蒸气反应的增重曲线,横坐标为反应时间(s),纵坐标为合金质量百分比(wt.%)和反应温度(℃),加热温度区间 25 ℃~ 1 000 ℃,步长 20 ℃/min,在1 000 ℃保温 10 min。从图 4 可以看出该合金/水反应分为以下 4 个阶段:
|
图 4 95Al-5Li 合金与水蒸气反应曲线 Fig. 4 Reaction curve of 95Al-5Li alloy and hot steam |
1)第1阶段为 70 ℃~100 ℃,样品质量在 200 s 内急剧上升,斜率基本保持不变,此时的反应主要是合金表面 Al-In-Mg 固溶体与水蒸气反应,In 和 Mg 的加入大幅降低了铝/水反应的启动温度,随着反应的进行,In3+无法穿透变厚的氧化膜,合金表面的 In 元素不足以满足反应的需求,反应速率变慢。
2)第2阶段为 100 ℃~400 ℃,曲线斜率逐渐提高,反应变快,合金内部低熔点金属熔化,并由于表面张力和毛细作用,扩散到合金表面,扩散过程中破坏了合金粉末的内部结构和表面氧化层,反应重新进行,后期曲线斜率与第1阶段相同,可见同为表面溶解-再沉积过程,反应机理相同,图 5(a)为金相显微镜下该阶段反应产物的表面形貌,可以在氧化物表面看到正在渗出的微小金属球。这一阶段的反应随着 In 与 Mg 的熔出和氧化层重新变厚而停止。

|
图 5 表面形貌 Fig. 5 Surface of alloy |
3)第3阶段为 400 ℃~1 000 ℃,曲线略有下降,此时的镁已经完全反应,内部 In 元素完全扩散到表面,铝表面的氧化层积累了一定厚度,活性的离子难以穿透,而反应生成的氢氧化物受热分解成氧化物,合金失重。
4)第4阶段为 1 000 ℃,合金开始重新与水蒸气反应,此时主要是剩余的未形成固溶合金的 Al 的燃烧,Al 不断熔化蒸发,破坏表面的氧化层结构并参与反应,直至反应结束,图 5(b)为该阶段的表面形貌,可以看见大滴的Al正在熔出。文献记载纯铝/水反应启动温度不低于 1 500 ℃,而第4阶段的反应温度明显低于 1 500 ℃,推测 In 和 Mg 向外扩散的过程中破坏了合金粉末的内部结构,增大了比表面积,形成类似于纳米铝粉的小尺寸效应,降低了反应温度。
2)高温类比实验
文献[6]提出了金属/水双反应区模型:低温区内,推进剂中的氧化剂与一部分金属反应放出热量,预热、液化和气化未反应的金属,为高温区的金属/水反应提供条件;高温区内,金属利用自身反应放热,使其与水的反应得以持续进行。
通过 93Al-5In-2Mg 高温水反应实验发现,合金活性成分在 450 ℃以前反应完全,能够实现低温区的反应目的,降低了一次燃烧温度。在此高温实验的基础上,对3组合金进行高温水反应测试,研究 In 含量对低温区(前2个阶段)合金/水反应性能的影响。图 6(a)和图 6(b)分别是以反应时间和反应温度为横轴的合金质量变化曲线,加热区间 25 ℃~700 ℃,步长 20 ℃/min。
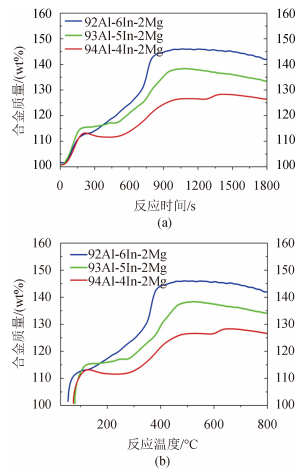
|
图 6 质量随反应时间和反应温度变化曲线 Fig. 6 Curve of weight change with time |
从图 6(a)可看出,小范围的配方变动对这一阶段的反应影响不大,不同配方的合金反应速度接近。考虑影响反应速度的诸多因素,该阶段的控制因素应该是合金颗粒的比表面积;合金反应的第2阶段,In 含量高的合金曲线斜率增长快,说明 In 和 Mg 的扩散速度随 In 含量提高而加快。In 熔化后由于表面张力和毛细作用,能够从合金内部瓦解合金颗粒,破坏氧化铝膜,这种作用随 In 含量的越多而越发明显。6(b)显示,3组配方分别在(502℃,145.95wt%)、(585.31℃,137.70wt%)和(645.64℃,128.35wt%)完成第2阶段的反应,即 In 含量的增加有助于第2阶段反应完成的提前。当温度达到 450 ℃时,3组合金分别达到 125.35 wt%、134.41 wt%和145.95 wt%,每增加 1% 的 In,在 450 ℃前就可以多反应约 10% 的合金。
3 结果与讨论通过对以上实验的分析,得到如下结论:
1)铝铟镁三相合金中的铟含量达到 6% 时,在常温下与水发生明显的反应,反应过程为溶解-再沉积反应,配方 93Al-5In-2Mg 单位质量的水反应的产氢量仅为 0.029 mL/mg,对空气湿度不敏感,可以安全储存;
2)镁的添加量为合金质量的 2% 时,对合金粉末储存最为有利,相同生产工艺下,高于或低于 2% 都会影响合金的储藏性能;
3)铝铟镁合金高温下与水蒸气反应分为 4 个阶段,前两阶段与金属燃烧低温区模型对应,该反应只能在表面进行,因此扩散过程是反应的决速步,减小粉末粒径能够加速反应进程;
4)每增加 1% 的铟,在 450 ℃前就可以多反应约 10% 的合金,这对后续点火药和推进剂配方有着指导意义;
5)93Al-5In-2Mg 的一次燃烧温度约 450 ℃,二次燃烧温度约 1 000 ℃,优于现有铝粉,并在常温下对水呈现惰性,能够代替现有普通铝粉和超细铝粉,用于水冲压发动机。
| [1] | 王晓欣, 党建军, 张学雷, 等. 一种水冲压发动机推力测试方法[J]. 鱼雷技术, 2015, 23(2):124-128, 133. |
| [2] | MILLER T F, WALTER J L, KIELY D H. A next-generation AUV energy system based on aluminum-seawater combustion[C]//Proceedings of the 2002 Workshop on Autonomous Underwater Vehicles.San Antonio, TX, USA:IEEE, 2002:111-119. |
| [3] | 郑邯勇. 铝水推进系统的现状与发展前景[J]. 舰船科学技术, 2003, 25(5):24-25. |
| [4] | 刘冠鹏, 李凤生, 郭效德. 铝粉燃料与水反应的研究进展[J]. 固体火箭技术, 2007, 30(2):138-141, 154. |
| [5] | 马广璐, 庄大为, 戴洪斌, 等. 铝/水反应可控制氢[J].化学进展, 2012, 24(4):650-658. |
| [6] | 李芳, 张为华, 张炜, 等. 铝基水反应金属燃料性能初步研究[J]. 国防科技大学学报, 2005, 27(4):4-7. |
| [7] | IVANOV G V, IVANOV V G, SURKOV V G, et al. Nanosize electro-explosion powders:assessement of safety in the production and application[M]//ZARKO V E, WEISERV, EISENREICH N, et al. Prevention of Hazardous Fires and Explosions.Netherlands:Springer,1999, 26:329-340. |
| [8] | 李鑫, 赵凤起, 郝海霞, 等. 不同类型微/纳米铝粉点火燃烧特性研究[J]. 兵工学报, 2014, 35(5):640-647. |
| [9] | VLASKIN M S, SHKOLNIKOV E I, BERSH A V. Oxidation kinetics of micron-sized aluminum powder in high-temperature boiling water[J]. International Journal of Hydrogen Energy, 2011, 36(11):6484-6495. |
| [10] | 江治, 李疏芬, 赵凤起, 等. 纳米铝粉和镍粉对复合推进剂燃烧性能的影响[J]. 推进技术, 2004, 25(4):368-372. |
| [11] | 李伟, 包玺, 唐根, 等. 纳米铝粉在高能固体推进剂中的应用[J]. 火炸药学报, 2011, 34(5):67-70. |
| [12] | ZIEBARTH J T, WOODALL J M, KRAMER R A, et al. Liquid phase-enabled reaction of Al-Ga and Al-Ga-In-Sn alloys with water[J]. International Journal of Hydrogen Energy, 2011, 36(9):5271-5279. |
| [13] | WANG H Z, LEUNG D Y C, LEUNG M K H, et al. A review on hydrogen production using aluminum and aluminum alloys[J]. Renewable and Sustainable Energy Reviews, 2009, 13(4):845-853. |
| [14] | KRAVCHENKO O V, SEMENENKO K N, BULYCHEV B M, et al. Activation of aluminum metal and its reaction with water[J]. Journal of Alloys and Compounds, 2005, 397(1/2):58-62. |
 2016, Vol. 38
2016, Vol. 38
