2. 河南中医药大学
畜禽血制品一般是指屠宰畜禽时收集其血液而制作的食品, 是川菜和火锅的特色原材料之一[1], 也是我国居民餐桌上常见的食品, 因其富含蛋白质、铁等营养物质而被民众喜爱[2]。但也因其营养物质丰富, 极易被细菌污染。因此, 一些不法宰杀点使用甲醛用于畜禽血制品的保鲜、防腐以及促进蛋白质凝固, 增加韧性和口感[3]。甲醛, 又称蚁醛, 是细胞原浆毒物, 对人体细胞功能损害较大, 能使蛋白质凝固, 对皮肤和黏膜有极强刺激作用和致敏作用, 能与核酸的羟基和氨基结合后导致其失去活性, 具有致癌、致突变效应, 可诱发鼻咽癌和白血病[4-6]。国际癌症研究机构(IARC)确认甲醛为致癌和致畸性物质[7-8], 国家明令禁止将甲醛用于食品, 但近期报道显示仍有含甲醛畜禽血制品流入市场[1, 9]。目前尚未有对畜禽血制品中甲醛含量测定的标准方法, 实验室检测多参照水产行业标准中对水产品中甲醛的测定方法[10], 样品前处理需单份进行水蒸气蒸馏, 操作较繁琐, 不适合批量样品测定。因此对畜禽血中甲醛的测定方法有待研究和改进。本法在相关文献的基础上, 根据畜禽血制品的特点, 增加了沉淀蛋白步骤, 用直接提取法代替水蒸气蒸馏, 对衍生剂的使用量和条件进行了改进, 优化了色谱条件, 建立了蛋白沉淀-柱前衍生-高效液相色谱法测定畜禽血制品中甲醛的方法, 方法操作简单, 灵敏度和准确度高且干扰少, 适合批量畜禽血制品中甲醛的准确、快速测定, 对畜禽血制品的安全食用和维护民众健康有着重要意义。
1 材料与方法 1.1 材料 1.1.1 样品来源畜禽血制品包含猪血和鸭血制品, 从本市区及辖区县超市和农贸市场购买, 连续三年采样, 共计90份样品。
1.1.2 仪器ACQUITY Arc高效液相色谱仪(美国waters, 配紫外检测器); 多位试管涡旋振荡器(德国Heidolph Multi Reax); 漩涡混匀器(SCILOGEX MX-S); 高速冷冻离心机(四川蜀科仪器有限公司TGL-16)Arium611超纯水机(德国赛多利斯); 万分之一电子天平(梅特勒AL-204);氮吹仪(美国organomation, N-EVAP-112);料理机(九阳JYL-B060);
1.1.3 试剂超纯水(电阻率为18.2 MΩ ·cm); 二氯甲烷(美国默克公司, 优级纯); 甲醇(美国默克公司, 色谱纯), 盐酸(上海国药, 优级纯); 无水硫酸钠(北京化工厂, 分析纯); 亚铁氰化钾(北京化工厂, 分析纯; 称取10.6 g亚铁氰化钾加水溶解定容至100 mL配置成10.6%亚铁氰化钾溶液); 乙酸锌(北京化工厂, 分析纯; 取乙酸锌21.9 g, 加水溶解并加入5.0 mL冰乙酸, 定容至100 mL, 配置成21.9%的乙酸锌溶液); 2, 4-二硝基苯肼(上海试剂三厂, 分析纯; 称取100 mg 2, 4二硝基苯肼溶解于24 mL浓盐酸中, 加水定容至100 mL配置成1 000 μg/mL的2, 4-二硝基苯肼溶液); 甲醛标准溶液(10.0 μg/mL, 国家标准物质研究中心)。
1.2 方法 1.2.1 仪器条件色谱柱:ODS-C18柱(4.6 nm×250 mm, 5 μm); 流动相:甲醇-水(65+35, V+V); 流速:0.5 mL/min; 柱温:40℃; 进样量:10 μL; 检测波长:338 nm; 检测器:紫外检测器。
1.2.2 样品前处理畜禽血制品, 料理机粉碎混匀后准确称取5 g于50 mL离心管内, 加入4 mL亚铁氰化钾、4 mL乙酸锌, 涡旋1 min, 加入15 mL超纯水, 振荡提取15 min, 6 500 r/min(离心半径12 cm)离心5 min, 收集上层清液于比色管内, 再用15 mL超纯水重复提取残渣一次, 离心后收集上清液于比色管, 定容至50 mL。样品衍生处理:吸取1 mL上述提取液于比色管, 加入0.2 mL衍生剂, 加盖60℃水浴中衍生15 min, 然后在流水中快速冷却, 加入2 mL二氯甲烷, 漩涡振荡器萃取1 min, 3 000 r/min、离心2 min, 取上清液再用2 mL二氯甲烷重复萃取一次, 合并两次萃取的下层黄色溶液, 将黄色萃取液用无水硫酸钠柱过滤脱水, 60℃氮气吹干, 放冷, 残渣用甲醇溶解定容至1 mL, 经0.22 μm滤膜过滤于进样瓶上机测定, 同时做空白对照试验。
1.2.3 标准系列的制备甲醛标准溶液(10.0 mg/mL, 国家标准物质研究中心), 用水稀释为100.0 μg/mL应用液, 吸取100.0 μg/mL应用液20、50、100、150、200和400 μL定容至1 mL, 配制浓度为2、5、10、15、20和40 μg/mL的标准系列, 加入0.2 mL衍生剂后, 处理同1.2.2样品衍生处理。
1.2.4 样品测定与结果计算仪器在1.2.1条件下依次对标准系列, 样品空白和样品溶液进行测定, 标准系列以峰面积对质量浓度拟合曲线。样品以保留时间定性, 峰面积定量, 从标准曲线上计算浓度值, 根据下式计算样品甲醛含量。
| $ X = \frac{{\left( {C - C'} \right) \times V \times 50}}{m} $ | (1) |
式中: X-样品中的甲醛含量, mg/kg;
C-样品中甲醛曲线含量, μg/mL;
C'-样品空白甲醛的曲线含量, μg/mL;
V-样品定容体积, mL;
50 -稀释倍数;
m-样品称样量, g。
1.3 统计学分析方法对比测定数据使用SPSS 20.0软件进行配对t检验统计分析。双侧检验水准α=0.05。
1.4 质量控制实验所用试剂均选用分析纯以上试剂, 流动相和萃取试剂选用色谱纯级, 通过全过程空白试验和加标回收实验及标准曲线的线性来保证数据的准确性, 同时与标准方法做对比测定, 通过统计学分析确认方法的一致性。
2 结果与分析 2.1 不同前处理方法的对比实验畜禽血中含有的蛋白质和其他大分子极性物质, 不仅对甲醛提取和衍生有干扰, 而且会对色谱柱带来损伤, 故需在第一时间去除, 目前测定畜禽血制品中甲醛含量并无标准方法, 实验室检测多参照水产行业标准中水产品中甲醛的测定方法[10], 该方法前处理需要逐份蒸馏, 费时费力, 近年来也有文献报道的不去除蛋白, 提取液衍生后不萃取直接进样测定的直接提取法[3]。对10份阳性样品, 分别采用行标的蒸馏法和本文的蛋白沉淀法以及文献报道的直接提取法3种方法进行对比测定, 并将蛋白沉淀法和直接提取法测定数据分别与蒸馏法数据进行配对t检验, 测定结果和分析统计见表 1, 结果蒸馏法和蛋白沉淀法测定值无统计学差异(t=1.76, P>0.05), 蒸馏法和直接提取法测定值有统计学差异(t=5.08, P < 0.05)。说明蛋白沉淀法测定结果准确可靠, 且避免了蒸馏法复杂的蒸馏过程, 直接提取法虽然操作简单, 但测定准确度较差, 故增加蛋白沉淀步骤是必要的, 而因为加入了蛋白沉淀剂, 使用二氯甲烷分步萃取, 不仅能消除畜禽血制品中水溶性物质干扰, 而且能消除蛋白沉淀剂等无机盐类对色谱柱的损伤。
| 样品 编号 |
蒸馏法 | 蛋白沉淀法 | 直接提取法 |
| 1 | 13.5 | 13.9 | < 0.2 |
| 2 | 14.5 | 13.2 | < 0.2 |
| 3 | 166 | 163 | 90.2 |
| 4 | 90.7 | 85.4 | 34.7 |
| 5 | 142 | 138 | 62.4 |
| 6 | 40.1 | 36.8 | 18.8 |
| 7 | 29.6 | 28.7 | 10.7 |
| 8 | 175 | 177 | 88.9 |
| 9 | 92.9 | 96.4 | 43.3 |
| 10 | 107 | 104 | 66.4 |
2.2 蛋白沉淀剂的选择和用量
实验对比了加入不同体积的亚铁氰化钾+乙酸锌、三氯乙酸[11]做沉淀剂时的样品测定结果, 同时以蒸馏法处理测定结果为真值比较回收率, 结果发现亚铁氰化钾+乙酸锌体积在(4 mL+4 mL)以上时, 测定结果趋于稳定, 回收率在92%~95%, 三氯乙酸加入4 mL以上时测定结果趋于稳定, 回收率为68%~72%(表 2)。说明亚铁氰化钾+乙酸锌(4 mL+4 mL)对于取样5 g畜禽血制品可有效去除蛋白质, 减少了对甲醛提取和衍生过程的干扰, 增加了测定的准确度。故本法选择沉淀剂为亚铁氰化钾+乙酸锌(4 mL+4 mL)。
| 前处理方法 | 加入量/mL | 测定均值 /(mg/kg) | 回收率/% |
| 蒸馏法 | - | 149 | 100.0 |
| 不加沉淀剂 | - | 60.5 | 40.6 |
| 沉淀剂: 亚铁氰化钾+乙酸锌 |
2+2 | 90.4 | 60.7 |
| 3+3 | 110 | 73.8 | |
| 4+4 | 141 | 94.6 | |
| 5+5 | 137 | 91.9 | |
| 6+6 | 142 | 95.3 | |
| 沉淀剂:三氯乙酸 | 3 | 90.7 | 60.9 |
| 4 | 107 | 71.8 | |
| 5 | 104 | 69.7 | |
| 6 | 102 | 68.4 | |
| 注:"-"表示不加入沉淀剂 | |||
2.3 衍生试剂的用量
方法使用2, 4-二硝基苯肼进行衍生, 2, 4-二硝基苯肼与甲醛反应为1+1定量反应[10], 试验取1 mL提取液加入0.2 mL衍生剂, 理论上能够满足400 mg/kg甲醛含量的样品, 根据相关文献和市场反馈畜禽血制品中甲醛含量[3, 12], 该衍生剂的加入量能满足大部分畜禽血制品中甲醛的衍生, 对于少数超过400 mg/kg样品, 可按比例减少取样量之后复核样品, 综合考虑选择加入量为0.2 mL衍生剂。
2.4 色谱条件的选择优化畜禽血中甲醛经衍生处理及萃取净化后, 待测溶液中干扰成分较少, 峰图主要是衍生剂峰(6.9 min)和待测物2, 4-二硝基苯腙(10.2 min, 图 1)[3], 试验得出流动相甲醇+水体系, 甲醇比例55%~75%之间, 流速0.5 mL/min时, 等度洗脱待测物均能得到较好分离, 分析时间可选择待测物出峰后5 min, 即15 min, 使样品其他组分流出完全。
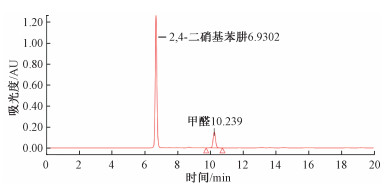
|
| 图 1 甲醛标准图谱 |
2.5 方法验证 2.5.1 方法的线性范围和检出限
根据市场前期畜禽血制品甲醛含量水平和本法样品处理稀释倍数, 配置系列最高浓度为40 mg/L, 待测组分在(2.0~40)mg/L线性良好, 回归方程为:y=1.37×105x-409, 相关系数r=0.999 1。
对0.02 mg/L的加标样品平行测定6次, 计算相对标准偏差(RSD), 以3倍标准偏差对应的浓度计算检出限, 以10倍标准偏差对应的浓度计算定量限, 检出限为0.2 mg/kg, 定量限为0.6 mg/kg(以5 g取样量定容体积50 mL计算)。
2.5.2 方法准确度与精密度挑选高、中、低浓度水平样品做加标回收和精密度试验, 在样品中加入高、中、低3个浓度水平的甲醛标准溶液, 按1.2方法处理分析, 平行测定6次, 计算其加标回收率和RSD(n=6), 结果见表 3, 由表可知甲醛加标回收率在86.0%~110%之间, RSD为2.3%~5.3%。
| 本底值 /(μg/mL) |
加入量 /(mg/L) |
测定值/(mg/L) | 回收率范围/% | RSD/% | |||||
| 未检出 | 5.0 | 4.89 | 5.45 | 5.43 | 5.33 | 5.05 | 4.84 | 96.8~109 | 5.3 |
| 10.0 | 9.27 | 9.14 | 9.45 | 9.48 | 9.70 | 9.19 | 91.4~97.0 | 2.3 | |
| 15.0 | 13.60 | 13.80 | 13.80 | 13.70 | 14.60 | 13.60 | 90.7~97.3 | 2.7 | |
| 8.54 | 5.0 | 13.80 | 13.10 | 13.30 | 14.00 | 13.20 | 14.00 | 91.2~109 | 3.1 |
| 10.0 | 17.60 | 17.80 | 17.90 | 18.10 | 19.30 | 18.50 | 90.6~108 | 3.4 | |
| 15.0 | 22.50 | 23.60 | 22.30 | 22.50 | 22.10 | 22.20 | 90.4~101 | 2.4 | |
| 21.5 | 5.0 | 25.90 | 27.00 | 25.80 | 25.80 | 25.90 | 27.00 | 86.0~110 | 2.3 |
| 10.0 | 31.90 | 30.70 | 30.50 | 32.10 | 30.70 | 32.00 | 90.0~104 | 2.4 | |
| 15.0 | 36.90 | 35.20 | 35.30 | 37.60 | 37.00 | 37.70 | 91.3~108 | 3.0 | |
2.6 方法应用
2016-2018年采集的90份畜禽血制品检测结果显示猪血、鸭血制品均有检出(表 4), 其中鸭血制品30份, 检出5份, 检出率16.7%(5/30), 猪血制品共60份, 检出19份, 检出率为36.7%(19/60)。其中猪血最高值为429 mg/kg, 鸭血最高值219 mg/kg, 三年猪血鸭血制品未检出样品占比为70%, 说明畜禽血制品甲醛含量本底较低, 与有关文献结果一致[9]。含量较高样品存在人为添加的可能, 应引起警示。
| 年份 | 样品 | 份数 /份 |
检出 份数/份 |
最大值 /(mg/kg) |
最小值 /(mg/kg) |
| 2016 | 鸭血 | 13 | 4 | 219 | 0.9 |
| 猪血 | 17 | 10 | 297 | 25.8 | |
| 2017 | 鸭血 | 8 | 0 | - | - |
| 猪血 | 22 | 6 | 429 | 29.6 | |
| 2018 | 鸭血 | 9 | 1 | 138 | - |
| 猪血 | 21 | 6 | 164 | 129 | |
| 合计 | 鸭血 | 30 | 5 | 219 | 0.9 |
| 猪血 | 60 | 22 | 429 | 25.8 | |
| 注:"-"表示无。 | |||||
3 小结
本文通过实验, 研究了高效液相色谱测定畜禽血制品中甲醛的不同前处理方法, 简化、改进了样品中甲醛的提取方法, 确定了采用乙酸锌-亚铁氰化钾沉淀蛋白, 使用2, 4-二硝基苯肼衍生甲醛的最佳反应条件, 优化了色谱条件, 建立了蛋白沉淀-柱前衍生-高效液相色谱测定畜禽血制品中甲醛的方法。该方法前处理方法为沉淀蛋白后直接提取, 有效改善提取效率, 比蒸馏法简单便捷, 不降低准确度, 二氯甲烷分步多次萃取, 进一步去除干扰杂质, 降低色谱分析共流出干扰, 通过加标回收样品测定和统计学检验评价, 确认该法适用于畜禽血制品中甲醛的分析测定。该方法精密度和准确度高, 线性范围宽, 适用于畜禽血制品的检测。
| [1] |
王瑶, 李晓辉, 刘艳, 等. 成都市畜禽血制品中甲醛含量及膳食暴露评估[J]. 现代预防医学, 2015, 42(20): 3676-3678. (In English: Wang Y, Li XH, Liu Y, et al. Assessment on the dietary exposure and the formaldehyde content in the animal blood products in Chengdu[J]. Mod Prev Med, 2015, 42(20): 3676-3678.) |
| [2] |
孔凡春. 畜禽屠宰后血液的利用现状及前景[J]. 肉类工业, 2011(5): 46-49. (In English: Kong FC. Present situation and foreground of livestock blood utilization after slaughtering[J]. Meat Ind, 2011(5): 46-49. DOI:10.3969/j.issn.1008-5467.2011.05.020) |
| [3] |
甘凝岚, 颜春荣, 徐春祥. 高效液相色谱法测定鸭血制品中甲醛含量[J]. 食品科学, 2014, 35(12): 204-207. (In English: Gan NL, Yan CR, Xu CX. Determination of formaldehyde in duck blood products by HPLC[J]. Food Sci, 2014, 35(12): 204-207. DOI:10.7506/spkx1002-6630-201412042) |
| [4] |
冯耀基, 黎少映, 兰红军. 柱后衍生-高效液相色谱法测定空气中甲醛[J]. 中国卫生检验杂志, 2018, 28(9): 1041-1043. (In English: Feng YJ, Li SY, Lan HJ. Determination of formaldehyde in air by high efficiency liquid chromatography with post-column derivation[J]. Chin J Health Lab Technol, 2018, 28(9): 1041-1043.) |
| [5] |
牛凤兰, 宋德锋, 吕喆, 等. 甲醛的毒性及预防研究进展[J]. 现代预防医学, 2010, 37(12): 2220-2222. (In English: Niu FL, Song DF, Lv Z, et al. The progression of the research on formaldehyde toxicity[J]. Mod Prev Med, 2010, 37(12): 2220-2222.) |
| [6] |
苗娟, 魏学锋. 甲醛对人体健康影响及其暴露水平的调查[J]. 环境科学与技术, 2008, 31(10): 79-81. (In English: Miao J, Wei XF. Health effect of formaldehyde and investigation on exposure dose[J]. Environ Sci Technol, 2008, 31(10): 79-81. DOI:10.3969/j.issn.1003-6504.2008.10.020) |
| [7] |
梁晓军, 施健, 赵萍, 等. 中国居民室内甲醛暴露水平及健康效应研究进展[J]. 环境卫生学杂志, 2018, 7(2): 170-181. (In English: Liang XJ, Shi J, Zhao P, et al. Progress on indoor formaldehyde exposure and health effects in China[J]. J Environ Hyg, 2018, 7(2): 170-181.) |
| [8] |
World Health Organization. IARC monographs on the evaluation of carcinogenic risks to humans Volume 88: formaldehyde, 2-butoxyethanol and 1-tert-Butoxypropan-2-ol[R]. Geneva: World Health Organization, 2006.
|
| [9] |
王瑶, 李晓辉, 刘艳, 等. 成都市水发食品中甲醛含量及膳食暴露评估[J]. 中国卫生检验杂志, 2016, 26(8): 1192-1194. (In English: Wang Y, Li XH, Liu Y, et al. Assessment on the dietary exposure and the formaldehyde content in soaked food in Chengdu[J]. Chin J Health Lab Technol, 2016, 26(8): 1192-1194.) |
| [10] |
中华人民共和国农业部渔业局. SC/T 3025-2006水产品中甲醛的测定[S].北京: 中国农业出版社, 2006. (In English: Fishery Bureau of the Ministry of Agriculture of the People's Republic of China. SC/T 3025-2006 Determination of formaldehyde in aquatic products[S]. Beijing: China Agricultural Press, 2006.)
|
| [11] |
陈俊, 周路明. 亚铁氰化钾-乙酸锌在HPLC测定酱油中防腐剂的应用[J]. 中国调味品, 2007(10): 72-74. (In English: Chen J, Zhou LM. Potassium hexacyanoferrate-Zine acetate is used in preservative of sauce by HPLC[J]. China Cond, 2007(10): 72-74. DOI:10.3969/j.issn.1000-9973.2007.10.016) |
| [12] |
石峻, 董勇. 一起食用血旺引起的食物中毒调查[J]. 现代预防医学, 2007, 34(2): 381. DOI:10.3969/j.issn.1003-8507.2007.02.091 |

