2. 南通市疾病预防控制中心
有机磷农药三氯杀螨醇杀虫剂自1982年已禁用于茶叶生产,但近年来茶叶中检出该农药时有报道。2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考中,三氯杀螨醇属于3类致癌物。拟除虫菊酯类农药是广谱的杀虫剂,多用于防治农业病虫害,但其毒性较大,应做好残留检测工作。我国国标《食品中农药最大残留限量》(GB 2763-2016)[1]对上述两类农药做了最大残留量(MRL)规定[1]。
目前,有机氯农药和拟除虫菊酯类农药残留检测方法主要有液相色谱法[2]、液相色谱—质谱法[3-4]、气相色谱法[5-9]、气相色谱—质谱法[10-14]、气相色谱—三重四级杆串联质谱[15-20]等。气相色谱—串联质谱(GC-MS/MS)优点是基于单四级杆的优点上更具有使用色谱柱的高效分离特性将样品组分进行有效的分离,从而进行定量分析;再结合质谱,能够将样品进一步离子化,从而能够准确的进行定性鉴别。鉴于在食品农药残留检测中得到越来越广泛的应用,能更好的保障公众的饮食安全。研究根据上述优点使用了气相色谱—三重四级杆串联质谱仪对样品进行三氯杀螨醇、氯氟氰菊酯、氟氯氰菊酯、氰戊菊酯和溴氰菊酯检测。对于茶叶样品存在着结构复杂,色素多等问题,本文对提取溶剂、N-丙基乙胺(PSA)用量以及净化方法等进行了比较,最终采用了乙腈提取,改进的快速、简单、廉价、有效、可靠和安全(QuEChERS)的净化方法进行处理,得到了比较好的结果。
与国标相比,本文应用改进的QuEChERS法作为茶叶净化方法,采用气相色谱—三重四级杆串联质谱仪质谱多反应监测MRM数据库对样品进行检测。
1 材料与方法 1.1 仪器与试剂GCMS-TQ8040气相色谱—串联质谱联用仪(岛津公司);FSH-Ⅱ型高速电动匀浆器(环宇仪器公司);TGL-16台式高速冷冻离心机(湖南湘仪);Vortex-genie22T涡旋振荡器(上海凌初公司);Techne氮吹仪(美国TECHNE公司);AR2130电子天平(感量0.000 1 g);WSZ-20 A震荡器(上海-恒科技有限公司);LABOROTA 4 000eco旋转蒸发仪(德国)。
农药标准品溶液:三氯杀螨醇(100 μg/mL,北京曼哈格生物科技有限公司,99.7%);氟氯氰菊酯(100 μg/mL,北京曼哈格生物科技有限公司,99.0%);氯氟氰菊酯(100 μg/mL,北京曼哈格生物科技有限公司,99.7%);氰戊菊酯(100 μg/mL,北京曼哈格生物科技有限公司,99.7%);溴氰菊酯(100 μg/mL,北京曼哈格生物科技有限公司,99.7%)。乙腈(色谱纯)、丙酮(色谱纯)、正己烷(色谱纯)、乙酸乙酯(分析纯);氯化钠(分析纯);无水硫酸钠(分析纯,用前在650 ℃灼烧4 h,储于干燥器中,冷却后备用)(北京曼哈格生物科技有限公司)。
5种农药及异构体混合标准溶液的配制:精确吸取0.1 mL,用丙酮溶液定容至10 mL容量瓶中,配成1 mg/L混合标准品使用液。精确吸取适量的混合标准使用液,用正己烷溶剂稀释,配制成含5种农药及异构体混合标准溶液的质量浓度分别为5、10、20、50、80和100 μg/L的系列标准工作液。
试样采购自江苏淮安地区市售的茶叶。将其分别匀浆后于-20 ℃下贮存备用。
1.2 分析条件 1.2.1 气相色谱条件色谱柱:Rtx-5MS(30 m×0.32 mm×0.25 μm) (岛津公司);载气:氦气(纯度>99.999%);碰撞气:氩气(纯度>99.999%);恒流:1.0 ml/min,不分流进样;进样量为1 μL;溶剂延迟5 min;柱温程序采用程序升温法,初始温度50 ℃,保持1 min,以25 ℃/min升至125 ℃,以10 ℃/min升至300 ℃,保持5 min。
1.2.2 质谱条件离子源温度:230 ℃;传输温度:250 ℃;采集方式:质谱多反应监测(MRM)模式。利用C9~C33正构烷烃数据和Smart MRM农药数据库创建MRM方法,各组分的保留时间和MRM扫描离子见表 1。
| 农药名称 | 保留时间/min | 定量离子对/(m/z) | 碰撞电压/eV | 定性离子对/(m/z) | 碰撞电压/eV | 定性离子对/(m/z) | 碰撞电压/eV |
| 三氯杀螨醇 | 13.886 | 139.0>111.0 | 16 | 139.0>75.0 | 28 | 250.0>139.0 | 14 |
| 顺式氯氟氰菊酯 | 18.697 | 208.0>181.0 | 8 | 197.0>141.0 | 12 | 197.0>161.0 | 8 |
| 反式氯氟氰菊酯 | 18.874 | 208.0>181.0 | 8 | 197.0>141.0 | 12 | 197.0>161.0 | 8 |
| 顺式氟氯氰菊酯 | 20.370 | 163.1>127.1 | 6 | 163.1>91.0 | 14 | 226.1>206.1 | 14 |
| 反式氟氯氰菊酯 | 20.413 | 163.1>127.1 | 6 | 163.1>91.0 | 14 | 226.1>206.1 | 14 |
| 顺式氰戊菊酯 | 21.430 | 225.1>119.1 | 20 | 225.1>147.1 | 10 | 419.1>225.1 | 6 |
| 反式氰戊菊酯 | 21.635 | 225.1>119.1 | 20 | 225.1>147.1 | 10 | 419.1>225.1 | 6 |
| 溴氰菊酯 | 22.208 | 180.9>151.9 | 22 | 252.9>93.0 | 20 | 252.9>171.9 | 8 |
1.3 试验方法 1.3.1 样品提取
称取匀浆样品2.0 g于50 mL离心管中,加入2 mL纯水浸泡5 min,加2.0 g氯化钠振摇混匀,加10 mL乙腈,涡旋混匀1 min,超声提取30 min,加入8.0 g无水硫酸钠,涡旋混匀1 min,5 000 rpm/min, 离心半径9.5 cm,离心5 min,取上清液于鸡心瓶中。用10 mL乙腈重复提取1次,合并上清液,待净化。
1.3.2 净化取上清液8 mL于15 mL QuEChERS离心管中,涡旋1 min,10 000 rpm/min,离心半径8.2 cm离心2 min。取上清液至鸡心瓶中,30 ℃水浴中减压浓缩至近干,以正己烷复溶并定容至1 mL,过0.22 μm滤膜,待气GC-MS/MS分析测定。
1.3.3 计算公式试样中农药残留含量按下式进行计算。
| $ C=c×v×k/m $ | (1) |
式中:C —待测样品中农药浓度,mg/kg;
c —测定液中农药浓度,μg/mL;
v —稀释倍数;
k —待测样品定容体积,mL;
m —待测样品量,g。
1.4 质量控制本文进行了茶叶中农药标准物质(GBW10083)的测定,进行质量控制。三氯杀螨醇和氟氯氰菊酯的标准值分别为(51.3±3.7)μg/kg和(47.2±4.8)μg/kg。将标准物质(GBW10083)通过上述方法净化提取后,用GC-MS/MS进行检测,三氯杀螨醇和氟氯氰菊酯的检测值分别为(47.7±4.4)μg/kg和(45.6±5.1)μg/kg。测得值和标准值基本一致。
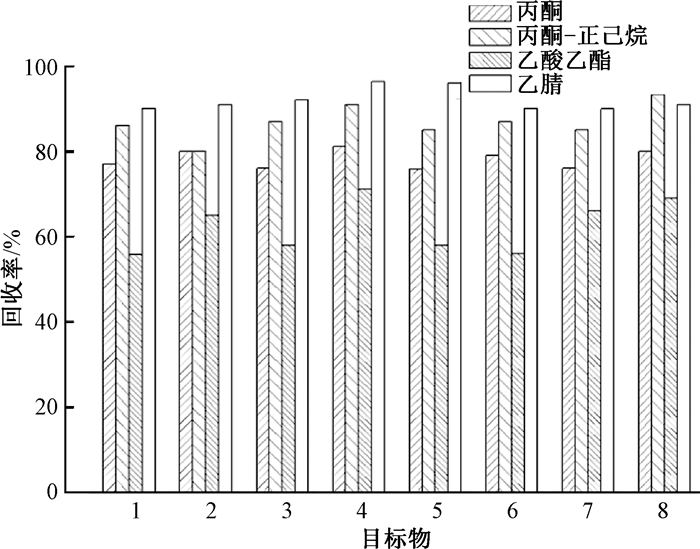
2 结果 2.1 提取溶剂的选择提取溶剂的选择主要取决于待测物的性质及待测样品的性质。目前农药多残留分析方法采用的提取溶剂有丙酮、丙酮—正己烷、乙腈和乙酸乙酯等。试验采用上述提取溶剂对目标物提取效率的影响进行了考察。以茶叶空白进行加标回收试验(加标水平为50 μg/kg,平行测定3次)进行对比(见图 1)。从中可以看出不同的提取溶剂对大多数的被测组分的提取效果。在目标组分比较中,乙腈提取回收率为89.9%~96.3%,优于乙酸乙酯(55.8%~71.1%)、丙酮(75.8%~81.1%)和丙酮—正己烷(80.0%~93.3%)。在试验中可以看出乙酸乙酯溶出目标物较少,丙酮和丙酮-正己烷溶出了较多的油脂和色素使得分层不好,净化过程变得复杂,而乙腈具有很好的通用性,对农药的溶解度较大,溶出的油脂类和色素杂质较少,而且其分子小,组织穿透能力强,故选用乙腈作为提取试剂。
|
| 目标物:1.三氯杀螨醇;2.顺式氯氟氰菊酯;3.反式氯氟氰菊酯;4.顺式氟氯氰菊酯;5.反式氟氯氰菊酯;6.顺式氰戊菊酯;7.反式氰戊菊酯;8.溴氰菊酯 图 1 不同提取溶剂对5种组分加标回收率比较 |
2.2 正一苯基乙二胺(PSA)对回收率影响
考察了PSA的用量对目标物净化提取的影响。在8 mL加标基质提取液中分别加入50、100、200、400、500和800 mg PSA,其它试验条件不变的情况下,试验结果见图 2。PSA是与氨气根物质(NH4)相似的吸附剂,具有两个氨基,比氨基柱的离子交换更强,同时其可与金属离子有螯合作用,可有效去除样品中的有机酸、金属离子和色素等干扰物。试验中目标物的回收率随着PSA用量的增加呈现先增加后下降的情况,并在PSA为400 mg时达到最大值。当PSA用量过大时,吸附完杂质达到饱和后,过多的会对目标化合物产生吸附作用。因此,本文选用PSA用量为400 mg。

|
| 图 2 PSA用量对5种组分加标回收率的影响 |
2.3 基质效应
基质效应一般是指除目标物外的其他成分对目标物的影响。由于茶叶样品中复杂基质成分的存在,基质效应的存在不可避免,研究采用较简单的相对响应值法来判断基质效应情况。主要过程是:分别配制5 μg/kg的混合目标物在不同并不含有本文所涉及目标物的茶叶基质的基质标准溶液和同浓度的正己烷溶剂标准溶液,在气相色谱—串联质谱中进行检测并计算其基质效应值。基质效应(matrix effect,ME)=B/A×100%,其中B为不含有本文所涉及目标物的茶叶样品基质中标准溶液的响应值,A为纯溶剂及不含样品的溶剂中相同含量标准溶液的响应值,通过比值考查基质效应的大小。基质效应值在80%以下视为强基质抑制效应,在80%~120%之间视为弱基质效应,在120%以上视为强基质增加效应。通过试验发现,三氯杀螨醇表现出弱基质效应(87%~102%),而其他拟除虫菊酯类农药表现出基质增加效应(>120%),而且目标物在不同茶叶中的基质效应结果相似(表 2)。目前减少基质效应影响的方法主要使用基质匹配标准溶液建立标准工作曲线,对基质效应进行校正。
| 农药 | 黑茶 | 白茶 | 红茶 | 绿茶 |
| 三氯杀螨醇 | 87 | 89 | 95 | 102 |
| 顺式氯氟氰菊酯 | 137 | 145 | 138 | 152 |
| 反式氯氟氰菊酯 | 145 | 154 | 128 | 162 |
| 顺式氟氯氰菊酯 | 126 | 132 | 135 | 141 |
| 反式氟氯氰菊酯 | 131 | 128 | 129 | 132 |
| 顺式氰戊菊酯 | 138 | 138 | 130 | 134 |
| 反式氰戊菊酯 | 142 | 144 | 140 | 147 |
| 溴氰菊酯 | 164 | 158 | 155 | 151 |
2.4 净化条件的选择
试验对3种常用的净化柱方法进行了加标回收试验比较。分别对QuEChERS、Carb/NH2柱、Florisil柱净化提取效果进行比较,在不含有本文所涉及目标物茶叶中加入混合标准溶液,配制成50 μg/kg并进行提取净化检测,计算其回收率并进行比较。具体方法:① QuEChERS净化按本文净化方法操作。② Carb/NH2柱净化:柱上加2 cm无水硫酸钠,用5 mL乙腈—甲苯(3 :1,v/v)溶液活化,提前液经5 mL乙腈复溶后上样并收集,以20 mL乙腈—甲苯(3 :1,v/v)溶液洗脱,合并洗脱液,经30 ℃水浴中减压蒸馏浓缩至近干,用1 mL正己烷准确定容过膜,上气相色谱串联质谱仪(GC-MS/MS)检测。③ Florisil柱净化:柱上加入80 mg的PSA粉末,依次用5 mL丙酮-正己烷(1 :9,v/v)和5 mL正己烷活化,提取液经5 mL正己烷复溶后上样并收集,采用20 mL丙酮—正己烷(1 :9,v/v)溶液洗脱,收集合并洗脱液,经30 ℃水浴中减压蒸馏浓缩至近干,用1 mL正己烷准确定容过膜,上GC-MS/MS检测。3种方法对目标物回收率影响如图 3,结果如下:在使用QuEChERS时为90.8%~105.4%,Carb/NH2柱时为85.6%~115.8%,Florisil净化柱为78.3%~124.0%。从结果中可以看出,在使用Carb/NH2柱、Florisil净化柱时较QuEChERS方法回收率相接近,因此这三种净化方法都可以用在茶叶基质净化,而考虑到所用试剂和操作简易程度等问题,本文采用了QuEChERS方法净化。

|
| 目标物:1.三氯杀螨醇;2.顺式氯氟氰菊酯;3.反式氯氟氰菊酯;4.顺式氟氯氰菊酯;5.反式氟氯氰菊酯;6.顺式氰戊菊酯;7.反式氰戊菊酯;8.溴氰菊酯 图 3 不同净化柱对5种组分加标回收率比较 |
2.5 GC-MS/MS测定
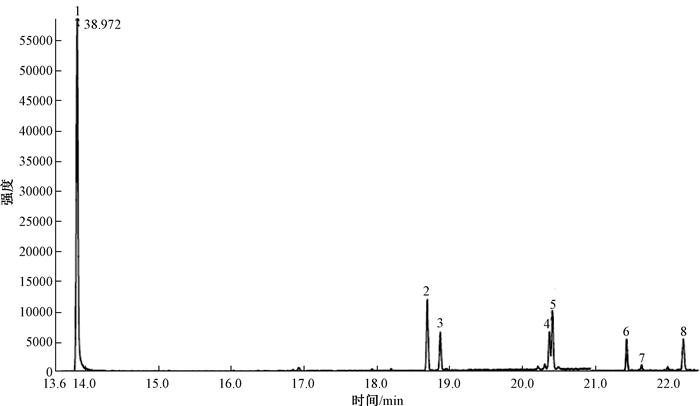
5种混合标准溶液(50 μg/kg)的总离子流图(图 4)。各组分都能够很好分离及定量检测。
|
| 1.三氯杀螨醇;2.顺式氯氟氰菊酯;3.反式氯氟氰菊酯;4.顺式氟氯氰菊酯;5.反式氟氯氰菊酯;6.顺式氰戊菊酯;7.反式氰戊菊酯;8.溴氰菊酯 图 4 5种目标物混合标准溶液(50 μg/kg)总离子流谱图 |
2.6 标准曲线和检出限
采用不含本试验目标物的茶叶做空白基质,配制混合标准工作液并绘制标准曲线,以目标化合物的质量浓度(μg/L)为横坐标,相对应的峰面积为纵坐标,得到线性方程及相关系数。以S/N=3时的质量浓度作为LOD值;以S/N=10时的质量浓度作为LOQ值。配制成5种农药的质量浓度分别为5、10、20、50、80和100 μg/L的系列标准工作液,分别进行GC-MS/MS测定。每个浓度点平行测定3次,以峰面积平均值对质量浓度进行线性回归,得到的回归方程见表 3。5种农药的线性范围在(5~100) μg/L之间,相关系数均>0.99。
| 农药 | 线性方程 | 相关系数r | 检测限/(μg/kg) |
| 三氯杀螨醇 | y=673.1 x+741.5 | 0.999 4 | 0.1 |
| 顺式氯氟氰菊酯 | y=511.6 x+1063.6 | 0.999 5 | 0.02 |
| 反式氯氟氰菊酯 | y=269.6 x+277.2 | 0.999 1 | 0.03 |
| 顺式氟氯氰菊酯 | y=286.8 x+355.7 | 0.999 4 | 0.08 |
| 反式氟氯氰菊酯 | y=483.2 x-17.2 | 0.999 3 | 0.09 |
| 顺式氰戊菊酯 | y=296.1 x-672.6 | 0.999 2 | 0.02 |
| 反式氰戊菊酯 | y=46.5 x-247.5 | 0.996 8 | 0.03 |
| 溴氰菊酯 | y=419.7 x-426.1 | 0.999 7 | 0.02 |
2.7 方法的精密度和回收试验
分别取不含有上述5种农药的空白茶叶样品为基质,进行4个不同水平(5、10、50和80 μg/kg)的加标回收试验,每个水平平行检测6次,连续做4 d。
4个加标水平的平均回收率在78.6%~111.2%之间,日内相对标准偏差(RSD) < 15.2%,日间RSD < 17.4% (表 3),说明方法的准确度和精密度良好。
2.8 样品检测按食品污染物风险监测2018年计划抽取本地区25例市售茶叶样品,包括5种红茶、10种绿茶、5种乌龙茶和5种黑茶,利用本方法对其进行分析测定。样品中检出三氯杀螨醇、氯氟氰菊酯、氟氯氰菊酯和溴氰菊酯等4种农药,共检出17频次。其中农药种类多并且含量较高的样品有:绿茶4号样品检出了三氯杀螨醇、氯氟氰菊酯和氰戊菊酯的含量分别为0.05、5.61和4.32 mg/kg,乌龙茶2号样品检出的氯氟氰菊酯2.44 mg/kg,红茶5号样品检出的溴氰菊酯6.01 mg/kg,黑茶1号样品检出的氟氯氰菊酯0.35 mg/kg,其它检出值较低。共17个样品中检出农药,检出率68.0%,检出农药的残留量均未超过中国MRL标准。
3 结论研究中可以看到茶叶的基质较复杂,基质效应较为明显,干扰了目标物的检测。针对基质的影响,主要是通过采用更好的提取净化方法,既能去除基质,又对目标物影响较小的方法;并用空白基质做工作曲线以最大程度减少基质对目标物的影响。本文通过实验比较了QuEChERS、Carb/NH2柱、Florisil柱三种农药残留中常用的提取方法,从结果中可以看出这三种方法都适用于茶叶的净化提取。但也有所不同,其中Carb/NH2柱和Florisil柱的商品化程度高,由于生产厂商不同和批号不同,其净化效率及回收率会有差异,在使用前需要做回收率测试,较为繁琐;而QuEChERS法与其他两种固相萃取柱相比较为简单、快速,其试剂材料可以自行添加操作较为灵活。
| 农药 | 5(μg/kg) | 10(μg/kg) | 50(μg/kg) | 80(μg/kg) | 日内RSD/% | 日间RSD/% | |||||||
| 回收率/% | RSD/% | 回收率/% | RSD/% | 回收率/% | RSD/% | 回收率/% | RSD/% | ||||||
| 三氯杀螨醇 | 77.8 | 5.8 | 88.9 | 4.6 | 93.3 | 3.2 | 102.5 | 2.5 | 1.5~8.3 | 1.9~9.5 | |||
| 氯氟氰菊酯1 | 84.3 | 2.1 | 87.9 | 1.5 | 96.6 | 3.5 | 111.2 | 3.1 | 1.7~10.3 | 1.2~8.9 | |||
| 氯氟氰菊酯2 | 74.3 | 3.4 | 85.9 | 4.8 | 93.8 | 5.3 | 97.9 | 4.1 | 7.1~15.2 | 2.5~16.1 | |||
| 氟氯氰菊酯1 | 81.2 | 3.8 | 87.9 | 4.2 | 98.2 | 2.8 | 97.8 | 2.2 | 3.1~8.8 | 3.6~9.6 | |||
| 氟氯氰菊酯2 | 75.8 | 5.6 | 79.8 | 5.1 | 79.9 | 5.7 | 90.1 | 2.6 | 4.3~8.3 | 3.8~11.5 | |||
| 氰戊菊酯1 | 93.2 | 1.5 | 94.8 | 2.5 | 102.5 | 4.8 | 100.2 | 3.2 | 3.8~4.6 | 2.8~5.6 | |||
| 氰戊菊酯2 | 74.9 | 4.8 | 80.8 | 4.3 | 100.9 | 1.2 | 93.3 | 3.5 | 4.2~8.9 | 3.5~10.1 | |||
| 溴氰菊酯 | 81.9 | 1.8 | 93.7 | 2.8 | 97.8 | 5.1 | 95.1 | 2.0 | 2.7~10.4 | 6.2~17.4 | |||
研究中使用GC-MS/MS来检测目标物,其优点是采用多反应监测(MRM)通过三重串联四级杆的选择作用,过滤掉基质中大部分离子,使得噪声大幅度降低,基质效应明显消除,从而信噪比增加,提高了灵敏度。特别对于复杂基质中假阳性结果能够得到准确的排除。还具有背景干扰低、选择性好、灵敏度高等特点。
本研究采用QuEChERS前处理的方法,建立了GC-MS/MS气相色谱-串联质谱法定量测定茶叶中5种杀虫剂残留量的方法,可为监管部门制定和监测三氯杀螨醇和拟除虫菊酯类农药残留相关安全法规和监控检测提供依据。
| [1] |
中华人民共和国国家卫生和计划生育委员会, 农业部, 国家食品药品监督管理总局. GB 2763-2016食品安全国家标准食品中农药最大残留限量[S].北京: 中国标准出版社, 2017. (In English: National Health and Family Planning Commission of the People's Republic of China, Ministry of Agriculture of the People's Republic of China, China Food and Drug Administration. GB 2763-2016 National food safety standard-Maximum residue limits for pesticides in food[S]. Beijing: China Standard Press, 2017.)
|
| [2] |
张雷, 曹淑瑞, 谭斯匀, 等. 高效液相色谱法快速检测茶叶中三氯杀螨醇[J]. 分析试验室, 2017, 36(9): 1048-1052. (In English: Zhang L, Cao SR, Tan SY, et al. Determination of dicofol residues in tea by high performance liquid chromatography[J]. Chin J Anal Lab, 2017, 36(9): 1048-1052.) |
| [3] |
秦伟瀚, 阳勇, 师萱, 等. 基质分散固相萃取法同时检测13种不同产地昆明山海棠中有机磷和拟除虫菊酯类农药残留[J]. 中国医院药学杂志, 2017, 37(7): 613-616. (In English: Qin WH, Yang Y, Shi X, et al. Simultaneous determination of organophosphorus pesticide and pyrethroid pesticide residues from 13 different habitats of Tripterygium hypoglaucum (Levl.) Hutch by matrix solid phase extraction[J]. Chin J Hosp Pharm, 2017, 37(7): 613-616.) |
| [4] |
张聪, 周常义, 江锋, 等. 超高效液相色谱-串联质谱法测定动物性食品中10种拟除虫菊酯类农药残留[J]. 分析测试学报, 2018, 37(8): 887-893. (In English: Zhang C, Zhou CY, Jiang F, et al. Determination of 10 pyrethroid pesticide residues in animal foods by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2018, 37(8): 887-893. DOI:10.3969/j.issn.1004-4957.2018.08.003) |
| [5] |
李丽春, 刘书贵, 尹怡, 等. 气相色谱法检测水产品中拟除虫菊酯类农药的基质效应研究[J]. 现代食品科技, 2018, 34(4): 270-281. (In English: Li LC, Liu SG, Yin Y, et al. Matrix effects of pyrethroid pesticides in aquatic products using gas chromatography[J]. Mod Food Sci Technol, 2018, 34(4): 270-281.) |
| [6] |
于飞飞, 郐鹏, 周宏霞, 等. 基于QuEChERS净化-气相色谱法检测樱桃中16种有机氯及拟除虫菊酯类农药残留[J]. 农药, 2018, 57(5): 340-342, 354. (In English: Yu FF, Kuai P, Zhou HX, et al. Determination of 16 organochlorine pesticides and pyrethroid pesticides in cherry using QuEChERS purification and GC[J]. Agrochemicals, 2018, 57(5): 340-342, 354.) |
| [7] |
胡艳, 余术, 陈聪, 等. 固相萃取-GC-ECD法测定草莓中的4种菊酯类农药[J]. 轻工科技, 2018, 34(5): 113-114. |
| [8] |
洪泽淳, 熊含鸿, 郑悦珊, 等. QuEChERS-气相色谱法测定蔬菜中15种有机氯及菊酯类农药残留[J]. 食品安全导刊, 2018(1-2): 92-94. |
| [9] |
麦岱玲, 李映纯. 气相色谱法测定果蔬中农药残留的应用分析[J]. 农业与技术, 2018, 38(11): 44-45. |
| [10] |
黄季维, 刘天洁, 梅玉琴, 等. 分散固相萃取法用于测定茶叶中10种拟除虫菊酯及有机氯农药残留[J]. 预防医学情报杂志, 2018, 34(11): 1414-1417. (In English: Huang JW, Liu TJ, Mei YQ, et al. Application of dispersive solid phase extraction in the determination of residual pyrethroid and organochlorine pesticides in tea[J]. J Prev Med Inf, 2018, 34(11): 1414-1417.) |
| [11] |
潘晓春. 液液微萃取-气相色谱质谱法测定生活饮用水中的5种菊酯类农药[J]. 中国测试, 2018, 44(11): 45-49. (In English: Pan CX. Determination of 5 pyrethroid pesticides in drinking water by liquid liquid microextraction coupled with gas chromatography-mass spectrometry[J]. China Meas Test, 2018, 44(11): 45-49. DOI:10.11857/j.issn.1674-5124.2018.11.008) |
| [12] |
郭红勤, 詹磊, 宋耀英, 等. 气相色谱法与气相色谱-质谱联用法测定卷心菜粉中联苯菊酯、溴虫腈和氟虫腈[J]. 中国卫生检验杂志, 2018, 28(4): 409-411. (In English: Guo HQ, Zhan L, Song YY, et al. Determination of biphenyl, bromine and fipronil in cabbage powder by gas chromatography-mass spectrometry[J]. Chin J Health Lab Technol, 2018, 28(4): 409-411.) |
| [13] |
曹亚林, 李伟, 裴晓华, 等. 快速溶剂萃取-气相色谱质谱法快速测定茶叶中7种拟除虫菊酯农残[J]. 分析仪器, 2018(3): 57-63. (In English: Cao YL, Li W, Pei XH, et al. Determination of seven pyrethroids in tea by APLE-GC/MS[J]. Anal Instrum, 2018(3): 57-63. DOI:10.3969/j.issn.1001-232x.2018.03.010) |
| [14] |
李瑾, 卜雕雕, 王媚, 等. 固相萃取净化-气相色谱质谱联用法快速测定金银花软胶囊浸膏中的农药残留[J]. 现代中医药, 2017, 37(3): 75-78. (In English: Li J, Bu DD, Wang M, et al. Rapid determination of pesticide residue in Jinyinhua soft capsule extract by SPE purification combined with GC-MS[J]. Mod Tradit Chin Med, 2017, 37(3): 75-78.) |
| [15] |
王吉祥, 牛之瑞, 冯雷, 等. SPE-GC-MS/MS法测定茶叶中49种农药残留[J]. 食品研究与开发, 2017, 38(13): 173-178. (In English: Wang JX, Niu ZR, Feng L, et al. Determination of 49 kinds of pesticide residues in tea by SPE and gas chromatography-tandem mass spectrometry[J]. Food Res Dev, 2017, 38(13): 173-178. DOI:10.3969/j.issn.1005-6521.2017.13.037) |
| [16] |
钱承敬, 史晓梅, 谢云峰, 等. 气相色谱-串联质谱法测定茶叶茶汤中多种农药残留量[J]. 食品安全质量检测学报, 2017, 8(8): 3218-3230. (In English: Qian CJ, Shi XM, Xie YF, et al. Determination of multi-pesticide residues in tea and tea infusion by gas chromatography-tandem mass spectrometry[J]. J Food Saf Qual, 2017, 8(8): 3218-3230. DOI:10.3969/j.issn.2095-0381.2017.08.062) |
| [17] |
鹿尘, 张正尧, 孙翠霞. 固相萃取-三重串联四级杆气相色谱-质谱联用法测定蔬菜中57种农药残留[J]. 中国卫生检验杂志, 2016, 26(5): 636-639, 643. (In English: Lu C, Zhang ZY, Sun CX. Determination of 57 kinds of residual pesticide in vegetables by solid-phase extraction-triple quadrupole gas chromatography-mass spectrometry[J]. Chin J Health Lab Technol, 2016, 26(5): 636-639, 643.) |
| [18] |
孙梦园, 石志红, 李建勋, 等. 分散固相萃取-分散液液微萃取结合气相色谱-三重四极杆质谱法测定茶叶中7种拟除虫菊酯类农药残留[J]. 分析测试学报, 2017, 36(5): 595-600. (In English: Sun MY, Shi ZH, Li JX, et al. Determination of 7 pyrethroid pesticide residues in tea by gas chromatography-triple quadrupole mass spectrometry combined with dispersive solid-phase extraction and dispersive liquid-liquid microextraction[J]. J Instrum Anal, 2017, 36(5): 595-600. DOI:10.3969/j.issn.1004-4957.2017.05.003) |
| [19] |
张延平, 沈丹玉, 陈振超, 等. 分散固相萃取-气相色谱/串联质谱法测定竹笋中38种持久性有机污染物[J]. 分析试验室, 2018, 37(6): 671-676. (In English: Zhang YP, Shen DY, Chen ZC, et al. Determination of 38 persistent organic pollutants in bamboo shoot by dispersive solid phase extraction gas chromatography-tandem mass spectrometry[J]. Chin J Anal Lab, 2018, 37(6): 671-676.) |
| [20] |
刘丽, 张琦, 王海雁, 等. 串联双柱固相萃取-气相色谱-串联质谱法检测茶叶中拟除虫菊酯[J]. 色谱, 2017, 35(8): 860-866. (In English: Liu L, Zhang Q, Wang HY, et al. Determination of pyrethroid pesticides in tea by series two-solid phase extraction-columns cleanup and gas chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2017, 35(8): 860-866.) |


