全氟及多氟类化合物(Per- and polyfluoroalkyl substances,PFASs)从上世纪50年代开始使用,是一类人为制造的化学品,常作为表面活性剂被用于润滑剂、涂料、洗护用品、纺织品、农药、防火材料等方面[1, 2]。PFASs的碳原子上的氢原子全部或者多数被氟原子取代,该类化合物具有很强的稳定性,难以光解、水解和被生物降解。在全球范围内,PFASs污染非常普遍,据研究报道,在环境介质(水、土和气)[3-5]、人体样本[6]、食物[7]和水生生物[8]中均有检出。2009年5月9日,全氟辛烷磺酸(Perfluorooctane sulfonic acid, PFOS)及其盐类和全氟辛烷磺酰氟(Perfluorooctanesulfonyl fluoride,PFOSF)作为新增的持久性有机污染物,被联合国环境规划署列入持久性有机污染物(POPs, Persistent Organic Pollutants)名单。另外,在联合国环境规划署的2015年和2017年的第七次和第十三次POPs大会上,全氟辛烷羧酸(Perfluorooctanoic acid,PFOA)和全氟己烷磺酸(Perfluorohexane sulfonic acid,PFHxS)也被提议列入斯德哥尔摩公约的POPs名单[1, 9]。
近年来,PFASs一直是研究热点,有研究表明,其可在生物体内蓄积并通过食物链放大,而且在生物体内的水平高于已知的有机氯农药和二噁英等持久性有机污染物的数百至数千倍,能够富集在血液、肝脏、肾脏、肌肉和脾脏等器官中,且以血液和肝脏中浓度最高[10]。血清蛋白是全氟化合物结合的主要目标物,这可能是全氟化合物具有生物富集性的原因之一[6]。毒理学研究表明,PFASs可能导致肝毒性、致癌性、免疫毒性、生殖毒性以及内分泌干扰毒性等[11]。
目前,用于检测人体PFASs暴露水平的生物样本包括血液(血清、全血)、乳汁、尿液、头发、指甲和脐带血等,以血清样本最多,其浓度水平也相对较高。污染物内暴露水平是反映其对人体健康危害的重要指标,因此,建立快速稳定的分析血清中PFASs方法尤为重要。本研究采用甲基叔丁基醚为萃取液,对震荡提取时间和试剂用量进行优化,并采用国际认可的4种质控样品对方法的准确性进行考核,建立了血清中18种全氟化合物快速、准确的分析方法。
1 材料与方法 1.1 仪器与试剂高效液相色谱—串联质谱联用仪:API 4000电喷雾离子化—三重四极杆质谱仪(美国AB公司);Acquity I Class超高效液相色谱仪(美国Waters公司);HY-5B型回旋式振荡器(中国金坛市城东新瑞仪器厂);600 C离心机(中国北京白洋医疗器械有限公司);3K15高速离心机(德国Sigma公司);EFCG-11848 MUTIVAP氮吹仪(美国ORGANOMATION);MS2涡流振荡器(美国Scientific Industries公司)。
乙腈、甲醇和水(LC-MS级,购自德国Merck公司);乙酸铵(LC-MS级,美国Fisher Chemical公司);甲基叔丁基醚(纯度99.8%,德国Merck公司);四丁基硫酸氢铵(纯度97%)、NaHCO3(纯度99.7%)和Na2CO3(纯度99.5%)均购自美国SIAMA-ALDRICH公司;超纯水(PALL cascada I所制,18.2 MΩ ·cm);18种全氟化合物混合标准溶液(PFAC-MXC)和13种全氟化合物混合内标溶液(MPFAC-C-ES)购自加拿大Wellington laboratories;血清NIST1957质控样(美国National Institute of Standards and Technology),胎牛血清(中国浙江天杭生物科技股份有限公司)。18种全氟化合物资料信息见表 1。
| 序号 | 化合物 | 缩写 | 英文全称 | 分子式 |
| 1 | 全氟丁酸 | PFBA | Perfluorobutyric acid | C3F7COOH |
| 2 | 全氟戊酸 | PFPeA | Perfluoropentanoic acid | C4F9COOH |
| 3 | 全氟己酸 | PFHxA | Perfluorohexanoic acid | C5F11COOH |
| 4 | 全氟庚酸 | PFHpA | Perfluoroheptanoic acid | C6F13COOH |
| 5 | 全氟辛酸 | PFOA | Perfluorooctanoic acid | C7F15COOH |
| 6 | 全氟壬酸 | PFNA | Perfluorononanoic acid | C8F17COOH |
| 7 | 全氟癸酸 | PFDA | Perfluorodecanoic acid | C9F19COOH |
| 8 | 全氟十一酸 | PFUnDA | Perfluoroundecanoic acid | C10F21COOH |
| 9 | 全氟十二酸 | PFDoA | Perfluorododecanoic acid | C11F23COOH |
| 10 | 全氟十三酸 | PFTrDA | Perfluorotridecanoic acid | C12F25COOH |
| 11 | 全氟十四酸 | PFTeDA | Perfluorotetradecanoic acid | C13F27COOH |
| 12 | 全氟丁烷磺酸 | PFBS | Perfluorobutane sulfonic acid | C4F9SO3H |
| 13 | 全氟戊烷磺酸 | PFPeS | Perfluoropentane sulfonic acid | C5F11SO3H |
| 14 | 全氟己烷磺酸 | PFHxS | Perfluorohexane sulfonic acid | C6F13SO3H |
| 15 | 全氟辛烷磺酸 | PFOS | Perfluorooctane sulfonic acid | C8F17SO3H |
| 16 | 全氟壬烷磺酸 | PFNS | Perfluorononane sulfonic acid | C9F19SO3H |
| 17 | 全氟癸烷磺酸 | PFDS | Perfluorodecane sulfonic acid | C10F21SO3H |
| 18 | 全氟十二烷磺酸 | PFDoS | Perfluorododecane sulfonic acid | C12F25SO3H |
1.2 UPLC条件
本实验所用色谱柱为Waters ACQUITY UPLC BEH C18色谱柱(100 mm ×2.1 mm,1.7 μm),柱温箱温度为40℃,流动相为2 mmol/L乙酸铵(A)和乙腈(B);梯度洗脱程序:0 min,90% A;1.0 min,80% A;(4.0~6.0) min,10% A;(6.1~8.0) min,90% A。进样量10 μL;流速300 μL/min。图 1为5 ng/mL目标分析物的色谱图和保留时间。
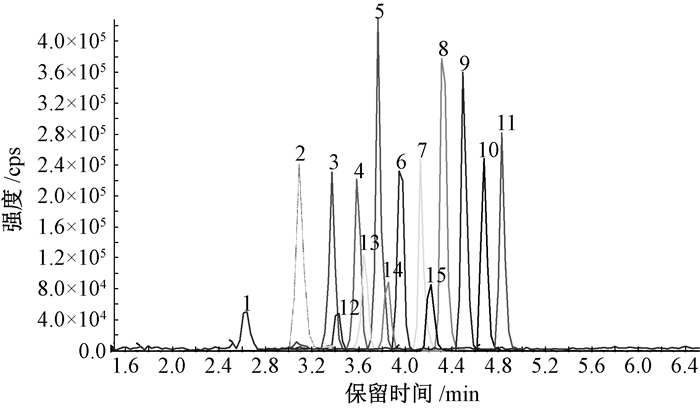
|
| 1. PFBA, 2. PFPeA, 3. PFHxA, 4. PFHpA, 5. PFOA, 6. PFNA, 7. PFNA, 8. PFUnDA, 9. PFDoA, 10. PFTrDA, 10. PFTeDA, 12. PFBS, 13. PFPeS, 14. PFHxS, 15. PFOS, 16. PFNS, 17. PFDS, 18. PFDoS 图 1 18种目标分析物的色谱图 |
1.3 MS条件
将18种全氟化合物的甲醇标准中间液稀释成10.0 ng/mL的标准使用液,以10 μL/min的流速采用流动注射方式进样,在负离子模式下进行全扫描,以选择适当的分子离子峰。以目标化合物的[M-H]-为母离子进行子离子扫描,选择丰度较高、干扰较少的子离子,优化碰撞电压(Collision Energy)和去簇电压(Declustering Potential),(表 2);用10. 0 ng/mL混合标准溶液,在负电离模式下,以多反应监测(MRM)方式优化气帘气(CUR)、碰撞气(CAD)、雾化气(GS1)、辅助气(GS2)、离子源电压(IS)、离子化温度(TEM)等参数。优化结果如下:碰撞气(CAD):83 kPa;气帘气(CUR):103 kPa;雾化气(GS1):345 kPa;加热气(GS2):241 kPa;喷雾电压(IS):-4 000 V。
| 序号 | 化合物 | 内标物 | 母离子/子离子 | 碰撞能量/eV | 去簇电压/V |
| 1 | PFBA | 13C4-PFBA | 212.600/168.900 | -11 | -24 |
| 2 | PFPeA | 13C5-PFPeA | 262.600/219.000 | -12 | -25 |
| 3 | PFHxA | 13C5-PFHxA | 312.600/269.000 | -9 | -22 |
| 4 | PFHpA | 13C4-PFHpA | 362.800/319.000 | -17 | -15 |
| 5 | PFOA | 13C8-PFOA | 412.900/368.900 | -14 | -16 |
| 6 | PFNA | 13C9-PFNA | 462.900/419.200 | -15 | -30 |
| 7 | PFDA | 13C6-PFDA | 513.000/469.100 | -14 | -31 |
| 8 | PFUnDA | 13C7-PFUnDA | 563.000/519.200 | -17 | -23 |
| 9 | PFDoA | 13C2-PFDoA | 613.000/569.200 | -15 | -31 |
| 10 | PFTrDA | 13C2-PFTeDA | 663.000/619.000 | -15 | -41 |
| 11 | PFTeDA | 13C2-PFTeDA | 713.000/669.000 | -18 | -35 |
| 12 | PFBS | 18C3-PFBS | 299.000/80.000 | -48 | -48 |
| 13 | PFPeS | 18C3-PFBS | 348.900/80.000 | -55 | -30 |
| 14 | PFHxS | 18C3-PFHxS | 399.000/80.000 | -56 | -43 |
| 15 | PFOS | 13C8-PFOS | 498.900/99.000 | -66 | -56 |
| 16 | PFNS | 13C8-PFOS | 548.900/80.000 | -57 | -55 |
| 17 | PFDS | 13C8-PFOS | 599.100/80.000 | -70 | -57 |
| 18 | PFDoS | 13C2-PFTeDA | 699.100/80.000 | -75 | -75 |
| 19 | 13C4-PFBA | - | 217.000/172.000 | -14 | -24 |
| 20 | 13C5-PFPeA | - | 268.000/223.000 | -13 | -20 |
| 21 | 18C3-PFBS | - | 302.000/80.000 | -45 | -43 |
| 22 | 13C5-PFHxA | - | 318.000/273.000 | -14 | -21 |
| 23 | 13C4-PFHpA | - | 367.000/322.000 | -14 | -31 |
| 24 | 18C3-PFHxS | - | 402.000/80.000 | -68 | -47 |
| 25 | 13C8-PFOA | - | 421.000/376.000 | -13 | -19 |
| 26 | 13C9-PFNA | - | 472.000/427.000 | -13 | -30 |
| 27 | 13C8-PFOS | - | 507.000/80.000 | -80 | -49 |
| 28 | 13C6-PFDA | - | 519.000/474.000 | -13 | -41 |
| 29 | 13C7-PFUnDA | - | 570.000/525.000 | -17 | -37 |
| 30 | 13C2-PFDoA | - | 615.000/570.000 | -18 | -43 |
| 31 | 13C2-PFTeDA | - | 715.000/670.000 | -18 | -44 |
1.4 标准溶液配制
将母液浓度为2.00×103 ng/mL的18种目标物混合标准溶液和13种全氟化合物混合内标溶液,用LC-MS级甲醇稀释,得到1.00×102、10.0 ng/mL的标准中间液和25.0 ng/mL的混合内标溶液,于-20 ℃储存备用。
1.5 样品前处理条件取200 μL血清样品,加入2 mL缓冲液(Na2CO3 5.30 g和NaHCO3 4.20 g溶于200 mL水中,浓度为0.25 mol/L,pH=10),1 mL TBAHs溶液(称取17.00 g四丁基硫酸氢铵于100 mL水中,浓度为0.5 mol/L),和40 μL的12.5 ng/mL内标,之后加入4 mL甲基叔丁基醚,用250 rpm速度在室温条件下震荡20 min,之后4 000 rpm转速离心10 min,吸取上清液,重复上述步骤两次,合并上清液,之后用氮吹仪在40 ℃下吹干。最后用200 μL的甲醇溶液定容,12 000 rpm转速下离心15 min,离心半径为9 cm,用移液枪吸取上清液,进行UPLC-MS/MS分析。
1.6 质量保证和质量控制实验过程中应避免使用聚四氟乙烯和玻璃材质的色谱管路与器皿,以降低背景干扰。前处理和UPLC-MS/MS进样过程中用到的枪头、进样小瓶、离心管、塑料滴管、管线均做空白对照试验,排除干扰。流动相均用LC-MS级的甲醇和水;2 mmol/L的乙酸铵流动相用LC-MS级的乙酸铵标准试剂和LC-MS级纯水配制,现用现配。实际进样过程中隔20个样品进一针甲醇溶剂,作为空白对照,观察仪器是否有背景干扰。通过加标回收试验、标准曲线的线性(r)、空白实验和重复试验结果评价方法特性,并保证满足质量控制要求。此外,购买了血清NIST质控样(Standard Reference Material 1957, National Institute of Standards and Technology)和Quebec的3种质控样品AM-S-Y1807和AM-S-Y1808和AM-S-Y1809,对其进行测定,通过对比NIST参考值和相关文献报道值来判断方法是否可行。
2 结果与讨论 2.1 前处理方法优化本研究对不同体积(4、5、8 mL)甲基叔丁基醚,不同震荡时间(20、30和60 min),以及是否采用SPE小柱OASIS WAX(6 mL, 500 mg, 美国SUPELCO),ENVI Carb(6 mL, 500 mg, 美国SUPELCO)进一步纯化等前处理方法进行各个优化。采用4 mL甲基叔丁基醚,震荡20 min,不使用SPE小柱,在0.500、1.00和2.00 ng/mL 3个浓度时,18种全氟化合物的加标回收率分别为:76.3%~112.1%、71.4%~110%和74.8%~105.7%。然而,当增加提取溶剂体积、延长提取时间、或者采用SPE小柱进一步净化,提取效率变化不大,说明其提取效率已达稳定水平。因此,本文采用4 mL甲基叔丁基醚、震荡20 min、不使用SPE小柱进行前处理。
2.2 方法的线性范围和检出限本研究采用内标法定量,进样量为10 μL。标准曲线系列浓度点分别为0.010、0.025、0.050、0.100、0.250、0.500、1.00、2.50、5.00、10.00和25.00 ng/mL,内标浓度为2.50 ng/mL,按照1.5前处理方法,之后进行UPLC-MS/MS定量分析,绘制标准曲线。并以此浓度系列加入到胎牛血清中,配置标准工作曲线,根据标准曲线低浓度点的信噪比估算方法的检出限(LOD,3倍信噪比)和定量限(LOQ,10倍信噪比)(表 3)。
| 序号 | 化合物 | 线性范围 /(ng/mL) |
回归方程 | 相关系数/r | 检出限 /(ng/mL) |
定量限 /(ng/mL) |
| 1 | PFBA | 0.01~5 | y=0.322x+0.000 2 | 0.999 7 | 0.1 | 0.3 |
| 2 | PFPeA | 0.01~5 | y=0.274x+0.006 0 | 0.999 8 | 0.01 | 0.025 |
| 3 | PFHxA | 0.01~5 | y=0.214x+0.000 7 | 0.999 9 | 0.01 | 0.025 |
| 4 | PFHpA | 0.01~5 | y=0.406x+0.008 6 | 0.999 9 | 0.01 | 0.025 |
| 5 | PFOA | 0.01~5 | y=0.644x+0.013 3 | 1.000 0 | 0.015 | 0.04 |
| 6 | PFNA | 0.01~5 | y=0.429x+0.000 3 | 0.999 9 | 0.01 | 0.025 |
| 7 | PFDA | 0.01~5 | y=0.587x+0.009 1 | 0.998 9 | 0.01 | 0.03 |
| 8 | PFUnDA | 0.01~5 | y=0.528x+0.007 4 | 0.998 2 | 0.01 | 0.025 |
| 9 | PFDoA | 0.01~5 | y=0.335x+0.003 8 | 0.999 5 | 0.01 | 0.025 |
| 10 | PFTrDA | 0.01~5 | y=0.354x+0.012 7 | 0.999 8 | 0.02 | 0.05 |
| 11 | PFTeDA | 0.01~5 | y=0.354x+0.001 0 | 0.998 1 | 0.03 | 0.1 |
| 12 | PFBS | 0.01~5 | y=0.253x+0.003 3 | 0.999 9 | 0.01 | 0.03 |
| 13 | PFPeS | 0.01~5 | y=0.337x+0.038 4 | 0.998 1 | 0.01 | 0.03 |
| 14 | PFHxS | 0.01~5 | y=0.338x+0.005 7 | 0.998 0 | 0.01 | 0.03 |
| 15 | PFOS | 0.01~25 | y=0.131x+0.002 9 | 0.999 7 | 0.015 | 0.05 |
| 16 | PFNS | 0.01~5 | y=0.163x+0.001 7 | 0.999 0 | 0.015 | 0.05 |
| 17 | PFDS | 0.01~5 | y=0.344x+0.031 2 | 0.999 2 | 0.05 | 0.15 |
| 18 | PFDoS | 0.01~5 | y=0.069x+0.003 7 | 0.998 5 | 0.03 | 0.1 |
2.3 样品基质效应
基质效应分为绝对基质效应和相对基质效应。绝对基质效应的评价可通过比较标准曲线和标准工作曲线的定量结果来进行。经过对比,在本方法中标准曲线和标准工作曲线测定的四种质控样品结果均在质控范围之内,这说明利用标准曲线和标准工作曲线定量结果无差别。为节约实验时间、降低实验成本,采用标准曲线进行定量。相对基质效应的评价可通过评估6个不同来源的血清来进行,在每个样品中加入浓度相同的内标,通过比较内标峰面积稳定性来评估基质效应。结果显示,6个不同来源的血清质谱信号强度稳定,内标峰面积相对标准偏差在5.5%~9.2%之间(表 4),说明相对基质效应稳定。因此,本实验采用标准曲线定量。
| PFBA | PFPeA | PFHxA | PFHpA | PFOA | PFNA | PFDA | PFUnDA | PFDoA | PFTrDA | PFTeDA | PFBS | PFPeS | PFHxS | PFOS | PFNS | PFDS | PFDoS | |
| 样品1 | 207 000 | 130 000 | 399 000 | 423 000 | 417 000 | 348 000 | 250 000 | 291 000 | 290 000 | 397 000 | 397 000 | 60 800 | 60 800 | 245 000 | 163 000 | 163 000 | 163 000 | 163 000 |
| 样品2 | 187 000 | 128 000 | 370 000 | 370 000 | 410 000 | 336 000 | 221 000 | 271 000 | 292 000 | 346 000 | 346 000 | 56 000 | 56 000 | 223 000 | 155 000 | 155 000 | 155 000 | 155 000 |
| 样品3 | 177 000 | 124 000 | 347 000 | 353 000 | 372 000 | 296 000 | 198 000 | 245 000 | 276 000 | 331 000 | 331 000 | 50 600 | 50 600 | 210 000 | 132 000 | 132 000 | 132 000 | 132 000 |
| 样品4 | 217 000 | 118 000 | 420 000 | 426 000 | 445 000 | 385 000 | 244 000 | 293 000 | 319 000 | 420 000 | 420 000 | 60 300 | 60 300 | 261 000 | 166 000 | 166 000 | 166 000 | 166 000 |
| 样品5 | 175 000 | 128 000 | 381 000 | 374 000 | 399 000 | 346 000 | 228 000 | 268 000 | 287 000 | 351 000 | 351 000 | 54 500 | 54 500 | 229 000 | 156 000 | 156 000 | 156 000 | 156 000 |
| 样品6 | 208 000 | 109 000 | 371 000 | 379 000 | 406 000 | 349 000 | 218 000 | 267 000 | 275 000 | 384 000 | 384 000 | 53 600 | 53 600 | 219 000 | 145 000 | 145 000 | 145 000 | 145 000 |
| RSD/% | 9.1 | 6.5 | 6.7 | 7.7 | 5.8 | 8.3 | 8.3 | 6.5 | 5.5 | 9.2 | 9.2 | 7.1 | 7.1 | 8.1 | 8.2 | 8.2 | 8.2 | 8.2 |
2.4 加标回收率和精密度
用移液枪吸取200 μL胎牛血清(FBS),分别加入质量浓度为1.00、5.00或10.0 ng/mL混合标准溶液40 μL,以及12.5 ng/mL的混合内标溶液40 μL,进行低、中、高三个浓度梯度的加标回收试验,每个浓度梯度做6次平行测定,三个添加水平的理论加标浓度分别为0.200、1.00和2.00 ng/mL。结果如表 5,18种全氟化合物的回收率在71.4%~119.8%之间,相对标准偏差(relative standard deviation, RSD)在3.3%~14.9%之间,能够满足定量分析的基本要求。
| 序号 No. |
化合物 | 0.200 ng/mL | 1.00 ng/mL | 2.00 ng/mL | |||||
| 回收率/% | 相对标准偏差/% | 回收率(%) | 相对标准偏差/% | 回收率/% | 相对标准偏差/% | ||||
| 1 | PFBA | 99.3 | 5.4 | 88.1 | 13.1 | 73.8 | 13.7 | ||
| 2 | PFPeA | 102.1 | 4.9 | 83.5 | 5.2 | 81.7 | 6.6 | ||
| 3 | PFHxA | 90.5 | 12.2 | 80.2 | 7.9 | 85.3 | 10.8 | ||
| 4 | PFHpA | 99.2 | 7.3 | 91.2 | 8.6 | 87.9 | 7.8 | ||
| 5 | PFOA | 92.0 | 10.8 | 94.2 | 4.2 | 94.2 | 8.5 | ||
| 6 | PFNA | 115.3 | 7.4 | 94.7 | 8.3 | 92.8 | 6.8 | ||
| 7 | PFDA | 106.0 | 5.5 | 95.2 | 6.2 | 89.4 | 7.5 | ||
| 8 | PFUnDA | 102.8 | 8.5 | 89.1 | 5.6 | 83.2 | 6.4 | ||
| 9 | PFDoA | 98.2 | 8.0 | 88.5 | 8.2 | 85.1 | 3.3 | ||
| 10 | PFTrDA | 80.4 | 8.8 | 71.4 | 6.7 | 74.1 | 8.6 | ||
| 11 | PFTeDA | 96.2 | 6.4 | 96.6 | 8.3 | 89.9 | 4.6 | ||
| 12 | PFBS | 118.4 | 14.9 | 103.1 | 8.2 | 98.8 | 6.9 | ||
| 13 | PFPeS | 113.6 | 7.1 | 84.1 | 6.5 | 72.7 | 9.8 | ||
| 14 | PFHxS | 117.5 | 7.2 | 89.4 | 4.5 | 77.2 | 10.9 | ||
| 15 | PFOS | 111.8 | 12.0 | 88.7 | 13.5 | 92.0 | 14.3 | ||
| 16 | PFNS | 84.9 | 13.1 | 81.3 | 7.4 | 79.0 | 14.5 | ||
| 17 | PFDS | 119.8 | 14.5 | 110.0 | 5.2 | 106.7 | 11.0 | ||
| 18 | PFDoS | 77.1 | 12.6 | 75.4 | 7.3 | 75.7 | 6.9 | ||
2.5 NIST质控样品测定结果
为了验证上述前处理和UPLC-MS/MS方法分析18种全氟化合物的准确性,测定了国际认可的质控样SRM 1957。SRM 1957给出了PFHpA、PFOA、PFNA、PFDA、PFUnDA、PFHxS和PFOS共7种物质的参考值范围。测定结果与已有文献报道的SRM 1957测定值相当,在可接受范围内,且7种全氟化合物5次测定的日间相对标准偏差在2.79%~15.37%之间(表 6)[12-18],说明方法的准确性与国际已有报道的研究结果相当。为进一步验证该方法是否可靠,购买了Quebec的3种质控样品AM-S-Y1807、AM-S-Y1808和AM-S-Y1809,测定结果与标准值基本吻合,说明该方法可以用于实际人体血清样品中全氟化合物的测定。
| PFHxA | PFHpA | PFOA | PFNA | PFDA | PFUnDA | PFHxS | PFHpS | PFOS | |||
| 标准曲线测定结果 | NIST 1957 |
测定值 | 0.220~0.236 | 4.51~4.63 | 0.811~0.943 | 0.15~0.20 | 0.092~0.106 | 3.23~4.04 | 18.8~19.5 | ||
| RSD(%) | 12.12 | 4.54 | 8.83 | 8.33 | 13.67 | 15.37 | 2.79 | ||||
| Geary W.Olsena [23] | 0.203 | 3.75 | 0.698 | 0.216 | 0.0897 | 3.25 | 19.9 | ||||
| Wouter A.Gebbink [24] | 0.18~0.22 | 3.73~3.99 | 0.68~0.76 | 0.23~0.25 | 0.10~0.12 | 3.19~3.31 | 17.8~19.2 | ||||
| Yeung [25-26] | 0.141~0.255 | 3.75~4.45 | 0.687~0.841 | 0.263~0.323 | 0.106~0.130 | 3.68~4.60 | 18.1~20.5 | ||||
| Gabriel Munoz [22] | 0.33~0.43 | 3.5~3.7 | 0.69~0.89 | 0.24~0.28 | <LOQ | 3.1~3.7 | 20.8~22 | ||||
| PAN [4] | 0.246~0.294 | 4.59~5.33 | 0.803~0.883 | 0.234~0.290 | 0.104~0.132 | 3.58~4.13 | 18.1~19.2 | ||||
| NIST范围(ng/g) | 0.254~0.356 | 4.56~5.44 | 0.801~0.955 | 0.27~0.51 | 0.136~0.208 | 3.17~4.83 | 19.8~22.4 | ||||
| AM-SY1807 | 测定值 | 1.52~1.64 | 0.068~0.106 | 2.81~3.07 | 2.59~3.0 | 0.156~0.191 | 1.89~2.33 | 11.3~12.4 | 0.078~0.126 | 34.9~37.5 | |
| 给出范围(ng/mL) | 1.58 | 0.103 | 3.21 | 2.47 | 0.22 | 2.29 | 11.9 | 0.0741 | 33.2 | ||
| AM-SY1808 | 测定值 | 0.71~0.78 | 0.226~0.280 | 6.32~6.57 | 0.653~0.81 | 1.64~1.78 | 0.766~0.866 | 4.59~4.99 | 0.753~0.874 | 75.9~80.2 | |
| 给出范围(ng/mL) | 0.76 | 0.251 | 6.84 | 0.669 | 1.78 | 0.778 | 4.79 | 0.699 | 73.1 | ||
| AM-SY1809 | 测定值 | 3.65~4.05 | 1.05~1.15 | 4.67~4.93 | 1.72~1.90 | 0.40~0.49 | 1.12~1.39 | 1.18~1.37 | 4.23~4.77 | 26.9~27.2 | |
| 给出范围(ng/mL) | 3.94 | 1.15 | 5.16 | 1.7 | 0.49 | 1.22 | 1.14 | 3.73 | 24.9 | ||
| 标准工作曲线测定结果 | NIST 1957 |
测定值 | 0.222~0.246 | 4.53~4.71 | 0.799~0.963 | 0.17~0.26 | 0.094~0.117 | 3.12~4.21 | 18.2~20.5 | ||
| 给出值(ng/g) | 0.254~0.356 | 4.56~5.44 | 0.801~0.955 | 0.27~0.51 | 0.136~0.208 | 3.17~4.83 | 19.8~22.4 | ||||
| AM-SY 1807 |
测定值 | 1.50~1.63 | 0.078~0.104 | 2.83~3.17 | 2.49~2.68 | 0.165~0.198 | 1.92~2.45 | 11.2~12.1 | 0.074~0.105 | 32.9~36.1 | |
| 给出值(ng/mL) | 1.58 | 0.103 | 3.21 | 2.47 | 0.22 | 2.29 | 11.9 | 0.0741 | 33.2 | ||
| AM-SY 1808 |
测定值 | 0.70~0.82 | 0.236~0.286 | 6.42~6.66 | 0.648~0.83 | 1.67~1.81 | 0.771~0.836 | 4.62~5.01 | 0.721~0.741 | 72.9~76.6 | |
| 给出值(ng/mL) | 0.76 | 0.251 | 6.84 | 0.669 | 1.78 | 0.778 | 4.79 | 0.699 | 73.1 | ||
| AM-SY 1809 |
测定值 | 3.69~4.25 | 1.07~1.12 | 4.57~5.04 | 1.68~1.81 | 0.42~0.52 | 1.10~1.41 | 1.12~1.32 | 4.01~4.51 | 23.9~27.5 | |
| 给出值(ng/mL) | 3.94 | 1.15 | 5.16 | 1.7 | 0.49 | 1.22 | 1.14 | 3.73 | 24.9 | ||
甲基叔丁基醚—离子对液液萃取法,最初由Hansen等发明[2, 19]。该方法操作简便,是常用的血清和其它生物组织中全氟化合物的前处理方法。UPLC-MS/MS灵敏度高、结果准确可靠、稳定性好,是PFASs常用的定量分析方法。已有的文献报道中[20-23],利用离子对液液萃取-UPLC-MS/MS方法分析人体血清,所需样品体积为500 μL或者1 mL,所需甲基叔丁基醚体积多(5或8 mL),且需要经过固相萃取小柱进一步纯化,难以满足珍贵样品中多种全氟化合物的快速检测需求。本研究建立的血清中全氟化合物的分析方法,所需血清体积仅为200 μL,所需甲基叔丁基醚体积少(4 mL),之后无需进一步纯化,直接进行质谱分析,这样既能够节约样品、缩短前处理时间,而且节约实验成本,因此本研究是对之前血清中全氟化合物定量分析的重要补充。该方法在样本数繁多的全氟化合物的分析检测(如:国家人体生物监测等项目)中具有优势。
3 结论本研究建立了18种全氟化合物人体血清的定量分析方法。该方法的检出限为0.01~0.1 ng/mL,定量限在(0.025~0.3) ng/mL之间,样品加标回收率良好,在71%~120%之间,相对标准偏差均在15%以内,所需血清体积相对之前研究比要少,能够满足实际人体血清样品的定量测定。测定了SRM 1957、AM-S-Y1807、AM-S-Y1808和AM-S-Y1809四种质控样,结果可靠,说明分析方法可行。该方法节约样本、分析速度快、实验成本低和重复性好,可同时定量分析18种全氟羧酸和全氟磺酸化合物。
| [1] |
Ruan T, Jiang G. Analytical methodology for identification of novel per- and polyfluoroalkyl substances in the environment[J]. TrAC, Trends Anal. Chem., 2017, 95: 122-131. DOI:10.1016/j.trac.2017.07.024 |
| [2] |
Ruan T, Lin Y, Wang T, et al. Methodology for studying biotransformation of polyfluoroalkyl precursors in the environment[J]. TrAC, Trends Anal. Chem., 2015, 67: 167-178. DOI:10.1016/j.trac.2014.11.017 |
| [3] |
Liu Z, Lu Y, Wang T, et al. Risk assessment and source identification of perfluoroalkyl acids in surface and ground water: Spatial distribution around a mega-fluorochemical industrial park, China[J]. Environ. Int., 2016, 91: 69-77. DOI:10.1016/j.envint.2016.02.020 |
| [4] |
Gao Y, Liang Y, Gao K, et al. Levels, spatial distribution and isomer profiles of perfluoroalkyl acids in soil, groundwater and tap water around a manufactory in China[J]. Chemosphere, 2019, 227: 305-314. DOI:10.1016/j.chemosphere.2019.04.027 |
| [5] |
Anderson RH, Long GC, Porter RC, et al. Occurrence of select perfluoroalkyl substances at U.S. Air Force aqueous film-forming foam release sites other than fire-training areas: Field-validation of critical fate and transport properties[J]. Chemosphere, 2016, 150: 678-685. DOI:10.1016/j.chemosphere.2016.01.014 |
| [6] |
Jian JM, Chen D, Han FJ, et al. A short review on human exposure to and tissue distribution of per- and polyfluoroalkyl substances (PFASs)[J]. Sci. Total Environ., 2018, 636: 1058-1069. DOI:10.1016/j.scitotenv.2018.04.380 |
| [7] |
Domingo JL, Nadal M. Per-and polyfluoroalkyl substances (PFASs) in food and human dietary intake: a review of the recent scientific literature[J]. J. Agric. Food Chem., 2017, 65(3): 533-543. DOI:10.1021/acs.jafc.6b04683 |
| [8] |
Fang S, Zhao S, Zhang Y, et al. Distribution of perfluoroalkyl substances (PFASs) with isomer analysis among the tissues of aquatic organisms in Taihu Lake, China[J]. Environ. Pollut., 2014, 193: 224-232. DOI:10.1016/j.envpol.2014.07.006 |
| [9] |
Feng H, Ruan Y, Zhang K, et al. Current analytical methodologies and gaps for per- and polyfluoroalkyl substances determination in the marine environment[J]. TrAC, Trends Anal., 2019. |
| [10] |
王懿, 孔德洋, 单正军, 等. 加速溶剂萃取-固相萃取净化-超高效液相色谱串联质谱法测定土壤中11种全氟化合物[J]. 环境化学, 2012, 31(1): 113-119. |
| [11] |
吴建刚, 龙强, 肖文, 等. 环境水样中全氟磺酸类和全氟羧酸类化合物分析方法研究进展[J]. 环境化学, 2018, 37(8): 1851-1859. |
| [12] |
Gao K, Fu J, Xue Q, et al. An integrated method for simultaneously determining 10 classes of per- and polyfluoroalkyl substances in one drop of human serum[J]. Anal. Chim. Acta, 2018, 999: 76-86. DOI:10.1016/j.aca.2017.10.038 |
| [13] |
Munoz G, Labadie P, Geneste E, et al. Biomonitoring of fluoroalkylated substances in Antarctica seabird plasma: Development and validation of a fast and rugged method using on-line concentration liquid chromatography tandem mass spectrometry[J]. J. Chromatogr. A, 2017, 1513: 107-117. DOI:10.1016/j.chroma.2017.07.024 |
| [14] |
Olsen GW, Mair DC, Lange CC, et al. Per- and polyfluoroalkyl substances (PFAS) in American Red Cross adult blood donors, 2000-2015[J]. Environ. Res., 2017, 157: 87-95. DOI:10.1016/j.envres.2017.05.013 |
| [15] |
Pan Y, Zhang H, Cui Q, et al. First report on the occurrence and bioaccumulation of hexafluoropropylene oxide trimer acid: an emerging concern[J]. Environ. Sci. Technol., 2017, 51(17): 9553-9560. DOI:10.1021/acs.est.7b02259 |
| [16] |
Gebbink WA, Glynn A, Berger U. Temporal changes (1997-2012) of perfluoroalkyl acids and selected precursors (including isomers) in Swedish human serum[J]. Environ. Pollut, 2015, 199: 166-173. DOI:10.1016/j.envpol.2015.01.024 |
| [17] |
Yeung LWY, Robinson SJ, Koschorreck J, et al. Part Ⅰ. A temporal study of pfcas and their precursors in human plasma from two german cities 1982-2009[J]. Environ. Sci. Technol., 2013, 47(8): 3865-3874. DOI:10.1021/es303716k |
| [18] |
Yeung LWY, Robinson SJ, Koschorreck J, et al. Part Ⅱ. A Temporal Study of PFOS and Its Precursors in Human Plasma from Two German Cities in 1982-2009[J]. Environ. Sci. Technol, 2013, 47(8): 3875-3882. DOI:10.1021/es4004153 |
| [19] |
Hansen KJ, Clemen LA, Ellefson ME, et al. Compound-Specific, Quantitative Characterization of Organic Fluorochemicals in Biological Matrices[J]. Environ. Sci. Technol., 2001, 35(4): 766-770. DOI:10.1021/es001489z |
| [20] |
Zhou Z, Shi Y, Vestergren R, et al. Highly elevated serum concentrations of perfluoroalkyl substances in fishery employees from Tangxun Lake, China[J]. Environ. Sci. Technol., 2014, 48(7): 3864-3874. DOI:10.1021/es4057467 |
| [21] |
Li J, Guo F, Wang Y, et al. Can nail, hair and urine be used for biomonitoring of human exposure to perfluorooctane sulfonate and perfluorooctanoic acid?[J]. Environ. Int., 2013, 53: 47-52. DOI:10.1016/j.envint.2012.12.002 |
| [22] |
Shan G, Wang Z, Zhou L, et al. Impacts of daily intakes on the isomeric profiles of perfluoroalkyl substances (PFASs) in human serum[J]. Environ. Int., 2016, 89-90: 62-70. DOI:10.1016/j.envint.2016.01.002 |
| [23] |
Fu Y, Wang T, Wang P, et al. Effects of age, gender and region on serum concentrations of perfluorinated compounds in general population of Henan, China[J]. Chemosphere, 2014, 110: 104-110. DOI:10.1016/j.chemosphere.2014.02.020 |



