抗生素是预防和治疗人类和动物感染性疾病的常用药,施用于动物的抗生素,大多数(60%~90%)以原药的形式通过粪便和尿液排出体外,可污染土壤、地表水、地下水,影响动物和微生物的正常生命活动[1]。长期滥用抗生素会导致体内及环境中耐药菌大量繁殖,破坏各种微生物种群数量和结构平衡,降低感染性疾病治愈的可能性,影响人体健康[2]。全世界水环境正受到抗生素污染,早在1999至2000年间,美国139条河流的80%检出了抗生素,其中检出频率较高的有磺胺甲唑、脱水红霉素、林可霉素等[3];西班牙和瑞士多条河流、英国莱因河、意大利波河和亚诺河、法国塞纳河等都检出抗生素[4]。中国地表水也检出多种抗生素,还曾检出90种非抗生素类医药成分[5]。
我国还没有饮用水中抗生素的标准检验方法,目前常用的检测方法有气相色谱—质谱联用[6]、液相色谱—二极管阵列(HPLC/DAD)[7]、液相色谱—荧光(HPLC/FD)[8]、液相色谱—串联质谱法(LC-MS-MS)[9-12]。前处理方法有固相萃取法[13-14]、分散液—液微萃取法(DLLME)等[15-16]。DLLME利用分析物在基质和有机溶剂中的溶解度差异进行分离,使用较少的有机溶剂,经济环保,是传统液—液萃取法的改进形式。本文研究样品前处理方法,建立简便、灵敏的DLLME-LC/DAD方法,可用于水中痕量抗生素的测定。
1 材料与方法 1.1 材料、仪器与试剂Agilent 1260高效液相色谱仪(美国Agilent公司),Sigma 3-30KS离心机(德国SIGMA公司),超声清洗器(美国Branson公司)。
甲硝唑、红霉素、氯霉素、土霉素、金霉素、美满霉素、四环素、多西环素盐酸盐、阿莫西林标准品(上海安普谱公司)。乙腈、甲醇、丙酮、氯仿、四氯化碳(色谱纯,天津科密欧化学试剂有限公司),其它有机溶剂由广州化学试剂厂产生。
准确称取适量的甲硝唑、红霉素、氯霉素、土霉素、金霉素、美满霉素、四环素、多西环素盐酸盐、阿莫西林标准品,溶于水,转移到棕色瓶中定容,配制成浓度为500.0 mg/L标准储备液,置于4℃冰箱中保存。混合标准系列溶液临用现配,分别移取适量的抗生素储备液于棕色瓶中,加水定容。
1.2 色谱条件色谱柱:Agilent C18柱(250 mm×4.6 mm,5 μm);柱温30℃;0.01 mol/L草酸和混合溶剂(甲醇-乙腈=1+1,V/V)按73 :27(V/V)比例混合所得溶液作为流动相,流速0.8 mL/min;紫外检测波长280 nm;进样量20 μL。
1.3 样品处理移取15.0 mL水样于具塞离心管中,用盐酸调pH值为4,加入NaCl 1.5 g、乙腈0.2 mL,用注射器快速注入0.5 mL正戊醇-甲基叔丁醚混合溶剂(4 :1),形成乳浊液,涡旋4 min,于8 000 rpm(有效离心半径15 cm)离心2 min,用注射器抽取上层有机层,氮吹蒸干,加入0.5 mL流动相溶解残渣,经0.45 μm滤膜过滤后测定。
1.4 质量控制用自来水配制含9种抗生素(10.0 μg/L)的质控水样,用于萃取条件优化,萃取实验进行3次平行测定,计算富集倍数。富集倍数为萃取平衡后,抗生素在萃取剂中的浓度与原水样中的浓度之比用ER表示。对水样进行高、中、低浓度加标实验,分别5次平行测定,评价方法的准确性。空白实验的结果应小于检出限。
2 结果与讨论 2.1 分散液—液微萃取条件优化 2.1.1 萃取剂的选择在5份pH为4.0的质控水样中,分别加入0.5 mL正戊醇、异戊醇、甲基叔丁醚、乙酸丁酯或邻苯二甲酸二(2-乙基已基)酯作为萃取剂,并以0.15 mL乙腈为分散剂,进行萃取实验,结果表明,正戊醇对土霉素、多西霉素、红霉素的富集倍数较高,而甲基叔丁醚对红霉素、多西霉素、氯霉素、美满霉素抗生素的富集倍数较高。因此,两种溶剂混合可起到一定的互补效果。进一步实验发现,正戊醇和甲基叔丁醚按4 :1混合,抗生素的富集倍数较高(图 1)。
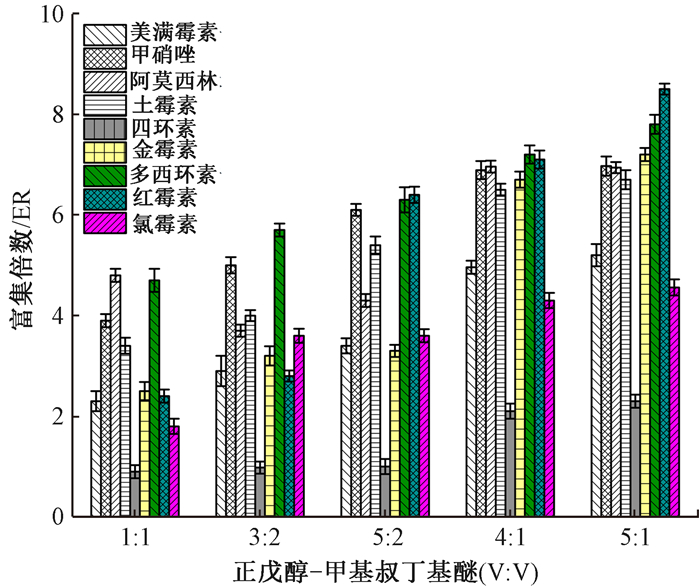
|
| 注:ER为抗生素在萃取剂中的浓度与原水样中的浓度之比 图 1 不同比例混合溶剂的富集倍数 |
2.1.2 萃取剂体积
实验以0.15 mL乙腈作为分散剂,且其它条件不变,比较混合溶剂(正戊醇—甲基叔丁醚4 :1)体积分别为0.40、0.50、0.70、0.80、1.0 mL时,对9种抗生素的富集倍数。富集倍数先随体积的增加而增大,当体积增大到0.50 mL时,ER值在2.3~8.5之间,萃取效率较高,然后,随着萃取剂体积增大而稍微下降,因此,选择0.50 mL为最佳萃取体积。
2.1.3 分散剂的种类和体积实验考察甲醇、乙醇、乙腈、丁酮作为分散剂,对富集倍数的影响,结果表明,以乙腈为分散剂,9种抗生素均有较好的富集倍数(ER值2.2~8.4)。实验考察了乙腈的用量分别为50、100、150、200、300 μL时,对富集倍数的影响。当乙腈体积增大,抗生素的ER值也增大,乙腈用量为150 μL时,ER值2.4~8.6,富集倍数最高,因此,分散剂用量150 μL最合适。
2.1.4 水样pH水样pH能改变抗生素的存在形态,从而影响分散液—液微萃取的效果。在其它条件不变的情况下,测定不同pH的质控水样。pH分别为1.50、2.05、3.50、4.05、6.01、8.00、9.05和11.00时,9种抗生素的ER值(图 2),红霉素和美满霉素的ER值随水样pH增大而增大,因为两者在酸性溶液中不稳定,影响富集倍数;其它7种抗生素的ER值,先随pH值增大而增加,当pH值大于4.05时,ER值下降,尤其是阿莫西林、土霉素、氯霉素的ER值明显下降,因为3种抗生素在碱性条件下不稳定。
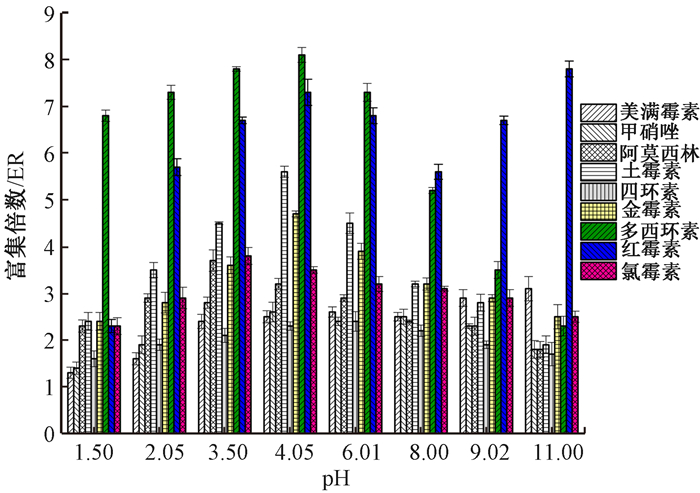
|
| 注:ER为抗生素在萃取剂中的浓度与原水样中的浓度之比 图 2 水样pH对抗生素富集倍数的影响 |
2.1.5 盐效应
固定其它条件不变,在15 mL质控水样中分别添加0.5、1.0、1.5、2.0、2.5 g NaCl,测定9种抗生素的ER值。结果表明,回收到的溶剂体积,随NaCl添加量的增加而增多。当添加量为1.5 g (10%)时,ER达到恒定值(2.4~8.9),富集倍数高,因此,适宜的NaCl添加量为10%。
2.1.6 萃取时间在其它条件不变的情况下,实验考察萃取时间为1、2、4、6和8 min的富集倍数,结果表明,ER值随萃取时间的增加而增大,但4 min后,ER值不再明显增加(图 3),因此,萃取时间4 min较合适。
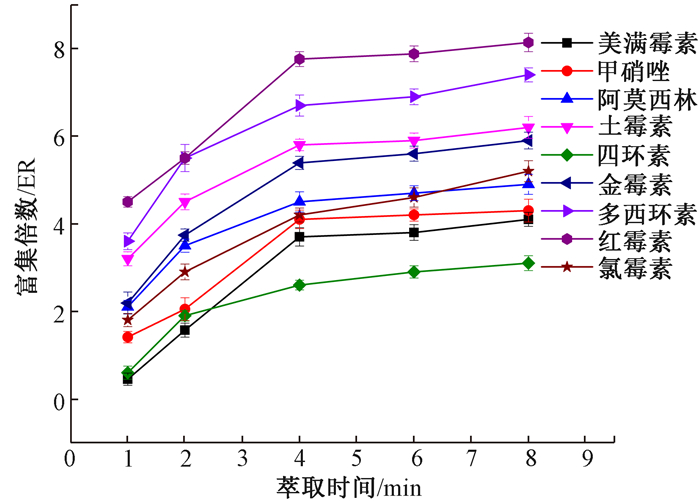
|
| 注:ER为抗生素在萃取剂中的浓度与原水样中的浓度之比 图 3 萃取时间对抗生素富集倍数的影响 |
2.2 线性范围、精密度与检出限
配制5个混合标准系列溶液,浓度范围5.00~50.0 μg/L,分别测定峰面积,制作标准曲线。对5.0 μg/L抗生素的加标水样连续7次测定,计算标准偏差s,及3 s、10 s值,再除以水样浓缩倍数30(15 mL水样浓缩到0.5 mL溶剂中),得到方法的检出限(LOD=3 s/30)和定量限(LOQ=10 s/30)。对浓度为25.0 μg/L加标水样连续5次测定,计算相对标准偏差(RSD),得到精密度(表 1)。相关系数0.998 1~0.999 4,线性关系良好,方法的检出限(0.43~1.57)μg/L、定量限(1.33~5.33)μg/L,RSD 0.35%~3.8%,方法的灵敏度高、精密度好。
| 抗生素 | 线性方程 | 相关系数/ r |
方法LOD/ (μg/L) |
方法LOQ/ (μg/L) |
精密度/ (RSD,%) |
| 美满霉素 | y=69.259c-0.569 3 | 0.999 2 | 0.43 | 1.33 | 0.95 |
| 甲硝唑 | y=33.212c+0.318 3 | 0.998 9 | 0.63 | 2.00 | 0.35 |
| 阿莫西林 | y=25.411c-0.196 3 | 0.998 1 | 0.90 | 3.33 | 1.2 |
| 土霉素 | y=47.943c+0.140 0 | 0.998 6 | 0.83 | 2.67 | 3.4 |
| 四环素 | y=17.527c+0.311 8 | 0.998 7 | 1.17 | 4.00 | 3.8 |
| 金霉素 | y=12.245c-0.306 0 | 0.999 4 | 1.40 | 4.67 | 1.0 |
| 多西环素 | y=17.295c+0.034 45 | 0.999 1 | 1.43 | 4.67 | 1.5 |
| 红霉素 | y=26.581c-0.200 9 | 0.999 3 | 1.47 | 5.00 | 3.0 |
| 氯霉素 | y=36.279c+0.127 13 | 0.998 3 | 1.57 | 5.33 | 1.2 |
2.3 实际水样测定
为验证方法的适用性,采用DLLME方法萃取实验室自来水和马涌河生活污水中的抗生素,HPLC测定。自来水中9种抗生素浓度均小于检出限,生活污水可检出2种抗生素。对生活污水加标高、中、低3个浓度,用于回收率测定,5次测定的平均回收率为66.4%~94.0%,相对标准偏差为1.5%~6.5%(表 2)。混合标准溶液及水样加标色谱图见图 4。
| 抗生素 | 原水样/ (μg/L) |
加标浓度/ (μg/L) |
测定值平均值/ (μg/L) |
回收率/ % |
精密度 (RSD,%) |
| 美满霉素 | 85.5 | 5.00 | 89.2 | 74.0 | 3.6 |
| 10.0 | 94.5 | 90.0 | 4.2 | ||
| 25.0 | 109 | 94.0 | 3.1 | ||
| 甲硝唑 | - | 5.00 | 4.02 | 80.4 | 4.3 |
| 10.0 | 8.89 | 88.9 | 2.5 | ||
| 25.0 | 21.5 | 86.0 | 1.8 | ||
| 阿莫西林 | 115 | 5.00 | 119 | 80.0 | 4.6 |
| 10.0 | 124 | 90.0 | 3.2 | ||
| 25.0 | 137 | 88.0 | 3.8 | ||
| 土霉素 | - | 5.00 | 4.52 | 90.4 | 2.9 |
| 10.0 | 8.76 | 87.6 | 4.1 | ||
| 25.0 | 23.1 | 92.4 | 3.7 | ||
| 四环素 | - | 5.00 | 4.23 | 84.6 | 4.7 |
| 10.0 | 7.98 | 79.8 | 3.8 | ||
| 25.0 | 22.7 | 90.8 | 1.7 | ||
| 金霉素 | - | 5.00 | 4.14 | 82.8 | 3.6 |
| 10.0 | 9.28 | 92.8 | 4.3 | ||
| 25.0 | 22.7 | 90.8 | 4.8 | ||
| 多西环素 | - | 5.00 | 4.03 | 80.6 | 1.5 |
| 10.0 | 8.97 | 89.7 | 3.8 | ||
| 25.0 | 22.4 | 89.6 | 2.9 | ||
| 红霉素 | - | 5.00 | 3.32 | 66.4 | 4.9 |
| 10.0 | 9.17 | 91.7 | 2.9 | ||
| 25.0 | 23.4 | 93.6 | 5.2 | ||
| 氯霉素 | - | 5.00 | 4.12 | 82.4 | 6.5 |
| 10.0 | 9.08 | 90.8 | 1.8 | ||
| 25.0 | 23.4 | 93.6 | 2.6 | ||
| 注:“-”为未检出 | |||||
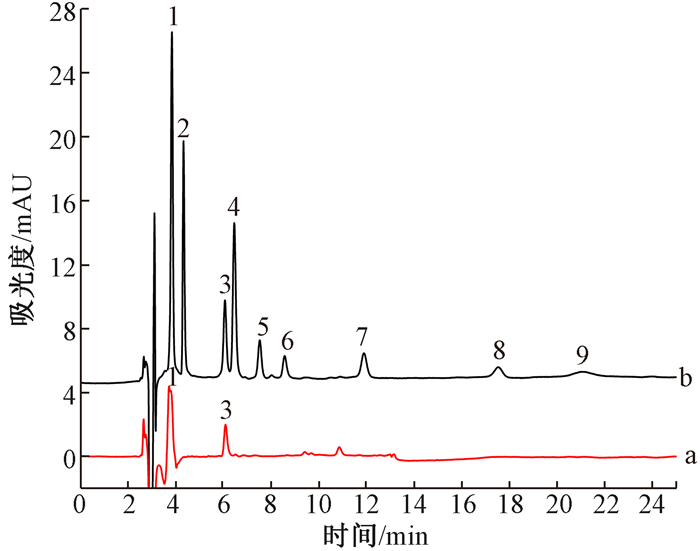
|
|
注:a-水样浓度:美满霉素90.0 μg/L,阿莫西林122 μg/L;b-加标水样加标浓度50.0 μg/L 色谱峰:1-美满霉素、2-甲硝唑、3-阿莫西林、4-土霉素、5-四环素、6-金霉素、7-多西环素、8-红霉素、9-氯霉素 图 4 混合标准液及水样加标色谱图 |
3 结论
本文建立了DLLME-LC测定水中9种抗生素的方法。方法操作简便,消耗有机溶剂少,实验成本低,萃取效率好,具有灵敏度高、精密度好、准确可靠等优点,可用于水样中痕量的多种抗生素萃取测定。
| [1] |
Looft T, Johnson TA, Allen HK, et al. In-feed antibiotic effects on the swine intestinal microbiome[J]. Proc Natl Acad Sci USA, 2012, 109(5): 1691-1696. DOI:10.1073/pnas.1120238109 |
| [2] |
郑惠东. 水环境中抗生素来源及对健康的影响[J]. 环境卫生学杂志, 2018, 8(1): 73-77. (In English: Zheng HD. The source of antibiotics in aquatic environment and its impact on human health[J]. J Environ Hyg, 2018, 8(1): 73-77.) |
| [3] |
Kolpin DW, Furlong ET, Meyer MT, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000:a national reconnaissance[J]. Environ Sci Technol, 2002, 36(6): 1202-1211. DOI:10.1021/es011055j |
| [4] |
Valcárcel Y, Alonso SG, Rodríguez-Gil JL, et al. Detection of pharmaceutically active compounds in the rivers and tap water of the Madrid region (Spain) and potential ecotoxicological risk[J]. Chemosphere, 2011, 84(10): 1336-1348. DOI:10.1016/j.chemosphere.2011.05.014 |
| [5] |
王丹, 隋倩, 赵文涛, 等. 中国地表水环境中药物和个人护理品的研究进展[J]. 科学通报, 2014, 59(9): 743-751. (In English: Wang D, Sui Q, Zhao WT, et al. Pharmaceutical and personal care products in the surface water of China:a review[J]. Chin Sci Bull, 2014, 59(9): 743-751.) |
| [6] |
Gatidou G, Thomaidis NS, Stasinakis AS, et al. Simultaneous determination of the endocrine disrupting compounds nonylphenol, nonylphenol ethoxylates, triclosan and bisphenol A in wastewater and sewage sludge by gas chromatography-mass spectrometry[J]. J Chromatogr A, 2007, 1138(1-2): 32-41. DOI:10.1016/j.chroma.2006.10.037 |
| [7] |
Phiroonsoontorn N, Sansuk S, Santaladchaiyakit Y, et al. The use of dissolvable layered double hydroxide components in an in situ solid-phase extraction for chromatographic determination of tetracyclines in water and milk samples[J]. J Chromatogr A, 2017, 1519: 38-44. DOI:10.1016/j.chroma.2017.09.005 |
| [8] |
Xu X, Su R, Zhao X, et al. Ionic liquid-based microwave-assisted dispersive liquid-liquid microextraction and derivatization of sulfonamides in river water, honey, milk, and animal plasma[J]. Anal Chim Acta, 2011, 707(1-2): 92-99. DOI:10.1016/j.aca.2011.09.018 |
| [9] |
王栋纬, 宋燕西, 冶晓凡, 等. 氧化石墨烯对磺胺甲恶唑和磺胺甲基嘧啶的吸附性能研究[J]. 分析化学, 2018, 46(2): 211-216. (In English: Wang DW, Song YX, Ye XF, et al. Study on adsorption of two sulfonamide antibiotics by graphene oxide[J]. Chin J Anal Chem, 2018, 46(2): 211-216.) |
| [10] |
Bayen S, Yi XZ, Segovia E, et al. Analysis of selected antibiotics in surface freshwater and seawater using direct injection in liquid chromatography electrospray ionization tandem mass spectrometry[J]. J Chromatogr A, 2014, 1338: 38-43. DOI:10.1016/j.chroma.2014.02.034 |
| [11] |
余胜兵, 郑惠东, 鲁琳, 等. 超高效液相色谱-串联质谱同时测定饮用水中60种抗生素[J]. 环境卫生学杂志, 2018, 8(3): 261-269. (In English: Yu SB, Zheng HD, Lu L, et al. Simultaneous determination of 60 kinds of antibiotics in drinking water samples by ultra-performance liquid chromatography-tandem mass spectrometry[J]. J Environ Hyg, 2018, 8(3): 261-269.) |
| [12] |
Richardson SD, Ternes TA. Water analysis:emerging contaminants and current issues[J]. Anal Chem, 2014, 86(6): 2813-2848. DOI:10.1021/ac500508t |
| [13] |
Andrés-Costa MJ, Andreu V, Picó Y. Analysis of psychoactive substances in water by information dependent acquisition on a hybrid quadrupole time-of-flight mass spectrometer[J]. J Chromatogr A, 2016, 1461: 98-106. DOI:10.1016/j.chroma.2016.07.062 |
| [14] |
李晓晶, 于鸿, 甘平胜. 超高效液相色谱-串联质谱法测定土壤中多种兽用抗生素残留[J]. 环境卫生学杂志, 2016, 6(4): 296-299. (In English: Li XJ, Yu H, Gan PS. Determination of antibiotic residues in soil by UPLC-MS/MS[J]. J Environ Hyg, 2016, 6(4): 296-299.) |
| [15] |
Herrera-Herrera AV, Hernández-Borges J, Borges-Miquel TM, et al. Dispersive liquid-liquid microextraction combined with ultra-high performance liquid chromatography for the simultaneous determination of 25 sulfonamide and quinolone antibiotics in water samples[J]. J Pharm Biomed Anal, 2013, 75: 130-137. DOI:10.1016/j.jpba.2012.11.026 |
| [16] |
Vázquez MMP, Vázquez PP, Galera MM, et al. Determination of eight fluoroquinolones in groundwater samples with ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction prior to high-performance liquid chromatography and fluorescence detection[J]. Anal Chim Acta, 2012, 748: 20-27. DOI:10.1016/j.aca.2012.08.042 |



