2. 天津市疾病预防控制中心;
3. 天津市卫生计生综合监督所
单胺类神经递质主要由多巴胺(DA)、5-羟色胺(5-HT)、去甲肾上腺素(NE)和肾上腺素(E)组成,对学习记忆、思维和反应能力等智力有重要调节作用。智力影响因素之一的碘元素在人脑发育中必不可少。已证实碘缺乏是导致智力低下的重要原因,而碘摄入过多是否影响智力尚有争议。动物研究表明[1-2],碘过量可影响大鼠脑内单胺类神经递质含量,而这些递质直接或间接参与大脑智力发展。目前多数研究局限于实验动物观察,缺乏人群流行病学结果。由于天津市水源性高碘地区同时伴随高氟,且高氟是可能的智力危险因素[3],同时也影响单胺类神经递质浓度[4-6],因此本研究在比较不同水碘地区儿童智商和血浆单胺类神经递质的水平以及碘对二者影响的同时将高氟考虑在内,旨在探讨高碘对儿童智力的影响及单胺类神经递质与智力的关系。
1 材料与方法 1.1 研究对象根据天津市18个区县历史水质监测数据[7],从天津市滨海新区水中碘化物质量浓度为(10~150) μg/L(适碘地区)的6个乡/镇中随机抽取2所小学,从滨海新区水中碘化物质量浓度为(150~300) μg/L(高碘一区)的太平镇随机抽取1所小学,从静海区水中碘化物质量浓度大于300 μg/L(高碘二区)的4个乡/镇中随机抽取1所小学,按照整群随机抽样的方法抽取研究对象(经天津市疾病预防中心生物医学伦理委员会审查批准,批件号为81372934):在每所小学的三年级和四年级学生中调查在当地出生和成长的(7~12)周岁儿童,排除患有躯体疾病、精神发育迟滞及精神病等疾病的儿童后,根据PASS 11软件计算的样本量(计算公式为完全随机设计多个样本均数比较的样本量估计公式,不同地区儿童智力水平和标准差的估计值由相关文献所得,且α=0.05,β=0.10,并考虑90 %应答率),共399名儿童纳入研究,其中适碘地区199名,高碘一区和高碘二区各100名。男生和女生分别有201和198名。所有儿童及其父母或监护人均已获得书面知情同意。
1.2 研究方法 1.2.1 智力测验采用《中国联合型瑞文测验(CRT-C2图册)》(中国农村版)测定儿童的智商。在安静教室中进行集体测试,并由训练有素的专业人员实施和监督,根据指导手册时间限定40 min。智商等级评判标准为:IQ≥130为非常优秀,120~129为优秀,110~119为中上,90~109为中等,80~89为中下,70~79为边缘,≤69为智力落后。
1.2.2 尿碘和尿氟水平的测定采集儿童晨尿15 mL,4℃保存,采用砷铈催化分光光度法(WS/T 107-2006)[8]检测尿碘水平,检出限为3 μg/L,重复测定的相对标准差为2.8%~5.5%;回收率为92.6%~107.0%;采用氟离子选择电极法(WS/T 89-1996)[9]检测尿氟水平,检出限为0.05 mg/L,重复测定的相对标准差为1.9%~2.7%,回收率为93.4%~108.3%。2007年WHO/UNICEF/ICCIDD第三次修订的《碘缺乏病的评估和消除监测的方案管理指南》规定:学龄儿童尿碘流行病学评价标准是尿碘中位数<100 μg/L为碘摄入不足,(100~199) μg/L为碘营养适宜,(200~299) μg/L为碘足量,≥300 μg/L为碘过量。
1.2.3 血生化指标检测采集儿童空腹静脉血5 mL于抗凝管,3 000 r/min(离心半径13.5 cm)离心15 min,收集上清并分装,-80℃保存。采用生物素双抗体夹心ELISA检测血浆中DA、5-HT、NE和E,试剂盒为南京建成生物工程公司生产。
1.3 统计学分析采用SPSS 24.0软件对正态分布资料采用协方差分析,非正态分布采用Kruskal-Wallis秩和检验,多组间两两比较采用LSD检验,相关性分析采用Spearman相关。通过EmpowerStats(易侕统计)软件和R软件的阈值效应与饱和效应模块进行平滑曲线拟合[10],并建立分段线性回归模型分析阈值效应。P<0.05为差异有统计学意义。
1.4 质量控制本研究的调查人员和监督人员均事前统一培训,以保证智力测试过程符合指导手册的要求和标准。血液和尿液的采集均由专业医师负责。检测实验室属于预防医学国家级实验教学示范中心,有严格的管理规章和质量控制体系。检测仪器、试剂盒均经计量认证且在有效期内,操作步骤严格按照国家标准或说明书执行。血、尿指标均随机抽取10 %的样品进行重测以保证结果偏差在10 %以内。
2 结果 2.1 儿童尿碘、尿氟、智力和单胺类神经递质的比较经检验,高碘二区儿童的尿碘中位数为476.30 μg/L,明显高于适碘地区201.85 μg/L和高碘一区209.15 μg/L,均具有统计学意义(H=152.050,P<0.001;H=156.331,P<0.001)。同时,高碘二区尿氟水平为2.18(1.52~2.79) mg/L,也明显高于适碘地区和高碘一区,差异均具有统计学意义(H=131.216,P<0.001;H=106.026,P<0.001)由于儿童年龄与DA、E、IQ均存在相关性(r=-0.289,P<0.001;r=-0.100,P=0.047;r=0.222,P<0.001),故采用扣除年龄影响的协方差分析。由表 1可知,在智商得分上,适碘地区、高碘一区和高碘二区儿童的IQ值分别为114.52分、115.57分和109.59分,智力水平差异具有统计学意义(P<0.05),高碘二区儿童智商得分相较适碘地区低4.93分,较高碘一区儿童低5.98分,差异均有统计学意义(均P<0.05)。不同水碘地区儿童血浆中DA和5-HT浓度差异也具有统计学意义(均P<0.05)。其中,高碘二区儿童的5-HT浓度低于适碘地区和高碘一区;高碘二区儿童的DA浓度高于适碘地区和高碘一区。但是不同水碘地区儿童血浆的E和NE浓度比较,差异不具有统计学意义(均P>0.05)。
| 适碘地区(n=199) | 高碘一区(n=100) | 高碘二区(n=100) | P值 | |
| 尿碘/(μg/L) | 201.85(147.92~275.73) | 209.15(137.23~258.38) | 476.30(332.2~639.3)ab | <0.001 |
| 尿氟/(mg/L) | 1.05(0.75~1.45) | 1.24(0.89~1.47) | 2.18(1.52~2.79)ab | <0.001 |
| IQ | 114.52±12.72 | 115.57±11.93 | 109.59±14.24 ab | 0.004 |
| 5-HT/(ng/mL) | 175.32±118.48 | 174.71±121.19 | 142.62±71.64ab | 0.045 |
| DA/(ng/mL) | 179.73±95.97 | 144.42±119.43a | 321.69±104.95ab | <0.001 |
| E/(ng/L) | 373.62±125.45 | 369.51±121.05 | 403.13±150.05 | 0.141 |
| NE/(ng/L) | 1 193.74±317.29 | 1 114.74±402.87 | 1 144.40±329.58 | 0.152 |
| 注:“a”表示与适碘地区相比,P<0.05;“b”表示与高碘一区相比,P<0.05 | ||||
2.2 尿碘对智商和单胺类神经递质的影响 2.2.1 尿碘对智商的影响
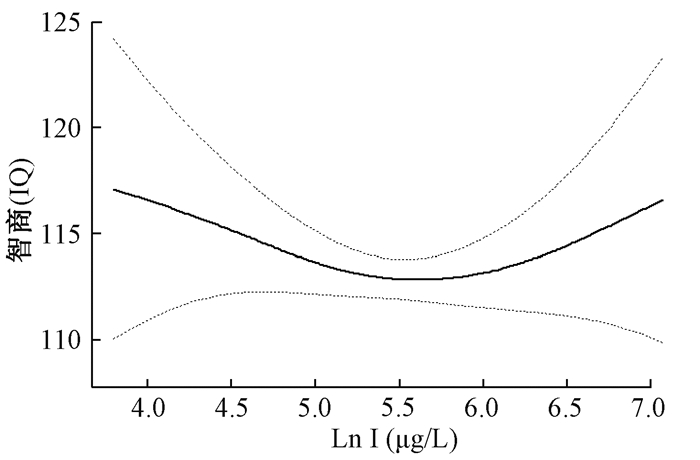
由于本研究儿童尿碘水平不呈正态分布,故对尿碘进行Ln转化得到正态分布。图 1和表 2可见,碘暴露与智力水平虽呈非线性关系,但平滑曲线无统计学意义(P>0.05)。而且分段线性回归模型分析显示,在儿童尿达到转折点(Ln I=5.2,I=181.27 μg/L),儿童智商得分达到最低水平,在Ln I≤5.2和Ln I>5.2范围内,尿碘对儿童智商的影响均无统计学意义(均P>0.05)。
|
| 注:调整因素为年龄、性别和尿氟浓度,实线和虚线分别代表β及其相应的95%置信区间 图 1 儿童的尿碘水平与智商得分的剂量反应关系 |
| Urinary Iodine/(μg/L) | Crude β (95% CI) | P值 | Adjusted β (95% CI) | P值 |
| Ln I≤5.2 | -3.4 (-9.3~ 2.5) | 0.260 | -5.8 (-11.7~0.1) | 0.054 |
| Ln I>5.2 | -1.8 (-4.9~1.4) | 0.266 | 2.2 (-1.6~6.1) | 0.261 |
| 注:调整因素为年龄、性别和尿氟浓度 | ||||
2.2.2 尿碘对单胺类神经递质的影响
从图 2(A)、(C)、(D)可见,Ln I与5-HT、E、NE呈线性相关。其中,5-HT和NE浓度随着尿碘的升高而降低,E浓度则升高,而平滑曲线和线性回归分析均未见统计学意义(均P>0.05,表 3)。由图 2(B)和表 3可知,尿碘与DA呈明显的非线性关系,拟合曲线存在统计学意义(P<0.001)。当儿童的尿碘达到转折点(Ln I=6.2,I=492.75 μg/L),血浆DA浓度为257.4 ng/mL。当Ln I≤6.2(I≤492.75 μg/L)时,DA浓度随着尿碘升高而明显升高;当Ln I>6.2(I>492.75 μg/L)时,曲线接近水平线,即DA浓度不随尿碘变化,趋于饱和状态。

|
| 注:调整因素为年龄、性别和尿氟浓度。(A)Ln I和5-HT;(B)Ln I和DA;(C)Ln I和E;(D)Ln I和NE。实线和虚线分别代表β及其相应的95%置信区间 图 2 儿童的尿碘水平与5-HT、DA、E和NE浓度的剂量反应关系 |
| Crude β (95% CI) | P值 | Adjusted β (95% CI) | P值 | |
| 5-HT | ||||
| Ln I | -3.9 (-22.0~14.3) | 0.675 | -5.6 (-29.6~18.3) | 0.645 |
| DA | ||||
| Ln I≤6.2 | 69.0 (44.3~93.7) | <0.001 | 65.7 (38.5~92.9) | <0.001 |
| Ln I>6.2 | 52.4 (-41.7~146.6) | 0.276 | 64.2 (-40.1~168.6) | 0.229 |
| E | ||||
| Ln I | 19.7 (-1.3~40.7) | 0.066 | 8.4 (-19.7~36.6) | 0.559 |
| NE | ||||
| Ln I | -6.4 (-63.0~50.1) | 0.824 | -25.5 (-99.1~48.1) | 0.498 |
| 注:调整因素为年龄、性别和尿氟浓度 | ||||
2.3 单胺类神经递质与智力水平的相关性
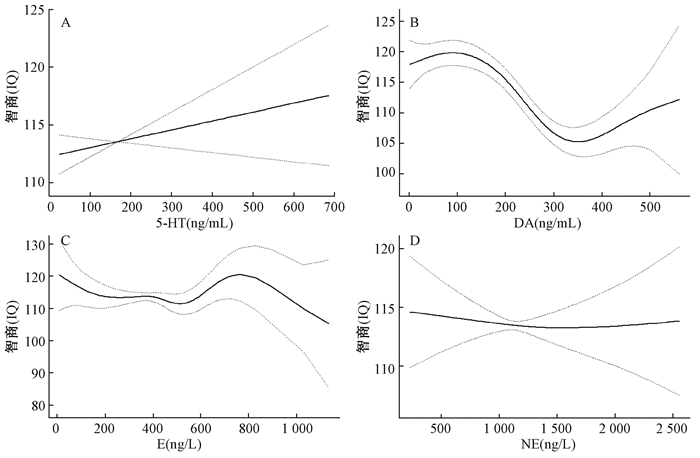
从图 3(A)、(C)和(D)可见,5-HT与IQ线性相关,NE和E与IQ非线性相关,但平滑曲线和分段线性回归模型分析,均未发现明显的阈值(均P>0.05)。由图 3(B)和表 4可知,DA与IQ呈明显的非线性关系,当儿童的多巴胺浓度在较低水平时(DA≤80.0 ng/mL),儿童体内DA浓度每升高1 ng/mL,智商升高0.1分;当多巴胺浓度在(80.0~359.8) ng/mL范围内,儿童智力水平随着血浆DA浓度的升高而降低,DA每升高1 ng/mL,智商降低0.1分;当DA浓度高于359.8 ng/mL时,智商与其浓度无相关性。
|
|
注:调整因素为年龄、性别和尿氟浓度。(A)IQ和5-HT;(B)IQ和DA;(C)IQ和E;(D)IQ和NE 实线和虚线分别代表β及其相应的95%置信区间 图 3 儿童的智商IQ与5-HT、DA、E和NE浓度的剂量反应关系 |
| DA/(ng/mL) | Crude β(95% CI) | P值 | Adjusted β(95% CI) | P值 |
| DA≤80.0 | 0.1 (0.1~0.2) | <0.001 | 0.1 (0.0~0.2) | 0.009 |
| 80.0<DA≤359.8 | -0.1 (-0.1~-0.1) | <0.001 | -0.1 (-0.1~-0.1) | <0.001 |
| DA>359.8 | -0.1 (-0.1~0.0) | 0.085 | 0.0 (-0.0~0.1) | 0.248 |
| 注:调整因素为年龄、性别和尿氟浓度 | ||||
3 讨论
碘是人体必需微量元素,碘缺乏可导致儿童智力低下,但随着全民食盐加碘措施的实施和普及,缺碘现象日渐减少,而碘过量引起的人群健康损伤日益受重视。碘过量对儿童智力是否有影响,其危害性如何,不同学者的研究结论不一致。任思思等[11]和赵金扣等[12]的研究认为,过高碘摄入降低儿童的智力,分别提出影响智力的水碘浓度界限为600和300 μg/L;本课题组前期对天津市农村地区的调查发现,相比适碘地区,高碘地区(水碘中位数234.7 μg/L)儿童IQ下降约9分[13]。而瞿胜等[14]、贾清珍等[15]和郭晓尉等[16]分别对武汉市、山西省和山东省的儿童智力调查均未发现高碘损害智力发育。从本研究得知,水碘大于300 μg/L地区儿童智商得分低于对照地区和水碘含量(150~300) μg/L的地区,但分段线性回归模型未发现高尿碘水平对儿童智商的影响,因此高碘对智力是否有不利影响还需进一步扩大样本量研究。
在脑发育的过程中,单胺类神经递质的作用不容忽视,它们是维持正常脑生理功能和学习记忆能力的重要因素。DA是工作记忆、抽象思维、创造力和执行功能等复杂任务的关键神经递质[17-18];5-HT对认知、疼痛、运动、交感神经系统的兴奋有调节作用;NE和E参与调节记忆、学习和注意力等生理变化。有研究表明,任何有害因素导致神经递质的代谢紊乱,破坏其生理平衡,无论含量过高或过低,都会导致智力功能受损[19]。本研究显示,尿碘水平对5-HT、NE和E的影响以及5-HT、NE和E与智力的关系均未见显著的线性关系或阈值效应。而高碘二区儿童的DA浓度高于适碘地区和高碘一区,且阈值分析表明碘暴露与DA呈明显的非线性关系,提示当儿童的碘内暴露水平在492.75 μg/L以内时,碘可导致DA代谢紊乱,使其浓度随碘暴露量的增加而增加,单胺类神经递质尤其是DA对外环境中碘的浓度变化敏感,处于高碘环境儿童的神经突触的多巴胺信号传递受到破坏。虽然目前缺乏碘对单胺类神经递质影响的人群调查研究,但在动物实验报道上有相似结果。研究显示健康大鼠经一段时间补碘后其大脑DA释放量增加[20];大鼠的单胺类递质浓度随碘摄入量的增加而改变,其中DA呈现峰型变化[1];高碘也会使单胺类氧化酶的活性明显增高,从而影响相关递质的降解[2]。由于动物学习记忆能力的下降是由多种神经递质的异常浓度水平、低回收率和异常功能所反映的[21],尽管这些研究未探讨大鼠学习记忆能力的改变,但高碘摄入大鼠的单胺类递质浓度异常也可提示其学习记忆能力可能会受到影响。曲线拟合显示,当儿童的多巴胺浓度在较低水平时(DA≤80.0 ng/mL),儿童体内DA浓度每升高1 ng/mL,智商升高0.1分;当多巴胺浓度在(80.0~359.8) ng/mL范围内,血浆DA浓度每升高1 ng/mL,智商降低0.1分。水碘地区儿童的智力水平在血浆多巴胺浓度为80.0 ng/mL时达到最高,低于或高于此水平,智商得分均下降。DA与智商存在明显阈值效应的这一发现与有些研究相同。Goldman-Rakic等人的研究表明,DA与前额叶皮质(Prefrontal cortex,PFC)的功能呈倒U型关系[22]。当DA水平过高或过低时,认知均会受到不利影响[23-24],PFC功能在DA浓度中间水平达到最佳[25]。虽然PFC的DA浓度更具代表性,但由于人脑组织检测受限且不可获得,外周组织如血浆易得,因此血浆中的DA也可代表神经组织的相应浓度[26]。
综上所述,与适碘地区和水碘含量(150~300) μg/L的地区相比,水碘浓度大于300 μg/L地区的儿童智商有所降低,其体内血浆DA和5-HT代谢发生紊乱;相较5-HT、E和NE,DA与智商的关系最明显。碘暴露过多儿童的DA代谢紊乱可能与其智商降低有关,且DA与智商存在明显的阈值效应。由于本研究为现况调查,高碘是否能通过影响单胺类神经递质的代谢进而影响智力还有待进一步的研究探讨。
| [1] |
王伟, 张艺馨, 谭龙, 等. 碘过量对大鼠脑组织和血清中单胺类神经递质浓度影响的研究[J]. 营养学报, 2017, 39(2): 200-202. (In English: Wang W, Zhang YX, Tan L, et al. Study on effects of iodine excess on brain and serum concentrations of monoamine neurotransmitters in rats[J]. Acta Nutrim Sin, 2017, 39(2): 200-202.) |
| [2] |
王赞鑫, 闫睿, 锁静, 等. 不同碘摄入量对子代大鼠脑神经递质及其相关酶活性的研究[J]. 中国地方病防治杂志, 2006, 21(3): 129-131. (In English: Wang ZX, Yan R, Suo J, et al. Study on the relationship between different iodine concentration and brain neurotransmitter and enzyme activity[J]. Chin J Ctrl Endem Dis, 2006, 21(3): 129-131.) |
| [3] |
Yu XC, Chen JW, Li YG, et al. Threshold effects of moderately excessive fluoride exposure on children's health:a potential association between dental fluorosis and loss of excellent intelligence[J]. Environ Int, 2018, 118: 116-124. DOI:10.1016/j.envint.2018.05.042 |
| [4] |
张文均, 刘南暖. 孕哺期染氟对子代大鼠空间记忆及中枢单胺类神经递质的影响[J]. 贵州医科大学学报, 2018, 43(4): 418-421. (In English: Zhang WJ, Liu NN. Effects of fluoride exposure during pregnancy on spatial memory and central monoamine neurotransmitters in offspring rats[J]. J Guizhou Med Univ, 2018, 43(4): 418-421.) |
| [5] |
雷雨. 高氟在孕期和哺乳期对仔鼠脑发育及单胺类神经递质的影响[J]. 中国优生与遗传杂志, 2018, 26(2): 13-14, 21. (In English: Lei Y. Effects of high fluoride on rat brain development and monoamine neurotransmitters during pregnancy and lactation[J]. Chin J Birth Health Hered, 2018, 26(2): 13-14, 21.) |
| [6] |
朱玉龙, 郑玉建, 吕小敏, 等. 氟对大鼠水迷宫学习记忆及脑内单胺类神经递质浓度的影响[J]. 新疆医科大学学报, 2012, 35(3): 330-333. (In English: Zhu YL, Zheng YJ, Lv XM, et al. Effects of fluoride exposure on performance in water labyrinth and monoamine neurotransmitters of rats[J]. J Xinjiang Med Univ, 2012, 35(3): 330-333.) |
| [7] |
曾强, 赵亮, 侯常春, 等. 天津市饮用水水源性高碘分布特征研究[J]. 中国预防医学杂志, 2012, 13(1): 23-25. (In English: Zeng Q, Zhao L, Hou CC, et al. Research on distribution status of high water iodine in Tianjin[J]. Chin Prev Med, 2012, 13(1): 23-25.) |
| [8] |
中华人民共和国卫生部. WS/T 107-2006尿碘的砷铈催化分光光度测定疗法[S].北京: 中国标准出版社, 2006. (In English: In English: Ministry of Health of the People's Republic of China. WS/T 107-2006 Method for determination of iodine in urine by As3+-Ce4+ catalytic spectrophotometry[S]. Beijing: Standards Press of China, 2006.)
|
| [9] |
中华人民共和国卫生部. WS/T 89-1996尿中氟化物的测定离子选择电极法[S].北京: 中国标准出版社, 1997. (In English: In English: Ministry of Health of the People's Republic of China. WS/T 89-1996 Determination of fluoride in urine-Ion selective electrode method[S]. Beijing: Standards Press of China, 1997.)
|
| [10] |
林林, 陈常中, 余晓丹. 应用Empower Stats软件分析阈值效应[J]. 中华流行病学杂志, 2013, 34(11): 1139-1141. (In English: Lin L, Chen CZ, Yu XD. The analysis of threshold effect using Empower Stats software[J]. Chin J Epidemiol, 2013, 34(11): 1139-1141.) |
| [11] |
任思思, 钟朝晖. 高碘对中国儿童智力影响的meta分析[J]. 卫生研究, 2014, 43(1): 133-138. (In English: Ren SS, Zhong CH. Meta-analysis on the relationship between Chinese children's intelligence and excessive iodine[J]. J Hyg Res, 2014, 43(1): 133-138.) |
| [12] |
赵金扣, 张庆兰, 尚莉, 等. 高碘摄入与儿童智力水平关系的研究[J]. 中国公共卫生, 2004, 20(5): 516-518. (In English: Zhao JK, Zhang QL, Shang L, et al. Relation between excessive iodine intake and mental development of children[J]. Chin J Public Health, 2004, 20(5): 516-518.) |
| [13] |
Liu HL, Lam LT, Zeng Q, et al. Effects of drinking water with high iodine concentration on the intelligence of children in Tianjin, China[J]. J Public Health (Oxf), 2009, 31(1): 32-38. |
| [14] |
瞿胜, 程丽娟. 碘摄取量对高碘区域小儿智商及其精神运动能力的影响[J]. 中国地方病防治杂志, 2016, 31(4): 389-390, 395. (In English: Qu S, Cheng LJ. Effect of iodine intake on children's intelligence quotient and mental exercise ability in high iodine area[J]. Chin J Ctrl Endem Dis, 2016, 31(4): 389-390, 395.) |
| [15] |
贾清珍, 张向东, 郭百锁, 等. 不同碘摄入水平对儿童甲状腺功能及智力的影响[J]. 中国地方病防治杂志, 2010, 25(1): 32-33. (In English: Jia QZ, Zhang XD, Guo BS, et al. Effect of different iodine ingestion on children's intelligence and thyroid function[J]. Chin J Ctrl Endem Dis, 2010, 25(1): 32-33.) |
| [16] |
郭晓尉, 秦启亮, 刘传蛟, 等. 不同碘摄入水平地区学龄儿童的智商水平测定[J]. 中国地方病防治杂志, 2007, 22(3): 174-177. (In English: Guo XW, Qin QL, Liu CJ, et al. Measurement of intelligence quotient in school-aged children with different iodine concentration in drinking water[J]. Chin J Ctrl Endem Dis, 2007, 22(3): 174-177.) |
| [17] |
Beaulieu JM, Espinoza S, Gainetdinov RR. Dopamine receptors-IUPHAR review 13[J]. Br J Pharmacol, 2015, 172(1): 1-23. |
| [18] |
Myrga JM, Failla MD, Ricker JH, et al. A dopamine pathway gene risk score for cognitive recovery following traumatic brain injury:methodological considerations, preliminary findings, and interactions with sex[J]. J Head Trauma Rehabil, 2016, 31(5): E15-E29. DOI:10.1097/HTR.0000000000000199 |
| [19] |
Murphy BL, Arnsten AF, Goldman-Rakic PS, et al. Increased dopamine turnover in the prefrontal cortex impairs spatial working memory performance in rats and monkeys[J]. Proc Natl Acad Sci USA, 1996, 93(3): 1325-1329. DOI:10.1073/pnas.93.3.1325 |
| [20] |
唐玄乐, 史力田, 孙礼. 碘对大鼠大脑去甲肾上腺素和多巴胺影响的实验研究[J]. 中国地方病学杂志, 1998, 17(5): 309-310. (In English: Tang XY, Shi LT, Sun L. Experimental study of iodine tablet on noradrenalin and dopamine in rat brain[J]. Chin J Endemiol, 1998, 17(5): 309-310.) |
| [21] |
高秋菊, 张世勇. 碘对中枢神经递质的影响及与学习记忆的关系[J]. 中国地方病学杂志, 2001, 20(4): 315-316. (In English: Gao QJ, Zhang SY. The impact of iodine on the central neurotransmitter and the relationship with learning-memory[J]. Chin J Endemiol, 2001, 20(4): 315-316.) |
| [22] |
Goldman-Rakic PS, Muly Ⅲ EC, Williams GV. D1 receptors in prefrontal cells and circuits[J]. Brain Res Rev, 2000, 31(2-3): 295-301. DOI:10.1016/S0165-0173(99)00045-4 |
| [23] |
Tunbridge EM, Harrison PJ, Weinberger DR. Catechol-o-methyltransferase, cognition, and psychosis:val158 met and beyond[J]. Biol Psychiatry, 2006, 60(2): 141-151. DOI:10.1016/j.biopsych.2005.10.024 |
| [24] |
Cools R, D'Esposito M. Inverted-U-shaped dopamine actions on human working memory and cognitive control[J]. Biol Psychiatry, 2011, 69(12): e113-e125. DOI:10.1016/j.biopsych.2011.03.028 |
| [25] |
Winterer G, Weinberger DR. Genes, dopamine and cortical signal-to-noise ratio in schizophrenia[J]. Trends Neurosci, 2004, 27(11): 683-690. DOI:10.1016/j.tins.2004.08.002 |
| [26] |
Gil F, Pla A. Biomarkers as biological indicators of xenobiotic exposure[J]. J Appl Toxicol, 2001, 21(4): 245-255. DOI:10.1002/(ISSN)1099-1263 |



