药品和个人护理品(Pharmaceutical and Personal Care Products,PPCPs)是一类在日常生活中大量使用的化学品,包括各种药用抗生素、类固醇、消炎镇痛药物、精神药物,在化妆品中常用做杀菌剂、芳香剂、防晒剂以及防腐剂等[1-2]。因其具有生物活性、生物累积性等特点,以及对生态环境、人体健康造成的潜在危害,目前已经引起各国学者的广泛关注,并将其归类为新兴污染物[3-4]。
喹诺酮类药物是人工合成的含有4-喹酮母核的抗菌药物,由于其具有抗菌谱广、高效、低毒、价格低廉等特点,近年来被广泛用作兽医诊治和水产养殖的抗感染药物[5]。据统计,喹诺酮类药物在国内的使用量约为500吨/年。这些药物在动物体内不能被充分吸收及代谢,其中部分药物在动物体内残留,另一部分则通过粪便及废水排放进入到自然环境中,进一步通过食物链进入人体,对人体健康造成潜在危害。例如:喹诺酮类药物可引起光敏反应及光毒性反应,并引起重症肌无力、呼吸肌无力等症状,严重时可危及生命[6-7]。此外,因其具有潜在的致癌性和遗传毒性,目前已被多个国家规定限量或禁止使用[8]。已报道的喹诺酮类药物的分析方法较多,包括液相色谱法、液相色谱串联质谱法[9-12]。研究对象除了传统药品,还包括环境介质、食品、化妆品等,重点关注环境污染水平、食品安全及化妆品中的违规添加行为[13-15]。近年来的研究显示我国广东、北京等地区的水源水及城市河流中已检出多种喹诺酮类药物,提示目前城市地表水存在不同程度的抗生素污染[16-17]。测定野生鱼肉中喹诺酮类药物的含量水平对于了解污染物的生物富集性,评估其生态风险具有重要意义。
本研究采用乙腈作为提取液,对现有鱼肉中诺氟沙星、恩诺沙星、氧氟沙星和环丙沙星的检测分析方法进行超声提取时间及固相萃取优化,研制了野生鱼肉中4种常见喹诺酮类药物的HPLC-MS/MS检测方法,并用该方法测定野生鱼肉样品20份。该方法操作简单、快速、实用,可准确定量鱼肉样品中喹诺酮类药物的含量水平。
1 实验部分 1.1 仪器与试剂API 4500 QTrap型三重四级杆串联质谱仪配电喷雾离子源(美国AB公司);LC-30 A型高效液相色谱(日本岛津公司);2-16KL型高速冷冻离心机(美国Sigma公司);GL Sciences固相萃取装置(Dikma公司);氮吹仪(美国Organomation公司);漩涡震荡仪(海门市麒麟医用仪器厂)。
甲醇、甲酸(色谱纯)购置于Dikma公司;柠檬酸、磷酸氢二钠、乙二胺四乙酸二钠、磷酸氢二钾均为分析纯,购置于国药集团化学试剂有限公司。诺氟沙星、恩诺沙星、氧氟沙星、环丙沙星及D5-诺氟沙星均购置于Dr.Ehrensorfer公司;HLB固相萃取柱(6cc,150 mg)购置于美国Waters公司。
1.2 液相色谱条件色谱柱选用Shim-pack XR-ODS Ⅲ C18 (2.0×50 mm,1.6 μm);流动相A为0.1%甲酸(v/v)水溶液;流动相B为甲醇溶液。流速:0.3 mL/min;进样量:5 μL;柱箱温:40℃;分析时间13 min,梯度洗脱程序见表 1。
| 时间/ min | 流动相A/ % | 流动相B/ % |
| 0 | 93 | 7 |
| 1 | 85 | 15 |
| 3 | 82 | 18 |
| 5 | 78 | 22 |
| 6 | 30 | 70 |
| 7 | 30 | 70 |
| 9 | 93 | 7 |
| 13 | 93 | 7 |
1.3 质谱条件
正离子模式(ESI+),多反应监测(MRM)扫描模式下采集数据;以全扫描、子离子扫描方式优化化合物及同位素内标的母离子和子离子强度。优化后的质谱分析条件:离子化电压(IS):5 500 V;离子源温度(TEM):550℃;气帘气压力(CUR):172 kPa;喷雾气(GS1):379 kPa;辅助加热气(GS2):379 kPa;去簇电压100 eV。定量离子、定性离子参数见表 2。
| 化合物 | 保留时间/min | 母离子/ (m/z) | 子离子/ (m/z) | 碰撞电压/ eV |
| 诺氟沙星 | 2.77 | 320.1 | 302.4*/276.1 | 29/25 |
| 恩诺沙星 | 3.49 | 360.2 | 316.2*/245.1 | 26/38 |
| 氧氟沙星 | 2.59 | 362.2 | 318.2*/261.2 | 26/37 |
| 环丙沙星 | 3.03 | 332.1 | 288.2*/314.3 | 23/29 |
| D5-诺氟沙星(内标) | 2.72 | 325.1 | 281.2 | 26 |
| 注:“*”表示定量离子 | ||||
1.4 标准溶液配制
各称取0.0100 g(精确至0.000 1 g)4种喹诺酮标准品,分别用甲醇溶解并定容至10 mL,配制成1 000 μg/mL的标准溶液。分别取4种喹诺酮标准溶液1 mL,甲醇定容至10 mL,配制成100 μg/mL的喹诺酮混标储备液。称取0.001 g(精确至0.000 1 g)同位素内标,甲醇定容至10 mL,配制成100 μg/mL的内标储备液。使用时,直接用甲醇逐级将混标储备液及内标储备液稀释成1 μg/mL工作液即可。
1.5 样品处理方法野生鱼肉样品用搅拌机搅成糜状,准确称取2.00 g(精确至0.01 g)糜状样品到15 mL聚丙烯离心管中加入1 μg/mL内标溶液40 μL,老化2 h。向离心管中加入1 mL McIIvaine缓冲液(11.8 g柠檬酸、27.6 g磷酸氢二钠、33.6 g乙二胺四乙酸二钠溶解于水中,定容至1 L)和4 mL乙腈,漩涡30 s,超声提取30 min,离心(10 000 rpm,离心半径7 cm, 10 min,4℃),转移上清液至另一干净15 mL聚丙烯离心管中。将沉淀物用4 mL乙腈重复提取1次,合并二次提取上清液,氮吹至近干后加入0.1 mol/L磷酸氢二钾缓冲液5 mL溶解后进行净化处理。
固相萃取柱依次用6 mL甲醇,6 mL磷酸氢二钾缓冲液活化;将上清液缓慢过柱后依次用5 mL 5%甲醇水淋洗;最后用5 mL 0.1%甲酸甲醇洗脱固相萃取柱,收集洗脱液并在10 000 rpm下离心10 min(离心半径7 cm)。取500 μL上清液上机测定。
1.6 空白基质匹配混合标准工作溶液配制称取8份2.00 g阴性鱼肉糜状样品到15 mL聚丙烯离心管,分别加入1、2.5、5、10、25、50、100和200 ng混标,并向每管中加入40 ng同位素内标。将上述8份样品与试样同时进行提取、复溶、净化后,得到基质匹配混合标准工作溶液,其含量水平为0.5、1.25、2.5、5、12.5、25、50和100 ng/g。
1.7 质量控制为保证样品测定的准确性,本实验所用的枪头、离心管等实验耗材均避免重复使用。离心管在使用前,分别用自来水,蒸馏水和甲醇润洗3次,以防止耗材污染。实验过程中,注意枪头更换等实验细节,避免样品交叉污染。
2 结果与讨论 2.1 前处理方法选择乙腈在沉淀蛋白质方面优于其他溶剂。鱼肉具有蛋白质含量丰富的特点,对于这种富含蛋白的基质,一般采用乙腈系统提取,以降低提取液中的蛋白质含量,有利于后续的净化处理。基于以上特点,本研究直接选用乙腈作为提取剂,对鱼肉中4种喹诺酮类药物进行提取。
本文在样品净化步骤中选择比较了HLB固相萃取和QuEChERs净化两种净化方式,旨在获得复杂基质中更优的样品净化方法。HLB固相萃取小柱填充的是亲水、亲脂平衡的水可浸润型反相吸附剂,能够有效去除干扰基质,又可大范围吸附包括目标检测物在内的酸性、中性和碱性化合物。而QuEChERs净化的填充物主要是PSA和MgSO4按不同比例混合,对极性化合物和酸性化合物有较强的吸附,其对于农药残留分析具有较好的针对性。HLB净化和QuEChERs净化后的空白基质加标回收率结果如表 3所示。结果显示,两种净化方式的空白基质加标回收效果均较好,相比之下,HLB净化处理后的样品可获得更好的空白基质加标回收率,在低、中、高3个浓度的加标回收率范围为85.7%~99.3%。
| ng/g | ||||
| 化合物 | 净化方式 | 加标回收率/% | ||
| 2 | 10 | 20 | ||
| 诺氟沙星 | HLB | 94.2 | 95.8 | 98.5 |
| QuEChERs | 89.3 | 90.1 | 87.2 | |
| 恩诺沙星 | HLB | 93.5 | 94.6 | 98.2 |
| QuEChERs | 82.8 | 79.3 | 88.3 | |
| 氧氟沙星 | HLB | 88.7 | 85.7 | 92.8 |
| QuEChERs | 85.6 | 75.6 | 86.5 | |
| 环丙沙星 | HLB | 92.8 | 95.4 | 99.3 |
| QuEChERs | 84.6 | 80.7 | 92.4 | |
2.2 超声提取时间选择
为获得更好的提取效果,本文比较了不同超声提取时间对4种喹诺酮空白基质加标(10 ng/g)的提取效果(图 1)。诺氟沙星在超声提取20 min后,其提取效率为104%,增大提取时间后,其提取效率变化不明显。恩诺沙星,氧氟沙星和环丙沙星四类药物在超声提取30 min后,其提取效率分别为98.4%、101%和95.3%,提取时间增至40 min时,其提取效率变化不大,说明其提取效率已达稳定水平。综合考虑,本文最终选择超声提取时间30 min,以获得较优的提取效果。

|
| 注:a.诺氟沙星;b.恩诺沙星;c.氧氟沙星;d.环丙沙星 图 1 不同超声提取时间加标回收率比较 |
2.3 流动相的选择
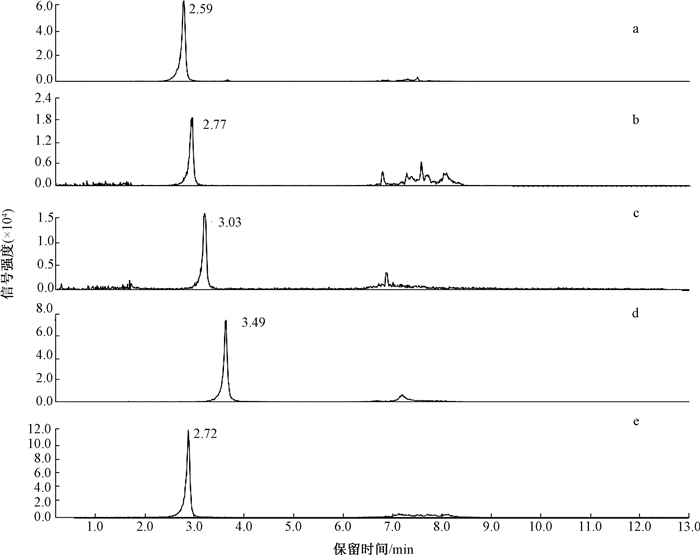
鱼肉制品中喹诺酮类药物残留HPLC-MS/MS检测方法,一般以0.1%甲酸水溶液和甲醇或乙腈为流动相[18]。本实验中,我们比较了甲醇和乙腈两种溶剂对目标化合物色谱峰的分离效果,结果发现甲醇和乙腈作为流动相对4种喹诺酮类药物色谱峰的分离无显著差异。但因乙腈价格贵,且毒性大,故本实验选择以0.1%甲酸水溶液和甲醇作为流动相,对4种喹诺酮类药物进行洗脱。图 2为HPLC-MS/MS分析4种喹诺酮类药物的MRM色谱图。
|
| a:氧氟沙星;b:诺氟沙星;c:环丙沙星;d:恩佐沙星;e:诺氟沙星内标 图 2 4种喹诺酮类药物及其内标在空白鱼肉基质溶液中的MRM色谱图(加标浓度为5ng/g) |
2.4 线性范围、检出限及定量限
向2 g空白基质中加入4种喹诺酮类药物,配制含量水平分别为0.5、1.25、2.5、5、12.5、25、50和100 ng/g的基质匹配混合标准工作溶液。以目标化合物定量离子峰面积和内标峰面积的比值为纵坐标,标准溶液浓度为横坐标,绘制标准工作曲线。结果显示4种喹诺酮类药物在(0.5~100) ng/g的含量范围内线性关系良好,相关系数为0.995~0.999(表 4)。
| 化合物 | 回归方程 | 相关系数 | 检出限/ (ng/g) | 定量限/ (ng/g) |
| 诺氟沙星 | y=0.030 2x+0.002 1 | 0.995 | 0.7 | 2.5 |
| 恩诺沙星 | y=0.099 4x+0.043 3 | 0.999 | 0.15 | 0.5 |
| 氧氟沙星 | y=0.128 9x+0.001 2 | 0.999 | 0.15 | 0.5 |
| 环丙沙星 | y=0.030 1x+0.013 8 | 0.997 | 0.7 | 2.5 |
将仪器各参数调至最佳工作状态,在MRM模式下,以目标化合物定量离子的3倍信噪比(3S/N)计算各物质检出限,以10倍信噪比(10S/N)计算定量限。检出限及定量限结果如表 4所示。其中诺氟沙星、恩诺沙星、氧氟沙星和环丙沙星的检出限分别为0.7、0.15、0.15和0.7 ng/g,其定量限分别为2.5、0.5、0.5和2.5 ng/g。目前国内利用LC-MS/MS测定鱼肉样品中喹诺酮药物残留时一般直接使用低浓度标准溶液,并计算对应的检出限和定量限。上述方法未考虑样品前处理过程的损失,导致方法检出限及定量限被低估。为获得更真实准确的方法检出限及定量限,本文考虑前处理的损失及空白基质的影响,采用更为合理的检出限及定量限计算方式。这也是本方法检出限及定量限高于其它相关方法的主要原因。
2.5 准确度和精密度随机选择3个野生鱼肉样品,向其中添加低、中、高3个浓度的喹诺酮类药物,加标含量为5、10和50 ng/g。每个加标样品中,每个浓度点进行6个平行样品测定,以获得加标回收率及方法精密度,结果如表 5所示。在3个加标水平内,4种喹诺酮类药物的平均回收率为80.4%~104%,相对标准偏差为3.2%~9.5%。
| 化合物 | 加标浓度(ng/g) | 准确度/% | 精密度/% |
| 诺氟沙星 | 5(低) | 87.6~90.3 | 4.5~7.6 |
| 10(中) | 85.2~94.9 | 3.2~8.2 | |
| 50(高) | 88.1~102.0 | 3.5~7.1 | |
| 恩诺沙星 | 5(低) | 86.5~94.5 | 5.3~7.3 |
| 10(中) | 85.3~98.7 | 4.5~8.8 | |
| 50(高) | 92.4~104.0 | 5.9~8.2 | |
| 氧氟沙星 | 5(低) | 82.7~97.4 | 3.6~7.7 |
| 10(中) | 85.3~90.1 | 4.3~8.2 | |
| 50(高) | 82.5~95.6 | 4.6~8.5 | |
| 环丙沙星 | 5(低) | 80.4~103.0 | 4.5~9.5 |
| 10(中) | 91.8~99.7 | 3.5~8.3 | |
| 50(高) | 91.2~98.4 | 3.6~7.6 |
2.6 实际样品测定
利用本方法,测定采自某市3个水库和1条河流的野生鱼样本共计20份,其中1个水库和1条河流野生鱼样本中检出诺氟沙星、恩诺沙星和环丙沙星3类喹诺酮类药物,含量水平为(3.5~25.8) ng/g,提示该市喹诺酮类药物的水体污染可能已影响到该水域的野生生物。另两个水库野生鱼样本未检出任何喹诺酮类药物。
3 结论本文研制同时测定鱼肉中诺氟沙星、恩诺沙星、氧氟沙星和环丙沙星4种喹诺酮类药物含量水平的高效液相色谱-串联质谱方法。该方法分析速度快、灵敏度高、检出限低、重现性好,可用于野生鱼肉中4种喹诺酮类药物残留的检测。
| [1] |
李晓晶, 于鸿, 甘平胜. 超高效液相色谱-串联质谱法测定土壤中多种兽用抗生素残留[J]. 环境卫生学杂志, 2016, 6(4): 296-299. (In English: Li XJ, Yu H, Gan PS. Determination of antibiotic residues in soil by UPLC-MS/MS[J]. J Environ Hyg, 2016, 6(4): 296-303.) |
| [2] |
刘印平, 祝凌燕, 李敬光. 药品与个人护理用品的生态与健康影响研究进展[J]. 卫生研究, 2009, 38(2): 237-240. (In English: Liu YP, Zhu LY, Li JG. Research progress of pharmaceutical and personal care products on ecological and human health[J]. J Hyg Res, 2009, 38(2): 237-240.) |
| [3] |
Wang JL, Wang SZ. Removal of pharmaceuticals and personal care products (PPCPs) from wastewater:A review[J]. J Environ Manage, 2016, 182: 620-640. DOI:10.1016/j.jenvman.2016.07.049 |
| [4] |
王斌, 邓述波, 黄俊, 等. 我国新兴污染物环境风险评价与控制研究进展[J]. 环境化学, 2013, 32(7): 1129-1136. (In English: Wang B, Deng SB, Huang J, et al. Environmental risk assessment and control of emerging contaminants in China[J]. Environ Chem, 2013, 32(7): 1129-1136.) |
| [5] |
高何刚, 王瑞, 杜赛, 等. 超高效液相色谱-串联质谱联用法同时测定鸡肉中磺胺和喹诺酮类兽药残留[J]. 中国卫生检验杂志, 2017, 27(17): 2481-2485. (In English: Gao HG, Wang R, Du S, et al. Simultaneous determination of 16 sulfonamides and 15 quinolones in chicken by ultra-high performance liquid chromatography tandem mass spectrometry[J]. Chin J Health Lab Technol, 2017, 27(17): 2481-2485.) |
| [6] |
张鹏, 李海霞, 王文峰, 等. 氟喹诺酮类药物的光化学性质及其光敏毒性机理[J]. 生物物理学报, 2010, 26(11): 1015-1024. (In English: Zhang P, Li HX, Wang WF, et al. Photochemistry and phototoxicity of fluoroquinolones[J]. Acta Biophys Sin, 2010, 26(11): 1015-1024.) |
| [7] |
王淑辉, 谢琰臣, 姜彬, 等. 喹诺酮类抗生素诱发重症肌无力症状加重的临床分析[J]. 中华医学杂志, 2013, 93(17): 1283-1286. (In English: Wang SH, Xie YC, Jiang B, et al. Fluoroquinolone associated myasthenia gravis exacerbation:clinical analysis of 9 cases[J]. Natl Med J China, 2013, 93(17): 1283-1286. DOI:10.3760/cma.j.issn.0376-2491.2013.17.002) |
| [8] |
张博华.固相萃取-高效液相色谱联用同时分析环境水体中四种喹诺酮类抗生素[D].泰安: 山东农业大学, 2016. (In English: Zhang BH. Simultaneous determination of 4 quinolones antibiotics in environmental water by SPME-HPLC[D]. Tai'an: Shandong Agricultural University, 2016.) http://cdmd.cnki.com.cn/Article/CDMD-10434-1016114869.htm
|
| [9] |
岳振峰, 林秀云, 唐少冰, 等. 高效液相色谱-串联质谱法测定动物组织中的16种喹诺酮类药物残留[J]. 色谱, 2007, 25(4): 491-495. (In English: Yue ZF, Lin XY, Tang SB, et al. Determination of 16 quinolone residues in animal tissues using high performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Chin J Chromatogr, 2007, 25(4): 491-495. DOI:10.3321/j.issn:1000-8713.2007.04.009) |
| [10] |
王志杰, 冷凯良, 孙伟红, 等. 高效液相色谱-串联质谱法同时测定鳗鱼和虾中残留的33种喹诺酮和磺胺类药物[J]. 色谱, 2009, 27(2): 138-143. (In English: Wang ZJ, Leng KL, Sun WH, et al. Simultaneous determination of 33 quinolone and sulfonamide residues in eels and shrimps by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2009, 27(2): 138-143. DOI:10.3321/j.issn:1000-8713.2009.02.002) |
| [11] |
张元, 周伟娥, 李绍辉, 等. 动物源性食品中喹诺酮类残留前处理及分析方法的研究进展[J]. 食品工业科技, 2016, 37(5): 378-383. (In English: Zhang Y, Zhou WE, Li SH, et al. Research progress in pretreatment technologies and detection methods of quinolones residues in foods[J]. Food Ind, 2016, 37(5): 378-383.) |
| [12] |
陈静, 郑荣, 季申, 等. 超高效液相色谱法同时测定化妆品中的19种喹诺酮类抗生素[J]. 分析化学, 2013, 41(6): 931-935. (In English: Chen J, Zheng R, Ji S, et al. Determination of 19 quinolone antibiotics in cosmetics by ultra performance liquid chromatography[J]. Chin J Anal Chem, 2013, 41(6): 931-935.) |
| [13] |
李丽莉, 罗轶, 何颂华, 等. 高效液相色谱一串联质谱法测定鱼肉中8种喹诺酮类药物的残留量[J]. 中国食品卫生杂志, 2012, 24(1): 37-40. (In English: Li LL, Luo Y, He SH, et al. Simultaneous determination of 8 quinolone residues in fish meat by high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Food Hyg, 2012, 24(1): 37-40.) |
| [14] |
李桂芝, 高福凯, 张兴梅, 等. 柠檬酸水溶液生物亲和萃取-高效液相色谱法检测鱼肉样品中喹诺酮类药物残留[J]. 分析化学, 2013, 41(10): 1592-1596. (In English: Li GZ, Gao FK, Zhang XM, et al. Determination of quinolones residues in fish samples with citric acid aqueous solution as biological affinity extractant by high performance liquid chromatography[J]. Chin J Anal Chem, 2013, 41(10): 1592-1596.) |
| [15] |
陈传斌.养殖场及周边环境中典型兽药的暴露水平和生态风险评估[D].南京: 南京大学, 2013. (In English: Chen CB. The exposure level and ecological risk assessment of typical Veterrinary medicines in livestock Husbandary[D]. Nanjing: Nanjing University, 2013.) http://cdmd.cnki.com.cn/Article/CDMD-10284-1013191444.htm
|
| [16] |
任珂君, 刘玉, 徐健荣, 等. 广东一饮用水源地河流沉积物及鱼体中氟喹诺酮类(FQs)抗生素残留特征研究[J]. 环境科学学报, 2016, 36(3): 760-766. (In English: Ren KJ, Liu Y, Xu JR, et al. Residues characteristics of fluoroquinolones (FQs) in the river sediments and fish tissues in a drinking water protection area of Guangdong province[J]. Acta Sci Cirumstant, 2016, 36(3): 760-766.) |
| [17] |
章琴琴.北京温榆河流域抗生素污染分布特征及源解析研究[D].重庆: 重庆大学, 2012. (In English: Zhang QQ. Determination and source apportionment of three classes of antibiotics in Beijing Wenyu rivers[D]. Chongqing: Chongqing University, 2012.) http://cdmd.cnki.com.cn/Article/CDMD-10611-1012049358.htm
|
| [18] |
刘冬虹, 吴玉銮, 王斌, 等. 分散固相萃取-超高效液相色谱-串联质谱测定肉制品中5类药物残留[J]. 现代食品科技, 2016, 32(10): 290-296. (In English: Liu DH, Wu YL, Wang B, et al. Analysis of five types of veterinary drug residues in meat products by dispersive solid phase extraction-UPLC-MS/MS[J]. Mod Food Sci Technol, 2016, 32(10): 290-296.) |



