半挥发性有机物是指沸点170℃~350℃或者蒸汽压为13.3 Pa~1.33×10-5 Pa的一类物质,这类物质包括氯苯类、有机氯农药类、有机磷农药类、硝基苯类、苯酚类、苯胺类等一大类化合物[1-2]。这类物质随着人类生产活动的增强及工农业的发展而逐渐在环境中蓄积,通过饮用水、食品、空气等途径进入人体内,对人体健康造成危害。这类物质除了对人造成急性刺激性危害外,还容易在人体内蓄积,多数具有致癌、致畸和致突变性,目前已成为全球范围内重点监控的污染物。
对于水中半挥发有机物的检测多采用液液萃取或固相萃取与气相色谱联用。这种方法步骤繁琐、耗时长、试剂用量大,且由于气相色谱检测器的限制能够同时检测的有机物种类有限。固相微萃取是20世纪90年代发展起来的一种新型的样品前处理技术,该技术将样品的萃取、浓缩、进样集于一体,并且可以和色谱质谱进行在线联用操作。目前已有多项研究将其运用于水中有机物的检测[3-7]。和传统的固相萃取、液液萃取等前处理方式相比,固相微萃取具有操作简便快速、不使用试剂等优点,具备较低的检出限和较好的重现性[8]。本文采用了固相微萃取和气相色谱质谱联用的方法检测了饮用水中25种半挥发性有机物,实现了不同类型多种化合物的同时测定。
1 材料与方法 1.1 仪器与试剂QP2010 Plus型气相色谱—质谱联用仪(日本岛津);DB-5MS型色谱柱(30 m×0.25 mm,1.8 μm,Agilent公司);AOC-5000固相微萃取自动进样器(CTC Analysis AG公司);Milli-Q Integral 3超纯水处理器(美国密理博公司);固相微萃取手柄及萃取头(100 μm PDMS纤维头、65 μm PDMS/DVB纤维头、85 μm PA纤维头,Suplco公司;)甲醇(色谱纯,批号:1 715 97)购自赛默飞世尔公司;25种半挥发有机物标准品购自Accustandard公司,纯度>98%,名称见表 1;高纯水由实验室纯水机制得,符合《分析实验室用水规格和检验方法》(GB/T 6682-2008)[9]一级水的要求。
| 序号 | 名称 | 峰面积 | |
| 直接萃取 | 顶空萃取 | ||
| 1 | 敌敌畏 | 13 629 | 8 754 |
| 2 | 1,3,5—三氯苯 | 123 578 | 49 317 |
| 3 | 1,2,4—三氯苯 | 101 807 | 32 940 |
| 4 | 1,2,3—三氯苯 | 120 143 | 50 683 |
| 5 | 1,2,3,5—四氯苯 | 83 214 | 9 096 |
| 6 | 1,2,4,5—四氯苯 | 85 333 | 8 278 |
| 7 | 1,2,3,4—四氯苯 | 96 818 | 10 027 |
| 8 | α—六六六 | 193 545 | 3 264 |
| 9 | 六氯苯 | 161 245 | 2 458 |
| 10 | 乐果 | 9 581 | 未响应 |
| 11 | β—六六六 | 271 658 | 5 663 |
| 12 | γ—六六六 | 435 491 | 8 486 |
| 13 | δ—六六六 | 170 818 | 7 829 |
| 14 | 五氯酚 | 18 104 | 3 069 |
| 15 | 百菌清 | 382 565 | 8 595 |
| 16 | 甲基对硫磷 | 51 137 | 973 |
| 17 | 七氯 | 146 729 | 2 551 |
| 18 | 马拉硫磷 | 67 946 | 589 |
| 19 | 毒死蜱 | 72 751 | 1 078 |
| 20 | 对硫磷 | 75 618 | 848 |
| 21 | P, P’-DDE | 1 327 514 | 8 603 |
| 22 | P, P’-DDD | 1 297 664 | 7 250 |
| 23 | O, P’-DDT | 1 371 369 | 6 425 |
| 24 | P, P’-DDT | 631 743 | 2 003 |
| 25 | 溴氰菊酯 | 122 504 | 1 376 |
1.2 标准溶液及标准系列配制
准确称取各标准品,用甲醇溶解配成浓度为1 000 μg/mL的标准储备液,于-18℃保存。用甲醇稀释标准储备液,配制成10 μg/mL混合标准溶液。分别取5、10、20、30、40和50 μL的混合标准溶液加入100 mL的容量瓶中并用纯水定容至刻度,混匀,配制标准系列浓度为0.5, 1.0, 2.0, 3.0, 4.0和5.0 μg/L。
1.3 方法 1.3.1 固相微萃取操作在20 mL顶空瓶中准确加入10 mL样品,选择85 μmPA微萃取纤维头,将其浸入样品溶液中,于40℃下萃取50 min,样品搅拌速率为500转/min。标准系列处理过程与样品溶液相同。将萃取后的纤维头置于气相色谱进样口,于250℃温度下解吸5 min,解吸后的组分经色谱柱分离后进入质谱测定。
1.3.2 色谱条件色谱柱DB-5MS型,30 m×0.25 mm,1.8 μm, Agilent公司;柱温程序:初始温度80℃,保持3 min,以10℃/min升温至300℃;进样口温度:250℃;色谱柱气流速:1.0 mL/min;
1.3.3 质谱条件接口温度:280℃;离子源温度:230℃;离子化方式:EI;采集方式:选择特征离子扫描方式;扫描离子范围m/z:x50 ~500。
1.3.4 定性分析以目标组分的保留时间和特征离子进行定性。样品中检出组分的保留时间与标准溶液中目标组分的保留时间偏差不大于5%,并且样品中检出组分的监测离子相对丰度与标准溶液中组分的监测离子相对丰度偏差不超过20%,则判定样品中存在该目标化合物。
1.3.5 定量分析以标准系列中目标组分的定量离子峰面积为纵坐标,以标准系列中目标组分的浓度为横坐标,绘制标准曲线,进行定量分析。
2 结果与讨论 2.1 萃取方式选择固相微萃取方式目前主要有顶空萃取和直接萃取两种,直接萃取模式的检出限低于顶空萃取模式[4-6],但是容易受到基体的干扰且花费时间多于顶空萃取模式。本实验选择两种处理方式对加标样品进行萃取,考察目标组分的响应值。结果表明,直接萃取模式虽然花费时间较长,但是获得的目标组分的响应值明显高于顶空萃取模式,所以本实验采用了直接萃取的方式。以峰面积表示响应值,目标组分在两种萃取方式下的响应值见表 1。
2.2 萃取纤维头选择目前常用的固相微萃取纤维有PDMS纤维头、PDMS/DVB纤维头、PA纤维头等,不同的纤维头分别适用于不同极性的化合物[4, 7, 10]。本实验选择了100 μm PDMS纤维头、65 μm PDMS/DVB纤维头、85 μm PA纤维头3种类型的纤维头对加标样品进行萃取,考察萃取效率。结果表明,85 μm PA纤维头对25种目标组分均能获得较为满意响应值,而100 μm PDMS纤维头和65 μm PDMS/DVB纤维头对于有机磷农药类和溴氰菊酯组分萃取后获得的响应值非常低。所以,本实验选取了85 μm PA纤维做为萃取头。以峰面积表示响应值,目标组分在3种萃取纤维头下的响应值见表 2。
| 序号 | 名称 | 峰面积 | ||
| 100 μm PDMS |
85 μm PA纤维 |
65 μm PDMS/DVB 纤维 |
||
| 1 | 敌敌畏 | 未响应 | 13 629 | 1 107 |
| 2 | 1,3,5—三氯苯 | 104 569 | 123 578 | 130 211 |
| 3 | 1,2,4—三氯苯 | 98 148 | 101 807 | 112 417 |
| 4 | 1,2,3—三氯苯 | 100 487 | 120 143 | 101 569 |
| 5 | 1,2,3,5—四氯苯 | 69 254 | 83 214 | 80 324 |
| 6 | 1,2,4,5—四氯苯 | 75 628 | 85 333 | 86 125 |
| 7 | 1,2,3,4—四氯苯 | 90 187 | 96 818 | 92 947 |
| 8 | α—六六六 | 139 845 | 193 545 | 176 519 |
| 9 | 六氯苯 | 153 204 | 161 245 | 180 324 |
| 10 | 乐果 | 未响应 | 9 581 | 未响应 |
| 11 | β—六六六 | 205 478 | 271 658 | 248 720 |
| 12 | γ—六六六 | 364 752 | 435 491 | 415 687 |
| 13 | δ—六六六 | 144 230 | 170 818 | 182 354 |
| 14 | 五氯酚 | 3 976 | 18 104 | 8 025 |
| 15 | 百菌清 | 315 687 | 382 565 | 401 207 |
| 16 | 甲基对硫磷 | 5 378 | 51 137 | 12 047 |
| 17 | 七氯 | 93 587 | 146 729 | 119 854 |
| 18 | 马拉硫磷 | 10 295 | 67 946 | 24 618 |
| 19 | 毒死蜱 | 17 468 | 72 751 | 31 920 |
| 20 | 对硫磷 | 18 805 | 75 618 | 35 542 |
| 21 | P, P’-DDE | 964 831 | 1 327 514 | 1 134 892 |
| 22 | P, P’-DDD | 910 258 | 1 297 664 | 1 204 783 |
| 23 | O, P’-DDT | 893 865 | 1 371 369 | 1 169 857 |
| 24 | P, P’-DDT | 521 204 | 631 743 | 702 456 |
| 25 | 溴氰菊酯 | 11 027 | 122 504 | 50 612 |
2.3 萃取温度选择
萃取温度升高,有利于目标组分在水介质中向萃取纤维扩散,但是也会影响到纤维头对目标组分的吸附。实验设定了30℃、40℃、50℃、60℃对加标样品进行萃取,考察目标组分的响应值。实验结果表明,随着萃取温度的增加,25种目标组分并非呈现简单升高的趋势,部分目标组分在超过一定温度后呈现下降的趋势。综合所有目标组分的响应值,实验选择40℃做为萃取温度。
2.4 萃取时间选择实验设定了30、40、50、60、70和80 min对加标样品进行萃取,考察不同时间下萃取效率。结果表明,随着萃取时间的延长,目标组分的响应值增大。但是当萃取时间达到50 min时,继续延长时间回收率增加不再明显。考虑的萃取效率和实验时间的最佳结合,本实验选择萃取时间为50 min。
2.5 搅拌速率选择直接萃取时目标组分需要在水介质中向萃取纤维头扩散传递,传递速率远低于空气介质,另外纤维层周围附着的水膜也妨碍了对目标组分的吸附,因此样品溶液需要高速搅拌。实验设定了200、300、400和500 rpm几种转速对加标样品进行萃取,考察不同速率下的萃取效率。目标组分的响应值随着转速增高而增大,实验设定了500 rpm的搅拌速率。
2.6 解吸温度与时间选择在进样口250℃的温度下,分别设定2、3、4、5和6 min的解吸时间,考察不同时间下目标组分的响应值。当解吸时间超过5 min时,目标组分响应值不再增加,所以实验设定为250℃下解吸5 min。
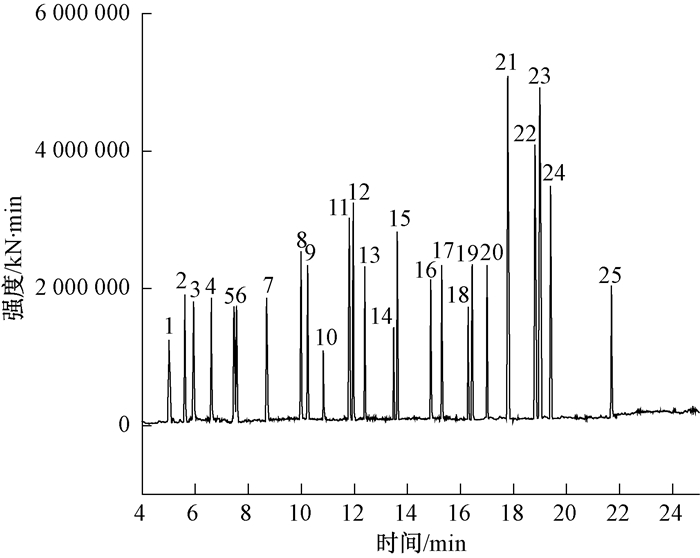
2.7 GC-MS分析实验选用DB-5MS色谱柱, 采用程序升温分离目标化合物,程序升温范围覆盖了25种化合物的沸点,各目标化合物获得了较好的分离。分离后的目标组分进入质谱系统,首先选择全扫描模式进行分析,获得目标组分的总离子流图及质谱图。根据质谱图及干扰情况确定各组分的定性定量离子,然后选择特征离子扫描模式进行定量分析。25种半挥发性有机物的总离子流图见图 1,其保留时间及SIM监测离子见表 3。
| 序号 | 名称 | 保留时间/ min |
定量离子/ (m/z) |
定性离子/(m/z) | 线性方程 | 相关系数 | 检出限/ (μg/L) |
||
| 1 | 敌敌畏 | 5.010 | 109 | 109 | 185 | 145 | y=5 102.8x+1 565 | 0.996 | 0.35 |
| 2 | 1,3,5—三氯苯 | 5.607 | 180 | 180 | 182 | 145 | y=64 150x-2 913 | 0.998 | 0.05 |
| 3 | 1,2,4—三氯苯 | 5.937 | 180 | 180 | 182 | 145 | y=54 413x-1 584 | 0.997 | 0.06 |
| 4 | 1,2,3—三氯苯 | 6.603 | 180 | 180 | 182 | 145 | y=58 110x-3 026 | 0.996 | 0.06 |
| 5 | 1,2,3,5—四氯苯 | 7.460 | 216 | 216 | 108 | 179 | y=39 029x+295.0 | 0.997 | 0.07 |
| 6 | 1,2,4,5—四氯苯 | 7.553 | 216 | 216 | 108 | 179 | y=40 112x+1 046 | 0.997 | 0.07 |
| 7 | 1,2,3,4—四氯苯 | 8.690 | 216 | 216 | 108 | 179 | y=51 802x-498.5 | 0.997 | 0.06 |
| 8 | α—六六六 | 9.987 | 183 | 183 | 181 | 219 | y=91 718x-876.0 | 0.997 | 0.01 |
| 9 | 六氯苯 | 10.240 | 284 | 284 | 282 | 286 | y=73 104x+3 312 | 0.995 | 0.03 |
| 10 | 乐果 | 10.827 | 125 | 125 | 87 | 93 | y=4 127.1+1 365 | 0.994 | 0.44 |
| 11 | β—六六六 | 11.807 | 109 | 109 | 111 | 181 | y=140 944x+4 115 | 0.997 | 0.008 |
| 12 | γ—六六六 | 11.960 | 111 | 111 | 219 | 181 | y=224 290x+5 011 | 0.997 | 0.007 |
| 13 | δ—六六六 | 12.390 | 109 | 109 | 111 | 181 | y=82 631x-342.5 | 0.996 | 0.02 |
| 14 | 五氯酚 | 13.480 | 266 | 266 | 264 | 268 | y=9 234.0x+541.0 | 0.995 | 0.17 |
| 15 | 百菌清 | 13.617 | 266 | 266 | 264 | 268 | y=196 533x+8 620 | 0.995 | 0.009 |
| 16 | 甲基对硫磷 | 14.880 | 263 | 263 | 109 | 125 | y=63 310x+722.0 | 0.997 | 0.04 |
| 17 | 七氯 | 15.297 | 100 | 100 | 272 | 274 | y=83 807x-686.2 | 0.996 | 0.02 |
| 18 | 马拉硫磷 | 16.290 | 125 | 125 | 173 | 127 | y=45 629x-3 547 | 0.996 | 0.07 |
| 19 | 毒死蜱 | 16.440 | 197 | 197 | 199 | 314 | y=76 115x+1 523 | 0.997 | 0.02 |
| 20 | 对硫磷 | 17.003. | 97 | 97 | 139 | 137 | y=79 409x+938.0 | 0.997 | 0.02 |
| 21 | P, P’-DDE | 17.780 | 246 | 246 | 248 | 318 | y=647 220x+3 975 | 0.996 | 0.002 |
| 22 | P, P’-DDD | 18.813 | 235 | 235 | 237 | 165 | y=626 982x+9 048 | 0.996 | 0.002 |
| 23 | O, P’-DDT | 18.993 | 235 | 235 | 237 | 165 | y=699 849x-9 427 | 0.996 | 0.002 |
| 24 | P, P’-DDT | 19.400 | 235 | 235 | 237 | 165 | y=306 342x+9 048 | 0.994 | 0.006 |
| 25 | 溴氰菊酯 | 21.697 | 181 | 181 | 253 | 251 | y=47 463x+7 682 | 0.997 | 0.06 |
2.8 方法线性及检出限
方法线性方程、相关系数及检出限见表 3。各目标化合物在(0.5~5) μg/L范围内具有较好的线性,其相关系数均≥0.99。检测样品空白,以3倍信噪比对应的目标化合物浓度做为方法的检出限,25种目标化合物的检出限范围为(0.002~0.44) μg/L。
2.9 方法回收率及精密度在水样中加入标准溶液,分别进行低、中、高3种不同浓度的加标实验,每个浓度进行六次平行测定,计算平均回收率和相对标准偏差。以平均回收率表示方法的准确度,以相对标准偏差表示方法的精密度。25种目标化合物的平均回收率范围为70.3%~119.0%,相对标准偏差范围为4.0%~13.4%,各组分的回收率及相对标准偏差见表 4。
| 序号 | 名称 | 低浓度(1.0 μg/L) | 中浓度(2.5 μg/L) | 高浓度(4.0 μg/L) | |||||
| 回收率/% | RSD/% | 回收率/% | RSD/% | 回收率/% | RSD/% | ||||
| 1 | 敌敌畏 | 95.1 | 8.3 | 93.0 | 6.0 | 107.0 | 5.7 | ||
| 2 | 1,3,5—三氯苯 | 91.8 | 6.4 | 92.0 | 6.7 | 95.4 | 5.8 | ||
| 3 | 1,2,4—三氯苯 | 86.0 | 5.8 | 91.0 | 5.4 | 84.0 | 6.1 | ||
| 4 | 1,2,3—三氯苯 | 94.5 | 5.8 | 103.5 | 5.6 | 90.7 | 4.9. | ||
| 5 | 1,2,3,5—四氯苯 | 82.8 | 6.9 | 86.0 | 6.4 | 92.5 | 6.0 | ||
| 6 | 1,2,4,5—四氯苯 | 82.4 | 6.4 | 84.0 | 6.2 | 85.0 | 5.7 | ||
| 7 | 1,2,3,4—四氯苯 | 85.4 | 6.8 | 90.1 | 5.8 | 88.0 | 7.0 | ||
| 8 | α—六六六 | 111.8 | 6.2 | 92.0 | 6.8 | 105.0 | 7.4 | ||
| 9 | 六氯苯 | 81.2 | 8.9 | 83.0 | 7.2 | 87.0 | 10.0 | ||
| 10 | 乐果 | 119.0 | 4.4 | 112.5 | 5.7 | 110.0 | 6.0 | ||
| 11 | β—六六六 | 108.6 | 5.7 | 101.4 | 5.2 | 112.3 | 6.9 | ||
| 12 | γ—六六六 | 109.8 | 6.8 | 93.4 | 5.7 | 106.5 | 6.4 | ||
| 13 | δ—六六六 | 116.8 | 6.7 | 111.0 | 6.5 | 84.6 | 5.8 | ||
| 14 | 五氯酚 | 87.3 | 6.8 | 89.0 | 5.5 | 85.0 | 5.2 | ||
| 15 | 百菌清 | 114.5 | 10.2 | 90.3 | 8.6 | 93.2 | 8.0 | ||
| 16 | 甲基对硫磷 | 111.5 | 5.8 | 87.0 | 5.2 | 89.2 | 4.9 | ||
| 17 | 七氯 | 70.3 | 13.4 | 80.0 | 9.6 | 72.6 | 11.2 | ||
| 18 | 马拉硫磷 | 108.0 | 4.0 | 88.4 | 5.0 | 94.2 | 4.4 | ||
| 19 | 毒死蜱 | 84.6 | 6.8 | 91.2 | 5.7 | 80.0 | 5.1 | ||
| 20 | 对硫磷 | 99.6 | 5.8 | 90.0 | 6.9 | 93.8 | 6.0 | ||
| 21 | P, P’-DDE | 92.0 | 8.1 | 96.0 | 7.0 | 95.4 | 7.8 | ||
| 22 | P, P’-DDD | 96.4 | 13.1 | 106.0 | 10.4 | 104.5 | 8.7 | ||
| 23 | O, P’-DDT | 91.2 | 9.6 | 90.4 | 10.5 | 98.0 | 7.4 | ||
| 24 | P, P’-DDT | 101.8 | 10.3 | 97.0 | 8.2 | 109.2 | 7.8 | ||
| 25 | 溴氰菊酯 | 89.0 | 4.7 | 85.0 | 5.3 | 92.0 | 5.0 | ||
3 实际样品测定
采用本方法检测北京市区域内10份生活饮用水,25种目标化合物均未检出,一定程度上说明了半挥发性有机物对北京市生活饮用水造成的影响较小。
4 结论本文建立了固相微萃取—气相色谱质谱联用测定水中半挥发性有机物的方法。该方法具有较好的准确度和精密度,具备操作简单、无需溶剂、在线自动化操作等特点,适用于包括有机磷有机氯农药、氯苯、菊酯等多种化合物在内的半挥发性有机物测定。
| [1] |
吕天峰, 张宝, 滕恩江, 等. 固相微萃取-气相色谱-质谱法测定水体中半挥发性有机污染物[J]. 理化检验-化学分册, 2013, 49(8): 957-960, 964. (In English: Lü TF, Zhang B, Teng EJ, et al. GC-MS determination of semi-volatile organic contaminants in water with SPME[J]. Phys Test Chem Anal (Part B:Chem Anal), 2013, 49(8): 957-960, 964.) |
| [2] |
刘茜, 练慧勇, 余翀天. SPME arrow测定生活饮用水中的半挥发性有机物[J]. 环境化学, 2017, 36(11): 2515-2517. |
| [3] |
张潜, 高舸, 王炼, 等. 自动固相微萃取-气相色谱/质谱法快速筛查饮水中45种挥发性和半挥发性有机物[J]. 实用预防医学, 2016, 23(3): 275-279. (In English: Zhang Q, Gao G, Wang L, et al. Automated solid phase micro-extraction coupled with gas chromatography-mass spectrometry for rapid analysis of 45 volatile and semivolatile organic compounds in drinking water[J]. Pract Prev Med, 2016, 23(3): 275-279. DOI:10.3969/j.issn.1006-3110.2016.03.006) |
| [4] |
王艳丽, 周阳. 固相微萃取-气相色谱-质谱法测定水中痕量有机磷和阿特拉津农药[J]. 中国环境监测, 2013, 29(1): 112-115. (In English: Wang YL, Zhou Y. Determination of organic phosphorus and atrazine in water by SPME-GC-MS[J]. Environ Monit China, 2013, 29(1): 112-115. DOI:10.3969/j.issn.1002-6002.2013.01.022) |
| [5] |
许秀艳, 曹方方, 丁曦宁, 等. 顶空固相微萃取-气相色谱法测定水中16种有机氯农药的含量[J]. 理化检验-化学分册, 2017, 53(10): 1171-1176. (In English: Xu XY, Cao FF, Ding XN, et al. GC Determination of 16 organochlorine pesticides in water with headspace solid phase microextraction[J]. Phys Test Chem Anal (Part B:Chem Anal), 2017, 53(10): 1171-1176. DOI:10.11973/lhjy-hx201710011) |
| [6] |
刘静, 曾兴宇, 烟卫. 自动顶空固相微萃取气相色谱法同步分析水中17种有机物[J]. 分析试验室, 2010, 29(12): 55-58. (In English: Liu J, Zeng XY, Yan W. Simultaneous quantization of seventeen organic compounds in water by automated HS-SPME and gas chromatography[J]. Chin J Anal Lab, 2010, 29(12): 55-58. DOI:10.3969/j.issn.1000-0720.2010.12.015) |
| [7] |
王凌, 徐晓琴, 李庆玲, 等. 固相微萃取-气相色谱/质谱(SPME-GC/MS)联用分析海水中痕量有机磷农药[J]. 环境化学, 2006, 25(1): 110-114. DOI:10.3321/j.issn:0254-6108.2006.01.028 |
| [8] |
傅若农. 固相微萃取(SPME)近几年的发展[J]. 分析试验室, 2015, 34(5): 602-620. (In English: Fu R N. Development of solidphase microextraction (SPME) in recent years[J]. Chin J Anal Lab, 2015, 34(5): 602-620.) |
| [9] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 6682-2008分析实验室用水规格和试验方法[S].北京: 中国标准出版社, 2008.
|
| [10] |
朱涛, 朱莉萍, 周宏琛, 等. 固相微萃取-气相色谱-质谱法检测30种农药残留[J]. 分析试验室, 2013, 32(3): 115-120. (In English: Zhu T, Zhu LP, Zhou HC, et al. Determination of different kinds of pesticides by SPME-GC/MS[J]. Chin J Anal Lab, 2013, 32(3): 115-120.) |