随着我国海水淡化产业的发展,海水淡化药剂在我国具有巨大的市场潜力。阻垢剂是指具有能够分散水中难溶性无机盐,阻止或干扰难溶性无机盐在金属表面沉淀、结垢的一类水处理药剂,其中共聚物类阻垢剂对推动我国水处理剂产业的可持续发展具有重要意义[1]。随着海水淡化水逐渐进入城市供水系统,海水淡化水的安全性越来越受到公众的重视[2-3]。高分子化合物本身无毒或毒性很小[4],但在聚合过程中加入的复配剂、还原剂等可能会降低阻垢剂中高分子化合物的纯度,对阻垢剂的安全性造成影响。本研究选用中国仓鼠卵巢细胞(Chinese Hamster Ovary, CHO),采用彗星试验和流式细胞术体外微核试验观察3种阻垢剂在DNA水平和染色体水平上对CHO细胞的遗传毒性效应。
1 材料与方法 1.1 试验样品本实验所用3种海水淡化阻垢剂分别为改性聚羧酸阻垢剂、聚丙烯酸阻垢剂(DM101)和马来酸阻垢剂,均为透明液体状,实际用量每升原海水(2~6) mg,由国家海洋局天津海水淡化与综合利用研究所提供。
1.2 仪器及试剂DYY-6C电泳仪(北京市六一仪器厂);CASP彗星分析系统(网站免费获得);单细胞凝胶电泳玻片(Trevigen);低熔点琼脂胶(low melting agarose, LMA;Trevigen);Gallios流式细胞仪(Beckman Coulter);体外微核试验试剂盒(Litron Laboratories);6 μm荧光微珠(Beckman Coulter);CHO细胞培养基、胎牛血清和胰酶均购自Thermo Fisher。
1.3 细胞株及培养条件中国仓鼠卵巢细胞(Chinese hamster ovary cells,CHO),购于中国协和医科大学基础医学研究所;培养于含10%胎牛血清、1%双抗的DMEM/F12基础培养液,在37℃、CO2体积为5%的培养条件下维持培养。
1.4 试剂配制彗星试验:1% LMA,90℃~100℃水浴5 min,37.5℃水浴备用;裂解液,使用前至少4℃条件下冷藏20 min;TE缓冲液(0.4 mol/L Tris-HCl缓冲液,1 mmol/L Na2EDTA,pH=7.5);SYBR Green 1染色液(SYBR Green 1 :TE buffer=1 :1 000);碱性电泳液及碱性解旋液(200 mmol/L Na2EDTA),调节pH≥13。
流式细胞术体外微核试验:试剂准备必须在收集细胞和染色当天准备。S9代谢活化系统(1.5%S9,0.7 NDPP/mL,3.0 mg异柠檬酸/mL);1×缓冲溶液/样本(3.6 mL去离子水,0.4 mL 10×缓冲液,0.08 mL胎牛血清);核酸A染色液/样本(0.33 mL 1×缓冲溶液,3.3 μL核酸A染料),使用前冰上避光保存;完全裂解液1/样本(0.55 mL非完全裂解液1,2.2 μL核酸B染料,2.75 μL RNase液),使用前避光室温保存;完全裂解液2/样本(0.55 mL非完全裂解液2,2.2 μL核酸B染料),使用前室温避光保存。
1.5 彗星试验 1.5.1 细胞染毒待接种细胞生长至对数生长期后,根据实时细胞分析技术试验得出改性聚羧酸阻垢剂、聚丙烯酸阻垢剂和马来酸阻垢剂24 h对CHO细胞的IC50分别为2.781、2.401和1.347 mg/mL, 将3种阻垢剂的IC50为最高浓度用培养液进行4倍稀释;阴性对照为培养液对照组;阳性对照为1 μg/mL的K2Cr2O7;每个剂量设置2个复孔,置于细胞培养箱中染毒3 h。细胞经PBS清洗后,加胰蛋白酶消化,经离心,HBSS调整细胞密度为1×105个/mL,备用。
1.5.2 解旋、电泳及观察取30 μL上述细胞悬液与300 μL LMA相混合后充分混匀,取30 μL于彗星电泳玻片上铺胶,4℃保存10 min。待细胞、LMA混合物凝固于玻片上后,经裂解、解旋、电泳、中和、脱水,滴加SYTOX Green Ⅰ暗处染色。染色后在荧光显微镜下观察,每个剂量随机拍摄100个细胞,用CASP软件进行分析。以尾部DNA含量(Tail DNA%)、尾距(Tail Moment)作为DNA断裂程度的评价指标。
1.5.3 彗星结果的数据处理统计分析采用GraphPad Prism 5统计软件,数据采用方差分析及多个试验组与1个对照组均数差别比较的Dunnett-t检验进行分析(P<0.05)。
1.6 流式细胞术体外微核试验 1.6.1 细胞染毒加样前1天,用0.25%的胰酶消化处于对数生长期的细胞,进行细胞计数和稀释,调整细胞密度满足试验设计要求。24孔板接种数量分别为每孔12 000个(-S9处理)及20 000个细胞(+ S9处理),接种后培养过夜。试验分为-S9处理组(处理时间为24 h),选择0.1 μg/mL MMC和0.1 μg/mL秋水仙素作为阳性对照;+ S9处理组(处理时间为4 h), 选择0.1 μg/mL CP和0.1 μg/mL秋水仙素作为阳性对照;阴性对照为培养液对照组;根据细胞毒性实验得出改性聚羧酸阻垢剂、聚丙烯酸阻垢剂和马来酸聚合物阻垢剂的IC50分别为1.347、2.401和2.781 mg/mL, 以3种阻垢剂的IC50为最高浓度用培养液进行2倍稀释。每个浓度设置两个复孔,染毒后24 h后收获细胞并进行微核检测。
1.6.2 流式细胞仪检测流式细胞术体外微核检测方法采用EMA和SYTOX Green双色标记技术。EMA荧光信号由FL3通道收集,SYTOX Green荧光信号收集在FL1通道。EMA染液可以穿过凋亡或坏死细胞的细胞膜,在光活化条件下以共价键的形式与DNA结合,无法穿过活细胞细胞膜。采用EMA和SYTOX Green双色标记可以区分活细胞和凋亡、坏死的细胞。试验组微核率高于对照组微核率2倍结果为阳性[5]。
1.6.3 体外微核结果的数据处理使用Microsoft Excel 2013对两个复孔结果求平均数。
2 结果 2.1 彗星试验结果 2.1.1 3种阻垢剂对CHO细胞尾部DNA含量(Tail DNA%)的影响如图 1所示,与阴性对照组相比,改性聚羧酸阻垢剂、聚丙烯酸阻垢剂、马来酸聚合物阻垢剂在高、中剂量组对尾部DNA含量的影响呈现显著性差异(P<0.001);改性聚羧酸阻垢剂、聚丙烯酸阻垢剂和马来酸聚合物阻垢剂在高、中、低剂量组均呈现出随剂量增加而增加的趋势。
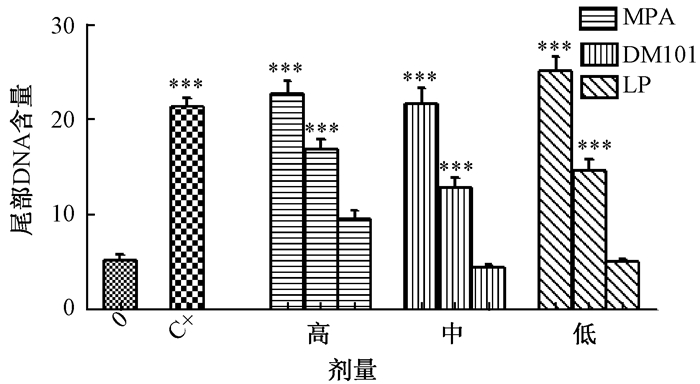
|
| 注:MPA:改性聚羧酸阻垢剂;DM101:聚丙烯酸阻垢剂;LP:马来酸聚合物阻垢剂;“0”:阴性对照组;“C+”:阳性对照,1 μg/mL K2Cr2O7.**P<0.01, ***P<0.001 图 1 CHO细胞暴露于阻垢剂3 h后对尾部DNA含量(%DNA in tail)的影响 |
2.1.2 3种阻垢剂对CHO细胞尾距的影响
如图 2所示,与阴性对照组相比,改性聚羧酸阻垢剂、聚丙烯酸阻垢剂、马来酸聚合物阻垢剂在高、中剂量组对尾距的影响在统计学上呈现显著性差异(P<0.001);改性聚羧酸阻垢剂、聚丙烯酸阻垢剂和马来酸聚合物阻垢剂在高、中、低剂量组上均呈现出随剂量增加而增加的趋势。
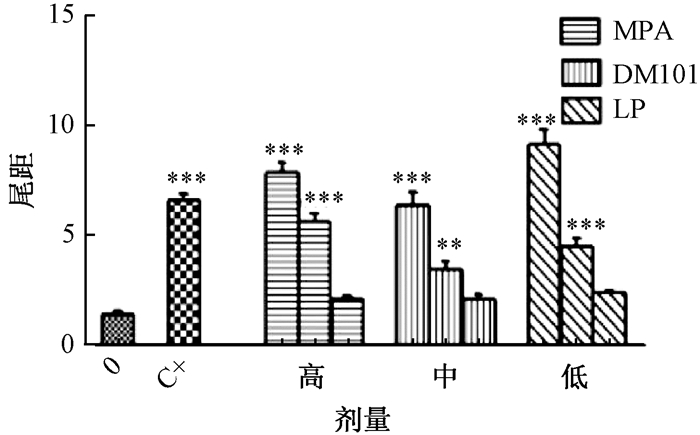
|
| 注:MPA:改性聚羧酸阻垢剂;DM101:聚丙烯酸阻垢剂;LP:马来酸聚合物阻垢剂;“0”:阴性对照组;“C+”:阳性对照,1 μg/mL K2Cr2O7. **:P<0.01, *** P<0.001 图 2 CHO细胞暴露于阻垢剂3 h后对尾距(tail moment)的影响 |
2.2 体外微核试验结果
在不加S9的试验组中,马来酸聚合物阻垢剂在高剂量组呈现阳性结果;加S9的试验组中,马来酸聚合物在高、中、低剂量组呈现阳性结果,聚丙烯酸阻垢剂和改性聚羧酸阻垢剂在高剂量组呈现阳性结果(表 1和表 2)。
| 化合物 | 浓度 | 微核 | 二倍体核 | |||
| 百分比/% | 倍数增加 | 百分比/% | 倍数增加 | |||
| 阴性对照 | 0 | 0.53 | 1 | 0.47 | 1 | |
| 丝裂霉素C | 0.1 μg/mL | 1.62 | 3.06a | 0.45 | 0.96 | |
| 秋水仙素 | 0.1 μg/mL | 1.31 | 2.47a | 1.11 | 2.36b | |
| 马来酸聚合物阻垢剂 | 高 | 1.41 | 2.66a | 0.65 | 1.38 | |
| 中 | 1.00 | 1.89 | 0.42 | 0.89 | ||
| 低 | 0.71 | 1.34 | 0.38 | 0.81 | ||
| 聚丙烯酸阻垢剂 | 高 | 0.74 | 1.39 | 0.19 | 0.40 | |
| 中 | 0.59 | 1.11 | 0.67 | 1.43 | ||
| 低 | 0.55 | 1.03 | 0.60 | 1.28 | ||
| 改性聚羧酸阻垢剂 | 高 | 0.93 | 1.75 | 0.37 | 0.79 | |
| 中 | 0.63 | 1.19 | 0.35 | 0.74 | ||
| 低 | 0.61 | 1.15 | 0.22 | 0.47 | ||
| 注:“a”:微核率(MN frequency)超过阴性对照组的两倍及以上;“b”:二倍体率(Hypodiploid Nuclei frequency)超过阴性对照组的两倍及以上 | ||||||
| 化合物 | 浓度 | 微核 | 二倍体核 | |||
| 百分比/% | 倍数增长 | 百分比/% | 倍数增长 | |||
| 阴性对照 | 0 | 0.78 | 1 | 0.89 | 1 | |
| 环磷酰胺/(μg/mL) | 0.1 | 1.97 | 2.53a | 0.79 | 0.89 | |
| 秋水仙素/(μg/mL) | 0.1 | 4.52 | 5.79a | 3.25 | 3.65b | |
| 马来酸聚合物阻垢剂 | 高 | 2.10 | 2.69a | 0.69 | 0.78 | |
| 中 | 1.83 | 2.35a | 0.47 | 0.53 | ||
| 低 | 1.64 | 2.10a | 0.66 | 0.74 | ||
| 聚丙烯酸阻垢剂 | 高 | 2.12 | 2.72a | 0.73 | 0.84 | |
| 中 | 1.45 | 1.86 | 0.75 | 0.82 | ||
| 低 | 0.99 | 1.27 | 0.47 | 0.52 | ||
| 改性聚羧酸阻垢剂 | 高 | 1.91 | 2.45a | 0.55 | 0.62 | |
| 中 | 1.53 | 1.96 | 0.78 | 0.88 | ||
| 低 | 1.52 | 1.95 | 0.78 | 0.88 | ||
| 注:“a”:微核率(MN frequency)超过阴性对照组的两倍及以上;“b”:二倍体率(Hypodiploid Nuclei frequency)超过阴性对照组的两倍及以上 | ||||||
3 讨论
单细胞凝胶电泳试验是一种在单细胞水平上检测真核细胞DNA损伤的方法。目前评价彗星实验结果常用的定量指标主要有:彗星尾长、尾部DNA含量和尾距。其中,尾部DNA含量是彗尾DNA荧光强度和“彗星”总荧光强度的比值[6];尾距的概念是由Olive提出的,尾距是由尾长和彗尾DNA含量相乘得到[7]。本实验采用尾部DNA含量和尾距作为评价实验结果的指标,由试验结果可以看出,3种阻垢剂在高、中剂量组对CHO细胞DNA具有一定的损伤。在体外微核试验中,以丝裂霉素C作为不加S9试验组的断裂剂的阳性对照,以环磷酰胺作为加S9试验组的断裂剂的阳性对照,以秋水仙素作为非整倍体剂的阳性对照。相同浓度下,加入代谢活化系统的试验组其微核率要高于未加入代谢活化系统的试验组,经过代谢活化系统的代谢活化后,其毒性作用有增强的趋势。3种阻垢剂在不同浓度下的二倍体核率与阴性对照组相比均小于2,说明3种阻垢剂在3种浓度下的遗传毒性作用方式为断裂剂。本试验的试验结果可以看出三种阻垢剂在彗星试验及流式细胞术体外微核试验中均表现出遗传毒性。
本研究采用流式细胞仪术进行微核实验结果检测,样品处理更为简便,明显缩短分析时间,更适于大样本分析工作。彗星试验与体外微核试验相结合的研究方法敏感、高效,可以为海水淡化阻垢剂的遗传毒性评价方法的制定和改进提供重要的科学依据,也为海水淡化水的水质卫生标准的制定奠定研究基础。目前,国内外本试验同类型海水淡化阻垢剂的安全性评价较少,而且缺乏卫生安全性评价标准,应继续深入开展对水处理药剂及杂质安全性的毒理学研究,并开展相应的人群暴露剂量研究,根据国内外相关饮用水卫生标准进行评价,确定其在我国海水淡化水中的使用限值。
| [1] |
张锐, 王姣龙. 绿色阻垢剂的最新研究进展[J]. 工业用水与废水, 2015, 46(6): 6-8, 27. (In English: Zhang R, Wang JL. Research progress of green scale inhibitor[J]. Ind Water Wastewater, 2015, 46(6): 6-8, 27. DOI:10.3969/j.issn.1009-2455.2015.06.003) |
| [2] |
杨曦, 杨晓雄, 秦宇, 等. 海水淡化后水质特性及其硼、钙、镁和氟对健康的影响[J]. 环境卫生学杂志, 2015, 5(6): 559-564. (In English: In Englishi:Yang X, Yang XX, Qin Y, et al. Characteristics of Boron, Calcium, Magnesium and Fluorine in desalinated seawater and their health effects[J]. J Environ Hyg, 2015, 5(6): 559-564.) |
| [3] |
徐赐贤, 董少霞, 路凯. 海水淡化后水质特征及对人体健康影响[J]. 环境卫生学杂志, 2012, 2(6): 313-319. (In English: Xu CX, Dong SX, Lu K. Characteristics of desalinated seawater and its effects on human health[J]. J Environ Hyg, 2012, 2(6): 313-319.) |
| [4] |
孙桂范, 邬堂春, 牛侨, 等. 职业卫生与职业医学[M]. 7版. 北京: 人民卫生出版社, 2012.
|
| [5] |
Shi J, Bezabhie R, Szkudlinska A. Further evaluation of a flow cytometric in vitro micronucleus assay in CHO-K1 cells:a reliable platform that detects micronuclei and discriminates apoptotic bodies[J]. Mutagenesis, 2010, 25(1): 33-40. DOI:10.1093/mutage/gep040 |
| [6] |
陈颖, 王磊, 王子健. 用彗星实验技术检测环境遗传毒性物质[J]. 土壤学报, 2006, 43(4): 673-678. (In English: Chen Y, Wang L, Wang ZJ. Development and application of comet assay for detecting genotoxic substances in environmental samples[J]. Acta Pedol Sin, 2006, 43(4): 673-678. DOI:10.3321/j.issn:0564-3929.2006.04.021) |
| [7] |
Olive PL, Banáth JP, Durand RE. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay[J]. Radiat Res, 1990, 122(1): 86-94. |



