2. 泰安医学院公共卫生学院;
3. 中国科学院城市环境研究所中国科学院城市环境与健康重点实验室
邻苯二甲酸二(2—乙基己)酯(di(2-ethylhexyl) phthalate, DEHP)在医用塑料中广泛应用,DEHP在聚氯乙烯血袋中的含量为(1.8~83.2) μg/mL,其浓度会随着储存时间推移而增加。使用这种血袋输血,DEHP的暴露量达0.7 mg/kg[1]。据统计,成人血液透析摄入DEHP达2.2 mg/kg/d,创伤患者短期大量输血时摄入DEHP更高达10 mg/kg/d[2]。邻苯二甲酸单乙基己基酯(monoeth-hexylphthalate, MEHP)在医用血袋的血液中也检出高达55.5 μg/mL[3]。DEHP和MEHP对细胞凋亡及类固醇合成机制缺乏系统的认识。在雄性生殖系统中,雄激素生物合成主要发生于间质细胞,睾丸间质细胞是睾酮产生的主要源头[4]。胆固醇从线粒体外膜转移到线粒体内膜后,在侧链裂解酶(cholesterol side-chain cleavage, CYP11A1)作用下胆固醇上的一个六碳链裂解产生类固醇孕烯醇酮。随后分别在3β羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, 3β-HSD)和细胞色素P45017羟化酶/17,20裂解酶(steroid 17α-hydroxylase and/or 17, 20 lyase A, CYP17 A)调节作用下产生孕酮和睾酮[5]。胰岛素样激素3(insulin-like hormone 3,INSL-3)是睾酮生物合成过程中的重要调节因子[6]。细胞凋亡会干扰类固醇激素合成,类固醇激素合成紊乱也会导致细胞凋亡的发生。本研究采用小鼠睾丸间质瘤细胞(Murine Leydig Tumor Cell Line,MLTC-1)分析细胞凋亡和类固醇激素合成过程,即采用qRT-PCR检测细胞类固醇激素合成过程中涉及到的CYP11A1、CYP17A1、3β-HSD、类固醇急性调节蛋白(steroid acute regulatory protein, STAR)、外源化合物代谢酶基因(cytochrome P450 1A1, CYP1A1);关键调控因子类固醇合成因子(steroidogenic factor-1, SF-1)和INSL-3;关键受体雄激素受体(androgen receptor, AR)和黄体激素受体(luteinizing hormone receptor, LHR)。通过检测这些基因表达水平的变化对DEHP及其主要代谢产物MEHP的类固醇激素合成干扰效应进行评定和机制研究。
1 材料与方法 1.1 实验材料MLTC-1细胞(中国科学院上海细胞生物学研究所)。
1.2 仪器与试剂仪器:CO2细胞恒温培养箱(日本SANYO);Spectra Max M5多功能酶标仪(美国,Molecular Devices);超净工作台(中国,Haier);UNIVERSAL 320R台式(常温/低温)离心机(德国Hettich Zentrifugen公司);ND-1000超微量紫外可见分光光度计(美国Gene Companey Limited公司);Mastercycler® personal PCR仪(德国EPPENDORF公司),Lightcycler 480实时荧光定量PCR仪(瑞士Roche公司);生物显微镜(中国,上海长方光学仪器有限公司);超纯净水系统(美国,Cascada);无菌工作台(中国,苏州安泰空气技术有限公司);细胞培养瓶、培养板(丹麦,NUNC公司)。
试剂:DEHP(优级纯,美国Supelco公司),二甲基亚砜(DMSO,优级纯,美国Sigma-Aldrich公司),浓度为1 g/mL,将母液用DMSO稀释至0.01 g/mL备用;MEHP(优级纯,美国AccuStandard公司)。将MEHP用DMSO配成0.01 g/mL母液备用;胎牛血清(美国,Life Technologies公司);0.05%胰酶EDTA溶液(美国,Life Technologies公司);Hepes(美国,Sigma公司);Nu Serum I(美国,BD Biosciences公司);MTT(美国,Sigma公司);ITS+Premix A(美国,Life Technologies公司);RNA提取试剂盒(美国Omega生物技术公司);反转录试剂盒(PrimeScriptTM RT-PCR Kit,宝生物工程(大连)有限公司);SYBR Premix Ex TaqTM试剂盒(宝生物工程(大连)有限公司)。
1.3 细胞培养细胞培养:MLTC-1培养采用90% RPMI-1640培养基(GIBCO,货号31800022,添加NaHCO3 1.5 g/L,glucose 2.5 g/L,Sodium pyruvate 0.11 g/L);10%优质胎牛血清,于37 ℃、5% CO2恒温培养箱中培养。将MLTC-1单细胞悬液以4. 0×105个/mL的密度接种到6孔板,每孔2 mL,(2~3) d更换1次培养液,倒置显微镜下观察细胞呈上皮样贴壁生长,待细胞生长至80%~95%融合后,以0.05%胰酶—0.02%EDTA溶液,按照1 :3比例传代。
1.4 细胞凋亡实验参考医用塑料以及血袋血液中DEHP和MEHP的浓度以及相关文献研究[7]。采用染毒剂量为DEHP和MEHP(0,1,10,100,1 000 μmol/L),细胞凋亡利用Annexin V/PI双染法测定,具体步骤为:将MLTC-1细胞接种到6孔板中在培养箱中培养24 h后,使用含DEHP和MEHP (0,1,10,100,1 000 μmol/L)培养基染毒24 h,将细胞消化收集后用400 μL 1×Annexin V结合液悬浮细胞,浓度大约为1×106个细胞/mL。在细胞悬液中加入5 μL Annexin V-FITC染色液,轻轻混匀后于2 ℃~8 ℃避光条件下孵育15 min。加入10 μL PI染色液后轻轻混匀,置2 ℃~8 ℃避光条件下孵育5 min。最后将样品转移到避光流式细胞管,用流式细胞仪检测分析。
1.5 RT-PCR分析MLTC-1基因表达变化将MLTC-1接种到6孔板中在培养箱内培养24 h后,使用含DEHP和MEHP (0,1,10,100 μmol/L)培养基染毒24 h。细胞染毒后总RNA的提取采用Omega RNA提取试剂盒,流程按照说明书进行,稍加改动,提取后采用分光光度法鉴定RNA质量,测定RNA浓度,采用反转录试剂盒进行反转录,获得cDNA。用SYBR Premix Ex TaqTM试剂盒在罗氏480仪器上进行荧光定量PCR反应。用于荧光定量PCR的引物序列见表 1。以GAPDH为内参基因,采用2 -ΔΔCT方法分析mRNA水平相对于对照的变化倍数[8]。
| 基因名称 | 引物序列(5′ to 3′) | 基因序列号 |
| INSL-3 | F: GCTTCCTCTCCAGGCTTCTCA | NM_013564.7 |
| R: TGTGGTCCTTGCTTACTGCGA | ||
| AR | F: CTTTCAAGGGAGGTTACGCCA | NM_013476.3 |
| R: ACAGAGACAGAGAGGACGGGA | ||
| SF-1 | F: TACCCACACTGCGGGGACAAA | NM_139051.3 |
| R: GGTTGTTGCGGGGCATCTCGT | ||
| STAR | F:TGGGACACGGTCATCA | NM_011485.4 |
| R:CTCCGGCATCTCCCCT | ||
| LHR | F:GAGAAGCGAATAACGAGACG | NM_013582.2 |
| R:AGCCAAATCAACACCCTAAG | ||
| CYP11A1 | F:CGTGACCAGGACAACA | NM_019779.3 |
| R:AGGATGAAGGAGAGGAGAGC | ||
| 3β-HSD | F:AGTGATGGAGGGCAGGT | NM_001304800.1 |
| R:GCAAGTTTGTGAGTGGGTTAG | ||
| CYP17A1 | F:TGGGCACTGCATCACGATAA | NM_007809.3 |
| R:GCTCCGAAGGGCAAATAACT | ||
| CYP1A1 | F:CCTAACTCTTCCCTGGATGCC | NM_001136059.2 |
| R:GCCCTTCTCAAATGTCCTGTA | ||
| GAPDH | F: GGAGAAGGCTGGGGCTCAT | NM_001256799.2 |
| R: TGATGGCATGGACTGTGGTC |
1.6 数据统计分析
采用SPSS 16.0软件进行数据分析。实验数据以 X±SD表示。对相对基因表达倍数和细胞凋亡图中细胞比例数据进行单因素方差分析(One-Way AVONA)和Turkey's检验。假设检验水准α=0.05。
2 结果如图 1所见,对照组大多为活细胞,测试剂量的DEHP对MLTC-1早期凋亡的发生没有很明显的影响,而100和1 000 μmol/L DEHP诱导MLTC-1晚期凋亡的发生,同对照组相比具有显著性差异。同对照组相比,10和1 000 μmol/L MEHP显著诱导MLTC-1晚期凋亡的发生(图 2)。1 000 μmol/L DEHP和MEHP显著降低了MLTC-1活力。研究结果表明DEHP和MEHP在高剂量情况下诱导了MLTC-1凋亡。
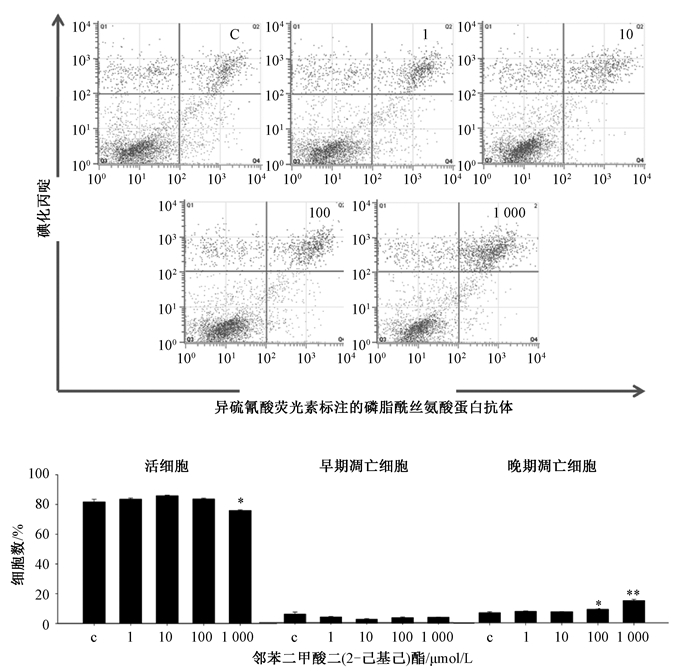
|
| 注:X轴表示Annexin V染色的细胞,Y轴表示PI染色的细胞,柱状图统计了活细胞,早期凋亡和晚期凋亡细胞在各自象限的比率。数值以Mean±SEM表示(n=3);“*”:P < 0.05;“**”:P < 0.01 图 1 Annexin V-PI染色检测DEHP暴露对MLTC-1凋亡的影响 |
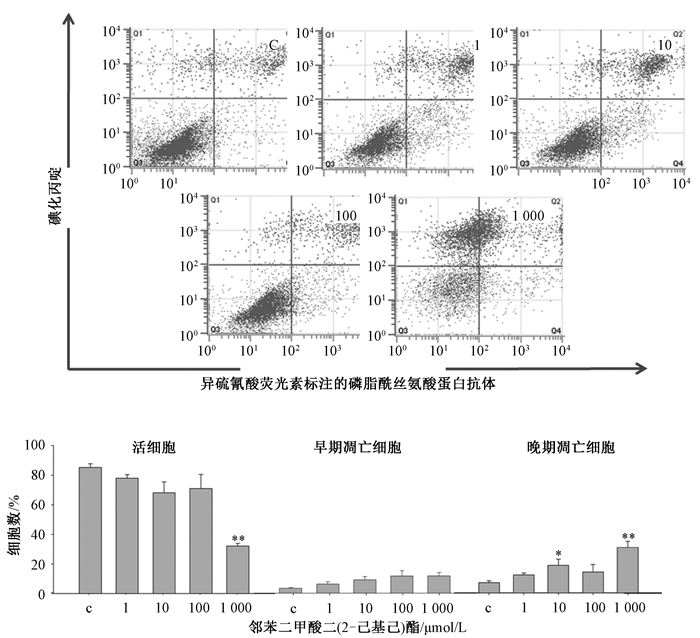
|
| 注:X轴表示Annexin V染色的细胞,Y轴表示PI染色的细胞,柱状图统计了活细胞,早期凋亡和晚期凋亡细胞在各自象限的比率。数值以Mean±SEM表示(n=3);“*”:P < 0.05;“**”:P < 0.01 图 2 Annexin V-PI染色检测MEHP暴露对MLTC-1凋亡的影响 |
1 000 μmol/L DEHP和MEHP对MLTC-1染毒24 h显著促进细胞凋亡并降低MLTC-1活力,鉴于此,后续研究采用以较低的染毒浓度(1、10和100 μmol/L)对MLTC-1染毒来评估DEHP和MEHP对MLTC-1类固醇合成通路的影响。结果显示,当MLTC-1暴露于DEHP和MEHP(0、1、10和100 μmol/L)24 h后,DEHP、MEHP对MLTC-1类固醇合成过程中关键酶基因的表达存在不同程度的影响(图 3)。1 μmol/L DEHP能够显著增加MLTC-1 CYP17A1基因表达水平,100 μmol/L DEHP显著抑制CYP17A1和CYP11A1基因表达水平。DEHP还改变了类固醇合成过程中关键调控因子基因的表达(图 3)。100 μmol/L DEHP显著抑制MLTC-1类固醇合成过程中关键调控因子SF-1基因表达水平。DEHP对外源化合物代谢酶CYP1A1的基因表达水平也产生了影响,10 μmol/L DEHP显著增加MLTC-1 CYP1A1基因表达水平。100 μmol/L DEHP显著抑制MLTC-1黄体激素受体LHR基因表达水平。MEHP改变了类固醇合成过程中关键酶因子3β-HSD基因的表达水平(图 4)。1 μmol/L MEHP显著增加MLTC-1 3β-HSD基因表达水平。然而MEHP对类固醇激素合成过程中一些酶如STAR、CYP17A1和CYP11A1等基因表达水平无显著影响。MEHP对类固醇合成过程中重要调节因子胰岛素样激素3 INSL-3和SF-1基因的表达无显著影响(图 4)。由此推断,DEHP、MEHP都可影响MLTC-1类固醇激素合成过程中关键基因的表达。
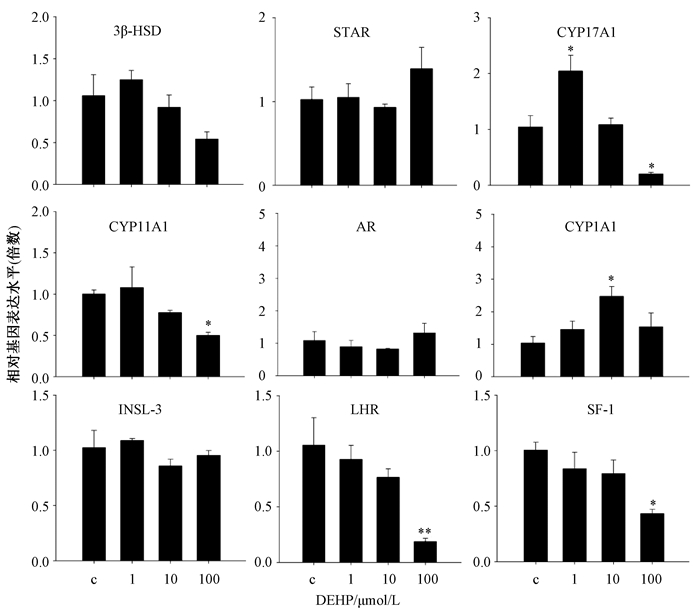
|
| 注:数值以Mean±SEM表示(n=3);*,P < 0.05 图 3 DEHP暴露对MLTC-1类固醇合成通路相关基因表达的影响 |

|
| 注:数值以Mean±SEM表示(n=3);“*”:P < 0.05 图 4 MEHP暴露对MLTC-1类固醇合成通路相关基因表达的影响 |
3 讨论
MLTC-1来源于可移植的小鼠睾丸间质细胞瘤(M540P)[9],该细胞对人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)的反应性与从正常组织分离的睾丸间质细胞相同,被广泛应用于生殖生理学和生殖内分泌学(如类固醇激素合成调节机制等)的研究[10],所以本研究采用MLTC-1模型。结果显示,DEHP、MEHP可不同程度的改变类固醇合成过程中关键酶、关键调控因子和受体基因的表达。类固醇激素合成是一个复杂的过程,涉及了许多酶、因子和受体的调控,任一调控点的干扰如编码类固醇合成相关酶的基因表达水平的干扰会引起酶活力的改变,直至激素水平的变化。类固醇合成过程中关键酶、因子和受体基因转录表达的改变可能造成类固醇激素分泌的紊乱,并且由于基因表达水平的改变比激素水平的改变更明显[11],所以选择基因表达水平的改变来评估DEHP和MEHP的内分泌干扰效应。
DEHP、MEHP可以不同程度的改变MLTC-1类固醇合成过程中关键酶基因的表达。100 μmol/L DEHP显著抑制MLTC-1类固醇生成相关酶(CYP17 A和CYP450scc)基因表达水平,说明DEHP抑制胆固醇转化为睾酮的几个关键酶的表达。类似地,许多文献研究显示邻苯二甲酸盐类化合物抑制包括CYP11 A、3β-HSD和CYP17 A等负责将胆固醇转化为睾酮的关键酶的表达[5]。100 μmol/L DEHP显著抑制MLTC-1关键调控因子SF-1基因表达水平,也有文献报道显示高剂量DEHP暴露显著抑制雄性大鼠睾丸中SF-1基因表达水平[12],SF-1是调控涉及类固醇生物合成如胆固醇转运和类固醇合成基因表达的关键调控因子,SF-1基因表达水平的抑制可能导致CYP11 A和CYP17 A表达水平的减少,最终可能导致睾酮等激素合成的减少[12]。100 μmol/L DEHP显著抑制黄体激素受体LHR基因表达水平,文献报道显示DEHP通过增加雌性斑马鱼卵巢中骨形态发生蛋白BMP-15从而抑制LHR表达水平[13]。黄体激素受体LHR和人体绒毛膜促性腺激素受体(HCGR)是性腺中与配体结合后调节类固醇生物合成并控制生殖过程的经典受体,LH会增加3β-HSD的表达和活性,从而增加孕烯醇酮向孕酮的转化[14]。10 μmol/L DEHP显著增加MLTC-1外源化合物代谢酶CYP1A1基因表达水平。CYP1A1参与了外源化合物的代谢,也参与了外源化合物毒性效应的激活或者去毒性效应,并且CYP1A1还受到性激素的调节[15]。MEHP对类固醇合成过程中重要调节因子胰岛素样激素3 INSL-3基因表达水平无显著影响。1 μmol/L MEHP显著增加MLTC-1 3β-HSD基因表达水平,从而能够促进睾酮的合成。类似地,Pathirana等[16]也研究指出邻苯二甲酸盐类化合物单酯对睾丸间质细胞中睾酮和INSL-3的分泌有直接影响。Laguë等[17]也指出邻苯二甲酸盐类化合物可通过间质细胞与睾酮拮抗从而抑制INSL-3的表达。文献报道显示低剂量的DEHP和MEHP显著诱导了MLTC-1 INSL-3和3β-HSD基因表达水平,这可能使得DEHP和MEHP对雄激素产生双向影响[18]。100 μmol/L DEHP显著抑制了类固醇激素合成通路相关酶、因子和受体基因表达水平,抑制胆固醇转化为睾酮,这就可能会增加细胞中胆固醇的水平,而相关文献研究显示胆固醇显著促进了脂肪性HepG2细胞的凋亡[19],所以猜测本研究中细胞中胆固醇含量增加可能导致细胞凋亡的发生,这还需相关实验进一步验证,细胞的凋亡也会进一步影响类固醇生物合成过程。
DEHP和MEHP对MLTC-1类固醇激素合成相关基因表达的影响有一些差别。在本研究中DEHP、MEHP可以不同程度的改变MLTC-1类固醇合成过程中关键酶基因的表达。100 μmol/L DEHP显著抑制MLTC-1类固醇生成相关酶(CYP17 A和CYP450scc、关键调控因子SF-1和黄体激素受体LHR基因表达水平,说明DEHP抑制胆固醇转化为睾酮的几个关键酶的表达。并且10 μmol/L DEHP显著增加MLTC-1外源化合物代谢酶CYP1A1基因表达水平。DEHP对类固醇激素合成过程中一些酶如3β-HSD和STAR的基因表达水平无显著影响。与DEHP相比,MEHP对MLTC-1类固醇激素合成关键基因表达的影响不太明显。1 μmol/L MEHP显著增加MLTC-1 3β-HSD基因表达水平。然而,研究显示体外研究中低剂量DEHP和MEHP(0.001 μmol/L和0.1 μmol/L)暴露MLTC-1增加了类固醇激素合成相关基因CYP11A1、CYP17和3β-HSD从而刺激了睾酮的分泌[18]。这是由于暴露剂量差异引起的。类似地,也有文献研究显示MEHP暴露囊状卵泡导致类固醇激素合成过程涉及的关键酶3β-HSD1基因表达水平下降,最终导致睾酮、雌酮和雌二醇水平下降[20],该研究结果也显示DEHP和MEHP对类固醇激素合成过程的干预模式是不同的。体内实验研究显示围产期暴露于DEHP下调了睾丸间质细胞类固醇激素合成相关基因如StAR、CYP11A1、3β-HSD、17β-HSD和CYP19等基因的表达从而显著降低血清睾酮和雌二醇水平并导致内分泌干扰生殖毒性效应[21]。DEHP和MEHP对MLTC-1细胞类固醇生成相关基因表达影响的差异机制还需进行进一步研究。DEHP代谢转化为MEHP的转化率以及MEHP进一步代谢转化为其他次级代谢产物的转化率需要进一步进行研究以解释DEHP和MEHP对类固醇生成相关基因表达影响的差异机制。DEHP和MEHP导致体外培养的MLTC-1凋亡,并对类固醇激素合成通路相关酶、因子和受体基因表达水平都产生了不同程度的影响,说明DEHP和MEHP在体外实验中显示出不同程度的内分泌干扰效应。
| [1] |
Inoue K, Kawaguchi M, Yamanaka R, et al. Evaluation and analysis of exposure levels of di(2-ethylhexyl) phthalate from blood bags[J]. Clin Chim Acta, 2005, 358(1): 159-166. |
| [2] |
European Commission, Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR). Opinion on the appropriateness of existing methodologies to assess the potential risks associated with engineered and adventitious products of nanotechnologies. Brussels: European Commission, 2008.
|
| [3] |
Peck CC, Odom DG, Friedman HI, et al. Di-2-ethylhexyl phthalate (DEHP) and mono-2-ethylhexyl phthalate (MEHP) accumulation in whole blood and red cell concentrates[J]. Transfusion, 1979, 19(2): 137-146. DOI:10.1046/j.1537-2995.1979.19279160282.x |
| [4] |
Zhang YH, Ge RS, Hardy MP. Androgen-forming stem leydig cells:identification, function and therapeutic potential[J]. Dis Markers, 2008, 24(4-5): 277-286. |
| [5] |
Gregoraszczuk E Ł, Ptak A, Rak-Mardyła A, et al. Differential accumulation of HCBz and PeCBz in porcine ovarian follicles and their opposing actions on steroid secretion and CYP11, CYP17, 17β-HSD and CYP19 protein expression. A tissue culture approach[J]. Reprod Toxicol, 2011, 31(4): 494-499. DOI:10.1016/j.reprotox.2011.01.006 |
| [6] |
Hannas BR, Lambright CS, Furr J, et al. Genomic biomarkers of phthalate-induced male reproductive developmental toxicity:a targeted RT-PCR array approach for defining relative potency[J]. Toxicol Sci, 2012, 125(2): 544-557. |
| [7] |
Ohlson CG, Hardell L. Testicular cancer and occupational exposures with a focus on xenoestrogens in polyvinyl chloride plastics[J]. Chemosphere, 2000, 40(9-11): 1277-1282. DOI:10.1016/S0045-6535(99)00380-X |
| [8] |
Richiardi L, Bellocco R, Adami HO, et al. Testicular cancer incidence in eight northern European countries:secular and recent trends[J]. Cancer Epidemiol Biomarkers Prev, 2004, 13(12): 2157-2166. |
| [9] |
Gunnarsson D, Leffler P, Ekwurtzel E, et al. Mono-(2-ethylhexyl) phthalate stimulates basal steroidogenesis by a cAMP-independent mechanism in mouse gonadal cells of both sexes[J]. Reproduction, 2008, 135(5): 693-703. DOI:10.1530/REP-07-0460 |
| [10] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [11] |
van den Dungen MW, Rijk JCW, Kampman E, et al. Steroid hormone related effects of marine persistent organic pollutants in human H295R adrenocortical carcinoma cells[J]. Toxicol in Vitro, 2015, 29(4): 769-778. DOI:10.1016/j.tiv.2015.03.002 |
| [12] |
Borch J, Metzdorff SB, Vinggaard AM, et al. Mechanisms underlying the anti-androgenic effects of diethylhexyl phthalate in fetal rat testis[J]. Toxicology, 2006, 223(1-2): 144-155. DOI:10.1016/j.tox.2006.03.015 |
| [13] |
Carnevali O, Tosti L, Speciale C, et al. DEHP impairs zebrafish reproduction by affecting critical factors in oogenesis[J]. PLoS One, 2010, 5(4): e10201. DOI:10.1371/journal.pone.0010201 |
| [14] |
Kundu S, Pramanick K, Paul S, et al. Expression of LH receptor in nonpregnant mouse endometrium:LH induction of 3β-HSD and de novo synthesis of progesterone[J]. J Endocrinol, 2012, 215(1): 151-165. DOI:10.1530/JOE-11-0486 |
| [15] |
Liu YT, Santillo MF, Flynn TJ, et al. Sex hormone modulation of both induction and inhibition of CYP1A by genistein in HepG2/C3A cells[J]. Vitro Cell Dev Biol Anim, 2015, 51(4): 426-431. DOI:10.1007/s11626-014-9848-9 |
| [16] |
Pathirana IN, Kawate N, Tsuji M, et al. In vitro effects of estradiol-17β, monobutyl phthalate and mono-(2-ethylhexyl) phthalate on the secretion of testosterone and insulin-like peptide 3 by interstitial cells of scrotal and retained testes in dogs[J]. Theriogenology, 2011, 76(7): 1227-1233. DOI:10.1016/j.theriogenology.2011.05.027 |
| [17] |
Chen X, Zhou QH, Leng L, et al. Effects of di(n-butyl) and monobutyl phthalate on steroidogenesis pathways in the murine Leydig tumor cell line MLTC-1[J]. Environ Toxicol Pharmacol, 2013, 36(2): 332-338. |
| [18] |
Chen X, Liu YN, Zhou QH, et al. Effects of low concentrations of Di-(2-ethylhexyl) and Mono-(2-ethylhexyl) phthalate on steroidogenesis pathways and apoptosis in the murine leydig tumor cell line MLTC-1[J]. Biomed Environ Sci, 2013, 26(12): 986-989. |
| [19] |
Zhu CY, Xie P, Zhao F, et al. Mechanism of the promotion of steatotic HepG2 cell apoptosis by cholesterol[J]. Int J Clin Exp Pathol, 2014, 7(10): 6807-6813. |
| [20] |
Hannon PR, Brannick KE, Wang W, et al. Mono(2-ethylhexyl) phthalate accelerates early folliculogenesis and inhibits steroidogenesis in cultured mouse whole ovaries and antral follicles[J]. Biol Reprod, 2015, 92(5): 120. |
| [21] |
Sekaran S, Jagadeesan A. In utero exposure to phthalate downregulates critical genes in Leydig cells of F1 male progeny[J]. J Cell Biochem, 2015, 116(7): 1466-1477. DOI:10.1002/jcb.v116.7 |



